Ks. artikkelin pdf-versio «http://www.fimnet.fi/cl/laakarilehti/pdf/2012/SLL92012-685.pdf»1 Lääkärilehden sivuilla (vaatii FiMnet-tunnuksen).
Kilpirauhaskokeiden tulkintaongelmia syntyy, kun tulokset eivät vastaa kliinistä kuvaa tai ovat ristiriitaisia sairauden, lääkkeen tai määritysmenetelmän virheen vuoksi.
Laboratoriomenetelmiin liittyvät ongelmat ovat harvinaisia avoterveydenhuollon potilailla.
Yleisimmät ongelmat kilpirauhasarvojen tulkinnassa liittyvät kilpirauhasen lieviin eli subkliinisiin toimintahäiriöihin ja kilpirauhastulehduksiin.
Sairaalapotilaalla matalan T3-arvon oireyhtymän aiheuttaa usein vakava yleissairaus.
Lääkkeiden aiheuttamat muutokset kilpirauhaskokeiden tuloksissa ovat yleisiä tyroksiinikorvaushoitoa saavilla. Kilpirauhaskokeita tulee seurata kaikilta amiodaronia, litiumia, tyrosiinikinaasi-inhibiittoreita tai interferonia käyttäviltä potilailta.
Aikuisten kilpirauhashormonien pitoisuusmittauksien (jatkossa: kilpirauhaskokeet) tulkintaongelmia syntyy, kun kliiniset löydökset ja laboratoriotulokset ovat ristiriitaisia, kilpirauhaskokeiden tulokset epäloogisia tai vuosien kuluessa käyttöön vakiintunut tyroksiinin annos yllättäen muuttuu. Kliinikon kyvyt joutuvat koetukselle, jotta sairaus tai muu häiriötekijä voidaan diagnosoida tai sulkea pois. Selityksen löytämiseksi saattaa riittää kliinisen tilanteen ja lääkityksen muutosten läpikäyminen. Joskus vaaditaan laboratoriotutkimusten laajentamista ja radiologisia sekä geneettisiä lisätutkimuksia (1).
Kilpirauhaskokeita tehdään maassamme erittäin paljon. Kilpirauhassairauksia esiintyy väestössä jopa 3-10 %:lla, kun mukaan luetaan lievät tautimuodot (2,3). Toisaalta osa tutkimuksista on varmuuden vuoksi tehtyjä seulontakokeita, koska kilpirauhasen toiminnan muutosten oireet ovat epäspesifejä ja laajalti sekä lääkäreiden että potilaiden tuntemia ja epäilemiä. Onneksi kilpirauhaskokeiden tulkinta on usein suoraviivaista: tyreotropiinin (TSH) ja vapaan tyroksiinin (T4v) pitoisuudet ja niitä vastaavat kliiniset löydökset kertovat, onko kyseessä eutyreoosi, hypertyreoosi vai hypotyreoosi.
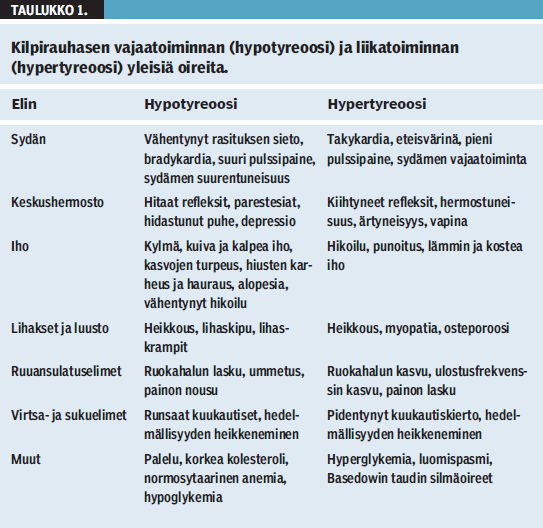
Kilpirauhaskokeita määrätessä on tärkeä tiedostaa poikkeavan koetuloksen todennäköisyys. Jos tutkimuksen lähtökohta on hypo- tai hypertyreoosille tyypillisten oireiden (taulukko 1 «»1) esiintyminen, ennustearvo nousee. Kun laboratoriotutkimuksia tehdään jatkuvan väsymyksen perusteella suunnattuna seulontatutkimuksena, todennäköisyys kilpirauhashäiriön löytymiselle on erittäin pieni (4). Kilpirauhaskokeet kannattaa määrätä herkästi yli 55-vuotiaille naisille, joilla on kilpirauhasen vajaatoimintaan sopivia oireita; heillä subkliininen hypotyreoosi eli tyreoideaperoksidaasi (TPO) -vasta-ainepositiivisen autoimmuunityreoidiitin pohjalta kohonnut TSH-taso (< 10 mU/l) on selvästi muuta väestöä yleisempää (5). Raskausaika on toinen poikkeustilanne, jossa sikiön terveyden vuoksi on erittäin tärkeää tunnistaa lieväkin hypotyreoosi. Väestötutkimuksen mukaan TPO-vasta-aineita tavataan raskauden ensimmäisellä kolmanneksella 18 %:lla naisista. Raskauteen liittyvän kilpirauhashäiriön seulonnan laajuudesta keskustellaan (6). Kilpirauhassairauden riskiryhmien kohdalla, kuten autoimmuunitauteja sairastavilla, vanhuksilla ja raskautta suunnittelevilla naisilla kilpirauhaskokeiden määräämiskynnystä on syytä pitää matalalla.
Poikkeavien kilpirauhaskoetulosten tulkinnassa ei ole syytä hätäillä. On pohdittava onko kyseessä laboratoriomääritykseen liittyvä ongelma tai normaalitilanteen variantti, sairauden tai lääkehoidon vaikutus vai todellinen kilpirauhassairaus, joka voi olla pysyvä tai ohimenevä. Syyn selvittäminen vaatii oireiden tarkkaa ajallista kartoitusta suhteessa laboratoriokoetulosten muutokseen. Usein vasta seuranta sekä mahdollinen hypo- tai hypertyreoosin hoitokokeilu varmentaa diagnoosiepäilyn.
Kilpirauhaseltaan terveen henkilön TSH:n, T4v:n ja vapaan trijodityroniinin (T3v) pitoisuudet vaihtelevat vain vähän mittauskerrasta toiseen, mutta yksilöiden välinen vaihtelu on suurempaa. Siksi yksilön arvojen muutos viitealueen sisälläkin voi olla merkityksellinen. Toistomittauksissa TSH:n yli 40 %:n ja T4v:n tai T3v:n yli 15 %:n muutos kertoo 90 %:n todennäköisyydellä todellisesta kilpirauhasen toiminnan muutoksesta (7). Toisaalta laboratoriomääritysten toistettavuudessa eri menetelmien välillä on paljon toivomisen varaa. Esimerkiksi TSH-pitoisuus voi vaihdella 39 % ja T4v-pitoisuus 21 % laboratoriosta toiseen. Standardisointityö on parantanut tutkimusten toistettavuutta, mutta on suositeltavaa seurata yhtä potilasta saman laboratorion määrityksin (8,9).
Jos TSH:n lisääntyminen ei ole linjassa kliinisten oireiden ja kilpirauhashormonien kanssa, syynä voivat olla heterofiiliset tai autovasta-aineet, jotka nostavat TSH-pitoisuutta virheellisesti. Nykyään nämä eivät ole suuri pulma aiempaa tarkempien TSH:n määritysmenetelmien vuoksi. Lisäksi suurimmat laboratoriot tutkivat pyynnöstä heterofiiliset vasta-aineet. Laboratoriolähetteessä on mainittava immunologisen ongelman epäilystä. Jos heterofiiliset vasta-aineet ovat koholla, kilpirauhassairauden diagnoosi tai tyroksiiniannoksen säätö tapahtuu kilpirauhashormonien (T4v ja/tai T3v) pitoisuuden ja kliinisen kuvan perusteella, eikä vasta-aineiden tasoa tai TSH-pitoisuutta tarvitse seurata.
TSH:n viitearvot perustuvat monessa laboratoriossa vanhoihin aineistoihin, joista kilpirauhaseltaan sairaita ei ole suljettu pois. Tuoreessa suomalaisissa väestössä tehdyssä tutkimuksessa on todettu TSH:n viitevälin todellisuudessa olevan hieman aiempaa matalammalla tasolla (10). Uusista TSH:n viitearvoistakin on olemassa poikkeus: raskaudessa TSH:n viiteväli laskee aina ja aiheuttaa haasteita hypotyreoosin tunnistamiselle (11). Amiodaronihoidon aikana T4v:n viiteväli nousee ja T3v:n viiteväli laskee hieman (12).
Kantajavalkuaisen pitoisuuden muutokset saattavat häiritä immunologisilla menetelmillä mitattuja T4v-pitoisuuksia ja tulokset voivat olla epäluotettavia esimerkiksi polyfarmasiassa, munuaisten vajaatoiminnassa sekä raskauden loppupuoliskolla (1,13). Jos T4v on epäsuhdassa kliinisten löydösten tai TSH:n kanssa, voidaan harkita pitoisuuden tarkistamista tasapainodialyysimenetelmällä. Kultaisena standardina pidettyyn dialyysimenetelmään liittyy toisaalta ongelmia kroonista munuaisten vajaatoimintaa sairastavilla, koska ureemiset toksiinit voivat sitoa T4:ää dialysaatissa in vitro ja vääristää tulosta todellista matalammaksi (14).
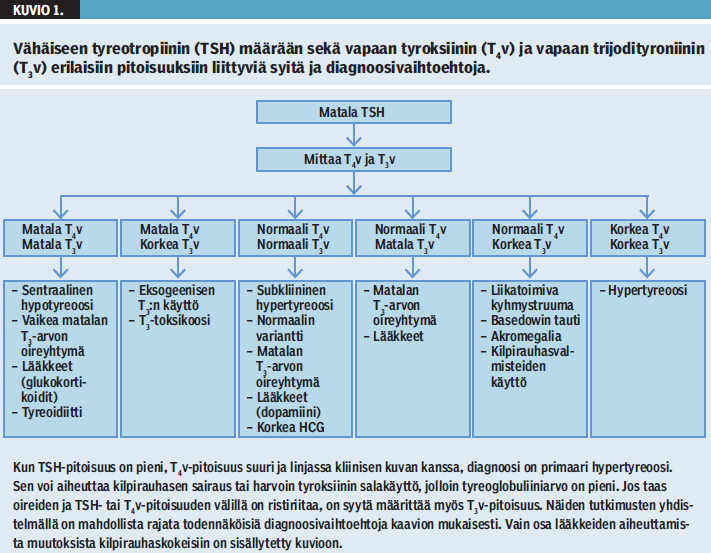
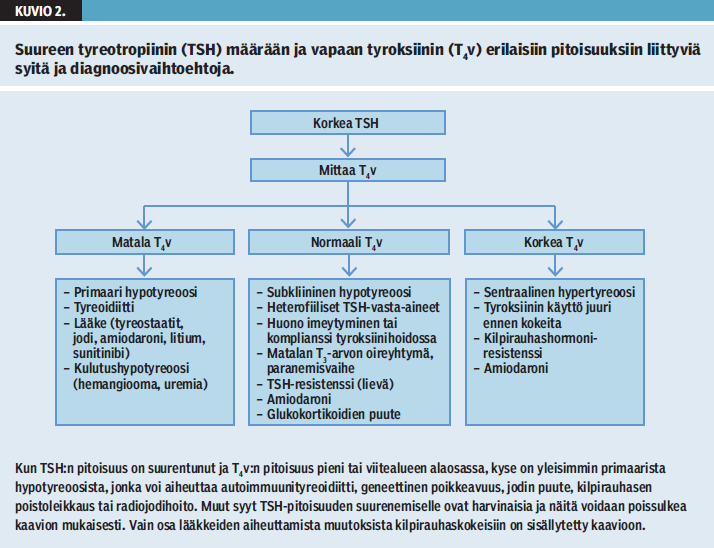
TSH:n muutos on ensimmäinen merkki alkavasta hypo- tai hypertyreoosista, mutta T4v ja T3v voivat pysytellä vuosia viitealueella. Vaihtoehtoisia diagnooseja on esitetty kuvioissa 1 «»2 ja 2 «»3. Vaikka subjektiiviset oireet puuttuvat usein kokonaan, statuksessa todetaan subkliinisestä kilpirauhasen toimintahäiriöstä johtuvia johdonmukaisia jänneheijasteiden, sydämen rytmin, ihon ja olemuksen vilkkauden muutoksia. Tyypillisimmät elinkohtaiset hypo- ja hypertyreoosin oireet on koottu taulukkoon 1 «»1 ja nämä sairaudet on tarkemmin kuvattu endokrinologian oppikirjassa (3). Vasta-ainetutkimuksista voi olla apua diagnostiikassa: TSH-reseptori- tai TPO-vasta-aineiden esiintyminen pienen TSH-pitoisuuden yhteydessä viittaa alkavaan Basedowin tautiin ja TPO-vasta-aineiden esiintyminen suurentuneen TSH-pitoisuuden yhteydessä viittaa autoimmuunityreoidiittiin. Basedowin taudissa esiintyy joskus silmäoireita ilman merkittävää hypertyreoosia (15). Kilpirauhasen tunnustelu on oleellinen osa kliinistä tutkimusta. Löydöksenä voi olla tasaisen kiinteä kilpirauhanen Basedowin taudissa, suuri kilpirauhanen kyhmystruumassa tai aristava rauhanen subakuutissa tyreoidiitissa.
Subkliininen hypertyreoosi lisää rytmihäiriöiden ja murtumien riskiä. Hoitopäätös tehdään yksilöllisesti kun TSH on pysyvästi alle 0,1 mU/l (16). Subkliininen hypotyreoosi johtaa vuosittain hypotyreoosiin 5-8 %:lla potilaista ja vaatii siksi säännöllistä seurantaa. Tyroksiinihoito on aiheellista viimeistään TSH:n ylittäessä 10 mU/l, mutta oireisilla tai struumapotilailla jo aiemmin (17,18). Nämä TSH:n muutosten kilpirauhasperäiset syyt ovat ylivoimaisesti yleisimpiä.
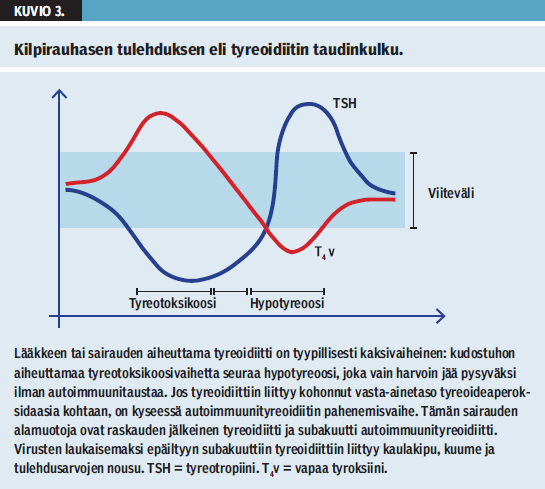
Jos potilaalla on ollut hypertyreoosin oireita, mutta kilpirauhaskokeiden tulokset muuttuvat nopeasti kohti eutyreoosia tai hypotyreoosia, voi kyseessä olla kilpirauhasen tulehdus eli tyreoidiitti. Tyreoidiitti kehittyy joko TPO-positiivisen autoimmuniteetin tai toksisen mekanismin, kuten lääkkeen tai tulehduksen pohjalta. Kuviossa 3 «»4 näkyy tyypillinen taudinkulku. Kilpirauhaskoetulokset voivat olla lähes millaiset tahansa, mutta on tärkeä havaita oireiden ja arvojen vaihtelu. Tulehduksen aiheuttama solutuho vapauttaa kilpirauhashormoneja verenkiertoon, jolloin kyse on tyreotoksikoosivaiheesta. Tyreoidiitin paranemista edeltää muutaman kuukauden kestoinen hypotyreoosivaihe, joka voi jäädä pysyväksi autoimmuunityreoidiitissa. Radiojodin kertymä on pieni erotuksena todelliseen hypertyreoosiin, jossa kilpirauhashormonien synteesi on kiihtynyt ja kertymä suurentunut. Subakuuttia tyreoidiittia sairastavan tulehdusarvot nousevat ja niiden seuraamisesta on hyötyä taudin aktiivisuuden arvioinnissa (3).
Yleisimmin suvuittain esiintyvät geneettiset poikkeavuudet kilpirauhasaineenvaihdunnan säätelyjärjestelmässä aiheuttavat vaihtelevan oirekirjon kongenitaalisesta hypotyreoosista oireettomuuteen. Lisääntynyt kilpirauhashormonien tarve muusta syystä tai jodin puute voivat tuoda esiin osittaisia geenivirheitä aikuisellakin (19). X-kromosomissa periytyvä monokarboksylaattitransportteri 8:n geenivirhe aiheuttaa pojille neurologisia oireita ja tyypillisen kilpirauhaskokeiden yhdistelmän, jossa TSH on normaali, T4v-pitoisuus pieni ja T3v-pitoisuus suurentunut (20). Joissain perheissä tavataan lievää hypertyreoosia TSH-reseptoria aktivoivan mutaation seurauksena.
Vaikka yleisin syy pieneen TSH-pitoisuuteen ja normaaliin T4v-pitoisuuteen on subkliininen hypertyreoosi, jokaisen potilaan kohdalla on syytä arvioida taudinkuvan loogisuus, jotta harvinainen sentraalinen hypotyreoosi ei jäisi huomaamatta. Jos potilaalla on hypotyreoosin oireita ja sekä TSH että T4v ovat viitealueen alarajalla tai matalia, diagnoosina on TSH:n puute. Sen voi aiheuttaa aivolisäkkeen tai hypotalamuksen sairaus, kuten kasvaimet, tulehdukselliset tilat, sädehoito tai aivovamman jälkitila joko TSH:n tai tyreotropiinin vapauttajahormonin vähentyneen erityksen kautta. TSH:n puutteen ilmenemisen viive esimerkiksi sädehoidon jälkeen voi olla vuosikymmeniä (3). On myös tärkeä havaita mahdolliset muiden aivolisäkehormonien, erityisesti kortikotropiinin puutteen oireet: laihtuminen, väsymys, kalpeus, hyponatremia, hyperkalemia ja matala verenpaine. Glukokortikoidikorvaushoito aloitetaan aina ennen tyroksiinia, koska aineenvaihdunnan kiihtyminen tyroksiinin vaikutuksesta voi johtaa Addisonin kriisiin. Toisaalta glukokortikoidien puute nostaa TSH-pitoisuutta ja pienentää kilpirauhashormonipitoisuuksia ja nämä muutokset saattavat korjaantua glukokortikoidikorvaushoidolla. Jos aivolisäkkeen sairauteen liittyy kasvuhormonin puute, T3v-pitoisuus voi olla pieni ja akromegaliassa vastaavasti suurentunut dejodinaasientsyymien aktiivisuuden muutoksen vuoksi (21).
Jos TSH on hypertyreoottisella potilaalla viitealueella tai suurentunut ja T4v-pitoisuus suurentunut, kyseessä voi olla joko erittäin harvinainen TSH:ta tuottava aivolisäkkeen adenooma tai kilpirauhashormoniresistenssi, jonka pituitaarisessa muodossa esiintyy lieviä hypertyreoosin oireita. Näiden sairauksien erotusdiagnostiikka kuuluu erikoissairaanhoitoon (1).
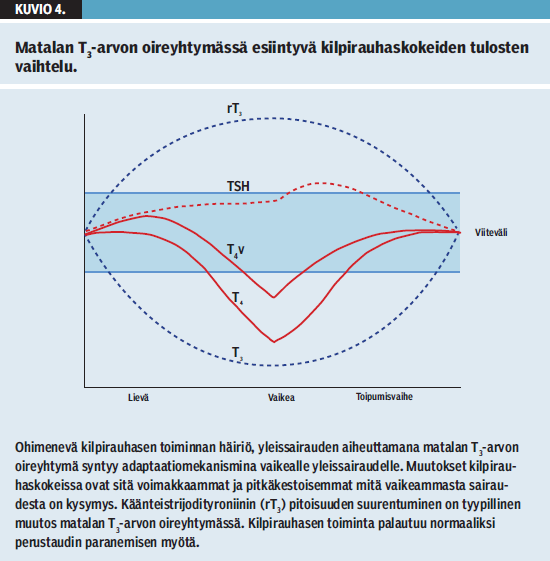
Vaikeat yleissairaudet, hengenvaaralliset traumat, laajat kirurgiset toimenpiteet ja paasto voivat heilauttaa ohimenevästi hypotalamus-aivolisäke-kilpirauhasakselin tasapainoa ilman varsinaista sairautta kilpirauhasessa tai sen säätelyjärjestelmässä. Ilmiö tunnetaan suomenkielisessä endokrinologian oppikirjassa nimellä matalan T3-arvon oireyhtymä. Tyypillinen kilpirauhaskokeiden vaihtelu on esitetty kuviossa 4 «»5: aluksi TSH on normaali tai lievästi pienentynyt, vapaan T3:n pitoisuus on pienentynyt ja käänteistrijodityroniinin (rT3) pitoisuus suurentunut. On huomattava, että T4v:n pitoisuus säilyy yleensä viitealueella ja pienenee vain erittäin vaikeassa yleissairaudessa. Matalan T3-arvon oireyhtymä korjautuu sairauden parantuessa. Ensin TSH-pitoisuus suurenee hetkellisesti, stimuloi T3:n nousua, ja entinen tasapainotila saavutetaan (3,22).
Kilpirauhaskokeiden mittaaminen vakavan yleissairauden aikana aiheuttaa lähes varmasti tulkintaongelmia ja seurannan tarvetta; yhden sairaalan potilasaineistossa jopa yli 60 %:lla sairaalahoitoon otetuista yli 60-vuotiaista todettiin kilpirauhaskokeiden poikkeavuus (23). Kilpirauhaskokeet on järkevintä siirtää tutkittaviksi muutama kuukausi yleissairauden paranemisen jälkeen. Jos potilaalla on kilpirauhassairauteen viittaavia oireita, mittaukset tulee toki tehdä. Matalan T3-arvon oireyhtymän hoito on kiistanalaista ja tutkimusten perusteella tyroksiinin käyttö on joskus parantanut ennustetta ja joskus jopa lisännyt kuolleisuutta perussairaudesta riippuen (24). Jos sairaalahoidossa olevalla potilaalla epäillään matalan T3-arvon oireyhtymää, seurataan kilpirauhaskokeita esimerkiksi 4-8 viikon välein, kunnes tasapaino palautuu.
TSH:lla ja koriongonadotropiinilla (HCG) on samankaltainen α-alayksikkö, joten HCG kykenee suurina pitoisuuksina stimuloimaan TSH-reseptoria. Näin tapahtuu normaalin raskauden aikana, mutta myös trofoblastisairauksissa. TSH-pitoisuus pienenee ja kilpirauhashormonien pitoisuus on normaali, viitealueen yläosassa tai suuri. Voimakkaaseen raskauspahoinvointiin voi liittyä suuri kilpirauhashormonipitoisuus (25).
Proteinuria saattaa lisätä kilpirauhashormonien poistumista, jolloin T4v-pitoisuus pienenee. Suuri verisuonikasvain voi ilmentää tyypin 3 dejodinaasientsyymiä, jolloin T3v-pitoisuus pienenee, TSH-pitoisuus suurenee ja T4v on yleensä muuttumaton (26). HIV-infektiossa tavataan oma tyypillinen kilpirauhashormoniprofiilinsa, jossa T3v- ja rT3-pitoisuudet ovat pienentyneet (3).
Tyroksiinihoito on yleensä koko elämän kestävää korvaushoitoa, joka vaatii potilaalta sitoutumista ja hoitavalta lääkäriltä kilpirauhaskokeiden arviointia ainakin vuosittain. Korvaushoidossa tähdätään TSH-pitoisuuden viitealueen alapuoliskoon ja T4v-pitoisuudessa viitealueella oleviin arvoihin. Jos potilaan sitoutuminen tyroksiinihoitoon on huono ja potilas ottaa lääkkeet säännöllisemmin juuri ennen laboratoriokäyntiä, TSH on usein koholla ja T4v on viitealueella tai suurentunut. Tällöin pelkkä TSH-pitoisuuden seuraaminen johtaa turhaan annosnostoon. Väestötutkimuksen perusteella todettiin, että tyroksiinikorvaushoitoa saavilla TSH-pitoisuus yli 4 mU/l tai supressio alle 0,03 mU/l lisää sydän- ja verisuonitautien, rytmihäiriöiden ja murtumien riskiä (27). Ongelma koskee merkittävää osaa korvaushoidon käyttäjistä: tuoreen väestötutkimuksen mukaan vain alle kaksi kolmasosaa tyroksiinin käyttäjistä saavutti tavoitellun TSH-tason (28).
Osa korvaushoidossa olevista potilaista käyttää tyroksiinin ja trijodityroniinin yhdistelmää, jolloin sekä TSH:n, T4v:n että T3v:n tulee olla viitealueella. Eläinperäisten kilpirauhasuutteiden käyttäjiltä ei pidä mitata T4v:tä, joka on aina matala. Seuranta perustuu TSH- ja T3v-mittauksiin ja tavoitteena ovat viitealueella olevat arvot. Kirjallisuudessa on hiljattain käsitelty kysymystä miten toimia, jos kilpirauhaskokeet ovat tavoittelukemissa, mutta potilaan vointi huono (17).
Papillaarista tai follikulaarista kilpirauhassyöpää sairastaville saatetaan käyttää TSH:ta 0,1 mU/l-tasolle suprimoivia tyroksiiniannoksia, jolloin T3v:n tulisi pysyä viitealueella, vaikka T4v-pitoisuus on useimmiten suuri. Tyroksiinin annosta ei pidä muuttaa ilman erikoissairaanhoidon konsultaatiota. Jos syövän uusiutumisen riski on pieni, luovutaan TSH-supressiosta ja tyroksiinikorvaushoitoa seurataan tavanomaiseen tapaan TSH- ja T4v-mittauksin (29).
Monet sairaudet muuttavat tyroksiinin tarvetta. Imeytyminen voi muuttua ruuansulatuskanavan sairauksissa kuten keliakiassa ja leikkauksissa, esim. ohutsuolen ohitusleikkauksessa. Tyroksiinia voi poistua merkittävästi virtsaan proteinuriassa, jolloin T4v-pitoisuus pienenee ja korvausannosta tulee nostaa. Fysiologiset tekijät vaikuttavat myös korvaushoitoon. Voimakas painon nousu voi lisätä ja painon lasku vastaavasti vähentää tyroksiinin tarvetta. Ikä vähentää hypotalamus-aivolisäke-kilpirauhasakselin vireyttä ja TSH:n määrä nousee negatiivisen palautejärjestelmän säätelemänä vähemmän kuin nuorilla (30). Terveyden muuttuessa kannattaa siis säännöllisesti seurata tyroksiinin käyttäjän kilpirauhashormoneja.
Lääkkeiden aiheuttamat kilpirauhaskoetulosten muutokset ovat yleensä ohimenevä ja siksi kliiniseltä merkitykseltään vähäisiä lukuun ottamatta amiodaronia, litiumia, tyrosiinikinaasi-inhibiittoreita ja interferonia. Piilevä kilpirauhassairaus tai usean kilpirauhasen toimintaan vaikuttavan lääkkeen yhteiskäyttö saattaa johtaa merkittäviin muutoksiin kilpirauhaskokeissa. Tyroksiinin käyttäjät ovat erityisen alttiita lääkkeiden vaikutukselle (31).
Pieni TSH-pitoisuus voi olla seurausta glukokortikoidihoidosta, dopamiiniagonisteista ja somatostatiinianalogeista, jotka vaikuttavat joko hypotalamukseen tai hypofyysiin vähentäen yleensä ohimenevästi TSH:n eritystä. Kilpirauhashormonipitoisuudet pysyvät yleensä viitealueella eli sentraalinen hypotyreoosi on erittäin harvinainen (32). Vain syöpälääkeryhmään kuuluva beksaroteeni aiheuttaa sentraalisen hypotyreoosin 10-70 %:lle potilaista (33,34). Metformiini vähentää TSH:a vain tyroksiinikorvaushoitoa käyttävillä diabeetikoilla (35). Metoklopramidi ja muut dopamiiniantagonistit yleensä lisäävät TSH:a ohimenevästi (32).
Kilpirauhasen hormonieritystä tai T4:n muuntumista T3:ksi estävät lääkkeet voivat aiheuttaa hypotyreoosia. Tällä mekanismilla syntyy myös tyreostaattien toivottu vaikutus. Lievempi vastaava vaikutus on esimerkiksi glukokortikoideilla, propranolonilla, litiumilla, jodivalmisteilla, sulfonamidilla, stavudiinilla, talidomidilla ja amiodaronilla. Jodipitoiset lääkkeet ja röntgenvarjoaineet voivat kiihdyttää hormonisynteesiä ja aiheuttaa hypertyreoosin erityisesti kyhmystruumapotilailla. Jos taas kilpirauhanen on ollut terve, jodiylimäärä voi aiheuttaa hypotyreoosin (36).
Jos tyroksiinia sitovan globuliinin (TBG) pitoisuus pienenee, vapaan kilpirauhashormonin osuus kasvaa eli T4v ja T3v lisääntyvät altistaen potilaan hypertyreoosille. Vastaavasti TBG-pitoisuuden suurentuessa voi syntyä hypotyreoosi. Androgeenit pienentävät ja oraaliset estrogeenit suurentavat TBG-pitoisuutta. Lisäksi TBG-pitoisuutta pienentävät nikotiinihappo ja glukokortikoidit sekä suurentavat klofibraatti, fluorourasiili, kapesitabiini, mitotaani ja opioidit. Vapaan hormonin osuuden muutoksella on merkitystä myös tyroksiinihoitoa käyttävien potilaiden kannalta: estrogeeninhoidon aloitus saattaa lisätä ja lopetus pienentää korvaushoidon annosta (37).
Furosemidi, salisylaatit, diklofenaakki, mefenaamihappo, fenytoiini, mitotaani ja hepariini syrjäyttävät tyroksiinia ja trijodityroniinia TBG:sta ja albumiinista suoraan tai vapaiden rasvahappojen lisääntymisen välityksellä. Näitä lääkkeitä säännöllisesti käyttävillä kilpirauhaskokeiden seuranta ei ole tarpeen, koska säätelyjärjestelmä mukautuu nopeasti lyhyen hypertyreoosijakson kautta uuteen tasapainoon. Tulkintaongelmia voi syntyä, jos akuutisti sairaalla potilaalla mitataan suuri T4v-pitoisuus esimerkiksi hepariini- tai suuriannoksisen furosemidihoidon aikana. Tulokset saatetaan erheellisesti tulkita hypertyreoottisiksi (14).
Tyreoidiitin kehittyminen on mahdollista amiodaronin, interferonin, litiumin, interleukiini-2:n, granulosyytti-makrofagikasvutekijän ja joidenkin tyrosiinikinaasi-inhibiittoreiden käytön aikana. Kilpirauhaskokeiden muutokset ovat kuvion 3 «»4 mukaisia.
Tyroksiinin maksapoistumaa lisääviä lääkkeitä ovat mm. entsyymi-induktorit fenytoiini, fenobarbitaali, rifampisiini, karbamatsepiini, sertraliini, mitotaani ja imatinibi, joiden aikana T4v vähenee ja tyroksiiniannoksen nostolle voi olla tarvetta. Tyroksiinin imeytymistä häiritsevät lääkkeet ovat toinen tavallinen kilpirauhaskokeissa todetun muutoksen syy. Tämän vuoksi raudan, kalsiumsuolojen ja sappihappoanalogien annosteluväli tyroksiiniin nähden tulisi olla vähintään neljä tuntia. Tutkimuksen mukaan omepratsolihoidon aloitus nosti tyroksiinin annosta kolmanneksella (38). Tyroksiini tulisi muistaa nauttia aamulla 10 minuuttia ennen ruokailua ja muiden lääkkeiden ottoa, jotta imeytyminen on tasaista ja mahdollisimman täydellistä (39).
Kilpirauhasen sairaudet voidaan yksinkertaistaa käsittämään hypotyreoosin, hypertyreoosin, struuman ja syövän, jotka viimeksi mainittua lukuun ottamatta muuttavat usein kilpirauhaskokeiden tuloksia. Hypofyysin tai aivolisäkkeen sairaudet ovat harvinaisia ja vaikeampia tunnistaa kilpirauhaskokeiden muutoksen perusteella. Vaikeaan sairauteen liittyvä matalan T3-arvon oireyhtymä selittää lääkkeiden vaikutuksen ohella suuren osan sairaalapotilaiden kilpirauhaskokeiden muutoksista.
Edellä kuvattuja kilpirauhaskokeiden tulosten tulkintaongelmia on vaikea diagnosoida yksittäisen mittauksen perusteella ja tärkein ohje epäselvässä tilanteessa on jäädä seuraamaan sekä potilaan oireita että kilpirauhaskokeita. Vain raskaudenaikainen lieväkin poikkeama raskauskolmannekselle tyypillisestä TSH:n viitearvosta muodostaa poikkeuksen tästä säännöstä.
The interpretation of thyroid function tests is usually straight forward. When thyroid stimulating hormone (TSH) and free thyroid hormone T4 and T3 concentrations are in accordance with clinical symptoms they confirm either normal thyroid function, hyperthyroidism or hypothyroidism. Sometimes problems with laboratory assays, subclinical thyroid disease, thyroiditis or low T3 syndrome cause obscure test results. It is also important to recognize rare secondary causes for thyroid function test abnormalities such as pituitary or hypothalamic TSH deficiency. Many medicines and illnesses cause subtle changes in thyroid function tests. The most important medicines that need follow-up of thyroid function include amiodarone, lithium, interferon and tyrosine kinase inhibitors. Subjects receiving thyroxin replacement therapy are more prone to effects of illnesses and medicines. Many times obscure thyroid function test results may be followed to detect serial changes. An exception to this strategy is pregnancy, during which prompt correction of even mild hypothyroidism is of vital importance.