Ks. artikkelin pdf-versio «http://www.fimnet.fi/cl/laakarilehti/pdf/2014/SLL152014-1133.pdf»1 Lääkärilehden sivuilla (vaatii FiMnet-tunnuksen).
Kilpirauhanen erittää kilpirauhashormoneja, joista tärkeimmät ovat tyroksiini (T4) ja trijodityroniini (T3). Kilpirauhashormonien tuotantoa säätelee aivolisäkkeen erittämä tyreotropiini (TSH). Kilpirauhasesta vapauduttuaan valtaosa tyroksiinista muuttuu elimistössä aktiiviseksi trijodityroniiniksi dejodiutumisen kautta. T3 on varsinainen biologisesti aktiivinen kilpirauhashormoni (1). Kilpirauhashormonit vaikuttavat lähes kaikkien kehon solujen toimintaan ja energiankulutukseen.
Kilpirauhasen liikatoiminnassa eli hypertyreoosissa kilpirauhanen tuottaa liikaa kilpirauhashormoneja, minkä vuoksi kilpirauhashormonien pitoisuus veressä ja kudoksissa nousee. Hypertyreoosin esiintyvyys on noin 2,5 % naisilla ja 0,6 % miehillä (2). Diagnoosi perustuu laboratoriokokeisiin, joissa havaitaan lisääntynyt vapaan T4:n ja T3:n pitoisuus. TSH on yleensä mittaamattoman matala. Hypertyreoosin tavallisimmat syyt ovat Basedowin tauti, liikatoimiva kyhmystruuma ja toksinen adenooma. Muita tyreotoksikoosin mahdollisia syitä voivat olla kilpirauhastulehdus, liiallinen jodin saanti esimerkiksi röntgenvarjoaineiden tai amiodaronin käytön vuoksi, liiallinen kilpirauhasvalmisteiden käyttö tai aivolisäkkeen adenooman aiheuttama sentraalinen hypertyreoosi (1).
Hypertyreoosin vakiintuneessa käytössä oleviin hoitomuotoihin, tyreostaattilääkitykseen, leikkaukseen ja radiojodihoitoon, liittyy kaikkiin omat ongelmansa (3). Pitkäaikaisen lääkehoidon toteuttaminen vaatii säännöllistä laboratoriokoeseurantaa, ja siihen liittyy haittavaikutusten ja taudin uusiutumisen riski. Lääkehoito ei aiheuta pysyvää hypotyreoosia, mutta Basedowin taudin inhiboivat vasta-aineet tai samaan aikaan esiintyvä autoimmuunikilpirauhastulehdus saattavat johtaa hypotyreoosiin tyreostaattihoidon aikana. Leikkaushoito vaatii sairaalahoitoa ja kokenutta kirurgia, ja noin 1-4 %:lle potilaista tulee hypoparatyreoosi tai äänen käheytyminen leikkauksen komplikaationa. Mikäli potilas leikataan hypertyreoosin vuoksi, yleensä koko kilpirauhanen poistetaan ja potilas joutuu pysyvään tyroksiinikorvaushoitoon. Radiojodihoito johtaa usein kilpirauhasen vajaatoimintaan, ja sen käyttöön liittyy säteilyturvamääräyksiä, jotka ovat lisänneet potilaiden tietoisuutta ja huolta sädealtistuksen aiheuttamista pitkäaikaishaitoista (1,3,4).
Olen koonnut tähän katsaukseen keskeiset hypertyreoosin ja sydän- ja verisuonisairastavuuden yhteyttä käsittelevät julkaisut viime vuosilta. Lisäksi olen kerännyt katsaukseen tietoa yhteyden taustalla todennäköisesti vaikuttavista mekanismeista.
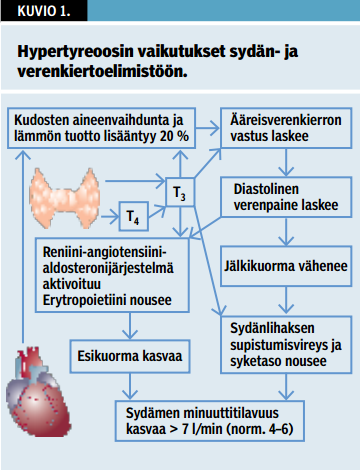
Hypertyreoosin sydän- ja verisuonivaikutukset on esitetty kuviossa «»1. Hypertyreoosissa lähes kaikkien solujen energiankulutus ja lämmöntuotto kasvavat. Kilpirauhasen liikatoiminnan aiheuttamien sydän- ja verenkiertoelimistön muutosten tarkoitus on vastata kiihtyneen aineenvaihdunnan vaateisiin ja poistaa tämän tuottama lämpö. Kilpirauhashormonit pienentävät ääreisverenkierron vastusta. Ne vähentävät perifeeristen arteriolien supistumista solukalvon ionikanavien ja typpioksidivälitteisen endoteelitoiminnan säätelyn välityksellä (5). Tämä vähentää keskipainetta, minkä reniini-angiotensiini-aldosteronijärjestelmä aistii ja lisää suolan ja nesteen kertymistä. Kilpirauhashormonit lisäävät myös erytropoietiinin eritystä ja punasolumassaa. Sydämen jälkikuorma vähenee ääreisverenkierron vastuksen pienenemisen myötä, ja esikuorma kasvaa verivolyymin lisääntyessä. Samaan aikaan sydämen syketaajuus kiihtyy ja supistumisvireys lisääntyy. Esikuorman, syketaajuuden ja sydämen supistumisvireyden kasvu nostavat iskutilavuutta, minuuttitilavuutta ja systolista verenpainetta. Hypertyreoosi lisää valtimoiden jäykkyyttä, ja siksi pulssipaine kasvaa. Hypertyreoosi johtaa myös keuhkovaltimopaineen kasvuun, koska kilpirauhashormonit eivät vähennä keuhkoverenkierron vastusta samoin kuin ääreisverenkierron vastusta (5).
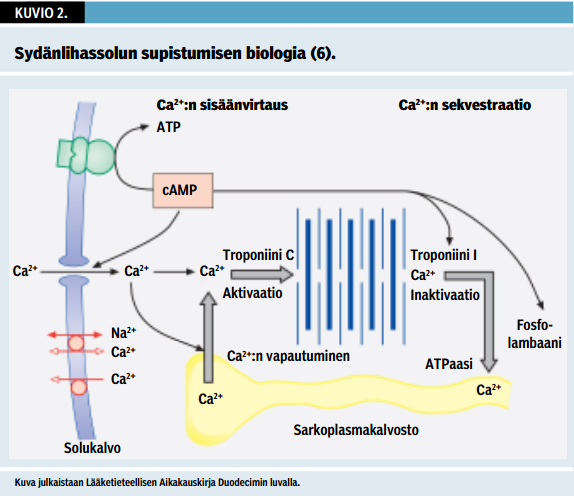
Sydänlihassolut ovat haaraisia ja niistä muodostunut kudos on verkkomaista. Sydänlihassoluissa on yksi tuma ja paljon mitokondrioita, jotka toimivat solujen energiatehtaina. Sydänlihassolun supistumiskyky perustuu aktiini- ja myosiinifilamentteihin, jotka supistumiskäskyn saadessaan liukuvat toistensa lomiin (kuvio «»2). Sydänlihaksen erityisominaisuus on, että sinussolmukkeessa syntyy aktiopotentiaali ilman ulkoista ärsykettä, josta se leviää sydämen muihin lihassoluihin. Solunsisäisen kalsiumin määrä systolessa säätelee sydänlihassolun supistuvuutta. Kun kalsiumionit pumpataan takaisin sarkoplasmiseen kalvostoon, supistus päättyy. Normaali kammiolihas supistuu tehokkaammin, jos se venyttyy diastolessa enemmän (Frank-Starlingin laki). Supistumisvireyttä lisää myös sympaattinen stimulaatio syklisen AMP:n välityksellä (6). Sileälihassoluja esiintyy muun muassa verisuonten seinämissä. Sileälihassolut ovat sukkulamaisia, ja eikä niissä ole poikkijuovaista rakennetta.
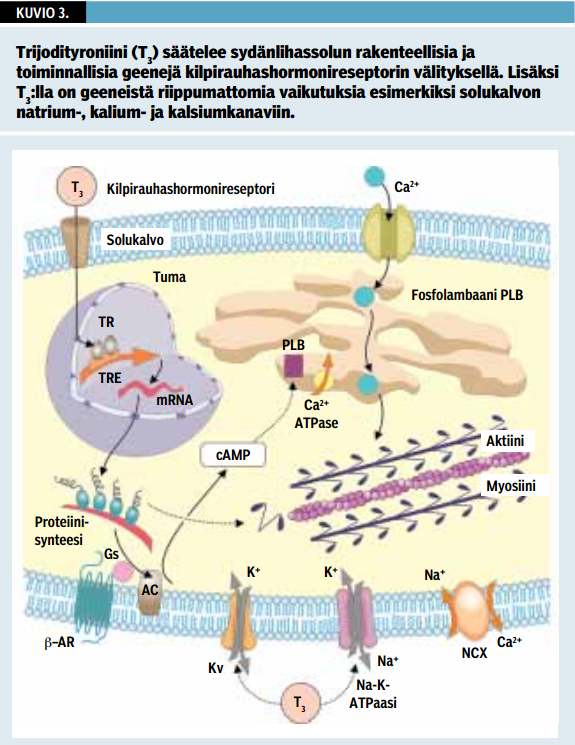
Autonominen hermosto ja kilpirauhashormonit säätelevät sydän- ja sileälihassolujen toimintaa. Kilpirauhashormoneista vain T3 pääsee sydänlihassoluun, eikä sydänlihassolussa tapahdu merkittävää T4:n dejodiutumista T3:ksi. Kilpirauhashormoneilla on sydänlihassoluihin sekä geenivälitteisiä että geeneistä riippumattomia vaikutuksia. Kilpirauhashormonit säätelevät sydänlihaksen rakenteellisia ja toiminnallisia geenejä solukalvon kilpirauhashormonireseptorien välityksellä (kuvio «»3). Kilpirauhashormonit vaikuttavat pääosin sydämen supistumisvoimaan ja diastoliseen venyvyyteen sekä beeta-adrenergisten reseptorien määrään ja herkkyyteen vaikuttaviin geeneihin (taulukko 1 «»4). Kilpirauhashormonien geeneistä riippumattomat vaikutukset kohdistuvat pääosin solukalvon natrium-, kalium- ja kalsiumkanaviin, aktiinin polymerisaatioon, mitokondrioiden toimintaan ja erilaisiin solunsisäisiin signalointijärjestelmiin sydän- ja sileälihaksessa (kuvio «»3). Geeneistä riippumattomat vaikutukset ovat nopeammin alkavia ja palautuvia kuin geenivälitteiset muutokset. Ei tiedetä, ovatko jotkin muutoksista pysyviä (5).
Aikaisemmin ajateltiin, että hypertyreoosin sydän- ja verisuonivaikutukset ovat vaarattomia ja hoidon myötä palautuvia. Kliinistä hypertyreoosia sairastavilla on kuitenkin 27 % korkeampi (7) ja subkliinisestä hypertyreoosista kärsivillä 29-52 % korkeampi (8,9) kuolleisuus sydän- ja verisuonitauteihin kuin normaaliväestöllä. Hypertyreoosiin sairastuneilla esiintyy enemmän eteisvärinää (10,11,12,13), aivoverenkierron häiriöitä (10,13,14,15), sydämen vajaatoimintaa (10,13,16,17), verenpainetautia (10,13), keuhkoverenpainetautia (18) sekä laskimotukoksia (10) ja keuhkoembolioita (19) kuin normaaliväestössä. Hypertyreoosi lisää veren hyytymistä ja vähentää verihyytymän liukenemista (20). Sen sijaan sepelvaltimotaudin ja hypertyreoosin välillä ei ole havaittu yhteyttä (10,13). Hypertyreoosin on havaittu lisäävän sydän- ja verisuonisairastuvuutta jo ennen kuin hypertyreoosin kliininen diagnoosi tehdään tai hoito aloitetaan. Vaikutus kestää jopa kymmenen vuotta hoidon jälkeen (10,12,13).
Hypertyreoosi altistaa eteisvärinälle todennäköisesti, koska se lyhentää eteisten refraktaariaikaa ja lisää supraventrikulaarista ektooppista aktiivisuutta muuttamalla solukalvon toimintaa ja lisäämällä beeta-adrenergisten reseptorien tiheyttä ja herkkyyttä (5,21). Lisäksi lisääntyneen verivolyymin aiheuttama eteisten venytys altistaa eteisvärinälle. Noin 60 % hypertyreoosin yhteydessä todetuista eteisvärinöistä kääntyy sinusrytmiin spontaanisti 2-3 kuukauden kuluessa hypertyreoosin hoidosta, mutta 3 kuukautta hoidon jälkeen enää harva eteisvärinä kääntyy spontaanisti sinusrytmiin. Eteisvärinä ruokkii itse itseään muuttamalla eteisen sähköisiä ja mekaanisia ominaisuuksia sekä rakennetta altistaen eteisvärinän uusimiselle (22). Mitä vanhempi potilas ja mitä pidempään kestänyt eteisvärinä, sitä huonommin se kääntyy sinusrytmiin hypertyreoosin korjaamisesta huolimatta (5). Vaikka hypertyreoosin aktiivisella hoidolla voidaan vähentää eteisvärinän ilmaantumista, nykyhoidoin potilaille jää selvästi lisääntynyt elämänaikainen eteisvärinän kehittymisen riski (10,13,23).
Sekä hypertyreoosi että eteisvärinä ovat helposti uusiutuvia ongelmia. Tyreostaattihoidon jälkeen hypertyreoosi uusiutuu 50 %:lla potilaista (1). Eteisvärinä uusiutuu 60 %:lla eteisvärinäpotilaista (24). Koska eteisvärinän yhteydessä seulotaan hypertyreoosia ja hypertyreoosin yhteydessä seulotaan eteisvärinää, näiden kahden yhteys saattaa voimistua toistuvan seulonnan myötä, mutta tuskin selittyy sillä kokonaan (12,25).
Amiodaronia käytetään osalla osa eteisvärinäpotilaista uusiutuvan eteisvärinän estohoitona. Amiodaroni on rasvaliukoinen rytmihäiriölääke, jonka puoliintumisaika on 100 vuorokautta ja jonka sisältämä jodi kertyy sydänlihakseen, kilpirauhaseen, rasvakudokseen ja lihaksiin. Amiodaronihoidon aikana kilpirauhasen toimintakokeita pitää seurata 3 kuukauden välein, koska se voi aiheuttaa sekä kilpirauhasen vajaa- että liikatoiminnan. Kilpirauhasen liikatoiminta voi johtua toksisesta destruktiivisesta tyreoidiitista tai siitä, että jodikuorma toimii polttoaineena subkliinisenä esiintyneelle Basedowin taudille tai kyhmystruumalle. Amiodaronin aiheuttamaa tyreotoksikoosia hoidetaan lopettamalla amiodaroni, kortisonilla, tyreostaateilla ja vaikeimmissa tapauksissa kilpirauhasen poistolla (26).
Eteisvärinä, takykardia, verenpaineen nousu, volyymikuorman nousu ja lisääntynyt hapenkulutus altistavat sydämen vajaatoiminnalle ja sen pahenemisvaiheille. Aikaisempi iskeeminen sydänsairaus, läppävika tai hypertensiivinen sydänsairaus saattavat pahentua hypertyreoosin aiheuttaman sydämen rasituksen myötä (5). Hypertyreoottinen eteisvärinäpotilas saattaa saada helpommin aivoinfarktin kuin eutyreoottinen eteisvärinäpotilas, koska hypertyreoosi vaikuttaa myös veritukoksen muodostusta lisäävästi (20). Varmaa tutkimusnäyttöä asiasta ei ole, eivätkä kaikki hypertyreoosiin liittyvät iskeemiset aivotapahtumat näytä selittyvän eteisvärinän aiheuttamilla embolioilla (10,15).
Epidemiologisissa tutkimuksissa havaittu yhteys hypertyreoosin ja sydän- ja verisuonisairauksien välillä voi selittyä todellisella syy-seuraussuhteella tai sattuman, systemaattisen virheen tai sekoittavien tekijöiden vaikutuksella. Syy-seuraussuhteen todennäköisyyttä voidaan arvioida tarkastelemalla yhteyden voimakkuutta, eri tutkimusten tuottamien tulosten yhtäpitävyyttä, yhteyden biologista uskottavuutta, syyn ja seurauksen väistä aikajärjestystä, annosvastesuhdetta ja palautuvuutta sekä muiden yhteyttä selittävien syiden mahdollisuutta (27).
Hypertyreoosin ja sydän- ja verisuonitautikuolleisuuden ja -sairastavuuden välillä on varsin voimakas yhteys, joka on osoitettu yhtäpitävästi amerikkalaisessa, englantilaisessa, skotlantilaisessa, ruotsalaisessa, taiwanilaisessa, tanskalaisessa ja suomalaisessa kohortissa (14-16,19, 23,28-30). Hypertyreoosilla on myös biologisesti uskottavia sydän- ja verisuonisairastavuutta lisääviä vaikutuksia, kuten edellä kuvailtiin.
Käytettävissä olevien tapausverrokkitutkimusten perusteella hypertyreoosin ja sydän- ja verisuonisairastavuuden aikajärjestys ei välttämättä ole aivan selvä. Vastikään julkaistussa rekisteritutkimuksessa eteisvärinän sairastaneilla potilailla oli suurentunut riski saada hypertyreoosi seurannassa, joka alkoi eteisvärinän toteamisesta. Todennäköisesti potilailla oli ensin subkliininen tai diagnosoimaton hypertyreoosi, joka havaittiin vasta eteisvärinän toteamisen tai sen uusiutumisen yhteydessä (25). Syy-seuraussuhde saattaa kuitenkin olla myös käänteinen: potilas voi saada jodi-Basedowin, koska hän on saanut eteisvärinän vuoksi amiodaronia tai hänelle on tehty sepelvaltimotaudin vuoksi sepelvaltimoiden röntgenangiografia. Amiodaroni aiheuttaa kuitenkin hypertyreoosin vain 2-10 %:lle potilaista (5,26). Sepelvaltimotaudin ja hypertyreoosin välillä taas ei ole todettu yhteyttä, joten koronaariangiografiat tuskin selittävät hypertyreoosin ja sydän- ja verisuonisairauksien yhteyttä (7,10).
Toistaiseksi ei juuri ole tutkimuksia, joissa osoitettaisiin hypertyreoosin vaikeusasteen tai keston vaikuttavan sydän- ja verisuonisairastavuuteen (annos-vastesuhde). Tuoreessa tutkimuksessa selvitettiin eteisvärinän esiintymistä kilpirauhasen ja sydämen suhteen aiemmin terveillä tanskalaisilla (n = 590 000), joilta oli tutkittu TSH. Eteisvärinän sai 13 % yli 65-vuotiasta henkilöistä, joilla oli TSH:n perusteella hypertyreoosi (12). Eteisvärinän ilmaantuvuus oli sitä korkeampi, mitä matalampi TSH oli (12). Tulos viittaa siihen, että hypertyreoosin vaikeusaste vaikuttaa sydän- ja verisuonisairauksien ilmaantuvuuteen.
Eri hoitomuotojen tehoa hypertyreoosin aiheuttamiin hemodynaamisiin muutoksiin ei ole kontrolloidusti verrattu. Englantilaiskohortissa kuolleisuus oli normaaliväestöön verrattuna korkeampi lääkehoidetuilla ja niillä radiojodihoidetuilla, joille ei kehittynyt hypotyreoosia hoidon jälkeen. Sen sijaan tehokas, hypotyreoosin johtanut radiojodihoito suojasi sydän- ja verisuonitautikuolemalta (31). Radiojodihoidettujen potilaiden hypotyreoosi suojasi sydän- ja verisuonisairastavuudelta ja -kuolleisuudelta myös suomalaistutkimuksessa (10,28). Tyreostaattihoidossa olevilla potilailla kudosten hypertyreoosi korjaantuu hitaasti, ja kammion yläpuolisten rytmihäiriöiden ja epäedullisten hemodynaamisten vaikutusten on todettu jatkuvan hoidosta huolimatta (32). Hypertyreoosin vuoksi leikattujen potilaiden sydän- ja verisuonisairastavuus lisääntyi 5 vuotta ennen leikkaukseen päätymistä ja oli leikkaushetkellä 50 % korkeampi ikä- ja sukupuolivakioituihin verrokkeihin verrattuna. Leikkauksen myötä sydän- ja verisuonisairauksien esiintyminen palautui osittain, mutta se jäi kuitenkin 12 % verrokkeja korkeammalle tasolle. Tulos oli sama riippumatta siitä, leikattiinko potilaita osa kilpirauhasesta vai koko kilpirauhanen (13). Nämä tutkimustulokset puoltavat hypertyreoosin ja sydän- ja verisuonisairastavuuden välistä syy-seuraussuhdetta ja tehokkaiden hoitomuotojen, kuten RAI-hoidon ja leikkauksen, käyttöä hypertyreoosin hoidossa.
On toki mahdollista, että jokin yhteinen geneettinen (33) tai ympäristötekijä (34,35) selittäisi sekä potilaan hypertyreoosin että sydän- ja verisuonisairauden eikä näiden sairauksien välillä olisikaan syy-seuraussuhdetta. Tupakointi on keskeinen sekoittava tekijä, jota ei ole pystytty vakioimaan tehdyissä tutkimuksissa. Tupakointi altistaa sekä hypertyreoosille että sydän- ja verisuonisairauksille (35). Niin ikään jotkut infektiot tai muut tulehdukselliset tekijät saattavat aiheuttaa tai laukaista sekä kilpirauhas- että sydän- ja verisuonisairauden. Esimerkiksi joitakin viitteitä on siitä, että TSH-reseptorivasta-aineet altistaisivat hypertyreoosin lisäksi myös eteisvärinälle (34). Tähän mennessä tehdyistä tutkimuksissa ei kuitenkaan ole osoitettu, että hypertyreoosin etiologia selittäisi lisääntyneen sydän- ja verisuonisairastavuuden (10,13,31,36,37).
Valtaosa hypertyreoosin aiheuttamista sydän- ja verisuonielimistön muutoksista korjaantuu eutyreoosin saavuttamisen myötä. Hypertyreoosipotilaille jää kuitenkin elinikäinen taipumus sairastua sydän- ja verisuonisairauksiin, ennen kaikkea eteisvärinään, sydämen vajaatoimintaan, aivoverenkiertosairauksiin ja laskimopuolen tromboembolisiin sairauksiin. Löydös on sama kaikissa hoitomuodoissa: radiojodihoidossa (10,14,29), tyreostaattihoidossa (32) tai leikkauksessa (13). Ei tiedetä, miksi hypertyreoosin aiheuttama sydän- ja verisuonisairastavuus ei täysin palaudu nykyisin käytettävissä olevilla hoidoilla. Ikä, aikaisempi sydänsairaus, diabetes, verenpainetauti ja vasemman eteisen venyminen huonontavat eteisvärinän kääntymistä sinusrytmiin eutyreoosin palautumisen jälkeen. Hypertyreoosin hoidossa ja seurannassa tulee huomioida, että potilaat ovat suuren riskin potilaita. Kilpirauhasarvot on syytä tarkistaa, jos potilaalla esiintyy hypertyreoosiin tai eteisvärinään sopivia oireita tai löydöksiä. Erityisesti iäkkäillä ja aiemmin sydänsairaudesta tai sen riskitekijöistä kärsineillä pitäisi pyrkiä nopeaan ja tehokkaaseen eutyreoosin saavuttamiseen sekä eteisvärinän tunnistamiseen ja varhaiseen hoitoon (38).
Lisätutkimuksia tarvitaan siitä, mitkä ovat hypertyreoosin pitkäaikaisten sydän- ja verisuonivaikutusten mekanismit ja onko eri syistä johtuvalla tyreotoksikoosilla erilainen vaikutus riskiin. Lisääntynyt T3-valmisteiden käyttö lisää huolta niiden aiheuttamaan tyreotoksikoosiin liittyvistä sydän- ja verisuonivaikutuksista (39). Lisäksi tarvittaisiin verrokkitutkimuksia erilaisten hoitokeinojen hyödystä sydän- ja verisuonisairastavuuden ehkäisemisessä hypertyreoosipotilailla.
Lämmin kiitos tutkimusryhmällemme: LL Essi Ryödi, dosentti Jorma Salmi, lehtori Heini Huhtala, dosentti Pia Jaatinen, dosentti Rauni Saaristo, professori Anssi Auvinen ja professori Matti Välimäki.
Thyroid hormones affect the heart and peripheral vasculature through the thyroid hormone receptors and autonomous nervous system. Hyperthyroidism leads to increased heart rate, systolic blood pressure, left ventricular contractility, blood volume, stroke volume, pulse pressure, pulmonary pressure, and oxygen consumption and decreased resistance of the peripheral vasculature. On the basis of the understanding of the cellular mechanisms of thyroid hormone action on the heart and cardiovascular system, it is possible to explain the changes in cardiac output, cardiac contractility, blood pressure and vascular resistance, and the rhythm disturbances that result from hyperthyroidism.
During the last few years, it has been learned that the cardiovascular morbidity and mortality associated with hyperthyroidism reverse only partly with the restoration of normal thyroid function. Further studies are needed to establish whether the current treatment modalities of hyperthyroidism differ in their reversal of the haemodynamic changes. Meanwhile, effective treatment of hyperthyroidism is recommended especially in the elderly and those with previous cardiovascular disease or risk factors for cardiovascular disease.