Ks. artikkelin pdf-versio «http://www.fimnet.fi/cl/laakarilehti/pdf/2017/SLL222017-1422.pdf»1 Lääkärilehden sivuilla (vaatii FiMnet-tunnuksen).
Syöpään sairastuu Suomessa vuosittain noin 240 alle 20-vuotiasta (Suomen Syöpärekisteri). Nykyisillä hoidoilla heistä noin 80 % paranee pysyvästi (1), mutta lapsuusiässä saaduilla syövän hoidoilla on pitkäaikaisvaikutuksia mm. sydämeen (2,3). Suomessa on elossa noin 7 000 alle 25-vuotiaana syövän sairastanutta. Vasta harva heistä on ehtinyt ylittää 50 vuoden iän, jolloin sydän- ja verisuonisairauksien riski yleensä alkaa lisääntyä, mutta ennusteen paranemisen ansiosta lapsena syövän sairastaneiden nuorten aikuisten määrä kasvaa nykyään noin 2 % vuodessa (3).
Lapsena tai nuorena sairastetusta syövästä selviytyneiden yleisimmät sairaudesta johtuvat kuolemansyyt ovat toinen syöpä sekä sydän- ja verisuonisairaudet (4). Sekä Suomessa että Pohjoismaissa tehdyissä ansiokkaissa epidemiologisissa tutkimuksissa on todettu lapsuusiän syövän jälkeen lisääntynyt riski sairastua sydän- ja verisuonisairauksiin niin sisarusten kuin väestönkin riskiin verrattuna (5,6). Tietyt syövän hoidot voivat aiheuttaa kardiomyopatiaa ja sydämen vajaatoimintaa, joiden kliiniset oireet saattavat ilmentyä vasta vuosikymmenten kuluttua (7,8). Sydämen vajaatoiminnan esiintyvyys kasvaa syövän sairastaneilla iän myötä selvästi nopeammin kuin verrokkiväestössä, eikä lisääntynyt riski pääty tietyn ajan kuluttua hoidoista (5,9).
Suomalaisessa rekisteriaineistossa lapsena tai nuorena sairastetusta syövästä parantuneilla kardiomyopatian ja sydämen vajaatoiminnan riskitiheyksien suhde sisarusten riskiin verrattuna oli 13,5, aivoverenkiertohäiriöiden 3,4, sepelvaltimotaudin ja sydäninfarktin 3,3 ja sydämen rytmihäiriöiden 1,7 (5). Vastaavassa pohjoismaisessa aineistossa 8,1 %:lla oli todettu sydän- tai verisuonisairaus, vaikka tutkittavista vasta 12 % oli tutkimushetkellä yli 50-vuotiaita (6). Lapsena tai nuorena syövän sairastaneilla myös tavanomaisten sydän- ja verisuonisairauksien riskitekijöiden esiintyminen on yleistä ja sydän- ja verisuonisairauksia esiintyy tavallista nuoremmalla iällä (9,10).
Syöpälääkkeiden tiedetään aiheuttavan sydänhaittoja sekä aikuisille (11) että lapsille. Hoitojen vaikutukset kasvavassa elimistössä voivat olla erilaisia kuin aikuisilla, ja myös vuosikymmeniä pidempi elinajan odote lapsena sairastetun syövän jälkeen voi vaikuttaa sydänhaittojen ilmenemiseen. Lasten tavallisimman syövän, akuutin lymfoblastileukemian (ALL), hoito kestää 2,5 vuotta, ja sairaalajaksojen ja hoitoon liittyvien sivuvaikutusten lisäksi keskuslaskimokatetrit ja infektioriski rajoittavat lapsen fyysistä aktiivisuutta. Pitkäkestoinen syövän hoito lapsuudessa voikin vaikuttaa liikuntataitoihin ja terveellisten elämäntapojen omaksumiseen.
Antrasykliinit ja alkyloivat solunsalpaajat kuuluvat olennaisena osana sekä lasten leukemioiden että useiden kiinteiden kasvainten hoitoon. Antrasykliinit ovat tunnetuin sydänhaittavaikutuksia aiheuttava lääkeryhmä. Ne voivat aiheuttaa välittömin oirein ilmenevää sydäntoksisuutta, mutta tavallisemmin sydänlihassoluihin syntyy pieniä vaurioita, jotka voivat edetä oireiseksi sydämen vajaatoiminnaksi laajentavan tai joskus restriktiivisen kardiomyopatian taudinkuvalla jopa vuosien tai vuosikymmenten kuluessa (7,8,12).
Oireisen kardiomyopatian ilmaantuvuus lapsuus- tai nuoruusiän syövän hoitojen jälkeen vaihtelee mm. hoitomuotojen ja seuranta-ajan mukaan. Oireettomia sydänlöydöksiä on paljon (13,14). Antrasykliinien sydäntoksisuus on pääosin annosriippuvaista (15). Sydämen vajaatoiminnan ilmaantuvuus on alle 5 %, kun antrasykliiniannos on alle 250 mg/m2, vajaat 10 % annoksen ollessa 250-600 mg/m2 ja yli 30 % annoksen ylittäessä 600 mg/m2 (15,16). Lapsille annetaan enää harvoin yli 300 mg:n/m2 kumulatiivista antrasykliiniannosta, mutta aiempina vuosikymmeninä hoidetuilla tai uusiutuneen syövän hoidossa annokset voivat olla tätä suuremmat.
Sydämen vajaatoimintaa ja oireettomia muutoksia sydänlihaksen toiminnassa on havaittu myös pienten antrasykliiniannosten jälkeen, eikä täysin turvallista annosta tiedetä (12,13). Myös geenit vaikuttavat riskiin (17). Riski saattaa olla suurempi naisilla ja nuorena sairastuneilla (8,13). Sydämen vajaatoiminnan kumulatiivinen ilmaantuvuus suurenee seuranta-ajan pidetessä, ja kolmekymmentä vuotta antrasykliinihoidon jälkeen se on noin 7,5 % (15). Riski ei tasaannu vuosikymmentenkään kuluessa (9,15).
Antrasykliinien sydäntoksisuuden mekanismeja ei tunneta täysin. Merkittävinä mekanismeina pidetään tuman topoisomeraasi IIβ -entsyymin toiminnan estoa ja vapaiden happiradikaalien muodostumista. Nämä johtavat eri mekanismein sydänlihassolujen toimintahäiriöihin, ohjelmoituneeseen solukuolemaan ja edelleen sydänlihaksen fibroosiin (7,17,18) aiheuttaen sydämen seinämien ohentumista, vasemman kammion laajentumista ja supistuvuuden heikkenemistä. Alkuvaiheessa oireeton sydänvaurio voi muuttua oireiseksi vajaatoiminnaksi, kun sydämen kompensaatiomekanismit ylittyvät lapsen kasvun tai muiden kuormitusta lisäävien tekijöiden vuoksi. Ohjelmoituneen solukuoleman lisäksi antrasykliinit aiheuttanevat pysyviä vaurioita jäljelle jääneiden sydänlihassolujen mitokondrioiden ja sarkomeerien toimintaan sekä kalsiumtasapainoon (18). Vaikkei kardiomyopatiaa kehittyisi, sydänlihaksen kyky selvitä tulevista stressitekijöistä ja vaurioista voi olla pysyvästi heikentynyt (18).
Muilla solunsalpaajilla on todettu olevan joitakin antrasykliinien vaikutuksista eroavia varhaisia haittavaikutuksia sydämeen, mutta niiden mekanismit tunnetaan huonommin (19). Suorien sydänvaikutusten lisäksi solunsalpaajat voivat vaikuttaa sydänsairastuvuuteen mm. tromboembolisten ja verenpainevaikutustensa takia.
Sädehoidon käyttöä lasten syöpiin on vähennetty. Sitä käytetään kuitenkin edelleen tiettyjen aivokasvainten hoidossa, paikallisesti kiinteiden kasvainten hoidossa ja palliatiivisena hoitona. Koko kehon sädehoito allogeenisen kantasolusiirron esihoitona vähenee koko ajan. Sydämeen kohdistuvat haittavaikutukset ovat myös vähentyneet kokonaissädeannoksen pienentämisen, terveen kudoksen sädealtistuksen minimoimisen ja sädehoidon jaksottamisen ansiosta.
Vaikka lapsen kehittyvä elimistö on herkempi sädehoidon haittavaikutuksille kuin aikuisen, suurin osa sädehoidon sydän- ja verisuonihaittavaikutuksista ilmenee vasta aikuisiässä. Sädehoito aiheuttaa terveessä kudoksessa tulehduksellisia muutoksia, verisuonten endoteelivaurioita ja myöhäisvaiheen muutoksena fibroosia, ja nämä voivat johtaa sydänhaittavaikutuksiin 5-20 vuoden kuluttua (17). Riskiä lisäävät suuri sädeannos ja sädehoidolle altistunut osuus sydämen tilavuudesta, sädehoidon ja antrasykliinien yhteisvaikutus, nuori ikä, sekä tavanomaiset sydän- ja verisuonitautien riskitekijät (20).
Jos on kasvuiässä saanut rintakehälle 15-35 grayn (Gy) sädeannoksen, sydämen vajaatoiminnan, sydäninfarktin, sydänpussin sairauksien ja läppäongelmien riski on 2-3-kertainen verrattuna sädehoidoille altistumattomien riskiin, ja sädeannoksen ollessa yli 35 Gy riski kasvaa 4-6-kertaiseksi (8). Myös 5-15 Gy:n sädeannoksiin liittyy pitkäaikaisseurannassa lisääntynyt sydänperäisen kuoleman riski (21).
Suurten sädeannosten aiheuttama perikardiitti on nykyisin harvinainen (17). Sekä antrasykliinit että sädevaurio aiheuttavat diastolisen toiminnan häiriön ennen systolisen vajaatoiminnan kehittymistä (22). Aortta- ja hiippaläpän toimintahäiriöt ovat tavallisia lymfooman sairastaneilla rintakehän suuriannoksisen sädehoidon jälkeen (22). Läppäongelmien ilmaantuvuus ja vaikeusaste lisääntyvät seuranta-ajan pidetessä (7). Tavanomaisilla ateroskleroosin riskitekijöillä on sädevaurion kanssa synergistinen vaikutus (20). Hiljaista iskemiaa on paljon, koska rintakivun aistiminen voi olla heikentynyt syöpähoitojen neurotoksisuuden vuoksi (7,23). Sädehoito voi aiheuttaa myös rytmi- ja johtumishäiriöitä, jotka voivat vaihdella oireettomista tahdistinhoitoa vaativiin.
Niin sädehoito kuin tietyt solunsalpaajatkin (mm. antrasykliinit, syklofosfamidi, sisplatiini ja metotreksaatti) voivat sydänvaikutustensa lisäksi vaurioittaa verisuonten endoteelia (19,24-26). Ateroskleroosin varhaisessa vaiheessa verisuonten endoteelin toiminta on heikentynyt verisuonten seinämän sileän lihaksen toiminnan säilyessä normaalina (24,27).
Pään ja selkäytimen alueen sädehoito lisää sydän- ja verisuonisairauksien riskiä myös hormonitoiminnan ja aineenvaihdunnan kautta (17). Munuaisten sädehoito lisää verenpainetaudin riskiä, ja pään ja kaulan alueen sädehoito altistaa aivoverenkiertohäiriöille (17). Koko kehon sädehoidossa käytetyt pienemmät sädeannokset voivat aiheuttaa systeemivaikutuksen välityksellä verenpaineen ja kolesteroliarvojen nousua (28).
Syövän hoitojen jälkeisen metabolisen oireyhtymän ajateltiin aluksi liittyvän lähinnä sädehoidon aiheuttamaan kasvuhormonivajeeseen. Uudempien tutkimusten perusteella kuitenkin ylipaino, insuliiniresistenssi, kohonnut verenpaine ja dyslipidemia ovat tavallisia myös sellaisilla lapsuusiän syövän sairastaneilla, jotka eivät ole saaneet sädehoitoa (10,29). Hoitojen suorien vaikutusten lisäksi riskitekijöiden lisääntymiseen vaikuttavat myös muut tekijät.
Huono kunto ja vähäinen fyysinen aktiivisuus ovat tavallisia syövän hoitojen jälkeen (30). Lihasmassan vähäisyys vaikuttanee insuliiniresistenssin esiintymiseen myös ilman ylipainoa erityisesti kantasolusiirron saaneilla (31). On myös esitetty, että metabolisten riskitekijöiden kehittyminen hoitojen aikana liittyisi osittain sentraaliseen leptiiniresistenssiin tai syövän hoitojen ja toistuvien antibioottilääkitysten aiheuttamiin muutoksiin suoliston mikrobistossa (32).
Suomalaisessa rekisteriaineistossa 0-19-vuotiaana sairastetusta syövästä selviytyneillä verenpainelääkityksen käyttö oli heidän sisarustensa lääkityksiin verrattuna 4,6-kertaista ja diabeteslääkkeiden 3,0-kertaista riskitiheyksien suhteella ilmaistuna (33). Pohjoismaisessa hoitoilmoitusrekisteriin perustuvassa aineistossa tyypin 1 diabeteksen todennäköisyys oli lapsena syövän sairastaneilla 1,3-kertainen ja tyypin 2 diabeteksen 1,8-kertainen väestön riskilukuihin verrattuna (34).
Lapsena syöpään sairastuneet ovat koko lapsuutensa lasten syöpälääkärin seurannassa. Aikuisena ilmenevien myöhäishaittojen seurannan järjestämiseksi yliopistosairaaloissa syöpäsairauksien klinikoiden yhteyteen on vasta perustettu myöhäisseurantapoliklinikoita, jotka koordinoivat tarvittavia seurantatutkimuksia ja hoitoa. Seuranta ja myöhäishaittojen tunnistus tapahtuu kuitenkin yhteistyössä perusterveydenhuollon kanssa (3).
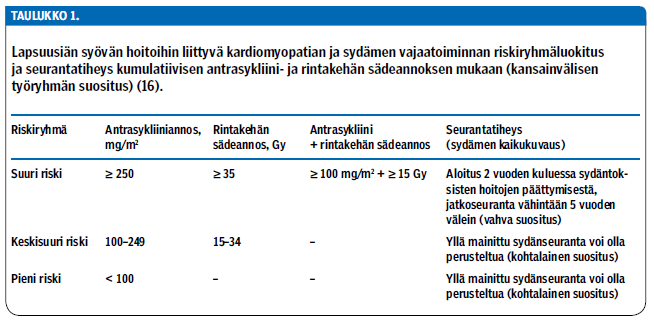
Antrasykliinejä tai rintakehän sädehoitoa kasvuiässä saaneet tarvitsevat myöhäisseurantaa, koska sydänvaurio voi olla pitkään oireeton ja ilmetä vasta vuosien kuluttua altistuksesta (17). Seurannalla pyritään löytämään oireeton kardiomyopatia varhain ja lääkehoidolla estämään sen eteneminen (17). Lasten seuranta on erityisen tärkeää, koska heillä sydämen toiminta on yleensä jo voimakkaasti heikentynyt oireiden ilmaantuessa eikä sydänperäistä syytä välttämättä osata epäillä. Kansainvälinen työryhmä julkaisi vuonna 2015 suosituksen seurannasta lapsuusiän syövän hoitojen aiheuttaman kardiomyopatian havaitsemiseksi (16), ja suomalainen työryhmä laati sen pohjalta vuonna 2016 konsensuslausuman (www.suomenlastenlaakariyhdistys.fi).
Syövän hoitojen perusteella on laadittu sydämen vajaatoiminnan riskiryhmäluokitus (taulukko 1 «»1). Suuren riskin ryhmään kuuluville suositellaan elinikäistä sydänseurantaa vähintään viiden vuoden välein, ja seuranta tulisi aloittaa kahden vuoden kuluessa sydäntoksisten hoitojen päättymisestä (16). Geneettisesti alttiit saattavat saada sydänhaittavaikutuksia jo pienempiä annoksia käytettäessä (17), joten myös keskisuuren ja pienen riskin ryhmissä sydänseuranta on aiheellinen ainakin lapsuudessa.
Sydämen kaikukuvaus on paras seurantamenetelmä. Sillä voidaan arvioida sydämen supistuvuutta ja lisäksi diastolista toimintaa, vasemman kammion kokoa, läppien toimintaa, mahdollista perikardiumnestettä sekä epäsuorasti keuhkovaltimopainetta (16,23). Kaikukuvaus on helppo tehdä myös lapsille, eikä siihen liity sädealtistusta. Tarkin ultraäänimenetelmä vasemman kammion ejektiofraktion mittaamiseen on kolmiulotteinen kuvaus, mutta sen puuttuessa tulee arvio tehdä kaksiulotteisella biplane-menetelmällä (23). Muovautumisen kuvantamisella voidaan havaita systolisia muutoksia ejektiofraktion ollessa vielä normaali (35). Diastolinen toiminta tulee arvioida doppler- ja kudosdopplermenetelmillä. Rintakehän sädehoitoa saaneille suositellaan lisäksi kajoamatonta sepelvaltimotaudin arviointia hiljaisen iskemian havaitsemiseksi viiden vuoden välein alkaen 5-10 vuoden kuluttua sädehoidosta (20,23).
Raskauden aiheuttama lisääntynyt volyymikuormitus voi saada oireettoman kardiomyopatian etenemään oireiseksi. Raskauteen liittyvät oireet voivat vaikeuttaa vajaatoimintaoireiden havaitsemista. Sydämen kaikukuvaus suositellaankin tehtäväksi kaikille antrasykliinejä tai sydämen alueen sädehoitoa saaneille joko ennen raskautta tai ensimmäisen raskauskolmanneksen aikana ja sen jälkeen tarvittaessa (16).
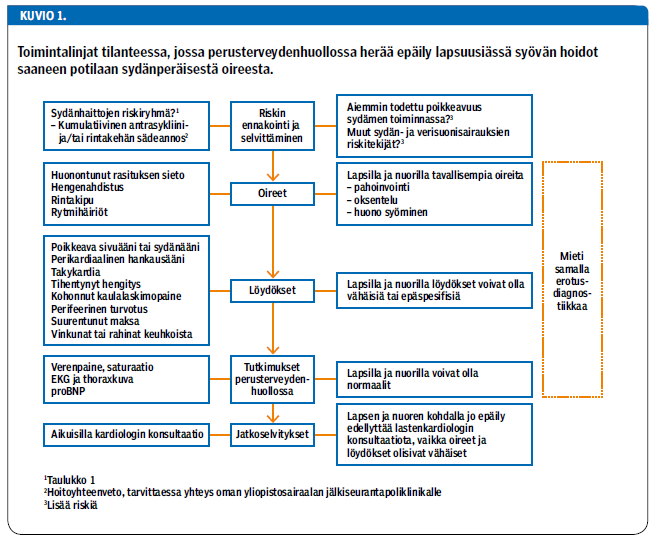
Kun perusterveydenhuollossa havaitaan lapsena syövän sairastaneella sydän- tai verisuonisairauteen viittaavia oireita ja löydöksiä, on käynnistettävä tutkimukset, vaikka potilas olisi nuori (kuvio 1 «»2). Lapsipotilas lähetetään lastenkardiologin konsultaatioon, vaikka löydökset olisivatkin vähäiset, ja myös aikuisista on syytä herkästi konsultoida kardiologia. Lisätutkimukset tehdään kardiologin arvion mukaan. Sydämen supistuvuutta arvioidaan kaikukuvauksella. Rasituskoetta voidaan myös tarvita, ja hengitys- ja verenkiertoelimistön toimintakykyä voidaan arvioida spiroergometrialla.
Syövän hoitoja on kehitetty sydän- ja verenkiertoelimistön kannalta turvallisemmiksi hoidon tehon kärsimättä, ja sädehoitotekniikoiden kehitys on vähentänyt terveen kudoksen haittavaikutuksia. Liposomaalisen doksorubisiinin ja suonensisäistä rautaa kelatoivan deksratsoksaanin on pienissä aineistoissa todettu vähentävän antrasykliinien sydänhaittavaikutuksia. Niiden käyttö on kuitenkin vähäistä, eikä pitkäaikaisvaikutuksia syövän hoitotuloksiin täysin tunneta (17).
Verenpainetauti, dyslipidemia, insuliiniresistenssi ja ylipaino lisäävät antrasykliinien ja rintakehän sädehoidon aiheuttamaa sydämen vajaatoiminnan ja sepelvaltimotaudin riskiä (17,36). Verenpaineen, paastoverensokerin ja rasva-arvojen mittaus ja tarvittavat interventiot kuuluvat syövän hoitojen jälkeiseen seurantaan myös aikuisiässä (16,17). Suuren riskin potilaille (ml. kantasolusiirto, munuaisten sädehoito) tulee harkita verenpaineen vuorokausirekisteröintiä (17,37).
Varhaisen metabolisiin riskitekijöihin puuttumisen vaikutuksista lapsena syövän sairastaneiden myöhempään sydän- ja verisuonisairastuvuuteen ei ole tutkimustietoa. Kuitenkin myös tässä potilasryhmässä liikuntainterventiolla on saatu positiivisia vaikutuksia sekä kuntoon että insuliiniresistenssiin ja verisuonten endoteelin toimintaan, vaikka painoindeksi ei muuttuisi (26,38).
Mikäli sydämen toiminta on normaalia, liikuntaa pidetään syövän hoitojen jälkeen suositeltavana ja turvallisena. Käypä hoito -suosituksen (39) mukaiset väestön terveysliikunnan tavoitteet ovat sopivia. Jos sydämen toiminnassa on havaittu poikkeavuutta, suositellaan kardiologin konsultaatiota turvallisen liikunnan rajojen määrittämiseksi. Voimakasta ponnistelua vaativia lajeja aloitettaessa kardiologin konsultaatiota tulee harkita ainakin suuren riskin potilaille (16).
Antrasykliinien aiheuttama sydämen vajaatoiminta oli aiemmin huonoennusteinen (12), mutta vaste lääkehoitoon on parantunut uusien vajaatoimintalääkkeiden ja varhaisemman diagnosoinnin ansiosta (40). Silti antrasykliinikardiomyopatia voi yhä johtaa sydämensiirtoon ja kuolemaan (41). Antrasykliinien aiheuttaman sydänvaurion hoidosta lapsilla on vain vähän tutkimusnäyttöä, ja hoito perustuu aikuisista syöpäpotilaista ja muista sydänpotilaista tehtyihin tutkimuksiin. Vuosia lapsuusiän syöpään annetun antrasykliinihoidon jälkeen aloitettu enalapriililääkitys paransi vasemman kammion toimintaa lyhytaikaisesti sekä oireisessa että oireettomassa kardiomyopatissa, mutta ei vaikuttanut ennusteeseen (42,43). Aikuisten syöpäpotilaiden tulokset ovat parempia, kun vajaatoimintalääkitys aloitetaan varhain (40). Sekä oireiseen että oireettomaan vajaatoimintaan suositellaan ACE:n estäjää, beetasalpaajaa tai niiden yhdistelmää (16,17,23,44).
Selvitimme sairauskertomustiedoista Tampereen ja Turun yliopistollisten sairaaloiden lastenklinikoissa vuosina 2005-15 tehdyt lasten syövän hoitoihin liittyneet kardiomyopatia- ja vasemman kammion vajaatoimintadiagnoosit. Tarkastelujakson aikana todettiin syöpä yhteensä 682 lapsella.
Syöpädiagnoosin jälkeinen vasemman kammion vajaatoiminta todettiin 20 lapsella (taulukko 2 «»3). Näistä 9 todettiin vuoden kuluessa antrasykliinihoidosta (varhainen), 9 yli vuoden kuluttua antrasykliinihoidon loppumisesta (myöhäinen) ja 2 vuosien jälkeen ilmaantuneen relapsin tai toisen syövän aikana. Vajaatoimintapotilaista 11 kuului hoitojensa sydäntoksisuuden perusteella suuren riskin, 8 keskisuuren riskin ja 1 pienen riskin ryhmään.
Kaikki myöhäiset vajaatoiminnat todettiin oireettomina rutiiniseurannassa, ja varhaisistakin vain yksi oli oireinen. Kaikille potilaille aloitettiin sydänlääkitys.
Vaikka antrasykliinien ja sädehoidon käyttöä on vähennetty, ne ovat edelleen keskeinen osa hoitoa monissa lasten ja nuorten syövissä ja kardiomyopatiaa esiintyy myös nykyisin käytettävien antrasykliiniannosten jälkeen. Myöhäisseurantapoliklinikat ovat jatkossa tärkeässä roolissa sydänhaittojen varhaisessa havaitsemisessa, mutta sydänhaittojen mahdollisuus on tärkeää muistaa myös perusterveydenhuollossa.
Lapsena syöpään sairastuneiden on hyvä olla tietoisia lisääntyneestä sydän- ja verisuonisairauksien riskistään, jotta he tarvittaessa hakeutuvat nopeasti tutkimuksiin ja kardiomyopatian hoito päästään aloittamaan varhain. Tietoisuus riskistä kannustaa myös vaikuttamaan tavanomaisiin riskitekijöihin omilla valinnoilla. Terveydenhuollon henkilöstön kannattaa aktiivisesti ohjata ja tukea lapsena syövän hoidot saaneita edistämään omaa sydänterveyttään liikunnallisella elämäntavalla, terveellisellä ravinnolla, tupakoimattomuudella ja normaalipainoon pyrkimisellä. Näiden potilaiden hypertension, dyslipidemian ja tyypin 2 diabeteksen lääkehoitoa ei pidä viivästyttää, jos elämäntapamuutokset eivät näytä yksin riittävän.
Kiitokset Tampereen yliopistollisen sairaalan tukisäätiölle tiedonhakupoimintaan saadusta apurahasta.
In Finland, around 240 children and adolescents aged < 20 years are diagnosed with cancer annually. Over 80% of them are cured and thus treatment-related late effects should be minimized. Anthracyclines and chest radiotherapy have mainly dose-dependent cardiotoxic effects that may become symptomatic years or even decades after therapy. Cancer treatment protocols have been modified to be safer for the heart but there are still a number of adult survivors who were exposed to high anthracycline or radiation doses during childhood. The incidence of many modifiable cardiovascular risk factors is increased after childhood cancer, further increasing the risk for cardiovascular morbidity and mortality.
A recent international guideline recommends lifelong cardiomyopathy surveillance with echocardiography for childhood cancer survivors exposed to high cumulative anthracycline (≥ 250 mg/m2) or chest radiotherapy doses (≥ 35 Gray), or their combined effect (anthracycline ≥ 100 mg/m2 and chest radiotherapy ≥ 15 Gray). The aim of the screening is to find cardiomyopathy at an asymptomatic stage and prevent its progression with medication. Screening for modifiable cardiovascular risk factors and necessary interventions should also be performed.
University hospitals in Finland have recently begun to organize follow-up clinics to coordinate the screening, diagnostics and therapy of the adult onset late effects of childhood cancer. Close collaboration with primary health care is needed to identify the survivors with cardiac late effects.
Childhood cancer survivors and their healthcare providers should be aware of the risk of cardiomyopathy and other cardiovascular disease. The awareness diminishes diagnostic delay and enables early treatment of cardiomyopathy. All childhood cancer survivors should be advised on a heart-healthy lifestyle. Regular exercise is recommended for all childhood cancer survivors with normal cardiac function.