Ks. artikkelin pdf-versio «http://www.fimnet.fi/cl/laakarilehti/pdf/2018/SLL162018-988.pdf»1 Lääkärilehden sivuilla (vaatii FiMnet-tunnuksen).
Keuhkopussissa eli pleurassa on normaalisti tilavuudeltaan 10-20 ml:n kokoinen 5-10 μm paksu liukastava nestekerros, joka mahdollistaa keuhkojen kitkattoman liikkumisen rintaontelossa hengitysliikkeiden aikana. Tavallisesti nesteen muodostuminen ja sen poistuminen ovat tasapainossa siten, että pleuratilassa vallitsee keuhkoja laajoina pitävä alipaine. Pleuranestettä alkaa kertyä, kun nestekierron fysiologinen tasapaino järkkyy. Varsinaiset pleuran sairaudet ovat harvinaisia, eikä nestekertymä itsessään ole sairaus, vaan melko tavallinen löydös, joka voi olla useiden patologisten tilojen seurausta.
Pleuranestekertymä voi olla molemminpuolinen tai vain toisella puolella. Selvittely nojaa huolelliseen anamneesiin ja potilaan kliiniseen tutkimiseen. Lisäksi tarvitaan kuvantamistutkimuksia. Nestekertymän ollessa toispuolinen, syyltään epäselvä ja hoitoon reagoimaton tulee harkita diagnostista pleurapunktiota ja nesteen koostumuksen analysointia. Vaikka tämän avulla ei varmaan diagnoosin päästäisikään, se rajaa vaihtoehtoja. Jos potilaalla on kliinisesti ilmeinen sydämen vajaatoiminta ja molemminpuoliset pleuranestekertymät ilman pleuriittiin viittaavaa rintakipua tai kuumeilua, lisätutkimuksia ei heti tarvita (1).
Pleuranestekertymän syyn selvittelyä ohjaa se, onko neste transsudaattia vai eksudaattia. Transsudaatin syntyprosessissa pleura on terve, mutta systeemisen hydrostaattisen tai onkoottisen paineen muutosten vuoksi pleuranestettä muodostuu enemmän kuin sitä ehtii poistua. Eksudaatti voi muodostua pleuran tai keuhkon inflammaatioprosessin aiheuttaman kapillaarivuodon seurauksena, rintakehän imuteiden takaisinvirtauksen estyessä tai näiden yhteisvaikutuksena. Tällöin nestettä ja proteiineja kertyy pleuratilaan (2,3). Pleuriitilla tarkoitetaan keuhkopussin tulehdusreaktiota, joka voi johtaa eksudatiivisen pleuranestekertymän muodostumiseen.
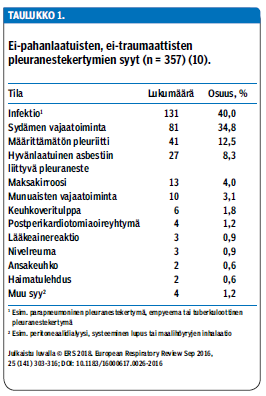
Ylivoimaisesti tavallisimmat pleuranesteen kertymisen syyt ovat sydämen vajaatoiminta, infektiot ja syövät (taulukko 1 «»1) (4-6). Sydämen vajaatoiminnasta aiheutuva keuhkokapillaarien hydrostaattisen paineen nousu voi johtaa transsudatiivisen pleuranesteen kertymiseen, tavallisimmin molemmille puolille (5,7,8). Keuhkokuumeet voivat aiheuttaa tulehdukseen liittyvän parapneumonisen pleuranestekertymän. Jos neste muuttuu märkäiseksi, kyse on empyeemasta. Arviolta jopa 25 % infektioperäisistä pleuriiteista on virustulehdusten aiheuttamia (6). Nämä ovat hyvänlaatuisia ja itsestään parantuvia. Kaikista pleuranesteistä 15-23 % on syövän aiheuttamia (4,6). Syövistä pleuraan leviävät tavallisimmin miehillä keuhkosyöpä ja naisilla rintasyöpä (3).
Hyvänlaatuista asbestialtistukseen liittyvää pleuranesteilyä esiintyy tavallisesti lyhyemmän latenssiajan jälkeen kuin muita asbestisairauksia. Tällöin nestekertymä on usein pieni ja oireeton. Sillä on taipumus parantua itsestään kuukausien kuluessa, mutta se jättää jälkeensä pleuraaliset paksuntumat (9,10). Munuaisten vajaatoimintaan, etenkin peritoneaalidialyysin yhteydessä, liittyy joskus transsudatiivista pleuranesteilyä. Maksan vajaatoiminnassa plasman onkoottisen paineen laskiessa voi muodostua transsudatiivista pleuranestettä. Useissa sidekudossairauksissa taudin yhtenä ilmentymänä voi olla pleuriitti, tai se saattaa liittyä myös näiden sairauksien hoidossa käytettyihin lääkkeisiin. Lääkereaktio syynä on harvinainen, mutta hyvin monet lääkkeet voivat sen aiheuttaa (10). Saman pleuranestekertymän taustalla saattaa olla useita tekijöitä (7).
Pieni pleuranesteen ylimäärä voi olla oireeton. Tavallisin oire on hengenahdistus, mutta sen voimakkuus ei välttämättä ole suhteessa nestekertymän kokoon (10,11). Lisäksi saattaa esiintyä kuivaa yskää sekä kipua rintakehällä tai palleapleuran ärsytyksen heijastamana hartiassa. Pleuriitissa saattaa olla kuumetta. Mikäli nestettä on vähän, saattaa esiintyä pistävää ja hengitysliikkeiden mukana vaihtelevaa kylkikipua ja auskultaatiossa voidaan kuulla pleuraalinen hankausääni. Nestemäärän lisääntyessä kipu voi lievittyä.
Kliinisellä tutkimuksella vähäistä pleuranestekertymää on vaikea todeta. Kun nestettä on runsaasti, keuhkojen auskultaatiossa hengitysäänet ovat vaimentuneet tai ne saattavat puuttua nesteen peittämällä alueella. Perkussiolla voidaan todeta nesteen kohdalla painumus. Löydösten puolieroon tulee kiinnittää huomiota. Koska huomattava osa pleuranestekertymistä johtuu muista kuin pleuran tai keuhkojen sairauksista, potilas on tutkittava huolellisesti kiinnittäen huomiota merkkeihin, jotka viittaavat systeemisairauden mahdollisuuteen.
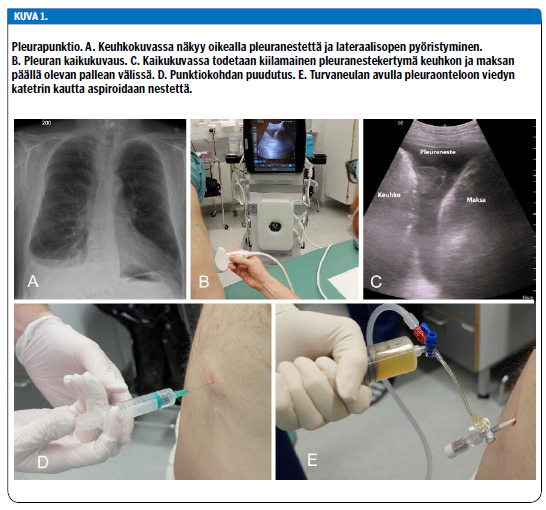
Pleuranestettä epäiltäessä ensimmäinen tutkimus on keuhkoröntgenkuva. Tyypillinen löydös on pleurasoppien pyöristyminen (kuva 1 «»2). Jos nestettä on runsaasti, se voi varjostaa keuhkoja laajastikin. PA-projektiossa neste on havaittavissa määrän ylittäessä 200-300 ml, sivukuvassa jopa 50 ml saattaa olla havaittavissa takasopen pyöristymisenä (12). Pelkässä makuukuvassa suurikin nestemäärä saattaa jäädä huomaamatta. Pieniä nestemääriä voidaan havaita myös kylkiasennossa otettavasta kylki- eli translateraalikuvasta ja samalla voidaan todeta, onko neste liikkuvaa vai lokeroitunutta.
Rintakehän kaikukuvaus on röntgenkuvauksia herkempi, ja otollisissa olosuhteissa jo 5-10 ml:n suuruinen paikallinen nestekertymä voi olla havaittavissa (13). Kaikukuvauksella nähdään paremmin myös keuhkopussin rakenteelliset poikkeamat, kuten paksuntumat tai sen kiinnikkeisyys ja lokeroisuus. Vähäiset pleuranestemäärät voidaan todeta myös rintakehän tietokonetomografialla (TT) tai magneettikuvauksella, mutta ne vaativat enemmän laiteresursseja ja ovat siksi rajoitetummin saatavilla (14). Kumpikaan ei kuulu pleuranestekertymän ensivaiheen tutkimuksiin.
Pleurapunktion voi tehdä turvallisesti, mikäli nestettä on kaikukuvauksella tai keuhkon translateraalikuvasta arvioituna vähintään 10 mm:n vaippa keuhkon ja rintaontelon seinän välissä. Punktiokohdan valinnassa ja tarvittaessa itse toimenpiteen suorittamisessa tulee käyttää apuna kaikukuvausta aina laitteen ollessa saatavilla, sillä se parantaa punktion osuvuutta ja vähentää komplikaatioiden riskiä (15) (kuva 1 «»2). Potilaan asento on hyvä valita siten, että painovoiman mukaisesti valuva neste on mahdollisimman helposti punktoitavissa. Parhaiten tämä onnistuu, kun potilas on tuettuna istuvassa asennossa tai selinmakuulla ylävartalo hieman kohotettuna. Kädet tulee kohottaa, sillä tällöin kylkiluuvälit avautuvat paremmin. Asennon tulee pysyä samana koko toimenpiteen ajan.
Diagnostinen punktio tehdään aseptisesti ohuella (21 G) neulalla ja ruiskulla. Ensin punktiokohta varmistetaan kaikukuvauksella ja puudutetaan 1-prosenttisella lidokaiiniliuoksella (kuva 1 «»2). Samalla nesteen sijainti vielä varmistetaan aspiroimalla sitä puuduteruiskuun. Odottelun jälkeen ruiskuun kiinnitetty punktioneula viedään kylkiluun yläreunaa hipoen kohti nestekertymää kevyesti aspiroiden, kunnes ruiskuun tuleva neste osoittaa neulan olevan pleuratilassa. Vaihtoehtona terävälle punktioneulalle on saatavilla myös turvaneulalla varustettu pleurapunktiosetti, jota käytettäessä komplikaatioriski on vähäisempi.
Kattavien diagnostisten näytteiden saamiseen riittää 50-150 ml pleuranestettä (9). Mikäli potilas oireilee runsaan pleuranesteen takia, sitä kannattaa poistaa enemmän. Keuhkopöhövaaran takia kerralla voi poistaa enintään 1 500 ml nestettä. Vanhusten, huonokuntoisten ja pienikokoisten potilaiden pleurapunktioissa kannattaa olla tätäkin varovaisempi (15).
Harkintaa ja varovaisuutta on syytä noudattaa, mikäli potilaalla on vuototaipumusta tai veren hyytymiseen vaikuttava lääkitys. Alustavaa näyttöä on siitä, että pleurapunktio on taiten tehtynä turvallinen näistä huolimatta (16,17); näyttöä on toistaiseksi vain hepariinivalmisteista, varfariinista, asetyylisalisyylihaposta (ASA) ja klopidogreelistä (17). Yleisesti hyväksyttyjen suositusten mukaan hyytymiseen vaikuttavat lääkkeet ASA:aa lukuun ottamatta on kuitenkin syytä tauottaa. Lisäksi trombosyyttitason on hyvä olla yli 50 x 109/l ja INR-arvon alle 1,5 (15). Toimenpiteen jälkeen potilasta on seurattava ainakin 1-2 tuntia ilmarinta- ja verenvuotoriskin takia. Keuhkokuvakontrolli helposti onnistuneen toimenpiteen jälkeen ei ole tarpeen, ellei ruiskuun aspiroidu ilmaa tai potilas saa komplikaatioon viittaavia oireita, kuten hengenahdistusta, kipua tai yskää (15).
Jo pleuranesteen ulkonäkö voi antaa viitteitä syystä ja suunnata laboratoriokokeita. Huomiota kiinnitetään nesteen väriin, sameuteen, viskositeettiin ja hajuun. Useimmiten neste on kirkasta, hennon kellertävää, hajutonta sekä helposti juoksevaa, eikä sen ulkonäkö tällöin anna viitettä etiologiasta.
Punertava väri viittaa vereen. Jos neste on ruskehtavaa, veri on voinut olla pleuratilassa jo pidempään. Verinen neste voi viitata maligniteettiin, keuhkoveritulppaan tai traumaan, mutta sen syynä voi olla myös veren hyytymiseen vaikuttava lääkitys. Mikäli nesteen hematokriittitaso on yli 50 % veren hematokriitistä, kyseessä on veririnta (9).
Pleuranesteen sameus johtuu tavallisesti sen solukkuudesta sekä solujen hajoamistuotteista ja voi viitata empyeemaan etenkin, jos neste haisee pahalle. Hyvin purulentti pleuraneste on yleensä myös varsin jähmeää. Imunesteestä koostuvassa kylothoraxissa nesteen triglyseridipitoisuus on suurentunut, ja tämä saa aikaan maitomaisen samean ulkonäön. Mesotelioomaan liittyvä pleuraneste on joskus kirkasta ja viskoosista suurentuneen hyaluronaattipitoisuuden takia (12).
Pleuranesteestä voidaan tutkia kaikkea sitä, mitä seerumistakin, mutta vain tietyistä tutkimuksista on kliinistä hyötyä. Rutiinityössä laboratoriomääritykset suunnataan potilaan kliinisen tilan ja punktoidun nesteen ulkonäön mukaan. Esimerkiksi maligniteettia epäiltäessä tulee ottaa näytteet myös sytologista analyysiä varten, ja infektiotilanteissa mikrobiologiset näytteet ovat oleellinen osa diagnostiikkaa. Nesteestä määritetään aina vähintään perustutkimukset (taulukko 2 «»3). Pleuranestetutkimuksia vastaavat näytteet otetaan samaan aikaan seerumista.
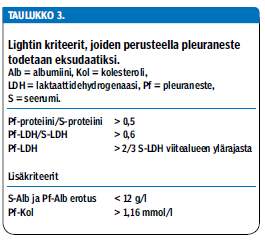
Tuloksista arvioidaan ensimmäiseksi, onko neste transsudaattia vai eksudaattia. Tällä luokittelulla on tärkeä merkitys erotusdiagnostiikan ja jatkotutkimusten kannalta. Karkeasti jako voidaan tehdä pleuranesteen proteiinipitoisuuden perustella: kun proteiinia on alle 30 g/l, kyseessä on transsudaatti, ja tämän arvon ylittyessä kyseessä on eksudaatti. Lightin kriteereitä käyttäen tilanne voidaan analysoida tarkemmin (taulukko 3). Yhden tai useamman pääkriteerin täyttyessä neste on eksudaattia hyvin suurella todennäköisyydellä (sensitiivisyys 98 %, spesifisyys 83 %) (1). Diureettilääkitystä käyttävillä sydämen vajaatoimintaa sairastavilla potilailla Lightin kriteerit joskus saattavat tulkita transsudaatin virheellisesti eksudaatiksi, jolloin kyseessä on pseudoeksudaatti. Tällöin lisäkriteerit selventävät asiaa (taulukko 3 «»4) (18).
Mikäli neste osoittautuu transsudaatiksi, hoidetaan taustalla oleva perustauti. Jos kyseessä on eksudaatti, lisätutkimukset nesteilyn etiologian selvittämiseksi ovat tarpeen.
Normaalin pleuranesteen ominaisuuksista on niukasti tietoa. Viitearvoina on tavallisesti käytetty transsudatiivisen pleuranesteen ominaisuuksia (taulukko 4 «»5).
Pleuranesteen valkosolujen erittelylaskenta on avuksi diagnoosivaihtoehtojen rajaamisessa, mutta mikään löydös ei ole spesifinen. Neutrofiilisten solujen suuri osuus (yli 50 %) viittaa pleuran akuuttiin prosessiin, tavallisesti infektioon.
Alkuperäisestä syystä riippumatta tilanteen kroonistuessa lymfosyyttien osuus tavallisesti kasvaa, ja niiden osuuden ollessa yli 50 % taustalla saattaa olla syöpä tai tuberkuloosi (9). Hyvin suuri (yli 80 %) lymfosyyttien osuus liittyy erityisesti tuberkuloottiseen pleuriittiin, lymfoomaan, sarkoidoosiin, postperikardiotomiaoireyhtymään tai sidekudossairauksiin (19).
Tavallisimmat syyt pleuranesteen eosinofiliaan (eosinofiilien osuus yli 10 %) ovat maligniteetit, keuhkokuumeen aiheuttama pleuranestekertymä ja ilma- tai veririnta (20). Harvinaisempia syitä ovat lääkeainereaktiot, asbestisairaudet, parasiitti- tai sieni-infektiot, tuberkuloosi, sidekudossairaus sekä astmaan liittyvä eosinofiilinen granulomatoottinen polyangiitti (6,20).
Pleuranesteen pH on yleensä vähän korkeampi ja glukoosipitoisuus sama kuin veren. Tilanteissa, joissa epäillään pleuran infektiota eikä pleuraneste ole selvästi märkäistä, kannattaa mitata sen pH sekä glukoosipitoisuus. Matala pH-arvo (alle 7,30) liittyy tavallisesti pieneen glukoosipitoisuuteen sekä suureen laktaattidehydrogenaasipitoisuuteen ja viittaa pleuran infektion, maligniteetin, reumaattisen pleuriitin suuntaan tai ruokatorvivaurioon (9,12). pH ja glukoosi olisikin syytä tutkia samanaikaisesti.
Infektion aiheuttaman pleuranestekertymän pH-arvon ollessa alle 7,20 pleuran dreneeraaminen on yleensä tarpeen (9,12). Tämä onkin kliinisessä työssä tärkein pH-tason mittaamisen aihe. Malignissa pleuriitissa matala pH on huonon ennusteen merkki (10). pH on herkkä virhelähteille. Ruiskuun päässyt puudute tai ilma voi merkittävästi muuttaa tulosta (21).
Pleuranesteen ollessa vaaleaa ja maitomaista siitä tulee määrittää triglyseridit ja kolesteroli. Mikäli triglyseridipitoisuus on suuri (yli 1,24 mmol/l), kyseessä on kylothorax, jonka tavallisin syy on rintakehän imuteiden vaurioituminen joko trauman, leikkauksen tai maligniteetin takia. Alle 0,56 mmol/l oleva triglyseridipitoisuus sulkee kylothoraxin luotettavasti pois (22).
Kylothorax tulee erottaa pseudokylothoraxista, joka on seurausta kolesterolikiteiden kertymisestä pleuranesteeseen. Kolesterolikiteiden havaitseminen tai 5,18 mmol/l ylittävä kolesterolipitoisuus varmistavat tilan riippumatta triglyseridipitoisuudesta. Tavallisimmin syynä on reuman tai tuberkuloosin aiheuttama pleuriitti (9,22).
Kun pleuraneste on eksudaattia, 42-77 %:ssa tapauksista syynä on syöpä (6). Sytologia on diagnostinen jopa 50-60 %:ssa maligniteettien aiheuttamissa pleuriiteissa (9,23); diagnostinen osuvuus on suurin adenokarsinoomassa (9).
Näytteen osuvuus paranee, mikäli sivelyvalmisteesta jäljelle jäävästä materiaalista tehdään lisäksi solublokki (24). Siinä näyte sentrifugoidaan, saatu solumassa valetaan parafiiniin ja sitten käsitellään kuten histologinen näyte. Tämä mahdollistaa myös lisävärjäyksiä ja solukon tarkemman tyypityksen.
Jos nestekertymän taustalla epäillään olevan syöpä, sytologisten näytteiden otto kannattaa toistaa kerran, mutta sitä useampien näytteiden tutkiminen ei enää paranna tuloksia (9).
Mikäli kliinisen kuvan perusteella ei epäillä infektiota, pleuranesteestä ei ole tarpeen ottaa bakteerinäytteitä rutiininomaisesti. Jos kuitenkin on kyse pleuropneumoniasta tai empyeemasta, diagnostisen tuloksen todennäköisyys kasvaa, mikäli tavanomaisen bakteeriviljelynäytteen lisäksi nestettä aspiroidaan sekä aerobiseen että anaerobiseen veriviljelypulloon (25). Mykobakteerivärjäys on harvoin positiivinen, ellei potilaalla ole AIDS tai suoranaista tuberkuloottista empyeemaa (6,25). Pleuranesteen mykobakteeriviljelyn herkkyys on yleensä heikko (26).
Adenosiinideaminaasi (ADA) on aktivoituneiden lymfosyyttien erittämä inflammaation merkkiaine, jonka pitoisuus pleuranesteessä suurenee tuberkuloottisessa pleuriitissa. Sen ennustearvo on riippuvainen taudin vallitsevuudesta: suuren ilmaantuvuuden alueilla korkea ADA-arvo on herkkä tuberkuloottisen pleuriitin todennäköisyyden mittari, ja vähäisen ilmaantuvuuden alueilla matala ADA-arvo taas sulkee hyvällä varmuudella tuberkuloosin mahdollisuuden pois (9,26). Selvästi poikkeava ja riskipotilailla tuberkuloottiseen etiologiaan viittaava pleuranesteen ja seerumin ADA-pitoisuuksien suhde on yleensä yli 2. ADA-pitoisuus saattaa suurentua myös empyeemassa ja reuman aiheuttamassa pleuriitissa (1).
Kun kliininen tilanne ja pleuranesteen huolellinen analyysi eivät selvitä eksudatiivisen pleuriitin syytä, tulee harkita lisätutkimuksia. Tietokonetomografialla saadaan hyvä kuva rintakehän alueen anatomiasta ja sen muutoksista. Tilanteen mukaan magneettikuvaus tai positroniemissiotomografia saattaa tuoda lisäinformaatiota. Sopivista pleuramuutoksista voidaan ottaa kaikukuvaus- tai TT-ohjatusti näytteitä histologisia tutkimuksia varten.
Jos vähemmän kajoavat toimenpiteet eivät johda diagnoosiin, tulee harkita paikallispuudutuksessa tehtävää pleuroskopiaa. Sen yhteydessä pleuratila tutkitaan visuaalisesti ja otetaan poikkeavilta alueilta histologiset näytteet. Tutkimuksen diagnostinen herkkyys on hyvä, maligniteeteissa 93 % (9).
Perusteellisista tutkimuksista huolimatta huomattava osa eksudatiivisten pleuriittien syistä jää selvittämättä ja diagnoosiksi jää "määrittämätön pleuriitti". Näitä potilaita tulee seurata. Suurimmalla osalla tila rauhoittuu itsestään ajan kuluessa. Venekampin ym. (27) kaksi vuotta kestäneessä seurantatutkimuksessa 91,7 % epäspesifisistä pleuriiteista pysyi hyvänlaatuisina, peräti 81,7 % rauhoittui spontaanisti seurannan aikana ja vain 8,3 % osoittautui ajan mittaan pahanlaatuisiksi.
Pleuran epäselvän nestekertymän tutkimisessa tarvitaan usein nesteestä otettuja näytteitä, joita varten potilas tulee ohjata erikoissairaanhoitoon. Pleurapunktio on kaikukuvausohjattuna tottuneissa käsissä suhteellisen helppo ja turvallinen toimenpide. Tärkeintä on erottaa eksudatiiviset pleuranesteet transsudaateista, joissa oletetun perussairauden (tavallisimmin sydämen vajaatoiminnan) hoito ja seuranta ainakin aluksi riittävät. Pleuranesteen ollessa eksudaattia ovat aktiiviset jatkotutkimukset ja huolellinen pleuranesteen analyysi tarpeen.
Pleural effusion is a common problem in adults. The aetiology is heterogeneous, and more often related to systemic disorders than to a specific disease of the pleura.
Symptoms are cough, dyspnoea and chest pain. The initial evaluation relies on a careful history and a clinical examination, followed by a chest radiograph. If the cause of the pleural effusion is apparent after this initial approach, no further immediate investigations are needed and therapy should be targeted to the assumed underlying problem (e.g. congestive heart failure). If the aetiology remains unclear, or the condition does not improve with treatment, pleural fluid analyses are needed.
Thoracentesis under ultrasound guidance is a safe procedure. An amount of 50-150 ml of pleural fluid is adequate for diagnostic purposes. The first step in the evaluation is to determine whether the effusion is transudative or exudative. This distinction is achieved by applying Light´s criteria, comparing the levels of protein and lactate dehydrogenase in pleural fluid and serum. If the effusion is transudative, no further investigations are needed. If it is exudative, additional tests of the pleural fluid are required to establish the cause of the pleural disease. These include pH, total and differential cell counts, cytological analyses, microbiological smears and cultures and adenosine deaminase if pleural tuberculosis is suspected.
If the cause of an exudative pleural effusion remains obscure, invasive investigations are needed. Computed tomography provides information about the pathology and can be used as guidance in taking biopsies of pleural changes. Thoracoscopy is the investigation of choice when other tests are inconclusive and malignancy is suspected.
In a significant number of patients with exudative pleural effusion no specific diagnosis can be made. However, most of these effusions follow a benign course with eventual spontaneous resolution.