
Ks. artikkelin pdf-versio «http://www.fimnet.fi/cl/laakarilehti/pdf/2020/SLL192020-1127.pdf»1 Lääkärilehden sivuilla (vaatii FiMnet-tunnuksen).
Kihti on tauti, jossa virtsahappo kiteytyy niveliin, luihin ja pehmytkudoksiin. Se voi ilmetä äkillisenä niveltulehduksena tai pitkäaikaisena niveltautina, jossa kidemassaa kertyy kudoksiin (1). Kihtiä esiintyy 1-2 %:lla väestöstä, ja se on yleistynyt viime vuosikymmeninä (2,3). Uusien kihtitapausten ilmaantuvuus oli Kuopion reumatologisilla poliklinikoilla 12/100 000 vuonna 2000 (4). Luku oli pysynyt samana Pohjois-Savon alueella vuonna 2010 (5). Reumatologien hoitoon päätyvät vain haastavimmat kihtipotilaat.
Puriiniemästen aineenvaihdunnan lopputuote on virtsahappo, jonka muodostumista katalysoi ksantiinioksidaasi. Virtsahappo liukenee huonosti, ja sen liukoisuusraja on 37 °C:ssa noin 410 µmol/l (1). Suurentunut virtsahappopitoisuus voi johtua joko virtsahapon liian vähäisestä erityksestä, sen liiallisesta tuotosta tai liiallisesta puriinien saannista. Kihdissä on yleisempää (90 %) virtsahapon vähentynyt eritys kuin sen lisääntynyt muodostus (10 %) tai metabolinen häiriö (6). Synnynnäisestä virtsahapon liikatuotannosta on kyse vain harvoin.
Virtsahappoa muodostuu paljon, kun soluja syntyy ja kuolee tavallista runsaammin proliferatiivisissa tai tulehduksellisissa häiriöissä, kuten verisyövissä tai psoriaasissa, kemoterapiassa ja kudoksen hapenpuutteessa. Tuotannon määrää voidaan tutkia mittaamalla virtsaan erittyvän virtsahapon määrää. Vähäpuriinisella ruokavaliolla virtsahappoa erittyy 300-500 mg/vrk. Yli 600 mg:n eritys on merkki runsaasta tuotannosta.
Todennäköisyys sairastua kihtiin kasvaa seerumin virtsahappopitoisuuden suurentuessa, mutta suurin osa henkilöistä, joilla on suuri seerumin virtsahappopitoisuus, ei kuitenkaan koskaan saa kihdin oireita. Välttämätön patofysiologinen linkki suurentuneen virtsahappopitoisuuden ja oireisen kihdin välillä on virtsahappokristallikiteiden kertyminen (7).
Niveltulehduksen lisäksi virtsahappokiteet voivat kertyessään aiheuttaa munuaiskivitaudin virtsatiehyissä tai virtsahappomunuaistaudin, jossa virtsahappokertymät munuaiskudoksessa johtavat tulehdukseen ja etenevään vaurioon munuaistiehyiden soluvälitiloissa. Tällöin potilaalla on usein ulkoisiakin kihtikyhmyjä, toofeja, ja virtsan virtsahappopitoisuus on todennäköisesti suuri. Kroonisessa munuaisten vajaatoiminnassa plasman virtsahappopitoisuus suurenee, mutta tähän häiriöön ei liity virtsahapon lisääntynyttä eritystä (8).
Virtsahappo erittyy munuaisista munuaiskerästen kautta. Proksimaalisessa munuaistiehyessä se imeytyy suurimmaksi osaksi takaisin vereen, mutta erittyy myös aktiivisesti virtsaan (9). Virtsahapon eritystä vähentävät munuaisten vajaatoiminta yleensä ja mm. nestevajaus, happomyrkytys, raskausmyrkytys, lihavuus sekä lisäkilpirauhasen liika- ja vajaatoiminta.
Virtsahapon takaisin imeytymiseen osallistuvat proksimaalisen munuaistiehyen epiteelisolujen apikaalisella kalvolla kuljetusproteiinit URAT1, GLUT9 ja OAT4 ja sen erittymiseen kuljetusproteiinit BCRP, MRP4, NPT1 ja NPT4 (9). Munuaiset erittävät virtsaan myös lääkeaineita, joista mm. tiatsidit ja furosemidi erittyvät proksimaalisessa munuaistiehyessä. Diureetit vähentävät virtsahapon erittymistä proksimaalisesta munuaistiehyestä lisäämällä sen imeytymistä takaisin tai vähentämällä sen eritystä. Furosemidi, hydroklooritiatsidi ja salisylaatti estävät MRP4:n välityksellä tapahtuvaa virtsahapon erittymistä, jota allopurinoli kiihdyttää (10). Myös siklosporiini ja takrolimusiini vähentävät virtsahapon eritystä (6).
Yhden emäksen monimuotoisuus virtsahapon kuljetukseen ja puriiniemästen aineenvaihduntaan liittyvissä geeneissä vaikuttaa virtsahappopitoisuuteen (11,12). Suurehko virtsahappopitoisuus ennen diureettihoidon aloittamista liittyy kihdin ilmaantumiseen useammin kuin pieni arvo (11).
Kun seerumin virtsahappopitoisuus ylittää liukoisuusrajansa, virtsahappo alkaa kiteytyä. Kiteytymistä voivat edistää myös mekaaninen vamma tai ärsytys, nivelen rasittaminen ja alhainen lämpötila (1,6). Kihti on autoinflammatorinen sairaus, jossa kehon luontainen puolustusmekanismi hyökkää kehoa itseään vastaan rajummin kuin olisi tarpeen oppimatta kuitenkaan vastustuskykyiseksi näitä ärsykkeitä kohtaan.
Kihtikohtauksessa tieto kihtikiteistä välittyy Tollin kaltaisen reseptori 4:n (TLR4) avulla inflammasomiin NLRP3, luontaisen immuniteetin proteiinikompleksiin (13,14). On todettu, että yhden emäksen muutos TLR4:ssa vaikuttaa tulehdusreaktioon (14). Toisaalta pelkkä kihtikide ei riitä aktivoimaan inflammasomia, vaan se tarvitsee signaalin TLR2:een sitoutuneiden vapaiden rasvahappojen välityksellä (3). NLRP3-inflammasomi säätelee ja käynnistää kaspaasi-1:n toiminnan. Kihtitulehduksessa interleukiini-1ß:n määrä riippuu kaspaasi-1:n aktiivisuudesta (15). Kihtikohtaus laantuu, kun ensin erilaistuneet makrofagit eristävät proteiinien peittämät kiteet, neutrofiilit ajautuvat apoptoosiin, tulehduksenvälittäjät inaktivoituvat ja anti-inflammatoriset välittäjäaineet aktivoituvat (6).
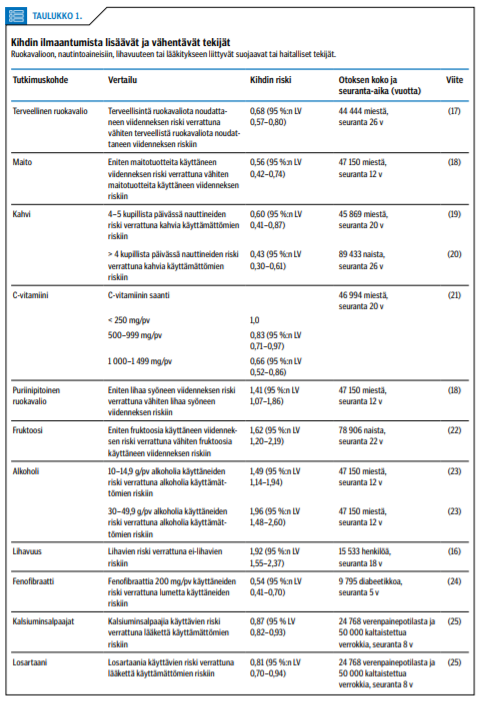
Ruokavalioon, nautintoaineisiin, lihavuuteen ja lääkitykseen liittyy suojaavia ja haitallisia tekijöitä, jotka vähentävät tai lisäävät kihdin ilmaantumista (taulukko «»1) (16-25). Ylipainon on todettu olevan selvä riskitekijä kihdin ilmaantumiselle. Yhdysvaltalaisen tutkimuksen mukaan jo 21-vuotiaana lihava henkilö sairastuu kihtiin keskimäärin 11 vuotta nuorempana kuin saman ikäisenä normaalipainoisena pysynyt henkilö (16). Runsaan lihan ja merenelävien, kanan- ja kalannahkan sekä alkoholin, erityisesti oluen ja väkevien alkoholien käytön yhteys kihtiin on tunnettu pitkään (17,18). Kihtikohtausten riskiä vähentää painon pysyminen normaalirajoissa sekä terveellinen C-vitamiinipitoinen ruokavalio, joka sisältää vähärasvaisia maitotuotteita ja päivittäin vähintään neljä kupillista kahvia (16-21).
Kihtiä tulee epäillä erityisesti miehillä, joilla on jalkaterän tai nilkan alueella yhden nivelen äkillinen kipu ja turvotus, joka voi toistua (1). Kihdissä voi kuitenkin sairastua mikä tahansa nivel, kuten olka- tai lonkkanivel tai pienet fasettinivelet selkärangan alueella. Monen nivelen samanaikaista tulehtumista on havaittu yhä useammin.
Kihtikertymiä ja niistä aiheutuvia oireita voi esiintyä myös pehmytkudoksissa, bursissa, jännetupissa, rustoissa ja jopa silmässä. Munuaiskivitauti saattaa olla viite kihdistä. Kihtikohtauksen yhteydessä voi ilmaantua kuumetta. Potilaalla todetaan usein kardiovaskulaarisia riskitekijöitä, kuten ylipaino, verenpainetauti, diabetes ja/tai rasva-aineenvaihdunnan häiriö, tai hänellä on jo tiedossa sepelvaltimotauti tai sydämen vajaatoiminta, ehkä myös suurentunut veren virtsahappopitoisuus (26). Ruokavaliosta on syytä selvittää oluen ja muiden alkoholijuomien, kala- ja liharuokien sekä makeutettujen virvoitusjuomien käyttöä ja niveltulehduksen ilmaantumisaikaa käyttöön nähden.
Nivelnestenäytetutkimuksella voidaan varmistaa diagnoosi. Tulehduksellisessa nivelnesteessä valkosoluja on yli 2 000 x 106/l ja polymorfonukleaaristen valkosolujen osuus erittelylaskennassa nousee 60-90 %:iin. Tällainen löydös voidaan todeta myös aktivoituneen kroonisen niveltulehduksen (kuten nivelreuman tai psoriaasiniveltulehduksen), bakteerin aiheuttaman reaktiivisen tai märkäisen niveltulehduksen tai kideartriitin yhteydessä. Kideartriitti voidaan todeta jopa samanaikaisesti em. niveltulehdusten kanssa. Märkäisen niveltulehduksen yhteydessä polymorfonukleaaristen valkosolujen määrä on usein yli 50 000 x 106/l, mutta tällainen löydös on tavallinen myös reaktiivisen artriitin ja kideartriitin yhteydessä.
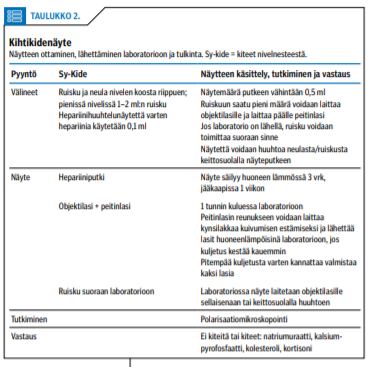
Myös aiemmin tiedossa olevan niveltaudin aktivoituessa on syytä tehdä nivelnestetutkimus, jos epäillään mahdollista oheissairautta. Kiteitä etsitään polarisaatiomikroskopoinnilla. Ohjeet kidenäytteiden ottamiseen ja lähettämiseen on esitetty taulukossa (taulukko «»2). Jos halutaan tutkia myös nivelnesteen solut, hepariiniputkeen otetun näytteen on oltava laboratoriossa tunnin kuluessa. EDTA-putkessa solut säilyvät 6 tuntia, mutta EDTA-putken näytteestä ei voi tutkia kiteitä.
Diagnoosin varmistuttua hoito voidaan kohdistaa oikein ja välttää epätarkoituksenmukaiset hoidot sekä mahdollisen pitkittyvän sairaalahoidon kulut. Tavallisin erotusdiagnostinen ongelma äkillisissä niveltulehduksissa on valekihti (27). Muiden reumatautien lisäksi erotusdiagnoosina on muistettava ruusu. Jalkaterässä äkillinen ja kivulias tulehduksen alku aamuyöllä viittaa kihtiin, samoin toofien löytyminen.
Tiedot lääkityksestä ja munuaisen toiminnanvajauksesta voivat auttaa erotusdiagnoosien arvioinnissa. Myös aiemmin tutkitut virtsahappopitoisuudet kannattaa huomioida. C-reaktiivisen proteiinin pitoisuus voi nousta kihtikohtauksen aikana rajustikin, joten siitä on enemmän hyötyä hoidontarvetta arvioitaessa kuin erotusdiagnostiikassa.
Kuvantamistutkimuksista kaikukuvauksella voidaan varmistaa nestekertymät, arvioida ruston paksuutta, luupintojen terävöitymistä ja kiteiden sijaintia rustoissa. Röntgenkuvista on harvoin apua äkillisissä niveltulehduksissa, mutta ruston kalkkeutuminen voi antaa viitteen valekihdistä. Kudoksissa olevista kihtikiteistä saadaan varmistus kaksoisenergiakerroskuvauksella, jossa kihtikidemassa erottuu vihreänä (28). Kuvauksen voi tehdä yksikössä, jossa on kerroskuvausmahdollisuus. Sitä on syytä käyttää kihtiä epäiltäessä, jos diagnoosia ei pystytä muuten tekemään.
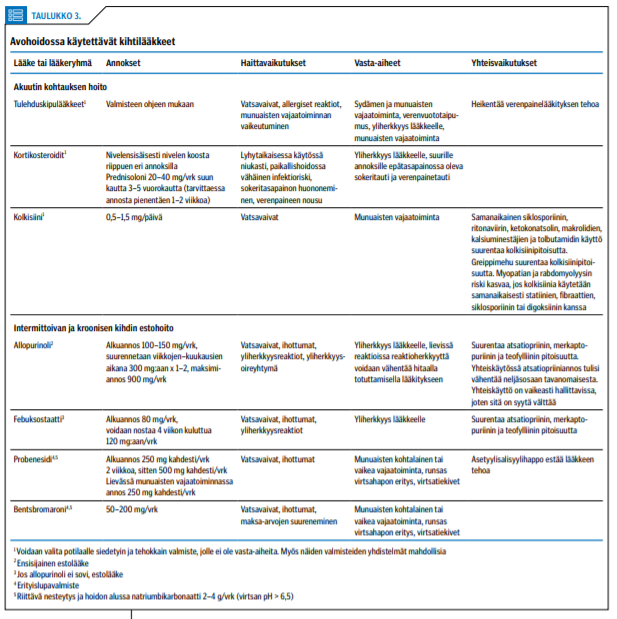
Jos taustalta paljastuu kideartriitti, käyttökelpoiset hoidot ovat paikallinen kortikosteroidi-injektio, kylmäpakkaukset, kipulääkitys ja lepo. Pelkkä nivelen tyhjennys helpottaa painetta ja kipua, jos nivelnestenäytteen ulkonäön perusteella epäillään infektiota ja pidättäydytään kortisonin ruiskuttamisesta. Mahdollisia vaihtoehtoja tai lisälääkkeitä ovat kolkisiini ja peroraalinen kortisoni (1,29).
Kun niveltulehduksen taustalla on kihti, potilaalle tulee antaa elämäntapaohjeet ja taudin toistuessa tarkastaa riskitekijät ja sen hetkisen hoidon riittävyys. Päivystyskäynnillä potilas kannattaa ohjata elintapaohjauskäynnille hoitajan vastaanotolle ja varmistaa käynnit omalla terveyskeskuslääkärillä lääkitysvasteen arvioimiseksi ja pitkäaikaisseurannan järjestämiseksi.
Koska seerumin virtsahappopitoisuus pienenee äkillisen kihtikohtauksen aikana, se kannattaa lääkityksen arviointia varten tarkistaa vastaanottokäynnillä myöhemmin. Seerumin virtsahappopitoisuuden tulisi olla pysyvästi alle 360 µmol/l, koska viileässä virtsahappo kiteytyy pienempinä pitoisuuksina. Jos kyseessä on toistunut kihtikohtaus ja/tai potilaalla on pitkäaikainen, palautumaton munuaisten vajaatoiminta eikä virtsahapon kertymistä ole mahdollista vähentää lääkitystä muuttamalla, on syytä aloittaa virtsahappopitoisuutta pienentävä lääkitys (taulukko «»3) (1,29).
Lääkitystä harkittaessa on syytä huomioida potilaan ikä, virtsahappopitoisuus ja oheissairauksien aiheuttama sydän- ja verisuonitautikuormitus (29). Virtsahappopitoisuutta pienentävä lääkitys voidaan aloittaa jo kihtikohtausta hoidettaessa, kunhan kihtikohtauksia estävästä lääkityksestä huolehditaan (29).
Vaikka kihtikohtausten uusiutumisriski on ensimmäisen hoitovuoden aikana huomattava, niiden määrän ei ole todettu lisääntyneen akuutissa vaiheessa aloitetun kihtilääkityksen vuoksi (30). Lääkitystä aloitettaessa on syytä sopia, miten kihtikohtaukset hoidetaan, jos niitä ilmaantuu: tulehduskipulääkekuuri, lyhyt kortikosteroidikuuri suun kautta tai yksittäisten nivelten paikallishoito. Kolkisiinia voidaan käyttää lyhytkestoisesti myös kohtausten estohoitona. Jos virtsahappopitoisuuden suurenemisen syytä ei voida poistaa, kohtausten estolääkitys on pysyvä.
Estolääkkeenä on käytettävissä kaksi ksantiinioksidaasin estäjää: allopurinoli ja febuksostaatti. Niiden vertailututkimukset on tehty vakioannoksilla, joten lääkitysten todellisen vasteen vertailua optimaalisella annoksella ei toistaiseksi ole (31,32). Lääkitykset eivät ole toteutuneet optimaalisesti, vaan annokset ovat monesti olleet liian pieniä hoitotavoitteen saavuttamiseksi. Allopurinolin käyttäjien vähäisiä yliherkkyysreaktioita voidaan ratkaista siedättämällä potilas lääkkeelle alkaen pienellä annoksella ja suurentamalla annos avohoidossa hitaasti käyttöannokseen (33).
Allopurinolilääkitys aloitetaan pienellä annoksella, ettei alkuun aiheutettaisi kihtikohtauksia. Jo parin viikon kuluttua kannattaa kuitenkin pyrkiä annokseen 300 mg/vrk, jos potilaan munuaiset toimivat normaalisti. Noin 4 viikon kuluttua aloituksesta kannattaa tutkia täydellinen verenkuva ja alaniiniaminotransferaasi (P-ALAT) mahdollisten lääkehaittojen selvittämiseksi. Allopurinoli voi joskus aiheuttaa neutropeniaa ja maksahaittoja. Plasman virtsahappopitoisuus on syytä arvioida noin 3 kuukauden kuluttua. Jos hoitotavoitetasolle alle 360 µmol/l ei ole päästy, annos kannattaa nostaa 450 mg:aan/vrk ja arvioida tilannetta uudelleen 3 kuukauden kuluttua. Näin toimien annosta voidaan titrata annokseen 900 mg/vrk saakka. Virtsahappopitoisuuksia määritettäessä kannattaa tutkia verenkuva ja P-ALAT-arvo.
Kun tilanne on saatu hallintaan pitkähköksi aikaa (esimerkiksi noin vuodeksi), eikä potilaalla ole ollut niveltulehduksia eikä hänellä ole kihtikyhmyjä ja virtsahappopitoisuus on ollut tavoitetasolla, voidaan kokeilla myös lääkeannoksen pienentämistä. Tämä edellyttää, että lääkitykseen ja elämäntapoihin liittyneitä riskitekijöitä on pystytty vähentämään. Mikäli riskitekijöitä ei saada vähennetyksi, kihtiä estävä lääkitys on pysyvä.
Jos potilaalla on munuaisten vajaatoiminta, allopurinoli-lääkitys tulee aloittaa annoksella 100 mg/vrk ja seurata vastetta. Jos tehoa ja haittoja ei ilmene, annos kannattaa kaksinkertaistaa ja jatkaa tehokkaan annoksen hakemista. Allopurinolia voidaan annostella myös esimerkiksi 100 mg joka toinen päivä. Tuoreimman tiedon turvallisesta annoksesta löytää esimerkiksi Renbase-tietokannasta. Allopurinoli ja sen metaboliitit poistuvat elimistöstä dialyysihoidossa. Dialyysihoidon yhteydessä lääkitystä voidaan annostella päivittäin tai dialyysin jälkeen. Jos munuaisten vajaatoimintapotilaan kihtikohtaukset saadaan hallintaan eikä lääkityksestä ole haittoja, lääkitystä tulee jatkaa pysyvästi.
Febuksostaattilääkitys aloitetaan 80 mg:n vuorokausiannoksella. Tarvittaessa annos suurennetaan 120 mg:aan/vrk. Tämä voidaan tehdä jo noin 4 viikon kuluttua aloituksesta. Verenkuvan ja P-ALAT-arvon seuranta voidaan toteuttaa samalla tavalla kuin allopurinolia käytettäessä. Febuksostaattia voidaan käyttää lievässä ja keskivaikeassa munuaisten vajaatoiminnassa. Sen käyttöä ei suositella merkittävää sydän- ja verisuonisairautta sairastaville. Peruskorvauksen edellytyksenä on B-todistus, jossa kuvataan lääkityskokeilu allopurinolilla ja siitä aiheutuneet haitat. Lisäksi kannattaa arvioida lääkkeen käytön pysyvyys huomioiden oheissairaudet ja munuaisen toiminta.
Probenesidi ja bentsbromaroni ovat virtsahapon eritystä lisääviä lääkkeitä, jotka estävät virtsahapon imeytymistä vaikuttamalla munuaistiehyiden kuljetusproteiineihin. Niitä voivat käyttää potilaat, joilla ei ole merkittävää munuaisten vajaatoimintaa (3,29). Niitä käytetään myös yhdessä ksantiinioksidaasin estäjien kanssa. Sekä probenesidin että bentsbromaronin käyttöön tarvitaan erityislupa.
Euroopassa on myyntilupa myös virtsahapon eritystä lisäävälle lesinurad-lääkkeelle. Se on URAT1-kuljetusproteiinin estäjä, jota on syytä käyttää yhdessä ksantiinioksidaasin estäjän kanssa, ettei virtsahappo saostuisi virtsateihin (31,34). Lääkkeestä voisi olla hyötyä samalla tavoin kuin muista virtsahapon eritystä lisäävistä lääkkeistä, kun ksantiinioksidaasin estäjän annosta ei pystytä riittävästi lisäämään haittavaikutusten vuoksi.
Inflammasomin äkillistä aktivoitumista vaimentavat myös interleukiini 1:n salpaajat, anakinra ja kanakinumabi. Ne ovat kalliita eikä niille ole hyväksytty lääkekorvausoikeutta, kun käyttöaiheena on kihti. Erityistilanteissa sairaalassa voidaan käyttää virtsahappoa hajottavaa rasburikaasia (1,31,32).
Reumatologian poliklinikalla hoidettujen kihtipotilaiden taudinkuvassa on todettu monenlaisia ongelmia (35). Kaksi kolmasosaa potilaista ohjautui arvioon päivystyspoliklinikalta, 21 % tuli ajanvarauslähetteellä ja loput 12 % vuodeosastoilta. Vain viidellä potilaalla 66:sta (8 %) ei ollut yhtään metabolisen oireyhtymän tautia. Potilaista 73 % oli miehiä. Heidän keski-ikänsä oli 67 v ja painoindeksiensä keskiarvo 31 kg/m2. Munuaisten toiminta oli normaali vain 21 %:lla. Monen nivelen tulehdus todettiin 44 %:lla ja isovarpaan tyvinivelen tulehdus vain 21 %:lla.
Edellä kuvattujen potilaiden kihdin hoidossa oli runsaasti haasteita. Ongelmallisissa tilanteissa voidaan konsultoiden sopia yhteisestä hoitolinjasta ja joskus rauhoittaa toistuvia kihtikohtauksia sairaalassa annettavalla lääkkeellä. Geeneillä ja ympäristötekijöillä on merkitystä taudin ilmaantumisessa. Geenitiedon soveltamisesta saattaisi olla hyötyä elintapaneuvonnassakin, mutta lääkevalintoja voitaisiin ohjata, jos kliinisessä työssä löydettäisiin geenitutkimuksella potilaat, jotka todennäköisimmin kehittävät kihdin diureettihoidon aikana (10-12). Rajallisiin hoitokeinoihin saataneen lisäystä virtsahapon takaisin imeytymistä ja erittymistä sääteleviin kuljetusproteiineihin vaikuttavista valmisteista (32).
Kun potilaalla on kihtikohtaus, ei kannata jättää käyttämättä tilaisuutta arvioida riskejä (taulukko «»4). Kohtuulliset elintavat ja maltillinen alkoholinkäyttö ovat tärkeimmät keinot ehkäistä käynnissä olevaa epidemiaa, jonka aiheuttavat metabolisen oireyhtymän yleistyminen, alkoholin käytön lisääntyminen, väestön keski-iän kohoaminen ja lääketieteellisen hoidon valinnat.

Gout is an autoinflammatory disease in which monosodium urate crystals deposit within joints and soft tissue. The diagnosis can be verified by identification of crystals from synovial or bursal fluid or from a tophus. In prolonged disease, imaging with radiographs, ultrasonography or dual energy CT may help in diagnostics. Gout flares can often be prevented by lifestyle changes and use of colchicine or xanthine oxidase inhibitor therapy. In patient care it is important to monitor the plasma uric acid concentration, and keep it constantly below 360 μmol/L. In addition to lifestyle changes, hyperuricaemia-inducing effects of medication used for comorbidities should be evaluated. If dietary, therapy related or comorbid risk factors cannot be reduced, urate-lowering therapy should be permanent. Patient adherence is a prerequisite for successful therapy.