
Ks. artikkelin pdf-versio «http://www.fimnet.fi/cl/laakarilehti/pdf/2020/SLL512020-2861.pdf»1 Lääkärilehden sivuilla (vaatii FiMnet-tunnuksen).
Clostridioides difficile (CD, aiemmin Clostridium difficile) -infektion (CDI) taustalla on yleensä suoliston normaalin mikrobiomin häiriintyminen antibioottikuurin seurauksena. Itämisaika on vuorokaudesta 6 viikkoon. Laukaisevana antibioottina voi olla mikä tahansa antibiootti, tavallisimmin fluorokinolonit, kefalosporiinit, amoksisilliini ja klindamysiini. Aina potilailla ei ole ollut edeltävää antibioottikuuria (1).
Kotimaisen selvityksen perusteella C. difficile aiheutti 5,5 % kaikista hoitoon liittyvistä infektioista vuonna 2016 (2). Ensimmäisen episodin jälkeen infektio uusii n. 25 %:lla potilaista, mutta n. 40-50 %:lla, jos infektio on jo kertaalleen uusiutunut (3-5).
Suomalaisessa tutkimuksessa on todettu 30 vrk:n kuolleisuudeksi 3,2 % avohoidossa saadussa ja 13,3 % sairaalasyntyisessä infektiossa (6). Uusiutuneessa infektiossa kuolleisuus on lisääntynyt (36 %) seuraavan puolen vuoden aikana verrattuna niihin, joilla uusimista ei ollut (26 %) (7). Tämä johtuu usein potilaiden vakavista perustaudeista ja korkeasta iästä. Kuolleista 90 % on yli 65-vuotiaita.
Hoidon kansainväliset suositukset ovat muuttuneet: vankomysiinistä tai fidaksomisiinistä on useimmissa tapauksissa tullut ensisijainen valinta (8-10). Alle 65-v potilailla, joilla ei ole uusiutumisen riskitekijöitä eikä vakavaa taudinkuvaa, voidaan ensimmäisen episodin hoidossa pitää edelleen ensisijaisena vaihtoehtona metronidatsolia sen huomattavasti halvemman hinnan vuoksi. Fidaksomisiini, joka on kapeakirjoinen imeytymätön antibiootti, pienentää uusiutumisriskin noin 15-20 %:iin - jopa niillä, joilla infektio on jo uusiutunut (11-14).
Myös kaikki C. difficile -infektioon käytettävät antibiootit muuttavat suoliston mikrobiomia ja näin altistavat osaltaan infektion uusiutumiselle (15). Vaihtoehtona mikrobilääkkeiden käytölle on ulosteensiirto. Monoklonaalinen vasta-ainehoito C. difficilen toksiinia kohtaan varsinaisen hoidon tukena pienentää infektion uusiutumisriskiä (16).
Uusiutumisen riskitekijät on esitetty taulukossa «»1 (14-15,17-23). C. difficile -bakteerit esiintyvät kahdessa muodossa: vegetatiivisessa ja itiömuodossa, joista jälkimmäinen selviää myös mahalaukun happamassa ympäristössä. Protonipumpun estäjien (PPI) käyttö altistaa infektiolle ja sen uusiutumiselle (24), minkä vuoksi on tärkeää tarkistaa, onko PPI-lääkkeelle todellista tarvetta. PPI-lääkitys näyttää noin kaksinkertaistavan riskin, mutta tutkimuksissa potilaiden absoluuttiset määrät jäivät kuitenkin pieniksi (25-26).

Ennen hoitovalintaa on tärkeää määrittää taudin vaikeusaste. Infektio voidaan jakaa lievään-keskivaikeaan, vakavaan tai fulminanttiin muotoon. Jako tehdään kliinisen tilanteen ja laboratoriolöydösten perusteella. Infektio on vakava, jos veren valkosolumäärä on yli 15 x 10E9/l tai jos seerumin kreatiniiniarvo kohoaa puolitoistakertaiseksi potilaan aiemmasta tasosta tai on yli 150 µmol/l.
Infektio on fulminantti, jos potilaan verenpaine on romahtanut tai tilanne on muutoin septinen tai tehohoitoa vaativa. Tilannetta pidetään fulminanttina myös, jos potilaalle on kehittynyt megakoolon tai suolistoperforaatio tai jos on päädytty kolektomiaan.
Jos vakavan tai fulminantin taudin kriteerit eivät täyty, tauti on lievä-keskivaikea. Taulukossa «»2 on karkea yhteenveto hoitovalinnoista erilaisissa tilanteissa. Tarkemmin asiaa on käsitelty seuraavissa kappaleissa.

Tuoreimman kansainvälisen hoitosuosituksen (Infectious Diseases Society of America / Society of Healthcare Epidemiology of America - IDSA/SHEA-CPG; 2017) mukaan suun kautta otettava vankomysiini on ensisijainen hoitovaihtoehto myös niille, joilla infektio on ensimmäistä kertaa eikä sitä ole luokiteltu vaikeaksi.
Eurooppalaisessa hoitosuosituksessa vuodelta 2013 (European Society of Clinical Microbiology and Infectious Diseases - ESCMID-CPG) kuitenkin suositellaan lievään tautiin metronidatsolia ja vakavaan tautiin vankomysiiniä - kuitenkaan metronidatsolia ei tule käyttää, mikäli uusiutumisriski on suurentunut (8-9). Riskiksi mainitaan yli 65 vuoden ikä, muuhun syyhyn otettava antibioottilääkitys, vaikea perussairaus ja/tai munuaisten vajaatoiminta, PPI-lääkitys sekä aiemmin sairastettu C. difficile -infektio. Näin ollen hoitovalinta on melko monimutkainen, eikä lopullinen valinta aina ole yksiselitteisesti suosituksen mukainen.
Vankomysiinin paremmuus metronidatsoliin verrattuna on havaittu kahdessakin satunnaistetussa tutkimuksessa: yhdistetty analyysi osoitti kliinisen tehon olevan 81 % vankomysiinillä ja 73 % metronidatsolilla. Vaikeassa taudissa tehot olivat vastaavasti 79 % vankomysiinillä ja 66 % metronidatsolilla (5). Vuonna 2017 julkaistussa meta-analyysissa todettiin niin ikään vankomysiinin parempi teho metronidatsoliin verrattuna (27).
Pian vuonna 2017 julkistetun amerikkalaissuosituksen jälkeen julkaistuissa suuressa tutkimuksessa havaittiin, etteivät metronidatsoli ja vankomysiini eronneet toisistaan uusimisen tai kuolleisuuden osalta, kun oli kyse lieväoireisesta taudista. Kuitenkin kaikki vaikeusasteet huomioiden 30 päivän kuolleisuus oli merkittävästi pienempi vankomysiinillä kuin metronidatsolilla hoidetuilla (28).
Johtopäätöksenä näistä tutkimuksista voidaan todeta, että alle 65-vuotiailla potilailla lieväoireisessa taudissa voi ensimmäisen episodin hoidossa edelleen käyttää huomattavasti muita vaihtoehtoja halvempaa metronidatsolia, mikäli uusiutumisen riskitekijöitä ei ole. Ensimmäisen episodin hoidon pituus on yleensä 10 vrk.
Lievästä C. difficile -infektiosta ei ole olemassa kontrolloituja tutkimuksia, joissa olisi selvitetty, olisiko infektion aiheuttaneen antibiootin lopettaminen yhtä tehokas hoitokeino kuin metronidatsolin tai vankomysiinin aloittaminen. Käytännössä ennen ulostenäytteen tuloksen saapumista kannattaakin odottaa vastetta antibiootin lopettamiseen. Jos ripuli on selvästi lievittymässä, ei antibioottihoitoa välttämättä tarvitse aloittaa, vaikka PCR-testin tulos olisi positiivinen. Empiiristä hoitoa testitulosta odottaessa kannattaa harkita vain suhteellisen vakavassa ja sairaalahoitoa vaativassa tilanteessa.
Probioottien tehosta C. difficile -infektion estossa tai hoidossa ei ole tarpeeksi tutkimustietoa, jotta hoitosuosituksia voitaisiin antaa. Eräässä systemaattisessa katsauksessa, jossa oli mukana meta-analyysi lähes 20 tutkimuksesta (yhteensä yli 6 000 potilasta), todettiin infektioita probiootteja saaneilla sairaalapotilailla yli puolet vähemmän (1,6 %) kuin niillä, jotka eivät probiootteja saaneet (3,9 %).
Tämän perusteella on selvää, että tarvitaan lisätutkimuksia probioottien tehosta ja erityisesti siitä, mikä tai mitkä olisivat sopivimpia valmisteita ja millä annoksella. Tutkimuksissa tulisi myös valikoida potilaat tiettyihin riskiryhmiin kuulumisen perusteella kohortteihin ennen satunnaistamista (29). Myös probiooteista lähtöisin olevia Lactobacilli-lajien bakteremioita ja Saccharomyces boulardii -sienten aiheuttamia fungemioita on kuvattu (30-32).
Metronidatsolin sivuvaikutuksista yleisin allergisten reaktioiden lisäksi lienee pahoinvointi. Pitkään metronidatsolihoitoon liittyy riski neuropatiaan, joka voi olla palautumatonta. Interaktioista merkittävin on varfariinin kanssa. Alkoholikiellosta antabusreaktion vuoksi tulee muistuttaa potilaita.
Vankomysiinin käyttöön liittyy suoliston mikrobiomissa enterokokkien vankomysiiniresistenssiä (VRE) suosiva valintapaine (33). Takautuvassa tutkimuksessa kuitenkin todettiin, ettei VRE-infektioita esiintynyt 3-6 kk:n kuluessa sen useammin vankomysiiniä saaneilla kuin niillä, jotka saivat metronidatsolia (34). Vankomysiiniresistenttejä C. difficile -kantoja on viime vuosina havaittu aiempaa enemmän (35).
Fidaksomisiinia (10 vrk ajan annoksella 200 mg x 2) voidaan meta-analyysin perusteella pitää ensisijaisena hoitovaihtoehtona jopa primaarisen C. difficile -infektion hoitoon (36), mutta sen käyttöä rajoittaa korkea hinta. EXTEND-tutkimuksen perusteella infektion uusimisriski edelleen pienenee, jos fidaksomisiini annostellaan 200 mg x 2 viiden vrk ajan ja sen jälkeen 200 mg x 1 joka toinen päivä ko. pakkaus loppuun, jolloin koko kuurin pituus on 25 vrk (37). Alaryhmäanalyysissä teho ja turvallisuus olivat riippumattomia potilaan iästä, mahdollisesta maligniteetista, hypervirulentin kannan läsnäolosta, taudin vakavuusasteesta ja aiemmasta infektiosta (38). Tutkimuksen mukaan fidaksomisiini on vankomysiinia parempi vaihtoehto jopa kustannustehokkuuden kannalta (39).
Suolen toimintaa hidastavien lääkkeiden käyttöä (esim. loperamidi, opioidit) tulee välttää. C. difficile -infektion hoidon tehon mittarina ei voi käyttää hoidon päättymisen jälkeen otettua toksiinigeenin PCR-testiä, koska ulosteessa voi hyvin esiintyä geenejä tuloksellisenkin hoidon jälkeen. Niin ikään ulosteiden löysyyttä esiintyy varsin yleisesti vielä jonkin aikaa infektion jälkeen. Uusintatestausta tarvitaan vasta, jos oireet pahentuvat selvästi. Mikäli C. difficile -infektio uusiutuu, se tapahtuu useimmiten noin kaksi viikkoa hoidon loppumisesta.
Vaikean C. difficile -infektion kriteerit on alun perin luotu immuunipuolustukseltaan normaalien potilaiden taudin perusteella. Sen vuoksi ne eivät ole sellaisenaan sovellettavissa kaikkiin potilaisiin, joilla perussairauden vuoksi voi olla esim. neutropeniaa tai varsin pieni kreatiniiniarvo (40-41). Tämä rajoitus on syytä muistaa, kun mietitään immunopuutteisen potilaan infektion vaikeusastetta.
Vastikään julkaistussa takautuvassa tutkimuksessa verrattiin vaikeaksi luokitellun infektion hoidossa yli 200 fidaksomisiinikuuria yli 600 vankomysiinikuuriin. Tilastollisesti merkitseviä eroja ei ollut primaarisen hoitotuloksen, uusimisen, sekundaaristen päätetapahtumien eikä kuolleisuuden (30 vrk, 90 vrk tai 180 vrk) suhteen (42).
Ulosteensiirron käytettävyydestä vaikean infektion hoidossa on toistaiseksi olemassa yksi tutkimus ja yksi tapaussarja, joiden tulokset näyttävät lupaavilta (90 % potilaista parani) (43,44). Lisäksi käynnissä on tutkimus betslotoksumabin käytöstä vaikean infektion hoidossa.
Fulminantissa infektiossa suositellaan kombinaatiohoitoa: vankomysiini tavallista suuremmalla annoksella (250-500 mg x 4/vrk) tai fidaksomisiini yhdistettynä metronidatsoliin (500 mg x 3/vrk, iv) (8,9). Suoneen annetun metronidatsolin hyödystä on kuitenkin vain rajallista näyttöä. Vankomysiiniä ei voi annostella suoneen C. difficile -infektion hoidossa.
Fulminantti infektio voi ilmetä myös septisenä sokkina. Tehohoidosta huolimatta hoito voi epäonnistua ja potilas menehtyä (45). Kansainvälisissä suosituksissa fulminantin infektion hoitoon kuuluu hyvissä ajoin tehty kolektomia, johon siihenkin luonnollisesti liittyy tietty kuolleisuus, mutta infektion uusimisesta ei kolektomian jälkeen ole pelkoa (46). Hiljattain on saatu tutkimusnäyttöä siitä, että lenkki-ileostomia olisi suositeltavampi vaihtoehto kuin totaalinen kolektomia (47).
Ileustilanteessa vankomysiini annostellaan suoraan rektumiin 10-14 vrk:n ajan (500 mg sekoitettuna 100 ml:aan keittosuolaa x 4/vrk). Osittaisessa ileustilanteessa vankomysiiniä annostellaan sekä suun kautta että rektaalisesti. Rektaalisessa annostelussa on kuitenkin noudatettava varovaisuutta, koska siihen voi liittyä suolenpuhkeaman riski (10).
Tulehduksellisten suolistosairauksien (IBD) pahenemisvaiheissa tulee sulkea pois C. difficile -infektio. Uusiutuva infektio tulee herkästi hoitaa ulosteensiirrolla, koska siirto voi estää myös tulehduksellisten suolistosairauksien aktivaatiota (48).
Eräillä muillakin kuin hoitosuosituksen mainitsemilla antibiooteilla on todettu olevan tehoa C. difficile -infektioon. Tällaisia ovat suun kautta otettavat teikoplaniini ja nitatsoksanidi sekä suoneen annettu tigesykliini (49).
Korkealuokkaista tutkimusta ei ole siitä, mikä olisi optimaalisin hoito C. difficile -infektion uusiutuessa ensimmäistä kertaa (48). Vankomysiini ja fidaksomisiini ovat edelleen suositeltavia myös tässä tapauksessa. Metronidatsolia ei ole syytä käyttää uusiutuneessa infektiossa, paitsi vakavassa taudissa suoneen annettuna. Jos ensimmäinen episodi hoidettiin vankomysiinillä, on loogista valita fidaksomisiini uusiutuneessa infektiossa. Parhaat tulokset fidaksomisiinilla on saatu edellä mainitulla pulssihoidolla.
Vankomysiinillä on hitaasti vähenevällä annostuksella kuvattu lupaavia hoitotuloksia uusiutuvan infektion hoidossa: 1-2 viikon ajan 125 mg x 4, minkä jälkeen viikon ajan 125 mg x 2, sitten viikon ajan 125 mg x 1 ja vielä 2-8 viikon ajan 125 mg joka toinen tai joka kolmas päivä (10).
Ulosteensiirtoa on hyvä harkita jo kolmannen episodin yhteydessä. Se on todettu nykyisistä hoitovaihtoehdoista tehokkaimmaksi (50,51).
MODIFY I ja II -tutkimukset osoittivat betslotoksumabin hyödyn kombinoituna tavanomaiseen hoitoon (52,53). Betslotoksumabi on uusi C. difficilen toksiini B:n monoklonaalinen vasta-aine. Hoito toteutetaan antibiootin ohessa kertainfuusiona (10 mg/kg, iv). Paras hyöty saadaan potilailla, joilla on useita riskitekijöitä taudin ja sairaalahoidon uusiutumiselle (54,55).
Toteuttamassamme takautuvassa tutkimuksessa Suomen yliopistosairaaloissa betslotoksumabihoidon saaneista parantui 3 kk:n seurannassa 73 % ilman taudin uusiutumista (56). Hoito toimi jokseenkin yhtä hyvin myös immunosuprimoiduilla potilailla. Vaikeassa tautimuodossa 63 %:lla infektio ei uusiutunut. Tämän vuoksi betslotoksumabia voi suositella uusiutuvassa taudissa standardihoidon ohessa jo toiseen tai kolmanteen episodiin suuren uusiutumisriskin omaavilla potilailla (esim. vähintään kolme uusiutumisen riskitekijää - vrt. taulukko «»1).
Tarkastelemamme potilasjoukon perusteella betslotoksumabia voidaan lisäksi käyttää vaihtoehtona ulosteensiirrolle. Betslotoksumabin käytöstä tulee konsultoida infektiolääkäriä tai gastroenterologia mm. sen vuoksi, että hoito on kohtalaisen kallis.
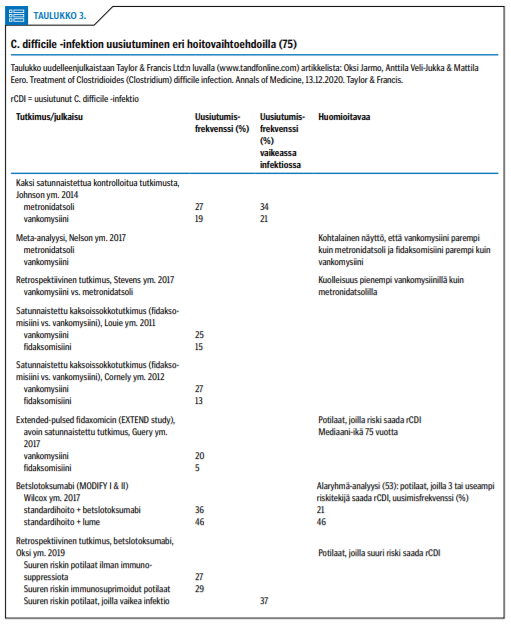
Tutkimustuloksia C. difficile -infektion uusiutumisesta eri hoitovaihtoehdoilla on esitetty taulukossa «»3.
C. difficile -infektion perimmäiset syyt ovat häiriintynyt suoliston mikrobiomi ja vähentynyt bakteerien diversiteetti, joita hoitoon käytettävät antibiootit voivat edelleen pahentaa. Tällaisessa tilanteessa C. difficile -itiöt voivat kypsyä tavallista helpommin toksiinia tuottaviksi bakteereiksi. Ulosteensiirron periaate on katkaista tämä kierre ja normalisoida suoliston mikrobiomi.
Ulosteensiirto on todettu tehokkaaksi toimenpiteeksi uusiutuneessa infektiossa - teho on ollut yleensä 80-90 % (57, 58). Satunnaistetuissa tutkimuksissa on saavutettu huonompia tuloksia kuin avoimissa/havainnoivissa tutkimuksissa (59). Eurooppalaisessa hoitosuosituksessa ulosteensiirto on arvioitu sopivaksi hoitomuodoksi, kun kyseessä on vähintään toinen episodi (8). Joissain tapauksissa sitä voidaan käyttää jo ensimmäisen tai pitkittyneen episodin hoidossa (60). Ulosteensiirto lienee kuitenkin tehokkaampi uusiutuneen kuin pitkittyneen taudin hoidossa (61).
Ulosteensiirto voidaan toteuttaa nenämahaletkun kautta, mahan tai paksusuolen tähystyksen yhteydessä tai nielemällä kapseleita. Kolonoskopian yhteydessä tehty ulosteensiirto on tutkimuksissa ollut jonkin verran tehokkaampi metodi kuin ruoansulatuskanavan yläosaan tehty ulosteensiirto (57,62,63). Paksusuolen tähystys mahdollistaa myös muiden ripulia aiheuttavien sairauksien, kuten esimerkiksi mikroskooppisen tai haavaisen koliitin diagnostiikan.
Standardoituja bakteeriseoksia on kehitetty, mutta niistä ei toistaiseksi ole vaihtoehdoksi ulosteensiirrolle kliiniseen käyttöön (64). Ulosteensiirto näyttäisi kuitenkin olevan pitkäaikaisen seurantatutkimuksen perustella turvallista (65). Patogeenien siirtyminen luovuttajalta saajalle ulosteensiirron mukana on mahdollista testaamisesta huolimatta. Myös autoimmuunisairauksien syntyminen on teoreettisesti mahdollista. Ulosteenluovuttajien tarkka seulonta onkin kansainvälisten suositusten mukaan ensiarvoisen tärkeää (66,67).
Kaikille potilaille ulosteensiirto ei ole perussairauksien vuoksi käytännössä mahdollista (esim. neutropeeniset potilaat tai allogeenisen kantasolusiirteen saaneet potilaat). Ulosteensiirtoon ei yleensä liity mitään muita sivuvaikutuksia kuin itse toimenpiteeseen liittyvät komplikaatiot, joiden yleisyys on verrattavissa muista syistä tehtyyn toimenpiteeseen (65).
Tärkeimmät keinot C. difficile -infektioiden ehkäisemiseksi ovat antibioottien hallittu käyttö ja tarkka käsihygienia niin terveydenhuollossa kuin potilaiden kotona (68). Potilaan lähiympäristön pintojen pyyhkimiseen voidaan käyttää klooripitoisia puhdistusaineita, joilla tuhotaan mahdolliset ympäristöön joutuneet itiöt.
Sairaalassa ripuloiva potilas hoidetaan kosketusvarotoimia noudattaen. Lähihoitotilanteissa käytetään kertakäyttöistä suojatakkia ja suojakäsineitä kosketettaessa potilasta tai hänen välitöntä ympäristöään. Myös kirurgisen suu-nenäsuojaimen käyttöä voidaan suositella. Stetoskoopit, kuumemittarit ym. pieninstrumentit ovat huonekohtaisia ja ne huolletaan hoitojakson päätyttyä.
Alkoholipohjaiset käsidesinfektioaineet eivät tuhoa itiöitä yhtä hyvin kuin saippuapesu, mutta vegetatiivisten bakteerien tuhoamisessa käsidesinfektioaineet ovat puolestaan tehokkaampia, joten molempien käyttö on perusteltua (9,69,70). Varotoimia jatketaan, kunnes on kulunut 2 vrk viimeisestä ripuliulosteesta.
Tärkeää on myös harkita PPI-lääkkeiden käyttöä tarkkaan niihin liittyvän C. difficile -infektioriskin vuoksi.
Cadazolidi- ja surotomysiiniantibiootin kehittely C. difficile -infektion hoitoon lopetettiin, koska teho ei ollut vankomysiiniä parempi (71,72). Ridinilatsoli, joka on faasi II:n tutkimuksissa oleva suolistosta imeytymätön antibiootti, on primaarisesti yhtä tehokas kuin vankomysiini, mutta sen käyttöön näyttää liittyvän vankomysiiniä vähäisempi uusiutumisriski (73).
Toksiinia erittämättömien itiöiden suojavaikutus toksiinia tuottavien kantojen kolonisaatiota vastaan voi vähentää infektion uusiutumisriskiä. Uusiutuminen todettiin faasi II:n tutkimuksessa 6 viikon aikana vain 2 %:lla potilaista, joille oli annettu toksiinia erittämättömien bakteerien itiöitä (74). Myös muiden anaerobisten bakteerien itiöiden käyttöä tutkitaan (70).
Useita C. difficile -rokotteen kehittämiseen tähtääviä tutkimuksia on meneillään. Rokote olisi tietyille suuren riskin omaaville potilaille tehokas ja myös edullinen tapa suojautua infektiolta (71).
C. difficile -infektion hoidon kulmakivet ovat vankomysiini ja fidaksomisiini. Metronidatsolia on syytä käyttää vain lievässä ja keskivaikeassa taudissa niillä nuorehkoilla potilailla, joilla ei ole merkittäviä riskitekijöitä taudin uusiutumiselle. Suuren uusiutumisriskin omaaville potilaille voidaan antaa antibioottihoidon ohessa betslotoksumabi-infuusio. Ulosteensiirtoa tulee harkita potilaille, joilla infektio on uusiutunut useasti.
Clostridioides (formerly: Clostridium) difficile infection (CDI) is a major cause of diarrhoea in both inpatient and outpatient settings. The majority of CDI cases are healthcare-associated but the numbers of community-acquired infections are also increasing. CDI is caused by changes in normal intestinal microbiota usually after administration of antibiotics. Elderly and immunocompromised patients are at greater risk for first CDI and recurrence. Guidelines for the treatment options for CDI have been changed recently: metronidazole for primary CDI is recommended in non-severe cases among patients younger than 65 years without risk factors for recurrence, while vancomycin and fidaxomicin are the first-line options for other cases. A new treatment option is the monoclonal antibody bezlotoxumab that can be used with a standard treatment to reduce the risk of recurrence. Faecal microbiota transplantation is the most effective treatment option for frequent recurrences of CDI.