
Ks. artikkelin pdf-versio «http://www.fimnet.fi/cl/laakarilehti/pdf/2021/SLL32021-120.pdf»1 Lääkärilehden sivuilla (vaatii FiMnet-tunnuksen).
Vaikka HIV:n taltuttamiseksi ei ole löydetty suojaavaa rokotetta eikä parantavaa hoitoa, on epidemian rajoittamisessa edistytty huomattavasti. Myönteinen suuntaus on liittynyt antiviraalisen hoidon ja hoitojärjestelmien kehittymiseen ja useampien toimintatapojen yhdistämiseen. Uusien tartuntojen määrä on maailmassa pienentynyt 20 vuodessa 2,8 miljoonasta 1,7 miljoonaan vuodessa (1).
Tartunnalta suojaavan HIV-rokotteen kehittäminen alkoi 1980-luvun puolivälissä, kun virus oli tunnistettu ja karakterisoitu. Se on osoittautunut hankalaksi. Tuoreissa mallinnuksissa on oletettu, että vuonna 2027 olisi käytettävissä suojaava rokote, jonka teho on noin 70 % (2). Samaa mieltä oli Yhdysvaltojen National Institutes of Healthin infektio- ja allergiaosaston johtaja Anthony Fauci katsausluennossaan AIDS-kongressissa 2018 Amsterdamissa. Äskettäin kuitenkin ilmoitettiin taas yhden lupaavan rokotekandidaatin kliinisen vaiheen tutkimuksen päättyneen tehottomuuden vuoksi (3).
Allogeenisella kantasolujen siirrolla HIV-infektioista pysyvästi parantuneesta "Berliinin potilaasta" käynnistyi noin 10 vuotta sitten vilkas tutkimus (4). HIV-positiiviselle potilaalle tehtiin leukemian parantamiseksi allogeeninen kantasolujen siirto, jossa luovuttajalla oli geneettisestä syystä viallinen kemokiinireseptori 5 (CCR5Δ32-homotsygootti), jonka HIV tarvitsee CD4-reseptorin lisäksi infektion alussa isännän solujen infektoimiseen (5). Britanniasta on julkaistu toinen potilastapaus, jossa kuvataan pitkäaikainen paraneminen HIV-infektiosta allogeenisen kantasolujen siirron ansiosta (6).
On selvää, että allogeenista kantasolujen siirtoa ei voida käyttää laajamittaisesti siihen liittyvien riskien, sopivien luuytimen luovuttajien harvinaisuuden (CCR5Δ32-homotsygootteja on alle 1 % maailman väestöstä) ja nykyisen HIV-lääkityksen hyvän tehon ja siedettävyyden vuoksi. Toistaiseksi pysyvää parantumista HIV-infektiosta ei ole onnistuttu saavuttamaan kevyemmillä hoidoilla.
HIV-infektion hoito kehittyi tehokkaaksi vasta 1990-luvun viimeisinä vuosina (7). Sitä ennen oli toimittava muilla keinoin. Neuvontaa on käytetty HIV-tartunnan ehkäisemiseksi siitä lähtien, kun viruksen ymmärrettiin tarttuvan seksissä ja veren välityksellä. Kondomin käyttö yhdynnässä vähentää HIV:n tarttumisen todennäköisyyttä 85 %, mutta ongelmana on heikko myöntyväisyys sen käyttöön (8).
Tutkimusten perusteella tietoisuus HIV-positiivisuudesta johtaa riskikäyttäytymisen vähenemiseen (9). Tartunnanjäljityksellä on yritetty rajoittaa tartuntaketjuja epidemian alusta lähtien. Tartunnanjäljityksen teho vaihtelee huomattavasti, tuoreen katsauksen mukaan partnereista on tavoitettu 10-97 % (10). Katsauksessa todetaan uusien välineiden, kuten sähköpostin tai tekstiviestien, parantavan tuloksia.
Kokemukset HIV:n leviämisestä maailmanlaajuisesti 1900-luvun lopussa osoittivat, että neuvonta, testaaminen, jäljittäminen ja suositus kondomin käytöstä tartunnan estämiseksi eivät olleet riittäviä (11). WHO päätyi vuonna 2014 suosittamaan kokonaisvaltaisia tavoitteita: HIV-positiivisista vähintään 90 %:n on oltava tietoisia tartunnastaan, tartunnastaan tietoisista 90 %:n on oltava HIV-lääkityksellä ja lääkitystä saavista 90 %:lla on oltava hyvä hoitovaste veren viruspitoisuuden perusteella (12).
HIV-infektiostaan tietämättömien määrän arvioiminen on hankalimmin arvioitava WHO:n 90-90-90-tavoitteista. Toteamattomien tartuntojen määrän arvioimiseksi käytetään tavallisesti mallinnuksia, joissa keskeinen tekijä on veren CD4-lymfosyyttitaso HIV-diagnoosin ajankohtana. Yhdysvalloissa tehdyssä laajaan aineistoon perustuvassa mallinnuksessa arvioitiin infektiostaan tietämättömiä olevan 18 % HIV-positiivisista ja näiden aiheuttavan 30 % tartunnoista (13). Maailmanlaajuisesti WHO arvioi, että 78 % HIV-positiivisista tietää diagnoosinsa (1).
Euroopan tartuntatautiviraston mallinnuksen avulla on äskettäin arvioitu, että Suomessa diagnoosistaan tietämättömiä on 18 % HIV-positiivisista (14). Uusien HIV-tartuntojen diagnosointi ei ole varhentunut 2000-luvulla (14). Todennäköisesti siis merkittävä osa HIV-tartunnoista on Suomessa peräisin HIV-positiivisilta, jotka ovat tietämättömiä taudistaan.
Kokemukset HUS-piirin miesten väliseen seksiin liittyvistä HIV-tartunnoista 2010-luvulta osoittavat, että testaamista tehostamalla tartuntoja voidaan Suomessakin vähentää avainryhmissä. Hivpointin Helsingin toimipisteen aktiivisuus sosiaalisessa mediassa ja testaustoiminnan profiloiminen johtivat tilastollisesti merkitsevästi aikaisempaan HIV-diagnoosiin miesten välistä seksiä harrastavien miesten joukossa (15).
WHO:n tavoite on, että 90 % diagnosoiduista HIV-positiivisista on kiinnittynyt hoitojärjestelmään ja saa hoitoa infektioonsa (12). Koko Euroopan käsittäneessä tutkimuksessa HIV:n tartuntatavoista pistohuumeiden käyttö ja heteroseksi olivat yhteydessä myöhäiseen HIV:n toteamiseen (16). Iäkkäät ihmiset hakeutuivat hoitoon nopeammin kuin nuoremmat.
Hoitoon ohjauksesta ja hoidossa pysymisen edellytyksistä on tehty tutkimuksia, joiden tulokset eivät tuo yllätyksiä. Selkeästi ohjeistetulla ja aktiivisella hoitoonohjauksella saadaan paremmat tulokset kuin jättämällä hoitoon hakeutuminen potilaan aktiivisuuden varaan (17,18). Mukautuva työnjako, potilaslähtöinen palveluohjaus, etsivä työ ja luottamuksellisuuden kokemus parantavat hoitoonohjauksen tuloksia (18). Potilaiden tyytyväisyys palveluihin ja asunnottomuuden estäminen parantavat potilaiden pysymistä HIV-hoitojärjestelmässä (19,20).
Onnistunut hoitoonohjaus ja hoidossa pysyminen ovat hoitojärjestelmän kulmakivi uusien tartuntojen ehkäisemisessä. Yhdysvalloissa on arvioitu, että siellä kaikista HIV-positiivisista 45 % on tietoisia diagnoosistaan, mutta ei ole kiinnittynyt hoitojärjestelmään (13). Tutkimuksessa arvioitiin, että 61 % HIV-tartunnoista on lähtöisin tästä ryhmästä.
Suomessakin on todettu onnistuneen hoitoon-ohjauksen merkitys. Pääkaupunkiseudulla havaittiin HIV-epidemia pistohuumeiden käyttäjien keskuudessa vuonna 1998. Epidemia havaittiin varsin alkuvaiheessa (21,22). Joulukuussa 2000 perustettiin HIV-positiivisille pistohuumeiden käyttäjille palvelukeskus, jonka palvelut räätälöitiin vaikeasti syrjäytyneelle kohderyhmälle (23). Huumeidenkäyttäjät saatiin hoidon piiriin vasta heille suunnatun palvelukeskuksen perustamisen jälkeen (kuviot «»1 ja «»2), ja samanaikaisesti pistohuumeiden käyttäjien uusien HIV-tapausten ilmaantuvuus kääntyi laskuun. Hoitojärjestelmään kiinnittyneitä oli 53 % (67/126) palvelukeskuksen avautuessa vuonna 2000 ja yli 99 % (183/184) vuonna 2016 (24).
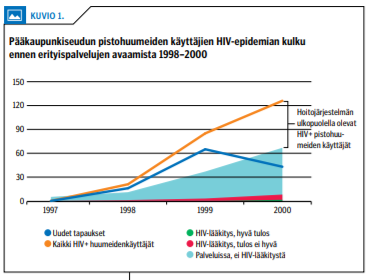
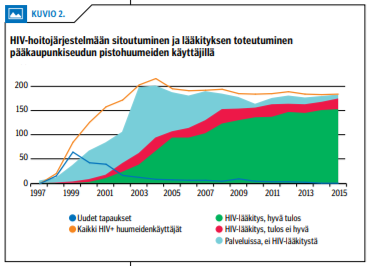
Palvelukeskuksessa on saavutettu sittemmin hyvät tulokset myös HIV-lääkityksen toteuttamisessa ja hoitotuloksissa myös kansainvälisen arvion mukaan (kuvio 2) (25).
Nykyään Suomessa HIV-positiivisten hoitoon-ohjaus ja hoidossa pysyminen onnistuvat hyvin. THL:n laaturekisterin pilottitietojen perusteella 2018 Suomen HIV-positiivisista 98 % sai HIV-lääkitystä (26). UNAIDS:n mukaan maailman HIV-positiivisista 62 % sai HIV-lääkitystä (1).
WHO:n tavoitteena on siis, että HIV-lääkitystä saavista potilaista yli 90 %:lla on hyvä hoitotulos käyttäen kriteerinä mittauskynnyksen alapuolella olevaa viruspitoisuutta (12).
HIV-lääkityksen kulmakiviä ovat potilaan sitoutuminen lääkehoitoon, riittävän tehokas HIV-lääkkeiden yhdistelmä ja hoitotuloksen seuraaminen veren viruspitoisuuden avulla (7). Hoidon kehittymisen seurauksena HIV-positiivisten AIDS-diagnoosit ja kuolemat vähenivät kehittyneissä maissa jyrkästi jo 1990-luvun lopulla ja myös kehitysmaissa 2000-luvulla (27). Vuodesta 2000 vuoteen 2018 oli AIDSiin kuolleiden vuotuinen määrä puolittunut 770 000:een (1).
Kattava lääkityksen toteuttaminen johtaa uusien HIV-tapausten vähenemiseen, mikä havaittiin ensimmäiseksi San Franciscossa ja Brittiläisessä Kolumbiassa kymmenisen vuotta sitten (28,29). Vuosituhannen vaihteesta alkaneen kehitystyön ansiosta HIV-lääkityksen saatavuus ja teho ovat nykyään eteläisessä ja Itä-Afrikassa yhtä hyvät kuin kehittyneissä länsimaissa (kuvio «»3) (30). Samanaikaisesti uusien HIV-tapausten määrä on laskenut voimakkaasti etenkin näissä osissa Afrikkaa (31) (kuvio «»4).
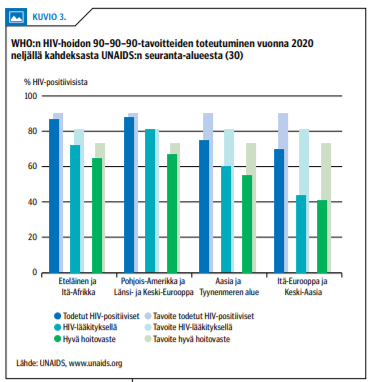
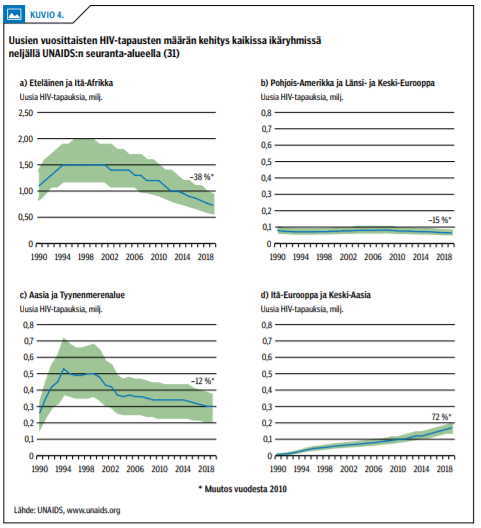
HIV-lääkityksen kehitys ei ole ollut yhtä suotuisaa Aasian ja Tyynenmeren alueella, jossa kuitenkin uusien tapausten määrä on lievästi laskussa. Hoidon ja lääkityksen kattavuus on edelleen heikkoa Itä-Euroopassa ja Keski-Aasiassa, joissa 2010-luvulla vuosittain todettujen uusien HIV-tapausten määrä on lisääntynyt 72 % (kuviot «»3 ja «»4).
Nykyaikaisen HIV-lääkityksen varhainen aloittaminen on potilaan ennusteen kannalta paras ratkaisu. Maailmalaajuinen START-tutkimus osoitti, että varhain aloitettu lääkitys esti vakavaa sairastumista merkittävästi enemmän kuin myöhemmin aloitettu ja että varhain aloitettuun lääkitykseen liittyi harvoin vakavia haittavaikutuksia (32).
Sveitsiläislääkärit havaitsivat runsaat kymmenen vuotta sitten, että onnistunut lääkitys estää HIV:n tarttumisen pariskunnilla, joissa toinen on HIV-positiivinen ja toinen HIV-negatiivinen, vaikka he eivät käyttäneet kondomia yhdynnöissään (33). Tämä havainto on vahvistettu kahdessa suuressa prospektiivisessa tutkimuksessa (34,35). Käytännössä tämä tarkoittaa, että hyvässä hoidossa oleva HIV-potilas ei tartuta virusta.
Suomessa HIV-lääkitystä saavista 95 %:lla oli hyvä hoitotulos vuonna 2018 (26). UNAIDS arvioi vuonna 2018 maailman kaikista HIV-lääkitystä saavista 85 %:lla olevan hyvä hoitotulos (1).
Paikallisesti limakalvolla käytettävillä mikrobisideilla ei ole onnistuttu toistaiseksi vähentämään merkittävästi HIV-tartunnan riskiä (36). Miesten ympärileikkauksen on osoitettu vähentävän kontrolloiduissa tutkimuksissa HIV-tartuntariskiä 58 % (37). Ympärileikkauksen hyväksyttävyys kulttuureissa kuitenkin vaihtelee.
HIV:lle altistumisen jälkeistä lääkeprofylaksia (PEP) on käytetty 1990-luvulta lähtien HIV-tartunnan ehkäisemiseen (38). Sen käyttö selkeissä altistustilanteissa on perusteltua, mutta sen vaikutus epidemiaan on rajallinen.
HIV:lle altistumista edeltävä lääkeprofylaksi (PrEP) on tullut käyttöön viime vuosina ensin Yhdysvalloissa ja hiukan myöhemmin EU-maissa. Sitä on käsitelty tuoreessa suomalaisessa katsauksessa (39). Satunnaistettujen vertailututkimusten perusteella edeltävä lääkeprofylaksi ehkäisee HIV-tartuntoja kustannustehokkaasti, kun sen käyttö kohdistetaan suuressa tartunnan vaarassa oleviin henkilöihin. Sen toteutus vaatii kuitenkin jatkuvaa lääketieteellistä seurantaa.
Hyvät hoitotulokset ovat johtaneet elossa olevien HIV-positiivisten määrän kasvuun. Vuodesta 2000 vuoteen 2019 HIV-positiivisten määrä maailmassa kasvoi 25 miljoonasta 38 miljoonaan (1). On tärkeää pitää yllä hyvää hoitojärjestelmää, koska hyvin toteutunut lääkitys estää viruksen tarttumista ja siten vähitellen johtaa myös hoidettavan potilasmäärän laskuun (12). Uudet pitkävaikutteiset kerran kuukaudessa tai harvemmin annosteltavat HIV-lääkkeet voivat helpottaa ja parantaa hoidon toteutumista osalla potilaista, mutta ne eivät välttämättä johda terveydenhuollon työmäärän vähenemiseen (40).
Edelleen on tärkeää estää uusia HIV-tartuntoja. Tässä työssä neuvonta ja valistus ovat tärkeitä työkaluja. WHO on suosittanut, että neuvontaa kohdistettaisiin entistä tarkemmin suuressa HIV-tartunnan riskissä oleviin ryhmiin, kuten pistohuumeiden käyttäjiin, miesten välistä seksiä harrastaviin, seksityöntekijöihin, transsukupuolisiin ja vankeihin (41).
Suomessa tulisi tehostaa testaamista, koska HIV todetaan Suomessa puolessa tapauksista myöhään (14). Hivpointin kokemukset osoittavat, että oikein suunnatuilla toimilla voidaan HIV:n toteamista aikaistaa Suomessakin (15). Varhaisesta diagnoosista hyötyy sekä potilas että yhteiskunta.
Varhainen testaus estää tartuntaketjujen syntymistä. Onnistunut tartunnanjäljitys johtaa myös tartuntaketjujen katkeamiseen. HIV-positiivisiksi todetuille on taattava nopea ja esteetön pääsy hoitojärjestelmään, koska onnistunut lääkitys estää tehokkaasti uudet tartunnat.
THL:n tartuntatautirekisteriin kerättävä tieto HIV-tapauksista on puutteellista. Esimerkiksi vuosina 2016-2019 lähes kolmasosasta rekisteriin ilmoitetuista uusista HIV-tapauksista puuttui tartuntatapa. Nykyisen rekisterin rakenne on niin jäykkä, että kerättyäkään tietoa ei voida riittävästi hyödyntää tiedon lisäämiseksi myöhäisistä HIV-diagnooseista. Lisäksi tartuntatautirekisterin tieto ei ole riittävää raportointivelvoitteiden täyttämiseksi WHO:lle ja Euroopan tartuntatautivirastolle, koska rekisteriin ei sen rakenteen vuoksi pystytä keräämään tietoa tapausten HIV-lääkityksestä eikä sen tuloksista.
HIV-infektion hoidon ylläpitäminen aiheuttaa terveydenhuollolle kaikkialla maailmassa valtavan työtaakan, jonka kesto on vuosikymmeniä. Suomessa ja Länsi-Euroopassa HIV:n juuriminen olisi todennäköisesti mahdollista nykyisin käytettävissä olevilla keinoilla, kun jatkuvasta ja riittävästä resurssoinnista huolehditaan. Silti on alueita, joissa HIV-lääkityksen kattavuus on HIV-positiivisilla pieni, kuten Itä-Euroopassa, Keski-Aasiassa, Lähi-Idässä ja Pohjois-Afrikassa alle 40 % (1). On mahdollista, että HIV-pandemian lopulliseen nujertamiseen voidaan tarvita apuna rokotetta (42).
Over four decades, 32 million people have died in the global HIV epidemic. There is no vaccine protecting from HIV infection and no cure in view. Over the past 20 years, the spread of the HIV epidemic has been controlled to some extent as medical developments have facilitated involving the health care system in prevention of the infection. On the other hand, with the current measures, health care systems around the world will need several decades to completely stifle the HIV epidemic.