
Ks. artikkelin pdf-versio «http://www.fimnet.fi/cl/laakarilehti/pdf/2022/SLL33-34-2022-1339.pdf»1 Lääkärilehden sivuilla (vaatii FiMnet-tunnuksen).
Idiopaattisen keuhkofibroosin (IPF) äkillinen pahenemisvaihe (AE, acute exacerbation) kuvattiin ensimmäisen kerran jo noin 30 vuotta sitten (1), mutta tietoisuus asiasta on lisääntynyt vasta viime vuosina. Vuonna 2007 kansainvälinen työryhmä esitti idiopaattisen keuhkofibroosin äkilliselle pahenemisvaiheelle (AE-IPF) ensimmäisen määritelmän, joka päivitettiin vuonna 2016 (2,3).
Äkillisiä pahenemisvaiheita esiintyy IPF:n ohella myös muissa fibroottisissa interstitiaalisissa keuhkosairauksissa (ILD) (4−6, taulukko 1 «»1), joihin viittaamme tässä katsauksessa yleistermillä keuhkofibroosi. Keuhkofibroosin äkilliseen pahenemisvaiheeseen (AE-ILD, acute exacerbation of interstitial lung disease) liittyy erittäin suuri kuolleisuus ja se tekee keuhkofibroosien ennusteen arvioinnista haastavaa (3).

AE-IPF:n määritelmän mukaan potilaalla tulee olla aikaisempi tai pahenemisvaiheen yhteydessä diagnosoitu keuhkofibroosi, tyypillisesti alle kuukauden kuluessa kehittynyt hengenahdistuksen vaikeutuminen ja uudet molemminpuoliset muutokset (mattalasit ja/tai konsolidaatiot) keuhkojen ohutleiketietokonekuvauksessa (HRTT) (3, kuva 1 «»2). Taudinkuvaan kuuluvat lisääntynyt liman eritys, yskä, flunssan kaltaiset oireet ja kuume (4,7,8).
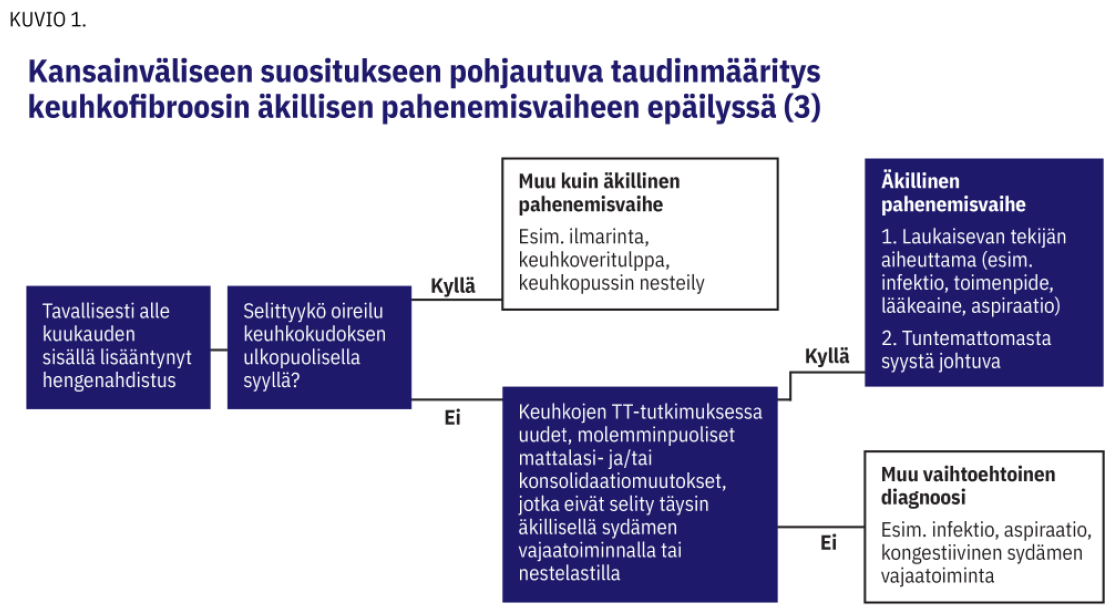
Nykyisen ohjeen mukaan äkilliset pahenemisvaiheet voidaan jakaa laukaisevien tekijöiden aiheuttamiin ja tuntemattomasta syystä johtuviin (3). Erotusdiagnostinen pohdinta keuhkokuumeen ja äkillisen pahenemisvaiheen välillä ei ole tarpeen uusimman, vuoden 2016 määritelmän mukaan, jos HRTT-löydös täyttää äkillisen pahenemisvaiheen kriteerit.
Myöskään infektioiden poissulkua keuhkohuuhtelututkimuksen (BAL) avulla ei suositella rutiininomaisesti tehtäväksi (3). Tutkimusten mukaan BAL:n tutkiminen ei ole vaikuttanut potilaiden hoitoon eikä ennusteeseen. Sen sijaan se on altistanut potilaat lisääntyneelle hengitystuen tarpeelle (9,10). BAL saattaa kuitenkin olla hyödyllinen opportunististen infektioiden poissulussa valikoiduilla, immunosuppressiivista lääkehoitoa saavilla, joihin usein kuuluvat esimerkiksi sidekudostautiin liittyvää keuhkofibroosia (CTD-ILD) sairastavat potilaat (11,12).
Opportunististen infektioiden aiheuttajista erityisesti Pneumocystis jiroveci ja sytomegalovirus tulisi huomioida diagnostiikassa. Mikäli keuhkohuuhtelututkimusta ei voi turvallisesti tehdä, voidaan tutkia ysköksestä Pneumocystis-PCR-näyte ja plasmasta sytomegalonukleiinihappo-osoitus.
Veren bakteeriviljelyt, hengitysteiden virusten PCR-testit ja virtsan pneumokokki- ja legionella-antigeenien määritykset voi tehdä samoilla periaatteilla kuin akuutteja alahengitystieoireita sairastaville potilaille, joilla ei ole keuhkofibroosia. Erotusdiagnostiikka hengitystieoireista kärsivien keuhkofibroosipotilaiden kohdalla on haastavaa, vaikka HRTT-kuvat olisivatkin saatavilla, sillä potilaat ovat usein iäkkäitä ja monisairaita ja heillä voi olla useita päällekkäisiä selittäviä tekijöitä oireidensa taustalla (13). AE-IPF:n nykyisen määritelmän mukainen diagnostista vuokaaviota (kuvio 1) voidaan soveltaa myös muissa keuhkofibroosityypeissä (6).
AE-IPF:n ilmaantuvuudeksi on arvioitu 5−17 % vuodessa (2,3). Vaikuttaa siltä, että äkilliset pahenemisvaiheet ovat yleisempiä IPF:ssä kuin muissa keuhkofibrooseissa (14). Pohjois-Pohjanmaan sairaanhoitopiirissä oli vuosina 2008−2017 yhteensä 128 keuhkofibroosin äkillisen pahenemisvaiheen saanutta potilasta, joista 62 %:lla oli IPF, 14 %:lla nivelreumaan liittyvä keuhkofibroosi, 9 %:lla asbestoosi, 6 %:lla epäspesifinen interstitiaalinen pneumonia (NSIP) ja lopuilla jokin muu keuhkofibroosi (15). Omassa tutkimuksessamme keuhkofibroosipotilaiden äkillisistä hengitystieoireista johtuvista sairaalahoitojaksoista äkillinen pahenemisvaihe selitti noin 40 % (13).
AE-ILD:n syy on tuntematon, mutta sen on arvioitu liittyvän sekä sisäsyntyisiin että ulkoisiin tekijöihin (3,16). Endoteelin ja keuhkorakkuloiden epiteelin vaurion on ajateltu olevan merkittävä tekijä äkillisen pahenemisvaiheen kehittymisen kannalta (5,17,18). Myös tulehdussolut ja niiden tuottamat välittäjäaineet osallistuvat patogeneesiin, mutta niiden tarkkaa merkitystä prosessissa ei tunneta (19−21). AE-ILD:ssä histopatologinen löydös on diffuusi alveolivaurio eli DAD (diffuse alveolar damage), joka nähdään myös aikuisen hengitysvaikeusoireyhtymässä (ARDS) ja vaikeiden virusinfektioiden, kuten influenssan ja COVID-19:n, yhteydessä (3).
DAD peittää AE-ILD:ssä alkuperäisen histologisen keuhkomuutoksen osin tai kokonaan. DAD:n eksudatiivisessa eli tulehdusnesteisessä vaiheessa todetaan hyaliinikalvoja keuhkorakkuloiden pinnalla ja edeemaa (5,22). Lisäksi keuhkorakkuloiden tasolla nähdään neutrofiliaa, alveoliverisuonten vaurio ja mikrotrombien muodostusta (22).
Kaikki ARDS:lle yleisesti altistavat tekijät, kuten infektiot, aspiraatio, massiivinen verensiirto ja kirurgia ovat myös AE-ILD:n riskitekijöitä (3,22). Keuhkoihin kohdistuva mekaaninen stressi esimerkiksi kirurgisen keuhkokudosnäytteen tai keuhkoputkien tähystyksen yhteydessä voi altistaa AE-ILD:lle (11,23-26). Riski suurenee keuhkofunktioiden laskiessa ja sairauden edetessä (17,27-29). Miessukupuolen, korkean iän ja heikentyneet keuhkofunktiot riskitekijöinä huomioiva GAP (Gender-Age-Physiology) -indeksi on yhteydessä varhaisempaan AE-ILD:n ilmaantuvuuteen (13,27). AE-ILD voi kuitenkin tulla missä vaiheessa sairautta tahansa, ja se on usein myös keuhkofibroosin ensimmäinen ilmenemismuoto (15,30).
Virus- ja bakteeri-infektioiden merkitys on epäselvä AE-ILD:n synnyssä, vaikkakin aihetta on tutkittu. Osalla potilaista AE-ILD on hengitystieviruksen tai bakteerin laukaisema, mutta enemmistöllä laukaisevaa tekijää ei todeta (4,15,27). Hengitysteiden bakteeri- ja viruskuorma vaikuttaa olevan suurempi AE-IPF:n aikana kuin stabiilissa taudissa (31,32). Äkillisiä pahenemisvaiheita vaikuttaa esiintyvän enemmän kylminä kuin lämpiminä vuodenaikoina (15,33,34). Äkilliselle pahenemisvaiheelle saattavat altistaa myös ilmansaasteet ja refluksitauti (28,35,36). Lisää AE-ILD:n mahdollisia riskitekijöitä on lueteltu liitetaulukossa 1 «https://www.laakarilehti.fi/pdf/2022/SLL33-34-2022-1339.pdf»2.
AE-ILD:hen ei ole olemassa tehokasta, tutkimusnäyttöön perustuvaa lääkehoitoa (3). Kliininen käytäntö on ollut hoitaa IPF:n pahenemisvaihetta antibiooteilla, glukokortikoideilla ja muilla immunosuppressiivisilla lääkehoidoilla (37). Oysin AE-ILD-aineistossa prednisoloni 1-2 mg/kg suun kautta tai suoneen, yhdistettynä antibioottiin oli tavallisin hoitomuoto. Pulssisteroidia käytettiin alle 20 %:ssa tapauksista ja muita immunosuppressiivisia hoitoja alle 10 %:ssa tapauksista (15).
AE-ILD:n pulssisteroidihoidon käyttö vaikuttaa olevan muissa maissa selvästi yleisempää kuin Oysin tutkimusaineistossa (37). Makrolidien suotuisa vaikutus ennusteeseen on tullut esille kahdessa tutkimuksessa, mutta kansainvälistä tai kansallista suositusta makrolidien käytöstä AE-ILD:ssä ei ole olemassa (33,38).
Joidenkin tutkimusten mukaan nykyiset keuhkofibroosin äkillisen pahenemisvaiheen hoitokäytännöt saattavat olla jopa haitallisia potilaille. Esimerkiksi kortisonihoito on ollut yhteydessä huonoon ennusteeseen AE-IPF:n hoidossa yhdessä tutkimuksessa (39). Edellä mainittua tulosta tulkittaessa on kuitenkin huomioitava, että tutkimusasetelma on ollut takautuva, jolloin hoitoon on voinut vaikuttaa muun muassa hengitysvajauksen vaikeusaste.
Vastajulkaistussa satunnaistetussa, kontrolloidussa tutkimuksessa syklofosfamidihoidon yhdistäminen pulssisteroidihoitoon lisäsi AE-IPF:ssä kuolleisuutta (40). Hoito trombomoduliini-alfalla on osoittautunut tehottomaksi AE-IPF:n hoidossa pulssisteroidihoitoon yhdistettynä (41). Rituksimabi yhdistettynä plasmanvaihtoihin, glukokortikoidihoitoon ja suonensisäiseen immunoglobuliinihoitoon on vaikuttanut parantavan AE-IPF:n ennustetta (42,43). Äkillisen pahenemisvaiheeseen käytössä olevia lääkehoitoja ja meneillään olevia lääketutkimuksia on esitetty liitetaulukossa 2 «https://www.laakarilehti.fi/pdf/2022/SLL33-34-2022-1339.pdf»2.
Keuhkofibroosilääkkeet pirfenidoni ja nintedanibi vaikuttavat molemmat ehkäisevän AE-IPF:ää (44−46). Ne myös parantavat ennustetta silloin, kun lääkkeet ovat olleet käytössä ennen sairastumista (47-49). Antifibroottista lääkehoitoa ei tarvitse tauottaa äkillisen pahenemisvaiheen aikana (50). Nintedanibihoidon mahdollisesta hyödyllisyydestä äkillisen pahenemisvaiheen hoidossa on olemassa tapausselostuksia, muttei laajempaa tutkimusnäyttöä (51,52).
Muiden kuin IPF-tyyppisten keuhkofibroosien pahenemisvaiheen hoidossa on sovellettu AE-IPF:n lääkehoidon käytäntöjä, joskin hoitojen tehosta on vielä vähemmän tutkimusnäyttöä kuin AE-IPF:ssä (27,53). On huomioitava, että CTD-ILD-potilailla on usein käytössä perustautinsa hoitoon immunosuppressiivisia lääkkeitä, jolloin mahdolliset opportunistien aiheuttamat hengitystieinfektiot on huomioitava hoidossa (6,12).
AE-ILD:ssä hengitysvajausta hoidetaan happihoidolla hyödyntäen erilaisia muita hengitystukihoidon muotoja. Usein keuhkofibroosipotilaat on korkean ikänsä ja perussairauksiensa vuoksi rajattu tehohoidon ja invasiivisen hengityskonehoidon ulkopuolelle. Suurivirtauksinen happihoito (high-flow nasal oxygen, HFNO) on osoittautunut hyödylliseksi potilailla, joille tavanomainen happihoito ei ole riittänyt (54). Osa AE-ILD:tä sairastavista vaikuttaa hyötyvän ei-invasiivisesta ventilaatiohoidosta, mutta eräässä tutkimuksessa heilläkin oli korkea, 70 %:n kuolleisuus vuoden seuranta-aikana (55).
Tutkimuksissa, jossa keuhkofibroosipotilaita on hoidettu invasiivisella hengityskonehoidolla, on sairaalakuolleisuus tai kuukauden kuolleisuus ollut noin 80 % (56,57). Vuoden 2016 suositus ohjeistaa kuitenkin tapauskohtaiseen harkintaan hengityskonehoidon aloittamisessa (3). Hoidon aloittamista voisi puoltaa, jos potilas on keuhkonsiirtokandidaatti, hänen keuhkofunktionsa ja toimintakykynsä ovat olleet hyvät ennen sairastumista, tai jos hänen keuhkofibroosinsa on tyyppiä, jossa ennuste on parempi kuin IPF:ssä (15,37,55). Suomessa ja maailmalla voidaan tarkasti harkituissa tapauksissa tehdä keuhkonsiirtoja äkillisessä pahenemisvaiheessa, jolloin kehonulkoista happeuttamista voidaan hyödyntää siltahoitona (Tikkanen, Jussi, henkilökohtainen tiedonanto) (58,59).
Keuhkofibroosien pahenemisvaiheen ennuste on useimmissa tutkimuksissa huono; kolmen kuukauden kuolleisuus on ollut 40− 80 % (15,27,53). Tutkimuksissa, joissa on ollut mukana pahenemisvaiheen saaneita sekä IPF- että ei-IPF potilaita, yleensä IPF:ään on liittynyt korkeampi kuolleisuus (4,15,27). Suomalaisessa aineistossa todettiin, että mediaanielossaolo oli IPF:ssä 2,6 kk, asbestoosissa 4 kk, nivelreuma-ILD:ssä 42 kk ja NSIP:ssä 62 kk (15). Tutkimuksissa on yhdenmukaisesti osoitettu, että ennustetta huonontavat erityisesti hengitysvajauksen vaikeutta kuvaavat muuttujat, kuten pieni valtimoveren happiosapaineen ja sisäänhengityshapen suhde (P/F-suhde) (4,17,39), pieni valtimoveren happiosapaine (27) ja tarve joko invasiiviseen tai ei-invasiiviseen mekaaniseen ventilaatiotukeen (4,39). Muita ennusteeseen vaikuttavia tekijöitä on lueteltu liitetaulukossa 3.
AE-ILD on huonoennusteinen tila, joka on haastava diagnosoida ja hoitaa. Vaikka muissa keuhkofibrooseissa pahenemisvaiheen ennuste vaikuttaisi olevan yleensä parempi kuin IPF:ssä, niissäkin sairauteen liittyy merkittävää kuolleisuutta. Mitä vaikeampi hengitysvajaus on, sitä tärkeämpää on varhainen tiedottaminen heikosta ennusteesta potilaalle ja hänen omaisilleen ja oikea-aikainen siirtyminen hyvään palliatiiviseen hoitoon.
Keuhkofibroosilääkkeet vähentävät IPF-potilaiden riskiä sairastua pahenemisvaiheeseen, minkä vuoksi keuhkofibroosia sairastavat potilaat tulisi saada riittävän varhain fibroosilääkehoidon piirin. Jo keuhkofibroosin toteamisvaiheessa on tärkeää pohtia potilaan kelpoisuutta keuhkonsiirtoon ja aloittaa siirron selvittelyt niillä potilailla, joilla taudinkuva on etenevä ja pahenemisvaiheiden riski suurentunut.