
Ks. artikkelin pdf-versio «http://www.fimnet.fi/cl/laakarilehti/pdf/2023/SLL21-22-2023-938.pdf»1 Lääkärilehden sivuilla (vaatii FiMnet-tunnuksen).
Syöpärekisterin mukaan vuonna 2020 Suomessa eli yli 300 000 syövän sairastanutta ihmistä (1). Hoitomenetelmien kehittyessä yhä useampi sairastunut paranee ja altistuu myös hoitojen haitoille.
Syövän lääkehoitoihin voi liittyä tiedonkäsittelytoimintojen eli kognitiivisten toimintojen heikkenemistä (cancer treatment induced cognitive impairment), jolle ei ole vakiintunutta suomenkielistä termiä. Arkikielessä puhutaan lääkehoidon tuottamasta aivosumusta (chemobrain, chemofog).
Kemoterapian jälkeiset kognitiivisten toimintojen hankaluudet ilmenevät tyypillisimmin prosessointinopeuden, tarkkaavuuden säätelyn ja toiminnanohjauksen alueilla (2). Tutkimustieto on rajallista, eikä kognitiivisten haittojen huomioiminen ole systemaattista kliinisessä työssä.
Solunsalpaajien lisäksi myös hormonaalisiin hoitoihin liittyy kognitiivisia oireita. Tässä katsauksessa keskitytään rinta- ja eturauhassyöpähoitojen kognitiivisiin vaikutuksiin, sillä muiden kiinteiden kasvainten osalta tutkimustieto aiheesta on niukkaa.
Syövän hoitoon liittyvien kognitiivisten vaikeuksien mekanismit ovat osin epäselvät. Taustalla lienee mm. immuunijärjestelmän, endokriinisen säätelyn ja aivoverenkierron häiriöitä, lääkkeiden suora neurotoksinen vaikutus ja yksilöllinen alttius. Syövän lääkehoidon on arveltu kiihdyttävän normaalia ikääntymistä (2-4).
Monet sekoittavat tekijät vaikeuttavat hoitojen kognitiivisten vaikutusten arviointia. Heikko ravitsemustila, psyykkiset tekijät, kuten masennus ja ahdistus, sairastumiseen liittyvä stressi ja pelko, uupumus, ikääntyminen ja muut sairaudet, voivat altistaa kognition heikkenemiselle (4).
Kognitiivinen kapasiteetti muodostuu korkeasta koulutustasosta ja laaja-alaisesta virikkeellisyydestä, jotka voivat auttaa ylläpitämään aivojen toimintaa. Potilaat, joiden kognitiivinen suorituskyky on heikentynyt, ovat tavallista herkempiä lääkehoitojen haitoille. Korkeasti koulutetut tai vaativaa työtä tekevät saattavat toisaalta huomioida lievätkin muutokset, mutta sopeutua niihin ilman toimintakyvyn huomattavaa heikkenemistä (4-6).
Varhaisvaiheen rintasyövän liitännäishoidoilla pyritään pienentämään uusiutumisriskiä. Hoitoon voi biologisen alatyypin mukaan kuulua solunsalpaajia, vasta-aineita, hormonaalista hoitoa tai näiden yhdistelmiä.
Liitännäishoitona käytetään taksaaneja (dosetakseli, paklitakseli) ja antrasykliinejä (epirubisiini, doksorubisiini). Taksaanipohjaisista hoidoista voi seurata tarkkaavaisuuden, keskittymisen tai toiminnanohjauksen ongelmia, jotka ovat havaittavissa vielä puoli vuotta hoitojen jälkeen (7).
Tuoreen meta-analyysin mukaan subjektiivista kognition heikkenemistä esiintyi 21-83 %:lla (keskimäärin 44 %) solunsalpaajahoitoa saaneista rintasyöpäpotilaista. Neuropsykologinen tutkimus osoitti mitattavaa kog-nition heikkenemää 34 %:lla hoidon aikana, 21 %:lla 2-3 vuotta ja 8 %:lla vielä 10 vuotta hoidon päättymisestä. Tulokset ovat kuitenkin korkeintaan suuntaa-antavia, ja pitkäaikaisia seurantatietoja on niukalti (3).
Kun varhaisvaiheen rintasyöpää sairastaneet naiset satunnaistettiin saamaan joko solunsalpaajia ja näiden jälkeen hormonihoitoa tai pelkkää hormonihoitoa, kognition heikkenemistä todettiin molemmissa ryhmissä. Hormonihoitona käytettiin tamoksifeenia, aromataasinestäjiä tai molempia peräkkäin. Solunsalpaajahoidon aikana oireita oli enemmän kuin pelkän hormonihoidon alussa, mutta puolen vuoden kuluttua solunsalpaajahoidon päättymisestä erot olivat tasoittuneet (8).
Valtaosa solunsalpaajien kognitiivisia vaikutuksia selvittävistä tutkimuksista on tehty rintasyöpään sairastuneilla. Eturauhassyöpää sairastavilla kemoterapian kognitiivisista vaikutuksista on niukalti tietoa (9). Esimerkiksi pienehkössä tutkimuksessa (n = 155) kastraatioresistenttiä metastasoinutta eturauhassyöpää sairastavilla miehillä dosetakseliin, uuden polven hormonihoitoihin (entsalutamidi ja abirateroni) tai radium 223 -isotooppihoitoon ei liittynyt merkittävää kognitiivisen tason laskua (10).
Rintasyövistä 65-75 % on estrogeenireseptorin (ER) suhteen positiivisia. ER-positiivisen syövän hormonaalinen liitännäishoito kestää viisi tai jopa 10 vuotta (11).
Rintasyövän solunsalpaajahoitoa saavien kognitiivinen oireilu on voimakkaampaa kuin hormonihoitoon liittyvä, mutta jopa puolet hormonihoitoakin saavista kokee kognition vaikeuksia (5). Neuropsykologisissa tutkimuksissa oireilua on todettu 32-64 %:lla hormonihoitoa käyttävistä (12,13).
Estrogeeni osallistuu hermosolujen kasvun säätelyyn. Sillä on myös aivojen estrogeenireseptorien kautta välittyvää hermokudosta ja kognitiota suojaavaa vaikutusta. Näitä reseptoreja on aivojen oppimiseen, muistiin ja toiminnanohjaukseen liittyvillä alueilla (4,14).
Rintasyövän hormonihoidot tähtäävät estrogeenivaikutuksen estoon. Estrogeenireseptorin muuntelija tamoksifeeni kilpailee sitoutumisesta estrogeenin kanssa. Letrotsoli, anastrotsoli ja eksemestaani estävät aromataasientsyymiä, jota tarvitaan muodostamaan androgeeneista estrogeenia. Premenopausaalisilla naisilla voidaan käyttää myös lääkkeellistä munasarjasuppressiota.
FDG-PET-kuvauksissa on havaittu sekä tamoksifeeniin että aromataasinestäjiin liittyvän aivojen glukoosiaineenvaihdunnan vähentymistä (15,16). Joissakin tutkimuksissa aromataasinestäjiin on liittynyt enemmän muistiin ja huomiokykyyn liittyviä kognitiivisia oireita kuin tamoksifeeniin, mutta päinvastaisiakin tuloksia on saatu (17-19).
Etäpesäkkeisessä ER-positiivisessa rintasyövässä käytetään sykliinistä riippuvaisten kinaasien (CDK 4/6) estäjiä yhdessä hormonaalisen hoidon kanssa. Palbosiklibi, ribosiklibi ja abemasiklibi hidastavat syöpäsolujen kasvua ja jakautumista. Alustavien tutkimusten pohjalta niillä saattaisi olla hormonihoidon kognitiivisilta haitoilta suojaavaa vaikutusta, mutta lisätietoa tarvitaan (20-22).
Ikääntyvillä miehillä matalat testosteronitasot ovat yhteydessä muistin, puheentuoton ja motoriikan heikkenemiseen. Androgeenireseptoreja (AR) esiintyy aivoissa mm. muistiin liittyvillä alueilla (23).
Androgeenideprivaatio (ADT) eli kastraatio on levinneen eturauhassyövän tärkein hoitomuoto. Lääkkeellistä kastraatiota käytetään myös sädehoidon liitännäishoitona sekä radikaalihoitojen jälkeen uusiutuneessa taudissa.
Mittausmenetelmäin mukaan kognitiivista heikkenemistä ei joko todettu lainkaan tai todettiin vaihdellen jopa 70 %:lla ADT-hoitoa käyttävistä (23,24). ADT-hoito vähentää glukoosiaineenvaihduntaa mielialaan, kielelliseen muistiin ja avaruudelliseen hahmottamiseen liittyvillä aivoalueilla (25).
Eturauhassyöpään sairastuvat miehet ovat usein iäkkäitä, ja osalla on kognitiivisia ongelmia jo ennen syöpään sairastumista. ADT voi heikentää avaruudellista hahmottamista, motoriikkaa ja toiminnanohjausta (23). Muistisairauden riski oli hiukan suurentunut niillä potilailla, joille annettiin yli vuoden mittainen ADT-hoito (26).
ADT-hoitoon voi liittyä psyykkistä oireilua. Erityisesti masennuksen ja ahdistuksen riski on suurentunut. Libidon heikkeneminen, uupumus ja unihäiriöt voivat osaltaan vaikuttaa kognitiivisiin toimintoihin (23,24,27).
Uudemmista hormonihoidoista antiandrogeenit entsalutamidi ja apalutamidi läpäisevät veri-aivoesteen. Niihin voi liittyä uupumusoireita. Entsalutamidia tai lumelääkettä ja entsalutamidia tai androgeenisynteesin estäjä abirateronia käyttävien kognitiivisessa suorituskyvyssä ei ole todettu eroja (28-30).
Tiedonkäsittelyn vaikeuksia voidaan tutkia kyselemällä subjektiivisia kokemuksia haitoista. Objektiivisempi kuva saadaan tiedonkäsittelysuoritusta testaamalla. Testatessa on tärkeää käyttää psykometrisesti laadukkaita menetelmiä, joiden validiteetti ja reliabiliteetti ovat hyviä. Tulkitsijallakin on väliä - menetelmien tulkinta vaatii koulutusta ja psykometriikan ymmärtämystä, joka kuuluu esimerkiksi psykologien ja neuropsykologien koulutukseen.
FACT-Cog (The Functional Assessment of Cancer Therapy-Cognitive Function) on syöpäpotilaille validoitu kognitiota mittaava kysely (31). EORTC QLQ-C30 (European Organization for the Research and Treatment of Cancer Quality of Life Questionnaire) on syöpäpotilaiden elämänlaatua mittaava kysely, jonka viidestä osa-alueesta yksi mittaa kognitiota (32).
The International Cognition and Cancer Task Force (ICCTF) suosittaa kognition mittaamista validoiduin neuropsykologisin menetelmin, jotka mittaavat oppimista, muistia, tiedonkäsittelyn nopeutta ja toiminnanohjauksen tehokkuutta. Testeistä on suositeltu mm. seuraavia: Hopkins Verbal Learning Test-Revised (HVLT-R), Controlled Oral Word Association Test (COWAT) ja Trail Making Test (TMT). Neuropsykologinen testaus rutiiniseurantamielessä vaatii kuitenkin paljon resursointia (33). Keskeinen haaste olisikin vakioitujen tietotekniikka-avusteisten tutkimusprotokollien luominen.
Tutkimustieto suomalaisten syöpäpotilaiden kognitiivisista ongelmista on vähäistä. Hus Syöpäkeskuksen koordinoimassa Euroopan komission BOUNCE (GA 777167) -hankkeessa tutkittiin rintasyövän lääkehoitoa saavia potilaita neuropsykologisin testein. Tulokset hoidon vaikutuksista kognitioon julkaistaan lähiaikoina. Syöpäpotilaille validoidun FACT-Cog-kyselyn kääntäminen suomeksi helpottaisi potilaiden kokemien haittojen kyselyä. Taulukkoon «»1 on kerätty kognition osa-alueiden sisältökuvauksia ja tutkimusmenetelmiä esimerkinomaisesti (34).

Syövän lääkehoitoon liittyvien kognitiivisten haittojen tausta tunnetaan puutteellisesti eikä spesifisiä hoitokeinoja ole toistaiseksi käytettävissä. Terveellisiä elämäntapoja, kuten riittävää unta, monipuolista ruokavaliota, tupakoinnin lopettamista ja alkoholinkäytön vähentämistä suositellaan (2). Liikunta vaikuttaa lupaavalta keinolta vähentää kognitiivisia haittoja, ja syöpään sairastuneita tulisikin motivoida noudattamaan liikuntasuosituksia (taulukko «»2).
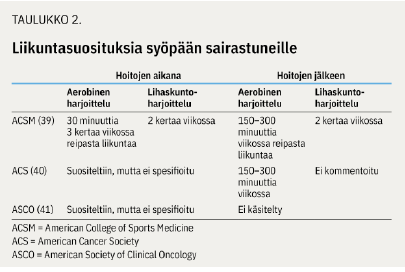
29 satunnaistetun liikuntatutkimuksen katsauksen mukaan liikunta vähensi varhaisvaiheen syöpään sairastuneiden kokemaa kognitiivista oireilua liitännäishoitojen aikana. Kymmenessä tutkimuksessa kognitiota oli arvioitu neuropsykologisin tutkimuksin ja näistä kolmessa liikunnan vaikutus arvioitiin merkitseväksi (33).
Prospektiivisessa kohorttitutkimuksessa rintasyöpään sairastuneiden (n = 580) kemoterapian aikaista liikuntakäyttäytymistä ja kognitiota verrattiin terveisiin verrokkeihin (n = 363). Vain kolmasosa potilaista liikkui suositusten mukaan, eli ≥ 150 minuuttia viikossa vähintään kohtuullisen rasittavaa liikuntaa. Suositusten mukaan liikkuneiden naisten kognitio ei merkittävästi heikentynyt kemoterapian yhteydessä, toisin kuin liikunnallisesti passiivisten (35).
Rintasyövän liitännäishormonihoitoa suositellaan uusiutumisriskin ja lääkityksen siedon mukaan 5-10 vuoden ajalle. Jopa kolmannes aromataasinestäjiä käyttävistä kuitenkin keskeyttää hoidon haittojen takia (36). Jos rintasyövän liitännäishormonihoidon aikana ilmenee hankalia kognitiivisia haittoja, lääkityksen voi tauottaa ja arvioida mahdollisuutta jatkaa toisella valmisteella.
Digitaalisten kuntoutus- ja harjoitusohjelmien käytöstä syöpäpotilaiden kognitiivisten ongelmien hoidossa on alustavia tuloksia, joiden mukaan niistä voi olla hyötyä joillakin kognitiivisten toimintojen osa-alueilla (37,38).
Pitkittyneiden tai vaikeiden kognitiivisten oireiden yhteydessä potilas tulisi ohjata tarkempiin neurologisiin tutkimuksiin ja arvioon esimerkiksi neuropsykologisten tutkimusten, ohjannan tai kuntoutuksen tarpeesta. Kognitiivisesta kuntoutuksesta on tutkitusti hyötyä syöpään ja sen hoitoon liittyvien kognitiivisten ja psyykkisten oireiden hoidossa (31). Myös toimintaterapiaa voidaan käyttää haittojen lievittämisessä.
Syövän lääkehoitoon liittyvät kognitiiviset oireet ovat tavallisia ja niiden mahdollisuudesta tulisi keskustella hoitoa aloitettaessa. Tutkimusta aiheesta on tehty melko niukasti, lähinnä rinta- ja eturauhassyöpään sairastuneilla. Erityisesti hoitojen pitkäaikaisvaikutuksista ja kognitiivisten haittojen ehkäisystä tarvitaan isää tietoa. Liikunnasta vaikuttaisi olevan hyötyä, ja syöpään sairastuneita tulisikin motivoida terveellisiin elämäntapoihin ja liikkumaan myös hoitojen aikana.