
Ks. artikkelin pdf-versio «http://www.fimnet.fi/cl/laakarilehti/pdf/2025/SLL15-2025-1176.pdf»1 Lääkärilehden sivuilla (vaatii FiMnet-tunnuksen).
Lisämunuaisten kuorikerroksesta (kuva 1 «»1) vapautuu mineralokortikoideja (tärkeimpänä aldosteronia), kortisolia ja muita glukokortikoideja sekä lisämunuaisperäisiä androgeenejä, kuten dehydroepiandrosteronia (DHEA). Kortisolin erityksen säätely perustuu kuvan 1 «»1 mukaisesti hypotalamus-hypofyysi-lisämunuaisakselin (HPA-akselin) palautesäätelyjärjestelmään.
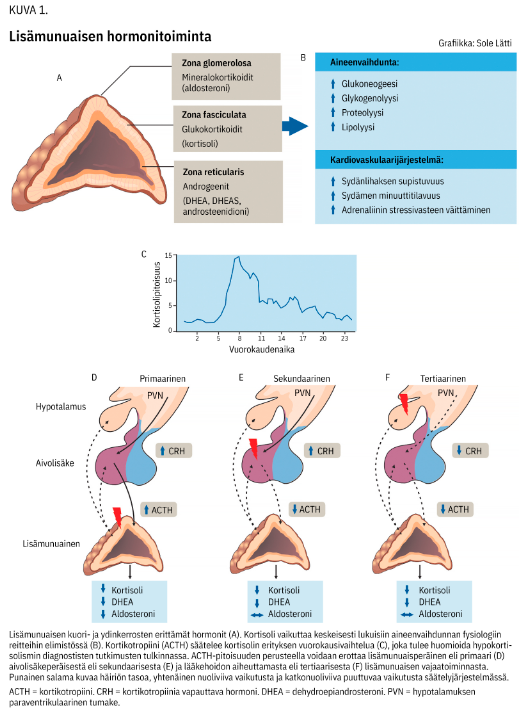
Aldosteronia säädellään pääosin reniini-angiotensiini-aldosteronijärjestelmän kautta. HPA-akselin aktiivisuuteen vaikuttavat elimistön kuormitustila ja vuorokaudenaika.
Kortikotropiinin (ACTH) ja siitä seuraavan kortisolin eritys on suurimmillaan aamuyöllä ja pienimmillään keskiyöllä (kuva 1 «»1) (1,2).
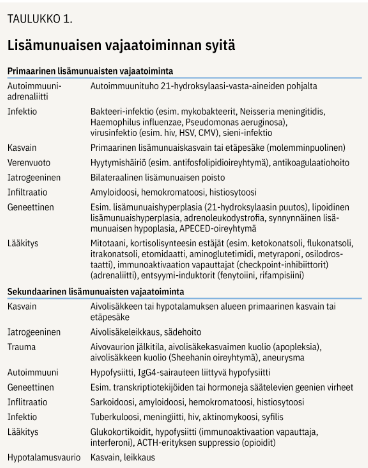
Hypokortisolismi eli kortisolin vajaaeritys jaotellaan vaurion sijainnin perusteella kolmeen eri tasoon (kuva 1 «»1, taulukko 1 «»2).
Primaarisessa muodossa koko lisämunuaisen kuorikerros toimii puutteellisesti, jolloin kehittyy kaikkien kuorikerroshormonien vaje. Palautesäätelyjärjestelmän aktivoituessa kortikotropiinia vapauttavan hormonin (CRH) ja ACTH:n pitoisuudet suurenevat.
Sekundaarisessa vajaatoiminnassa hypofyysin ACTH:n eritys on puutteellista. Jos koko HPA-akseli lamaantuu hypotalamuksen tasolla, kirjallisuudessa käytetään nimitystä tertiaarinen vajaatoiminta (kuva 1 «»1).
Primaarisen lisämunuaisten vajaatoiminnan eli Addisonin taudin yleisin aiheuttaja on autoimmuuniadrenaliitti, jossa muodostuu kuorikerrosautovasta-aineita steroidisynteesientsyymejä, kuten 21-hydroksylaasia, vastaan. Toiseksi yleisin syy on synnynnäinen lisämunuaishyperplasia, jossa CYP21A2 -geenin mutaation seurauksena 21-hydroksylaasin toiminta heikkenee (2).
Kortisolin ja aldosteronin vaje sekä lisämunuaisen androgeenien ylimäärä vaihtelevat entsyymitoiminnan mukaan (3). Näiden ohella taustalla voi olla jokin lisämunuaisten toimintaan vaikuttava lääke tai muu harvinaisempi syy (taulukko 1 «»2) (2,4,5).
Sekundaarisen lisämunuaisten vajaatoiminnan taustalla on ACTH:n puutos, joka kehittyy aivolisäke- tai hypotalamusvaurion myötä. Aivolisäkkeen kasvain voi johtaa ACTH:n puutokseen kudostuhon tai kasvaimen säde- tai leikkaushoidon seurauksena.
Pituitaarisessa apopleksiassa aivolisäkkeen sisäinen verenvuoto saa aikaan nopeasti aivolisäkkeen etulohkon vajaatoiminnan eli hypopituitarismin.
ACTH:n puutos voi aiheutua myös aivovammasta tai syöpälääkkeinä käytettävien immuno-aktivaation vapauttajien haittavaikutuksena kehittyneestä aivolisäkkeen tulehduksesta, hypofysiitistä (taulukko 1 «»2) (2,5).
Farmakologisen glukokortikoidilääkityksen lopettaminen on lisämunuaisten vajaatoiminnan yleisin syy. Tässä koko HPA-akseli lamaantuu: tieto fysiologista suuremmasta kortisolipitoisuudestatasosta välittyy hypotalamukseen ja hypofyysiin, minkä seurauksena CRH:n ja ACTH:n eritys vähenee. Lisämunuaisten atrofian kehittyminen vähentää edelleen kortisolin eritystä (6).
Jokaisen glukokortikoideja määräävän tulisi pitää mielessä lääkkeen lopettamiseen liittyvä oletettua yleisempi lisämunuaislama. Sen kehittymiseen vaikuttavat muun muassa glukokortikoidin annostelutapa, ajankohtainen ja kumulatiivinen annos, käyttöaika, biologinen hyötyosuus sekä geneettiset tekijät.
Jo 5 mg:n vuorokausiannos prednisoloniekvivalenttia yli 4 viikon ajan aiheuttaa merkittävän riskin hypokortisolismin kehittymiselle. Myös lyhyiden ja toistuvien kuurien on osoitettu aiheuttavan lisämunuaislamaa, erityisesti jos käytössä on useampi eri glukokortikoidivalmiste.
Glukokortikoidien valmistemuodoista inhaloitavat ja injektiot kuuluvat myös suuren riskin lääkkeisiin. Ihon kautta annostelu aiheuttaa pienemmän riskin HPA-akselin lamaantumiselle (liitetaulukko 1 «https://www.laakarilehti.fi/tieteessa/katsausartikkeli/hypokortisolismin-tunnistaminen-voi-olla-vaikeaa/»2 verkossa) (4,7).
Oireisto vaihtelee kortisolipuutoksen kehittymisnopeuden ja taustasairauden mukaan: Addisonin taudissa tai pituitaarisessa apopleksiassa hypokortisolismi voi kehittyä akuutisti äkillisen sairastumisen laukaisemana hengenvaarallisena kriisinä. Sekundaarisessa hypokortisolismissa puutos kehittyy usein hitaasti kuukausien kuluessa. Hypokortisolisminaste vaihtelee osittaisesta täydelliseen (8).
Glukokortikoidien puutteeseen liittyy laaja-kirjoisia oireita, kuten voimattomuutta, väsymystä, ruokahaluttomuutta, tahatonta painonlaskua, vatsakipua, lihas- ja nivelkipuja, masentuneisuutta ja kuukautiskierron häiriöitä (liitetaulukko 2 «https://www.laakarilehti.fi/tieteessa/katsausartikkeli/hypokortisolismin-tunnistaminen-voi-olla-vaikeaa/»2). Spesifien oireiden puute voi viivästyttää diagnoosia.
Primaariseen vajaatoimintaan liittyvä mineralokortikoidien vaje aiheuttaa natriumin hukkaa ja matalaa verenpainetta, joiden oireina ovat suolannälkä ja huimaus (8). Lisämunuaisen androgeenien puutteeseen voi naisilla liittyä libidon laskua, kainalo- ja genitaalialueen karvoituksen vähenemistä ja ihon kuivumista (1).
Addisonin taudin diagnoosivaiheen laboratoriotutkimuksissa on 84 %:lla hyponatremia, 52 %:lla suurentunut tyreotropiini (TSH) ja 34 %:lla hyperkalemia (2,9). Hypoglykemia on myös yleistä.
ACTH:n erityksen kiihtyminen aiheuttaa melanosyyttejä stimuloivan hormonin välityksellä auringolle altistuvan ihon tummumisen. Taipeisiin, kämmenten poimuihin, polviin, kyynärpäihin, tuoreisiin leikkausarpiin ja limakalvoille voi ilmaantua ruskeita ihomuutoksia. Autoimmuunisairauksissa voi ilmetä myös vitiligoläiskiä (8).
Sekundaarisessa lisämunuaisten vajaatoiminnassa kortisolin puutos on usein vain osittainen, eikä mineralokortikoidipuutosta ole (8). Iho on kalpea ACTH:n vähäisyyden vuoksi (3).
Glukokortikoidihoidon aiheuttaman kortisolivajeen oireet voivat sekoittua perustaudin oireisiin tai annoslaskusta aiheutuviin vieroitusoireisiin. Jos sekundaarisen lisämunuaisten vajaatoiminnan syynä on hypofyysin tai hypotalamuksen kasvain tai tulehdus, voi esiintyä muihin aivolisäkehormonipuutoksiin liittyviä oireita. Laboratoriotutkimuksissa ilmenee tyypillisesti hyponatremiaa.
Hypokortisolismin diagnosoimiseksi keskeistä on muistaa epäillä sairautta. Toisaalta on huomioitava, että farmakologisen hoidon, kuten inhaloitavien glukokortikoidien tai nivelpistosten, käyttöaikana kortisolipitoisuuden mittaaminen on turhaa. Tuolloin mitattu seerumin kortisolipitoisuus on pieni, koska sen määrittämisessä käytetty laboratoriomenetelmä ei mittaa synteettisten glukokortikoidien pitoisuuksia. Elimistön glukokortikoiditarve on silti turvattu.
Akuuttitilanteessa vaikeaoireiselta potilaalta otetaan diagnostiset kortisoli- ja ACTH-näytteet vuorokaudenajasta riippumatta talteen ennen glukokortikoidin antamista. Vahvan hypokortisolismiepäilyn herättyä hoito aloitetaan heti näytteenoton jälkeen. Kortisonihoidon jatkamista arvioidaan hoitovasteen ja arkena valmistuvien tulosten perusteella.
Hypokortisolismin toteamiseen ja tasodiagnostiikkaan tarvitaan kaksi verinäytettä: seerumin kortisoli- ja plasman ACTH-pitoisuudet. Hypokortisolismin osoittaminen perustuu aamulla mitattuun seerumin kortisolipitoisuuteen. Kortisolin eritys on huipussaan aamulla (kuva 1 «»1), ja tämän erityspiikin puuttuminen vahvistaa hypokortisolismin. Samaan aikaan mitattu ACTH kertoo, millä tasolla HPA-akselia vaurio sijaitsee.
Hypokortisolismin vaihteleva ja yleisluontoinen kliininen oireisto tulee osata suhteuttaa HPA-akselin toimintaa kuvaaviin laboratriomäärityksiin, joiden diagnostiset raja-arvot ovat suuntaa antavia.
Aamun seerumin kortisolipitoisuus < 140 mol/l vahvistaa hypokortisolismin (2,8). Tutkimusten perusteella seerumin kortisolipitoisuus > 275-480 nmol/l hyväkuntoisella potilaalla sulkee pois hypokortisolismin (2,8,10-12). Jos kortisolipitoisuus määritetään plasman sijaan seerumista, viitearvot ja raja-arvot todennäköisesti eroavat edellä mainituista (esim. Fimlabin ohjekirja).
Jos kortisolipitoisuus on harmaalla alueella ja oirekuva sopii hypokortisolismiin, tehdään tarvittaessa ACTH-rasituskoe, jossa annetaan 250 µg synteettistä ACTH:ta laskimoon tai lihakseen.
Kortisoli mitataan ennen injektiota, 30 ja 60 minuutin kohdalla. Jos pitoisuus ACTH:n annon jälkeen on yli 500 nmol/l, on tuotanto selvästi normaalia (10). Myös matalampia tasoja (30 minuutin kohdalla > 412-450 nmol/l tai 60 minuutin kohdalla > 450-500 nmol/l) on pidetty normaaleina (2,8). Tulkintarajat vaihtelevat laboratorioittain.
Estrogeenivalmisteiden käyttö tulee tauottaa kuudeksi viikoksi ennen tutkimusta. ACTH-rasitusta niin sanotulla miniannoksella (1 µg / 1,73 m2) ei ole osoitettu suuriannoksista paremmaksi, ja se on hankalampi toteuttaa (13-15).
Hypovolemia ja pieni aldosteronipitoisuus yhdessä suurentuneiden reniini- ja kalium-pitoisuuksien kanssa vahvistavat mineralokortikoidien puutteen primaarisessa lisämunuaisten vajaatoiminnassa. Myös DHEA-pitoisuus on pienentynyt.
Suuri ACTH-pitoisuus vahvistaa primaarisen lisämunuaisten vajaatoiminnan. Etiologian selvittämiseksi (taulukko 1 «»2) määritetään seerumin 21-hydroksylaasivasta-aineet tai lisämunuaisen kuorikerrosvasta-aineet. Negatiivisen tuloksen jatkotutkimuksena suositellaan lisämunuaisten tietokonekuvantamistaja 17-hydroksiprogesteronipitoisuuden määrittämistä; tarvittaessa tehdään laaja ACTH-rasituskoe.
Jos miehen lisämunuaisten vajaatoiminnalle ei löydy syytä, suljetaan pois adrenoleukodystrofia määrittämällä seerumin hyvin pitkäketjuiset rasvahapot.
Aamun kortisolipitoisuus < 83-100 nmol/l ja pieni tai normaali ACTH-pitoisuus yhdistyneenä kliiniseen oirekuvaan ja hyponatremiaan varmistavat aivolisäkeperäisen hypokortisolismin. Aamun kortisolipitoisuus > 400 nmol/l sulkee puutoksen pois suurella todennäköisyydellä (2,8).
Käytännön työssä raja-arvoja tulkitaan laboratoriomenetelmän, toistomittausten, taudin ennakkotodennäköisyyden ja kliinisen kuvan mukaan vapaammin (16,17).
Pitkäaikainen, viikkoja kestänyt ACTH:n puute johtaa lisämunuaiskuoren surkastumiseen, joten ACTH-rasitustestiä voidaan käyttää kortisolipitoisuuden ollessa raja-arvoinen (2,8). Aivolisäkeleikkauksen jälkeen rasituskoetta suositellaan aikaisintaan kuusi viikkoa toimenpiteestä (3).
Farmakologisen glukokortikoidien käytön jälkeisen hypokortisolismin riski on pieni alle 3-4 viikon kestoisen kortisonikuurin jälkeen (18). Arviointia tarvitaan, kun pitkäkestoisen glukokortikoidihoidon lopetusta suunnitellaan. Kuvion 1 «»3 mukaisesti pitkävaikutteiset glukokortikoidit vaihdetaan fysiologiseen hoitoon ennen kortisolipitoisuuden tutkimista (18).
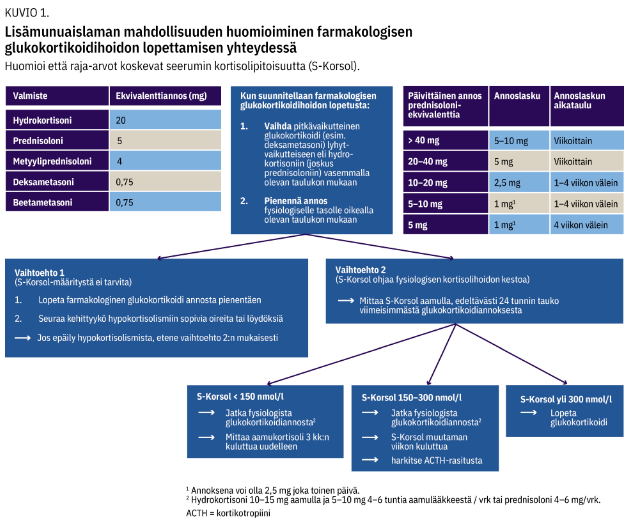
Raja-arvoisina seerumin kortisolipitoisuuksina on pidetty < 150 nmol/l ja > 300 nmol/l, jotka joko vahvistavat tai sulkevat pois hypokortisolismin (11). Tällä välillä olevilla pitoisuuksilla fysiologista kortisonihoitoa voi jatkaa (kuvio 1 «»3) (18).
Erityistilanteissa ACTH-rasituksen tarpeellisuudesta voi konsultoida endokrinologia. Kortisolipitoisuus > 350 nmol/l 30 minuutin näytteessä ennustaa parhaiten lisämunuaislaman parantumista. Pitoisuuden jäädessä alle 100 nmol/l:n paraneminen on epätodennäköisempää (19).
Suomessa on käytössä useita eri kortisolin määritysmenetelmiä. Immunologisten menetelmien tulostaso vaihtelee, ja massaspektrometristen menetelmien tulostaso on näitä heikompi (2).
Seerumin kortisolipitoisuus mittaa vapaata osuutta ja kortisolia sitovaan globuliiniin (cortisol binding globulin, CBG) sitoutunutta muotoa. CBG-pitoisuutta suurentavien estrogeenihoidon sekä raskauden aikana kortisolipitoisuus voi olla hypokortisolismissa normaalitasolla.
Vaikeaan maksa- tai yleissairauteen voi liittyä pienentynyt CBG-pitoisuus, mikä voi johtaa virheelliseen hypokortisolismidiagnoosiin (8). Myös tutkimuksen aikaan käytetyt synteettiset glukokortikoidit (mm. prednisoni) häiritsevät kortisolimääritystä.
Hypokortisolimin diagnostiikassa sairausanamneesiin liittyvä hypokortisolismin riski sekä oireiden tyypillisyys antavat käsityksen siitä, kuinka todennäköinen tämä on tutkittavalla. Tarvitaan myös aamun seerumin kortisolipitoisuus, jolle ei voi määrittää yksittäistä diagnostista raja-arvoa, vaan tulos tulee suhteuttaa kliiniseen kokonaiskuvaan.
Kortisolimäärityksen virhelähteet otetaan huomioon. Epäselvissä tilanteissa aamukortisolin toistomittaukset ja mahdollisen kortisonikorvaushoidon vaste selkiyttävät diagnoosin. Pitkäaikaista glukokortikoidihoitoa lopetettaessa uusi kansainvälinen ohjeisto auttaa kliinikkoa lopettamaan hoidon turvallisesti (18).