MS-tauti
Ota käyttöön
- Luentomateriaali: Keskeinen sanoma ja oireenmukainen hoito «https://www.kaypahoito.fi/khl00138»1
- Lisätietoa: McDonaldin diagnostiset kriteerit 2017: aaltomainen MS-tauti ja ensisijaisesti etenevä MS-tauti «McDonaldin diagnostiset kriteerit 2017: aaltomainen MS-tauti ja ensisijaisesti etenevä MS-tauti»1
- Taulukko: Eri valmisteiden turvavälit ennen uutta hoitoa «Eri valmisteiden turvavälit ennen uutta hoitoa....»1
- Taulukko: Eri valmisteiden turvavälit ennen suunnitellun raskauden alkua ja valmisteiden käyttö imetyksen aikana «Eri valmisteiden turvavälit ennen suunnitellun raskauden alkua ja valmisteiden käyttö imetyksen aikana ....»2
Miten viitata Käypä hoito -suositukseen? «K1»1
Keskeinen sanoma
- Multippeliskleroosi eli MS-tauti on krooninen keskushermoston autoimmuunisairaus.
- MS-taudin diagnoosi tehdään McDonaldin vuoden 2017 kriteereiden mukaisesti eli neurologisiin oirejaksoihin, magneettikuvantamiseen ja lannepistolöydökseen tukeutuen.
- Hoito aloitetaan viipymättä diagnoosin jälkeen, mikäli tautiaktiivisuutta todetaan.
- MS-tauti määritetään aktiiviseksi tai erittäin aktiiviseksi kliinisten pahenemisvaiheiden ja/tai magneettikuvauksessa (MK) todettavien T2- tai gadolinium (Gd) -tehostuvien MS-tautiin sopivien muutosten perusteella.
- Lääkevalinta tehdään yhdessä potilaan kanssa, ja siinä tulee huomioida myös kustannukset potilaalle ja yhteiskunnalle «hoi36070a.pdf»1, «The effectiveness and costs of disease-modifying therapies for relapsing-remitting multiple sclerosis»2.
- Varhaisen korkeatehoisen lääkehoidon merkitys ennusteelle tulee huomioida lääkehoitoa valittaessa. Tämä on erityisen tärkeää erittäin aktiivisessa MS-taudissa, mutta todennäköisesti hyödyllistä myös aktiivisessa aaltomaisessa MS-taudissa.
- KEO (kliinisesti eriytynyt oireyhtymä) -potilaita, joilla on likvor- tai MK-löydöksen perusteella suurentunut riski sairastua MS-tautiin, seurataan MK:lla tilanteen mukaan 3–12 kuukauden välein MS-taudin varhaisen diagnoosin varmistamiseksi.
- Tautiaktiivisuutta seurataan säännöllisesti pahenemisvaiheiden, kliinisen tilanteen (yleensä EDSS-pistein arvioituna) ja MK:n avulla ja niiden perusteella tehdään päätökset hoidon tehostamisesta tai muutoksesta.
- Tulehduksellisella aktiivisuudella tarkoitetaan pahenemisvaiheita ja MK:ssa näkyviä Gd-tehosteisia tai uusia ja/tai laajenevia T2-muutoksia. Aaltomaisessa MS-taudissa oirekuvan hidas eteneminen ei ole tässä tarkoitettua tulehduksellista aktiivisuutta.
- Lääkityksen lopetukseen liittyvä rebound-riski on huomioitava joidenkin lääkkeiden lääkevaihdoissa.
- Lääkityksen lopettamista suositellaan, jos sairauden oireet etenevät tasaisesti eikä tulehduksellista aktiviteettia enää ole, ja yleensä viimeistään, kun potilas on yli 60-vuotias.
- Lääkinnälliseen kuntoutukseen kuuluvat hyvä informointi sairaudesta, riittävä ja oikea-aikainen sopeutumisvalmennus, liikuntaneuvonta sekä yksilöllinen ja moniammatillinen havaittujen tarpeiden mukainen kuntoutus.
- Työkyvyttömyyden uhka tulee tunnistaa ajoissa, ja siihen on viipymättä puututtava työterveyshuollon ja ammatillisen kuntoutuksen toimin. Työkykyarvion tekee työolot tunteva työterveyslääkäri. Neurologian erikoislääkäri suunnittelee muun hoidon ja arvioi sairauden vaikutusta toimintakykyyn, tarvittaessa moniammatillisen työryhmän avulla.
Tiivistelmä ja potilasversio
- Suosituksen tiivistelmä «MS-tauti»1
- Suosituksen yleiskielinen potilasversio suomeksi «MS-tauti»2 ja ruotsiksi «MS (multipel skleros)»3
Sisältö ja kohderyhmät
- Suosituksessa keskitytään MS-taudin diagnostiikkaan, hoitoon ja kuntoutukseen.
- Suositus on tarkoitettu MS-taudin parissa työskenteleville terveydenhuollon ammattilaisille.
Määritelmiä
- MS-tauti: keskushermoston hajapesäkkeinen tulehduksellinen sairaus, jonka oireet aiheutuvat joko suoranaisesta hermokudoksen vauriosta tai tulehduksen välittäjäaineiden vaikutuksesta hermosoluihin tulehduspesäkkeissä tai niiden ympäristössä «Ruutiainen J, Tienari P. MS-tauti ja muut demyelin...»1.
- KEO: kliinisesti eriytynyt oireyhtymä: ajallisesti rajautunut ensimmäinen MS-tautiin sopiva oirejakso, jossa MS-taudin diagnostiset kriteerit eivät täyty.
- Oirejakso/pahenemisvaihe: tilanne, jossa MS-taudin aiheuttama uusi neurologinen oireisto tai vanhojen oireiden äkillinen selvä paheneminen kestää vähintään 24 tuntia ja enintään neljä viikkoa. Oireet voivat olla peräisin yhdeltä tai useammalta keskushermoston alueelta. Potilas voi toipua oirejaksosta kokonaan tai vain osittain «Thompson AJ, Banwell BL, Barkhof F, ym. Diagnosis ...»2.
- REO: radiologisesti eriytynyt oireyhtymä (RIS; radiologically isolated syndrome). MK:ssa todetaan sattumalöydöksenä MS-tautiin sopivia muutoksia ilman MS-taudin kliinisiä löydöksiä.
- RRMS (relapsing remitting MS): aaltomainen MS-tauti. Diagnoosivaiheessa RRMS käsittää
85–90 % kaikista MS-tautitapauksista. Potilaalla esiintyy toistuvaa tulehduksellista
aktiivisuutta, jonka merkkinä on
- pahenemisvaiheita, joista on toivuttu joko osin tai kokonaan tai
- yksi pahenemisvaihe, jonka yhteydessä todetaan tyypilliset MK-muutokset sekä likvorin oligoklonaliteetti, jolloin diagnoosi varmistuu jo yhden oirejakson yhteydessä, tai
- KEO, jonka seurannassa todetaan MK:ssa uudet tulehdukselliset muutokset.
- PPMS (primary progressive MS): ensisijaisesti etenevä MS-tauti: taudin alusta asti
tasaisesti etenevä liikunta- ja toimintakyvyn heikentyminen ilman selkeitä pahenemisvaiheita.
- PPMS käsittää 10–15 % MS-tapauksista.
- SPMS (secondary progressive MS): toissijaisesti etenevä MS-tauti. Aaltomainen MS-tauti
muuttuu osalla potilaista eteneväksi vuosien mittaan.
- Potilaalla ilmenee tasaisesti etenevää liikunta- ja toimintakyvyn heikentymistä. Myös pahenemisvaiheita voi vielä esiintyä.
- Tarkkoja diagnostisia kriteereitä SPMS-tautimuodolle on vaikea esittää.
- MS-rekisteri «https://www.neurorekisteri.fi/»2 arvioi SPMS-tautimuotoon siirtymistä kliinisten tietojen perusteella (kriteerit «Ziemssen T, Bhan V, Chataway J, ym. Secondary Prog...»3).
- EDSS (extended disability severity scale): mittari, jolla MS-potilaan toimintakykyä seurataan (kuva «Toimintakyvyn arviointiasteikko EDSS (Expanded Disability Status Scale)»1).

Toiminta- ja liikuntakykyä MS-taudissa voidaan arvioida kymmentasoisella EDSS-asteikolla. Taso 0 tarkoittaa oireetonta henkilöä, jolla on normaali toimintakyky, kun taas suurempi pistemäärä ilmaisee liikunta- tai muun toimintakyvyn heikkenemistä. Taso 10 merkitsee MS-taudista johtuvaa kuolemaa. Asteikon kehitti alun perin neurologi John Kurtzke vuonna 1983, minkä jälkeen se on ollut neurologien laajassa käytössä kliinisenä toimintakyvyn heikkenemisen seurannan työkaluna.
Muokattu lähteestä: Kurtzke JF. Rating neurologic impairment in multiple sclerosis: an expanded disability status scale (EDSS). Neurology 1983;33:1444-52 PMID: 6685237
© Suomalainen Lääkäriseura Duodecim
Oireet ja löydökset
- Ensimmäinen aaltomaisen MS-taudin oirejakso paikantuu tyypillisesti
- näköhermoon (toispuoleinen näköhermotulehdus, oireina näöntarkkuuden heikkeneminen ja silmän liikutteluarkuus)
- isoaivoihin (esimerkiksi toispuoleinen tuntohäiriö tai toispuoleinen raajaheikkous)
- selkäytimeen (raajan tai raajaparin, vartalonpuoliskon tuntohäiriö ja heikkous, jossa mukana on usein rakko-oire)
- aivorungon ja pikkuaivojen alueelle (kaksoiskuvat, silmien liikehäiriö kuten internukleaarinen oftalmoplegia, tasapainon ylläpidon vaikeus, ataksia) «Thompson AJ, Banwell BL, Barkhof F, ym. Diagnosis ...»2.
- Pahenemisvaiheen jälkeen esiintyviä jäännösoireita voivat olla
- raajojen lihasheikkous ja myöhemmin kehittyvä spastisuus
- keskushermostoperäiseksi sopivat tuntopuutokset, poikkeavat tuntoelämykset tai neuropaattiset kivut
- raajakoordinaation häiriöt ja ataksia, jotka ilmenevät esimerkiksi kävely- ja tasapainovaikeutena
- virtsarakon tai suolen toiminnan häiriö
- poikkeava uupumus ja kognitiiviset vaikeudet.
- PPMS:n yleisin alkuoire (70–80 %:lla) on spastinen parapareesi, joka ilmenee ensisijaisesti kävely- ja tasapainovaikeutena «Miller DH, Leary SM. Primary-progressive multiple ...»4.
- Perusterveydenhuollossa tulee osata epäillä MS-taudin mahdollisuutta ja tunnistaa sen oireet.
Diagnostiikka
- MS-diagnoosi on kliininen johtopäätös tyypillisten oireiden ja tutkimuslöydösten kokonaisuudesta. Diagnoosi edellyttää kliinistä ja kuvantamisarviota sekä pääsääntöisesti likvorin oligoklonaliteetin varmistamista.
- MS-tauti todetaan yleensä 20–40-vuotiaana.
- McDonaldin vuoden 2017 kriteerit määrittelevät lisäkriteerit, joiden on täytyttävä MS-diagnoosin asettamiseksi «Thompson AJ, Banwell BL, Barkhof F, ym. Diagnosis ...»2. Muiden diagnoosien tulee olla lähtökohtaisesti epätodennäköisempiä, jotta diagnoosi voidaan asettaa.
- Aaltomaisen MS-taudin diagnoosi edellyttää aina vähintään yhtä oirejaksoa.
- Kliinisen tutkimuksen lisäksi pään MK on keskeinen tutkimus MS-taudin diagnostiikassa «Wattjes MP, Ciccarelli O, Reich DS, ym. 2021 MAGNI...»5.
- Pään ja tarvittaessa selkäytimen MK:n avulla voidaan todeta diagnoosin edellyttämä keskushermoston tulehduksellisten pesäkemuutosten ajallinen ja paikallinen hajapesäkkeisyys.
- KEO-diagnoosin jälkeen seuraavan kuvauksen voi tehdä kliinisen harkinnan perusteella yksilöllisesti 3–6 kuukauden sisällä.
- Ajallinen hajapesäkkeisyys tarkoittaa kahta ajallisesti erillistä oirejaksoa tai eri-ikäisiä (tehostuvia ja tehostumattomia) muutoksia MK:ssa. Likvorin oligoklonaliteetti korvaa tarvittaessa MK:n puuttuvan ajallisen hajapesäkkeisyyden.
- Paikallinen hajapesäkkeisyys tarkoittaa kliinisiä löydöksiä tai oirejaksoja vähintään kahdelta keskushermoston alueelta tai sitä, että MK-löydös täyttää paikallisen hajapesäkkeisyyden kriteerit vähintään kahdella neljästä keskushermoston alueesta «McDonaldin diagnostiset kriteerit 2017: aaltomainen MS-tauti ja ensisijaisesti etenevä MS-tauti»1.
Tyypillinen oirejakso
- Oirejakso on aaltomaisen MS-taudin diagnoosin edellytys «Thompson AJ, Banwell BL, Barkhof F, ym. Diagnosis ...»2.
- Oirejakso sopii MS-taudissa neuroanatomisesti keskushermostoperäiseksi ja kestää yhtäjaksoisesti vähintään vuorokauden.
- Ensioireet voivat olla peräisin yhdeltä tai useammalta keskushermoston alueelta (ks. Oireet ja löydökset «A1»2).
- Suoraan etenevän MS-taudin (PPMS) yleisin alkuoire (70–80 %:lla) on hitaasti (viikoissa tai kuukausissa) kehittyvä spastinen parapareesi, joka ilmenee ensisijaisesti kävely- ja tasapainovaikeutena «Miller DH, Leary SM. Primary-progressive multiple ...»4, «Abdelhak A, Hottenrott T, Mayer C, ym. CSF profile...»6.
Tyypilliset magneettimuutokset
- MS-taudin diagnoosia varten tarvitaan 1,5 T:n tai 3 T:n kenttävahvuuden MK-laite. Nämä ovat riittäviä MS-taudin diagnostiikkaan ja seurantaan.
- MS-taudille tyypillisiä pään MK-muutoksia ovat soikeat, periventrikulaariset (aivokammioita vastaan kohtisuoraan sijoittuvat), jukstakortikaaliset (aivokuoreen liittyvät) ja takakuopan pesäkkeet «Rovira À, Wattjes MP, Tintoré M, ym. Evidence-base...»7, «Filippi M, Preziosa P, Arnold DL, ym. Present and ...»8.
- Eri magneettisekvenssit tuovat erilaista tietoa diagnostiikkaan:
- T2-kirkassignaaliset muutokset, joiden muoto, koko ja sijainti keskushermostossa arvioidaan osana erotusdiagnostiikkaa. Seurantakuvissa uudet T2-kirkassignaaliset muutokset kertovat uudesta aktiivisuudesta.
- FLAIR (fluid attenuated inversion recovery) -sekvensseissä uusien pesäkkeiden seurantamuutokset
- T1-sekvenssien krooniset MS-muutokset ("black holes") ja yhdessä varjoaineen kanssa tuoreen tulehdusaktiivisuuden löydökset.
- MK:n perusteella ei voi arvioida poikkeavuuden patologiaa tarkasti.
- MK:n pesäkemuutokset kehittyvät aktiivisesta Gd-tehostuvasta muutoksesta 1–2 kuukauden sisällä T2-kirkassignaalisiksi pesäkkeiksi.
- CVS (central vein sign) MK:ssa liittyy kehittyviin T2-muutoksiin MS-taudissa, ja radiologi voi hyödyntää sitä T2-muutosten erotusdiagnostisessa arvioinnissa «Sati P, Oh J, Constable RT, ym. The central vein s...»9, «Castellaro M, Tamanti A, Pisani AI, ym. The Use of...»10.
- Aivokuoren kortikaaliset muutokset ovat yhtä merkittäviä MK-löydöksiä kuin jukstakortikaaliset muutokset, mutta niiden havaitseminen nykyisin MK-menetelmin on epäluotettavaa «Harrison DM, Oh J, Roy S, ym. Thalamic lesions in ...»11.
- MS-potilaan pään MK käsittää aksiaalisen T1-, koronaalisen T2-, FLAIR- ja diffuusiokuvan. Muita MK-tekniikoita (DWI, DIR, MTR, DTI, PWI) voidaan tarvita erotusdiagnostiikkaan sekä kudosvaurion tarkempaan tulehduksellisuuden ja atrofian paikannuksen arvioon.
- MS-potilaalla voi esiintyä aivoatrofiaa jo taudin alussa sekä sentraalisesti että aivokuorella, mutta tämä on harvinaista «Wattjes MP, Ciccarelli O, Reich DS, ym. 2021 MAGNI...»5.
- Suurimmalla osalla (noin 80 %:lla) MS-potilaista on jo diagnoosivaiheessa myös selkäytimen alueella oireisia tulehduspesäkkeitä «Wattjes MP, Ciccarelli O, Reich DS, ym. 2021 MAGNI...»5, «Polman CH, Reingold SC, Banwell B, ym. Diagnostic ...»12.
- MK tulisi tehdä ennen steroidihoitoa tai 2–3 kuukautta sen jälkeen, jolloin steroidihoidon vaikutus kuvantamislöydökseen on väistynyt (steroidihoito voi vähentää Gd-tehostuvia muutoksia) «Wattjes MP, Ciccarelli O, Reich DS, ym. 2021 MAGNI...»5.
Tyypilliset likvorilöydökset
- MS-tautiepäilyssä tulee määrittää vähintään seuraavat tutkimukset likvorista: solut, proteiini, oligoklonaaliset jaokkeet ja IgG-indeksi ja tarvittavat erotusdiagnostiset tutkimukset. Keskushermoston immunopatologian merkkinä ovat lievästi lisääntynyt leukosyyttimäärä, suurentunut IgG-indeksi ja positiivinen löydös oligoklonaalisten alajaokkeiden (OCB) suhteen «Thompson AJ, Banwell BL, Barkhof F, ym. Diagnosis ...»2, «Boscá I, Magraner MJ, Coret F, ym. The risk of rel...»13.
- Selkäydinnesteen lisääntynyt immunologinen aktiivisuus eli keskushermostoperäisen IgG:n synteesi todetaan noin 95 %:lla varmaa MS-tautia sairastavista, ja useat oligoklonaaliset jaokkeet (≥ 2, usein yli 10) ovat tyypillinen ja MS-diagnoosia vahvistava löydös «Bernitsas E, Khan O, Razmjou S, ym. Cerebrospinal ...»14, «Cole SR, Beck RW, Moke PS, ym. The predictive valu...»15, «Imrell K, Landtblom AM, Hillert J, ym. Multiple sc...»16.
- IgG-indeksi on suurentunut 70–80 %:lla kliinisesti varmaa MS-tautia sairastavista «McLean BN, Luxton RW, Thompson EJ. A study of immu...»17, «Link H, Kostulas V. Utility of isoelectric focusin...»18, «Giles PD, Heath JP, Wroe SJ. Oligoclonal bands and...»19.
- Likvorilöydökset ovat samankaltaisia RRMS:ssä ja PPMS:ssä. IgG-indeksi on suurentunut 49–82 %:lla ja oligoklonaalisia jaokkeita löydetään 89–91 %:lta PPMS-potilaista «Abdelhak A, Hottenrott T, Mayer C, ym. CSF profile...»6, «Sola P, Mandrioli J, Simone AM, ym. Primary progre...»20.
Diagnostiset kriteerit
- MS-diagnoosi asetetaan McDonaldin vuoden 2017 kriteerien mukaan «Thompson AJ, Banwell BL, Barkhof F, ym. Diagnosis ...»2, «McDonaldin diagnostiset kriteerit 2017: aaltomainen MS-tauti ja ensisijaisesti etenevä MS-tauti»1.
Aaltomainen MS-tauti
- Aaltomaisen MS-taudin (RRMS, relapsing remitting MS) diagnoosi tehdään jo yhden oirejakson jälkeen, jos likvorin oligoklonaliteetti on positiivinen ja MK:ssa todetaan demyelinaatioleesio vähintään kahdessa seuraavista neljästä sijainnista: 1) kortikaalinen tai jukstrakortikaalinen, 2) periventrikulaarinen, 3) infratentoriaalinen ja 4) selkäytimeen paikantuva.
- RRMS käsittää 85–90 % kaikista MS-tautitapauksista diagnoosivaiheessa «Lublin FD, Reingold SC, Cohen JA, ym. Defining the...»21.
Ensisijaisesti etenevä MS-tauti
- Ensisijaisesti etenevän MS-taudin (PPMS, primary progressive MS) diagnoosi edellyttää, että oireisto etenee taudin alusta alkaen tasaisesti ilman selviä pahenemisvaiheita vähintään vuoden ajan ja aiheuttaa liikunta- ja toimintakyvyn heikentymistä. Tämän lisäksi potilaalla todetaan vähintään kaksi seuraavista kolmesta kriteeristä: 1) vähintään yksi kortikaalinen tai jukstrakortikaalinen, periventrikulaarinen tai infratentoriaalinen demyelinaatioleesio, 2) vähintään kaksi demyelinaatioleesiota selkäytimessä, 3) positiivinen likvorin oligoklonaliteetti.
- PPMS käsittää 10–15 % MS-tapauksista diagnoosivaiheessa «Lublin FD, Reingold SC, Cohen JA, ym. Defining the...»21.
Erotusdiagnostiikka
- MS-taudin kriteerit korostavat tarkkaa erotusdiagnostiikkaa ennen diagnoosin asettamista «Solomon AJ, Pettigrew R, Naismith RT, ym. Challeng...»22.
- Useissa erotusdiagnostisissa sairauksissa likvorin oligoklonaliteetti on negatiivinen.
- Epätyypilliset oireet «Thompson AJ, Baranzini SE, Geurts J, ym. Multiple ...»23 tai MK-löydökset viittaavat muihin sairauksiin kuten
- ADEM (acute disseminated encephalomyelitis)
- neuromyelitis optica -kirjon häiriö tai MOGAD (MOG antibody-associated disease) «Banwell B, Bennett JL, Marignier R, ym. Diagnosis ...»24
- neurosarkoidoosi
- keskushermostovaskuliitti
- sidekudossairauksien keskushermostoilmentymät: SLE (systeeminen lupus erythematosus), Sjögrenin oireyhtymä, antifosfolipidi-oireyhtymä
- aivojen pienten suonten geneettiset taudit
- Susacin oireyhtymä
- Behcetin oireyhtymä
- CLIPPERS (chronic lymphocytic inflammation, pontine perivascular enhancement responsive to steroids)
- Fabryn tauti.
Demyelinaatio sattumalöydöksenä (radiologisesti eriytynyt oireyhtymä, REO)
- Radiologisesti eriytynyt oireyhtymä (REO, radiologically isolated syndrome "RIS") tarkoittaa MK:n sattumalöydöstä, jossa ilman tyypillisiä MS-oirejaksoja tai kliinisiä löydöksiä todetaan MS-taudin mahdollisuuteen viittaavia tyypillisiä tulehduspesäkemuutoksia «Wattjes MP, Ciccarelli O, Reich DS, ym. 2021 MAGNI...»5.
- Noin kolmasosalle niistä, joilla todetaan REO, kehittyy viiden vuoden sisällä MS-tauti «Thompson AJ, Banwell BL, Barkhof F, ym. Diagnosis ...»2, «Maunula A, Martola J, Atula S, ym. Incidental demy...»25, ja riski on suurin alle 35-vuotiailla «Maunula A, Martola J, Atula S, ym. Incidental demy...»25.
- REO-potilaille ei suositella aloitettavaksi lääkehoitoa. Tarkkuutta vaaditaan kuitenkin oirejakson ja suoraan etenevän taudinkuvan tunnistamisessa, ja jos MS-taudin epäily näiden perusteella herää, suositellaan lannepistoa.
Aaltomaisen MS-taudin hoidon aloitus ja seuranta
Tautiaktiivisuuden arviointi
- Aktiivisen ja erittäin aktiivisen MS-taudin kriteereissä diagnoosivaiheessa ja hoidon seurannassa on eroja eurooppalaisten hoitosuositusten välillä «Wiendl H, Gold R, Berger T, ym. Multiple Sclerosis...»26, «Medicinrådets behandlingsvejledning vedrørende læg...»27. Työryhmä suosittaa seuraavaa arviointitapaa.
Diagnoosivaiheessa
- Diagnoosivaiheessa aaltomainen MS-tauti luokitellaan erittäin aktiiviseksi, jos yksi
seuraavista ehdoista täyttyy:
- vähintään kaksi pahenemisvaihetta viimeisen vuoden aikana
- yksi pahenemisvaihe viimeisen vuoden aikana JA pysyviä jäännösoireita
- yksi pahenemisvaihe viimeisen vuoden aikana JA vähintään yhdeksän T2-muutosta JA vähintään yksi T1 Gd+ -muutos tai uusi T2-muutos.
Hoidon seurannassa
- Aktiivisen MS-taudin lääkehoidon aikana hoitoa tehostetaan erittäin aktiivisen aaltomaisen
MS-taudin hoitoon, jos lääkityksen täysi teho on saavutettu ja yksi seuraavista ehdoista
täyttyy:
- yksikin pahenemisvaihe viimeisen vuoden aikana
- vähintään kaksi uutta T2-muutosta viimeisen vuoden aikana
- yksi T1 Gd+ -muutos viimeisen vuoden aikana.
- Lääkityksen täyden tehon voidaan ajatella olevan saavutettu, jos lääkkeen annostelu lääkeohjeen mukaisesti on toteutunut ja lääkealoituksesta on kulunut 6 kuukautta.
- Lähtötason MK eli baseline-MK otetaan 6 kuukauden kuluttua lääkealoituksesta. Siinä voidaan hyväksyä uusia T2-leesioita, muttei T1 Gd+ -muutoksia.
- Pahenemisvaiheen vaikeusaste ja oireet (sensorinen/motorinen) ja uusien leesioiden koko, sijainti (infratentoriaaliset ja spinaaliset leesiot ennakoivat etenevää MS-tautia ja mahdollisesti myös suurempaa relapsitiheyttä «Minneboo A, Barkhof F, Polman CH, ym. Infratentori...»28, «Tintore M, Rovira A, Arrambide G, ym. Brainstem le...»29, «Cordonnier C, de Seze J, Breteau G, ym. Prospectiv...»30) ja hoidon kesto voidaan huomioida päätöksenteossa.
- Remissioon tulee pyrkiä ensimmäisten vuosien aikana.
- MK osoittaa herkästi taudin tulehduksellisen aktiivisuuden, minkä vuoksi sitä käytetään lääkehoidon seurannassa.
- Kliiniseen seurantaan kuuluu toimintakyvyn arviointi säännöllisesti.
- EDSS (extended disability severity scale) on mittari, jolla toimintakykyä arvioidaan «Kurtzke JF. Rating neurologic impairment in multip...»31.
- Neurorekisterin MS-osiota käytetään hoidon seurannassa «Laakso SM, Viitala M, Kuusisto H, ym. Multiple scl...»32.
- Rekisteriin kirjataan pahenemisvaiheet, MK ja vuosittain EDSS, joka voidaan määrittää rekisterin automatisoidun EDSS-laskurin avulla.
- Rekisterin omaraportointiportaalia (MyMS) suositellaan käyttämään tiedon keräämiseksi potilaskokemuksesta ja potilaan raportoimasta toimintakyvystä.
- Veren neurofilamentti-kevytketjujen (NfL) pitoisuuden käyttö MS-taudin seurannassa ei vielä ole muotoutunut «Neurofilamentti MS-taudin seurannassa»3.
Lääkehoidon valintaan vaikuttavat seikat
- Lääkehoidon valinnassa huomioitavia seikkoja ovat sairauden aktiivisuuden lisäksi (ks. yllä) muun muassa potilaan ikä, muut sairaudet, lapsitoive, mahdolliset lääkkeen ennakoitavat haitat ja lääkitykseen liittyvän turvallisuusseurannan tarve. Päätös lääkkeen valinnasta tehdään yhdessä potilaan kanssa «Kysely MS-tautia sairastavien ja heidän läheistensä näkemyksistä»4, «Jaettu päätöksenteko»5.
- Lääkehoitoa suunniteltaessa on tarkistettava myös potilaan rokotusten voimassaolo ja suunniteltava tarvittavien rokotusten antaminen ennen lääkityksen aloittamista (ks. kohta Rokotukset «A2»3).
- Kelan korvattavuuskriteereissä kladribiini ja fingolimodi ovat korvattavia vain erittäin aktiivisessa MS-taudissa (www.kela.fi «http://www.kela.fi»3).
Korkeatehoisella lääkityksellä aloittamisen merkitys
- Immunologisten lääkkeiden valikoiman monipuolistumisen myötä on kertynyt havainnoivaa
tutkimusnäyttöä siitä, että varhain aloitettu korkeatehoinen lääke saattaa suojata
myöhemmältä toimintakyvyn heikkenemiseltä paremmin kuin niin sanottu eskalaatiohoitostrategia
«Korkeatehoisella lääkehoidolla aloittaminen aaltomaisessa MS-taudissa, kirjallisuuskatsaus»6.
- Eskalaatiohoito aloitetaan kohtalaisen tehon lääkityksellä ja korkeatehoisiin lääkkeisiin siirrytään, mikäli tautiaktiivisuutta ilmenee pahenemisvaiheina tai uusina MK-muutoksina.
- Lääke voidaan luokitella korkeatehoiseksi, jos sen voidaan odottaa vähentävän pahenemisvaiheita vähintään 50 % ja MK:ssa nähtäviä uusia tai tehostuvia muutoksia vähintään 70 % lumeeseen verrattuna «Filippi M, Amato MP, Centonze D, ym. Early use of ...»33.
- Korkeatehoisiksi lääkkeiksi on luokiteltu CD20-monoklonaaliset vasta-aineet (ofatumumabi, okrelitsumabi ja rituksimabi), natalitsumabi, alemtutsumabi, kladribiini ja fingolimodi.
- Korkeatehoisina lääkkeinä tutkimuksissa, joissa on selvitetty varhaisen korkeatehoisen lääkehoidon ennustevaikutusta, on ollut mukana pääosin infuusiomuotoiset CD20-monoklonaaliset vasta-aineet, natalitsumabi ja alemtutsumabi «Korkeatehoisella lääkehoidolla aloittaminen aaltomaisessa MS-taudissa, kirjallisuuskatsaus»6.
- Tutkimukset korkeatehoisen lääkkeen merkityksestä diagnoosivaiheessa ovat havainnoivia, mutta kaikki yhdensuuntaisia. Kontrolloidut suorat vertailututkimukset varhaisen korkeatehoisen lääkityksen ja eskalaatiohoidon välillä ovat vielä kesken.
- Kansainvälisissä asiantuntijakannanotoissa on ehdotettu, että erityisesti alle 40-vuotiaille potilaille suositeltaisiin varhaista korkeatehoista hoitoa. Vanhemmille potilaille puolestaan kohtalaisen tehon lääkitys saattaisi soveltua paremmin ottaen huomioon infektio- ja muut riskit «Filippi M, Amato MP, Centonze D, ym. Early use of ...»33, «Stankiewicz JM, Weiner HL. An argument for broad u...»34.
- Immunologisen lääkityksen suurin hyöty saadaan luultavasti kahden vuoden sisällä diagnoosista «Scalfari A, Neuhaus A, Daumer M, ym. Onset of seco...»35, «Chalmer TA, Baggesen LM, Nørgaard M, ym. Early ver...»36, ja se on suurempi alle 41-vuotiailla kuin sitä vanhemmilla «Weideman AM, Tapia-Maltos MA, Johnson K, ym. Meta-...»37.
Immunologiset lääkehoidot
- Immunologisten lääkehoitojen vaikutusmekanismit liittyvät lymfosyyttien toimintaan (kuva «MS-taudin immunologisten lääkkeiden vaikutusmekanismit»2).
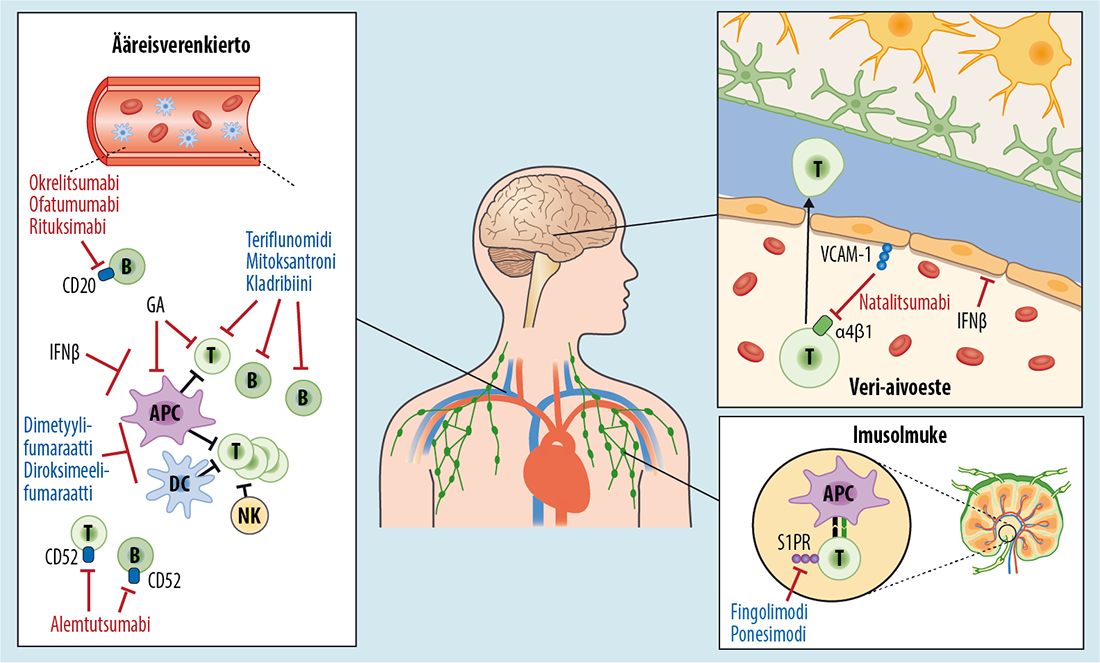
MS-lääkkeiden vaikutusmekanismit.
Lääkkeet vaikuttavat pääasiassa systeemisesti keskushermoston ulkopuolella, sillä veri-aivoeste estää useimpien MS-lääkemolekyylien merkittävän pääsyn keskushermostoon. Lymfosyyttien vähentäminen tai niiden toiminnan hillitseminen tai muokkaaminen on beetainterferonien (IFNβ), glatirameeriasetaatin (GA), pienimolekyylisistä lääkeaineista dimetyylifumaraatin, diroksimeelifumaraatin, teriflunomidin, mitoksantronin ja kladribiinin sekä monoklonaalisista vasta-aineista alemtutsumabin, okrelitsumabin, ofatumumabin ja rituksimabin pääasiallinen vaikutustapa. Pienimolekyyliset fingolimodi ja ponesimodi estävät lymfosyyttien poistumista imusolmukkeista. Monoklonaalinen vasta-aine natalitsumabi estää lymfosyyttien pääsyä keskushermostoon veri-aivoesteen läpi. Biologiset lääkkeet on merkitty punaisella ja pienimolekyyliset sinisellä tekstillä.
APC = antigeenia esittelevä solu, DC = dendriittisolu, NK = luonnollinen tappajasolu
Kuvan lähde: Atula S, Laakso S, Nevala R ym. MS-taudin ja sen lääkehoitojen vaikutus syöpäriskiin. Duodecim 2022;138(18):1595-602
© Suomalainen Lääkäriseura Duodecim
CD20-monoklonaaliset vasta-aineet (ofatumumabi, okrelitsumabi, rituksimabi)
Kliininen teho
- MS-taudin hoidossa B-solujen määrää vähentävien CD20-monoklonaalisten vasta-aineiden
teho on todettu useissa tutkimuksissa «Hauser SL, Bar-Or A, Comi G, ym. Ocrelizumab versu...»38, «Hauser SL, Bar-Or A, Cohen JA, ym. Ofatumumab vers...»39, «Svenningsson A, Frisell T, Burman J, ym. Safety an...»40:
- Ofatumumabi vähentää pahenemisvaiheiden määrää, toimintakyvyn heikkenemistä, varjoaineella tehostuvien MK-muutosten määrää ja uusien MK-muutosten kehittymistä «Ofatumumab reduces annualized relapse rate, decreases 6-month confirmed disability worsening, the number of gadolinium-enhancing lesions and the annualized rate of new lesions on T2-weighted MRI.»A.
- Okrelitsumabi vähentää pahenemisvaiheiden määrää ja hidastaa toimintakyvyn heikkenemistä sekä vähentää magneettikuvauksella arvioitavaa taudin aktiivisuutta aaltomaisessa MS-taudissa «Okrelitsumabi vähentää pahenemisvaiheiden määrää ja hidastaa toimintakyvyn heikkenemistä sekä vähentää magneettikuvauksella (MK) arvioitavaa taudin aktiivisuutta aaltomaisessa MS-taudissa.»A.
- Rituksimabi ilmeisesti vähentää pahenemisvaiheiden ja magneettikuvauksessa näkyvien aktiivisten muutosten määrää aaltomaisessa MS-taudissa «Rituksimabi ilmeisesti vähentää pahenemisvaiheiden ja magneettikuvauksessa näkyvien aktiivisten muutosten määrää aaltomaisessa MS-taudissa.»B.
- Okrelitsumabi ja rituksimabi ovat infuusiomuotoisia valmisteita, ofatumumabi annostellaan pistoksina ihon alle.
- Okrelitsumabi annostellaan puolen vuoden välein, rituksimabi puolen vuoden välein kahden vuoden ajan ja sitten yleensä harvemmin «Starvaggi Cucuzza C, Longinetti E, Ruffin N, ym. S...»41 ja ofatumumabi kerran kuukaudessa.
- Ofatumumabi on humaani, okrelitsumabi humanisoitu ja rituksimabi kimeerinen vasta-aine.
- Ofatumumabi on erityiskorvattava aaltomaisessa MS-taudissa (korvausoikeus 157).
- Pohjoismaissa on käytetty myös rituksimabia, vaikka sille ei ole haettu käyttöaihetta MS-taudin hoitoon.
Hoidon toteutus
- Ennen hoidon aloitusta tulee potilaan ajankohtainen rokotussuoja tarkistaa (ks. kohta Rokotukset «A2»3).
- Turvakokeina ennen aloitusta tarkistetaan hepatiittivirusvasta-aineet, HIV-testi, tuberkuloosin poissulkuun vaadittavat kokeet yksilöllisen riskiarvion mukaisesti, immunoglobuliinien pitoisuus veressä, täydellinen verenkuva (lymfosyyttien minimiarvo 0,8) ja raskaustesti.
- Turvakokeita seurataan ennen infuusiomuotoisia valmisteita ja kolme kuukautta niiden annon jälkeen; ofatumumabihoidon aikana ei valmisteyhteenvedon mukaan tarvitse seurata turvakokeita.
- Okrelitsumabi saattaa hidastaa liikunta- ja toimintakyvyn heikentymistä sekä vähentää
magneettikuvauksella (MK) arvioitavaa taudin aktiivisuutta primaarisesti etenevässä
MS-taudissa lumeeseen verrattuna «Okrelitsumabi saattaa hidastaa liikunta- ja toimintakyvyn heikentymistä sekä vähentää magneettikuvauksella (MK) arvioitavaa taudin aktiivisuutta primaaristi etenevässä MS-taudissa lumeeseen verrattuna.»C.
- Suoraan etenevässä MS-taudissa on mielekästä seurata toimintakyvyn säilymistä fysioterapeutin arvioita hyödyntäen.
- Mikäli kävelymatka tai muu arjen toimintakyky heikkenee merkittävästi MS-taudin vuoksi, lääkitys lopetetaan. Yli 50-vuotiailla potilailla on harkittava tarkkaan yksilöllistä infektio- ja syöpäriskiä, johon immunosuppressiivisella lääkityksellä on vaikutusta. Vakavan infektion riski suurenee erityisesti pyörätuolipotilailla (8,5-kertainen riski «Vollmer BL, Wallach AI, Corboy JR, ym. Serious saf...»42).
- Hoidon aloituksesta, lääkeannostelusta, hoidon seurannasta ja vasta-aiheista ks. valmisteyhteenvedot.
Tärkeimmät haittavaikutukset
- CD20-monoklonaalisten vasta-aineiden tärkeimpiä haittavaikutuksia ovat ylähengitystieinfektiot ja infuusio- tai injektioreaktiot.
- Infuusioreaktioriskin vuoksi annostellaan antihistamiinia ja parasetamolia suun kautta sekä metyyliprednisolonia suonensisäisesti puoli tuntia ennen rituksimabi- tai okrelitsumabi-infuusiota.
Fumaraatit (dimetyylifumaraatti ja diroksimeelifumaraatti)
Kliininen teho
- Dimetyylifumaraattia on tutkittu RRMS-potilailla kolmessa lumekontrolloidussa satunnaistetussa tutkimuksessa, joiden kesto on vaihdellut 6 kuukaudesta 2 vuoteen (n = 2 908) «Fox RJ, Miller DH, Phillips JT, ym. Placebo-contro...»43, «Kappos L, Gold R, Miller DH, ym. Efficacy and safe...»44, «Gold R, Kappos L, Arnold DL, ym. Placebo-controlle...»45.
- Dimetyylifumaraatti vähentää pahenemisvaiheen riskiä aaltomaista MS-tautia sairastavilla potilailla lumeeseen verrattuna «Dimethyl fumarate reduces both the number of patients with a relapse and the annualised relapse rate over two years in comparison with placebo in relapsing remitting multiple sclerosis. The efficacy is sustained over 5 years regarding both low relapse rate and MRI activity.»A.
- Pitkäaikaistehosta on julkaistu satunnaistetun alkuperäistutkimuksen viiden vuoden avoin seurantatutkimus (44 % alkuperäistutkimuksen potilaista pysyi mukana loppuun asti), jonka mukaan pahenemisvaiheiden määrä säilyi pienenä ja suurimmalle osalle potilaista ei kehittynyt uusia MK-muutoksia «Gold R, Arnold DL, Bar-Or A, ym. Long-term effects...»46.
- Diroksimeeli- ja dimetyylifumaraatti muuttuvat suun kautta annettuna nopeasti monometyylifumaraatiksi ennen pääsyä verenkiertoon, ja niiden hyöty- ja haittavaikutukset imeytymisen jälkeen ovat oletettavasti samanlaisia (ks. valmisteyhteenveto).
Hoidon toteutus
- Valmiste otetaan suun kautta 2 kertaa päivässä.
- Hoidon aloituksesta, lääkeannostelusta, hoidon seurannasta ja vasta-aiheista ks. valmisteyhteenveto.
Tärkeimmät haittavaikutukset
- Dimetyylifumaraatin haittavaikutuksia ovat punastuminen ja maha-suolikanavan oireet (ripuli, pahoinvointi, vatsakipu).
- Maha-suolikanavan haittavaikutusten kokonaisesiintyvyys oli diroksimeelifumaraattiryhmässä
34,8 % ja dimetyylifumaraattiryhmässä 49,0 % «Naismith RT, Wundes A, Ziemssen T, ym. Diroximel F...»47.
- Diroksimeelifumaraatti näyttää lääkehoidon alkuvaiheessa aiheuttavan vähemmän maha-suolikanavan haittavaikutuksia kuin dimetyylifumaraatti «Diroksimeelifumaraatti näyttää lääkehoidon alkuvaiheessa aiheuttavan vähemmän maha-suolikanavan haittavaikutuksia kuin dimetyylifumaraatti.»B.
- Potilaat, jotka saavat hankalia maha-suolikanavan haittoja, voivat hyötyä dimetyylifumaraatin vaihtamisesta diroksimeelifumaraattiin tai toisen vaikutusmekanismin lääkkeeseen.
- Hoito aloitetaan aina dimetyylifumaraatilla, mutta jos maha-suolikanavan haittoja ilmenee eivätkä ne häviä seurannassa, hoito vaihdetaan diroksimeelifumaraattiin.
- Kumpaankin valmisteeseen liittyy punastelutaipumus, jota vähentää 100 mg:n ASA-annos ennen lääkkeenottoa.
- Haittavaikutusten minimoimiseksi aloitusannoksen käyttöä voidaan harkinnan mukaan pidentää viikosta 2–4 viikkoon.
- Lymfopeniariskin vuoksi lymfosyyttipitoisuutta seurataan 3 kuukauden välein koko hoidon ajan.
- Jos potilaan lymfosyyttipitoisuus on alle 0,5 x 109/l jatkuvasti yli 6 kuukauden ajan, on hoito lopetettava progressiivisen multifokaalisen leukoenkefalopatian (PML) riskin vuoksi.
- Jos hoito lopetetaan lymfopenian vuoksi, lymfosyyttipitoisuutta on seurattava, kunnes se palautuu normaaliksi.
Natalitsumabi
Kliininen teho
- Natalitsumabin vaikutusta RRMS:n hoidossa lumeeseen tai beetainterferoniin verrattuna on selvitetty kolmessa satunnaistetussa tutkimuksessa, joiden kesto vaihteli 6 kuukaudesta 2 vuoteen (n = 2 344).
- Natalitsumabi vähentää pahenemisvaiheiden ja magneettikuvausmuutosten (MK) määrää aaltomaisessa MS-taudissa «Natalitsumabi vähentää pahenemisvaiheiden ja magneettikuvausmuutosten (MK) määrää aaltomaisessa MS-taudissa.»A.
- Natalitsumabi ei vähennä toimintakyvyn heikentymistä toissijaisesti etenevässä MS-taudissa «Natalitsumabi ei vähennä toimintakyvyn heikentymistä toissijaisesti etenevässä MS-taudissa.»A.
- Avoimia pitkäaikaisseurantatutkimuksia on julkaistu useita, ja seuranta-aikaa on kertynyt parhaimmillaan yli 10 vuotta «Butzkueven H, Kappos L, Wiendl H, ym. Long-term sa...»48, «Bigaut K, Fabacher T, Kremer L, ym. Long-term effe...»49. Turvallisuustulokset vastasivat rekisteritutkimuksen tuloksia.
Hoidon toteutus
- Valmiste annetaan laskimonsisäisinä infuusioina tai ihonalaisesti 4–6 viikon välein.
Annostelumuodon ja pidennetyn annosvälin tutkimuksissa hoito on vaihdettu 7–12 kuukauden
kuukausittaisen annon jälkeen eri annostelumuotoon tai -väliin.
- Annostelumuoto (suonensisäinen tai ihonalainen) ei ilmeisesti vaikuta natalitsumabihoidon tehoon ja turvallisuuteen sairauden tasaisessa vaiheessa, kun hoitoa on jatkettu vähintään vuoden ajan «Annostelumuoto (suonensisäinen tai ihonalainen) ei ilmeisesti vaikuta natalitsumabihoidon tehoon ja turvallisuuteen sairauden tasaisessa vaiheessa, kun hoitoa on jatkettu vähintään vuoden ajan.»B.
- Neljän tai kuuden viikon annosteluväli ei ilmeisesti vaikuta suonensisäisen natalitsumabihoidon tehoon tai turvallisuuteen sairauden tasaisessa vaiheessa, kun hoito on ollut käytössä vähintään vuoden ajan «Neljän tai kuuden viikon annosteluväli ei ilmeisesti vaikuta suonensisäisen natalitsumabihoidon tehoon tai turvallisuuteen MS-taudin tasaisessa vaiheessa, kun hoito on ollut käytössä vähintään vuoden ajan.»B.
- Hoidon aloituksesta, lääkeannostelusta, hoidon seurannasta ja vasta-aiheista ks. valmisteyhteenveto.
Tärkeimmät haittavaikutukset
- Natalitsumabin lopettamiseen liittyy merkittävä rebound-tautiaktivaation riski «Prosperini L, Kinkel RP, Miravalle AA, ym. Post-na...»50, (ks. kohta Lääkityksen lopetukseen liittyvä rebound «A3»4), joka on syytä huomioida hoitoa harkittaessa.
- Natalitsumabin tärkeimpiä haittavaikutuksia ovat
- PML
- Natalitsumabihoitoon liittyy PML:n riski. PML johtaa kuolemaan vuoden sisällä diagnoosista 38 %:lla potilaista «Joly M, Conte C, Cazanave C, ym. Progressive multi...»51.
- PML-riskiä suurentavat JC-viruksen esiintyminen ja suuri JC-virusindeksi, aiempi immunosuppressiivinen lääkitys ja hoidon kesto «Ho PR, Koendgen H, Campbell N, ym. Risk of nataliz...»52. PML-riskiä pienentää merkittävästi annosvälin pidentäminen neljästä kuuteen viikkoon «Ryerson LZ, Foley J, Chang I, ym. Risk of natalizu...»53. PML-riskin arvioimiseksi tutkitaan veren JC-virusvasta-aineet ennen hoidon aloitusta ja vasta-ainenegatiivisilla potilailla puolen vuoden välein hoidon ajan «Plavina T, Subramanyam M, Bloomgren G, ym. Anti-JC...»54.
- Natalitsumabin aloitusta JC-virusvasta-ainepositiiviselle potilaalle tulee välttää.
- Jos potilas muuttuu vasta-ainepositiiviseksi, lääkkeen vaihtoa suositellaan.
- PML:n riskin vuoksi aivojen MK tehdään hoidon aikana erillisen ohjeen mukaan ja vielä uuden lääkkeen aikanakin (ks. Aaltomaisen MS-taudin kuvantamisseuranta «A4»5).
- PML voi aktivoitua natalitsumabin lopetuksen jälkeen noin 6 kuukauden sisällä «Rigau V, Mania A, Béfort P, ym. Lethal multiple sc...»55 «Clerico M, Artusi CA, Liberto AD, ym. Natalizumab ...»56.
- infuusioreaktiot, tavallisimpina päänsärky, uupumus, nivelkivut ja yliherkkyysreaktiot «Polman CH, O'Connor PW, Havrdova E, ym. A randomiz...»57
- pysyvien vasta-aineiden muodostuminen (3–6 %:lle), mikä liittyy sekä allergisiin reaktioihin että hoidon tehon heikkenemiseen «O'Connor P, Goodman A, Kappos L, ym. Long-term saf...»58, «Calabresi PA, Giovannoni G, Confavreux C, ym. The ...»59. Natalitsumabivasta-aineet määritetään 3, 6 ja 12 kuukautta hoidon aloituksesta sekä silloin jos potilaalle tulee pahenemisvaihe. Jos pysyviä vasta-aineita ilmaantuu (seuranta 6 viikon kuluttua), hoito lopetetaan.
- infektiot, muut opportunistiset infektiot mukaan luettuina
- maksaentsyymien suureneminen, hyperbilirubinemia ja vakavia maksavaurioita, joita on raportoitu myyntiluvan saamisen jälkeen. ALAT-seuranta tehdään ensimmäisen hoitovuoden aikana 3 kuukauden välein.
- PML
Kladribiini
Kliininen teho
- Kladribiinin vaikutusta on selvitetty 2 satunnaistetussa lumekontrolloidussa 96 viikon RRMS- ja KEO-potilaiden tutkimuksessa (n = 1 942). Kladribiini ilmeisesti vähentää pahenemisvaiheiden määrää, viivästyttää taudin etenemistä EDSS-pisteytyksellä arvioituna ja vähentää magneettikuvauksessa aktiivisten muutosten määrää aaltomaisessa MS-taudissa «Kladribiini ilmeisesti vähentää pahenemisvaiheiden määrää, viivästyttää taudin etenemistä EDSS-pisteytyksellä arvioituna ja vähentää magneettikuvauksessa (MK) aktiivisten muutosten määrää aaltomaisessa MS-taudissa.»B.
- Kladribiinin vaikutuksen alku todetaan 1 kuukauden kohdalla, jolloin MK:ssa MS-muutosten määrä vähenee ja 2 kuukauden jälkeen vähenevät myös T1 Gd -tehostuvat leesiot «de Stefano N, Barkhof F, Montalban X, ym. Early Re...»60.
- Kladribiinihoidon lisäannostelu vuosina 3 ja 4 ei ilmeisesti tuo lisätehoa aktiivista aaltomaista MS-tautia sairastavalle potilaalle, mutta ilmeisesti lisää herpesinfektioiden riskiä «Kladribiinihoidon lisäannostelu vuosina 3 ja 4 ei ilmeisesti tuo lisätehoa aktiivista aaltomaista MS-tautia sairastavalle potilaalle, mutta ilmeisesti lisää herpesinfektioiden riskiä.»B.
- Uudesta annostelusyklistä 4 vuoden jälkeen ei ole tutkimustietoa. Neljän vuoden kestoisen täyden hoitovasteen saaneella potilaalla voidaan tautiaktiivisuuden palatessa harkita kladribiinihoidon uusimista, mutta sen pitkäaikaisvaikutuksista ei ole tutkittua tietoa «Centonze D, Amato MP, Brescia Morra V, ym. Multipl...»61.
- Mikäli lääkehoidon seurannassa jo ensimmäisen hoitosyklin 6 kuukauden lähtötason (baseline) kuvauksessa todetaan Gd-tehostuva leesio, tulee harkita lääkkeen vaihtoa potilaan kliininen kokonaistilanne huomioon ottaen.
Hoidon toteutus
- Valmiste otetaan suun kautta kahtena hoitojaksona vuoden välein. Otettavien tablettien määrä riippuu potilaan painosta. Hoitojakso sisältää painon mukaan 4–5 päivän lääkityksen kahdesti kuukauden välein.
- Hoidon aloituksesta, lääkeannostelusta, hoidon seurannasta ja vasta-aiheista ks. valmisteyhteenveto.
- Toisen vuoden annostelujaksoa voidaan siirtää 6 kuukautta, jos se on lääketieteellisesti tarpeen, esimerkiksi lymfosyyttimäärän normaalistumiseksi vähintään tasolle 0,8 x 109solua/l ennen hoidon aloittamista toisena vuonna.
Tärkeimmät haittavaikutukset
- Kladribiinin yleisimmät haittavaikutukset ovat lymfopenia (vakava lymfopenia 1%), suun alueen herpes ja vyöruusu «Kladribiini ilmeisesti vähentää pahenemisvaiheiden määrää, viivästyttää taudin etenemistä EDSS-pisteytyksellä arvioituna ja vähentää magneettikuvauksessa (MK) aktiivisten muutosten määrää aaltomaisessa MS-taudissa.»B, ihottuma, alopekia ja infektiot (10 %), «Nabizadeh F, Mohamadi M, Rahmani S, ym. Safety and...»62, «Giovannoni G, Soelberg Sorensen P, Cook S, ym. Saf...»63, «Giovannoni G, Comi G, Cook S, ym. A placebo-contro...»64.
- Hoitoon voi liittyä vakavan maksavaurion riski, ja maksatoiminnan seurantaa on tarkennettu markkinoille tulon jälkeen «Rauma I, Viitala M, Kuusisto H, ym. Finnish multip...»65.
Pistettävät immunostimulantit (beetainterferonit, glatirameeriasetaatti)
Kliininen teho
- Beetainterferoni 1a:ta on verrattu lumeeseen RRMS-potilailla kahdessa satunnaistetussa 2 vuoden tutkimuksessa (n = 861) ja beetainterferoni 1b:tä yhdessä satunnaistetussa 2 vuoden tutkimuksessa (n = 372).
- Beetainterferoni 1a vähentää pahenemisvaiheiden määrää ja magneettikuvauksella arvioitavaa taudin aktiivisuutta aaltomaisessa MS-taudissa «Beetainterferoni 1a vähentää pahenemisvaiheiden määrää ja magneettikuvauksella (MK) arvioitavaa taudin aktiivisuutta aaltomaisessa MS-taudissa.»A.
- Beetainterferoni 1b ilmeisesti vähentää pahenemisvaiheiden määrää lumeeseen verrattuna aaltomaisessa MS-taudissa, mutta sillä ei ilmeisesti ole vaikutusta toimintakykyyn 2 vuoden seurannassa. Lisäksi se ilmeisesti vähentää magneettikuvauksella arvioitavaa taudin aktiivisuutta 3 vuoden seurannassa «Beetainterferoni 1b ilmeisesti vähentää pahenemisvaiheiden määrää lumeeseen verrattuna aaltomaisessa MS-taudissa, mutta sillä ei ilmeisesti ole vaikutusta toimintakykyyn 2 vuoden seurannassa. Lisäksi se ilmeisesti vähentää magneettikuvauksella arvioitavaa taudin aktiivisuutta 3 vuoden seurannassa.»B.
- Pegyloidun interferonin, peginterferonin, on osoitettu lumeeseen verrattuna vähentävän pahenemisvaiheita sekä uusia ja laajentuvia T2-muutoksia MK:ssa 48 viikon seurannassa «Calabresi PA, Kieseier BC, Arnold DL, ym. Pegylate...»66.
- Glatirameeriasetaattia on tutkittu RRMS:ssä yhdessä lumekontrolloidussa satunnaistetussa 3 vuoden tutkimuksessa (n = 251). Glatirameeriasetaatti vähentää pahenemisvaiheiden määrää, parantaa toimintakykyä ja ilmeisesti vähentää magneettikuvausmuutosten lukumäärää aaltomaisessa MS-taudissa «Glatirameeriasetaatti vähentää pahenemisvaiheiden määrää, parantaa toimintakykyä ja ilmeisesti vähentää magneettikuvausmuutosten (MK) lukumäärää aaltomaisessa MS-taudissa.»A.
Hoidon toteutus
- Markkinoilla on sekä ihon alle (joka toinen päivä, 3 kertaa viikossa tai joka toinen viikko) että lihakseen (kerran viikossa) pistettäviä valmisteita. Hoidossa tulisi suosia ihon alle mahdollisimman harvoin annosteltavia muotoja «Coyle PK, Shang S, Xiao Z, ym. Matching-adjusted c...»67.
- Hoidon aloituksesta, lääkeannostelusta, hoidon seurannasta ja vasta-aiheista ks. valmisteyhteenveto.
- Beetainterferoneja käytettäessä MxA-vaste eli MxA-proteiinin pitoisuus (lääkevasteen mittari) määritetään 12 ja 24 kuukauden kuluttua hoidon aloituksesta. Vasteen vähäisyys tai puuttuminen voidaan varmistaa viimeistään 3 kuukauden kuluttua uusintatestillä. Jos MxA-vasteen puuttuminen on todettu kahdesti, hoito tulee lopettaa. Pienentynyttä vastetta voidaan seurata ilman hoidon lopetusta, kunnes MxA-vaste joko suurenee normaaliksi tai puuttuu kokonaan, jolloin hoito lopetetaan «Lublin FD, Reingold SC, Cohen JA, ym. Defining the...»21.
Tärkeimmät haittavaikutukset
- Beetainterferoneiden aiheuttamia flunssan kaltaisia oireita ja paikallisia ihon pistosreaktioita hoidon alkuvaiheessa voidaan lievittää tulehduskipulääkkeillä «Lublin FD, Reingold SC, Cohen JA, ym. Defining the...»21.
- Glatirameeriasetaatti voi aiheuttaa pistospaikkareaktioita ja pistospaikan lipoatrofiaa
«Drago F, Brusati C, Mancardi G, ym. Localized lipo...»68.
- Noin 15 %:lla esiintyy ainakin kerran heti pistoksen jälkeen alle minuutista 30 minuuttiin kestävää kasvojen punoitusta ja rintakehällä ilmenevä painon, sydämentykytyksen ja hengenahdistuksen tunnetta, joka on vaaratonta.
Teriflunomidi
Kliininen teho
- Teriflunomidin vaikutusta RRMS:ssä on tutkittu 6 satunnaistetussa tutkimuksessa (n = 3 354), joissa sitä on annettu joko yksinään verrattuna lumeeseen «O'Connor P, Wolinsky JS, Confavreux C, ym. Randomi...»69, «Confavreux C, O'Connor P, Comi G, ym. Oral teriflu...»70, «Vermersch P, Czlonkowska A, Grimaldi LM, ym. Terif...»71 tai lisälääkkeenä lumekontrolloidusti beetainterferonin «Freedman MS, Wolinsky JS, Wamil B, ym. Teriflunomi...»72, «NCT01252355. Efficacy and Safety of Teriflunomide ...»73 tai glatirameeriasetaatin kanssa «Freedman MS, Wolinsky JS, Truffinet P, ym. A rando...»74. Tutkimusten kesto on vaihdellut 24 viikosta 2 vuoteen.
- Teriflunomidi ilmeisesti vähentää pahenemisvaiheen riskiä 1–2 vuoden seuranta-aikana aaltomaisessa MS-taudissa lumeeseen verrattuna «Teriflunomide at a dose of 14 mg/day appears to decrease both the number of patients with at least one relapse and the relapse rate in multiple sclerosis over one or two years.»B.
- Teriflunomidia on verrattu ponesimodiin ja ofatumumabiin. Ponesimodilla ja ofatumumabilla ilmaantui vähemmän pahenemisvaiheita ja uusia MK-leesioita «Kappos L, Fox RJ, Burcklen M, ym. Ponesimod Compar...»75, ja ofatumumabi vähensi lisäksi tautitaakan etenemistä verrattuna teriflunomidiin «Hauser SL, Bar-Or A, Cohen JA, ym. Ofatumumab vers...»39.
- Taudin eteneminen EDSS-pistein mitattuna väheni vuoden seurannassa lumeeseen verrattuna «Confavreux C, O'Connor P, Comi G, ym. Oral teriflu...»70. Jos keskeyttäneiden osuus huomioidaan, ero ei ollut merkitsevä.
- Teriflunomidista lisälääkkeenä joko beetainterferonin tai glatirameeriasetaatin kanssa ei saatu merkitsevää lisähyötyä «Freedman MS, Wolinsky JS, Wamil B, ym. Teriflunomi...»72, «Freedman MS, Wolinsky JS, Truffinet P, ym. A rando...»74.
- Pitkäaikaisnäyttöä turvallisuudesta on avoimesta RRMS-seurantatutkimuksesta, jossa potilaat olivat mukana keskimäärin 6,3 vuotta (37 % keskeytti tutkimuksen) «Freedman MS, Wolinsky JS, Wamil B, ym. Teriflunomi...»72, «Freedman MS, Wolinsky JS, Truffinet P, ym. A rando...»74, «Miller AE, Olsson TP, Wolinsky JS, ym. Long-term s...»76. Uusia haittavaikutuksia ei havaittu, ja lääke oli turvallinen myös pitkäkestoisessa käytössä.
Hoidon toteutus
- Valmiste otetaan suun kautta kerran päivässä.
- Hoidon aloituksesta, lääkeannostelusta, hoidon seurannasta ja vasta-aiheista ks. valmisteyhteenveto.
- Teriflunomidi poistuu elimistöstä hyvin hitaasti: keskimääräinen poistumisaika on 8 kuukautta, mutta siihen saattaa kulua jopa 2 vuotta.
- Lääke voidaan poistaa nopeutetusti elimistöstä kolestyramiinilla. Ks. valmisteyhteenveto.
Tärkeimmät haittavaikutukset
- Teriflunomidin tärkeimpiä haittavaikutuksia ovat
- ylähengitystie- ja virtsatieinfektiot
- hiusten ohimenevä lähteminen tai oheneminen
- ripuli
- ALAT-arvon suureneminen
- lymfopenia ja neutropenia.
Sfingosiini-1-fosfaattireseptorin (S1PR) antagonistit (fingolimodi, ponesimodi, siponimodi)
Kliininen teho
- Fingolimodin vaikutusta on tutkittu lumeeseen ja beetainterferoniiin verrattuna RRMS-potilailla 3 satunnaistetussa kontrolloidussa tutkimuksessa, joiden kesto vaihteli 6 kuukaudesta 2 vuoteen (n = 2 845).
- Fingolimodi vähentää pahenemisvaiheita ja uusia MK-muutoksia verrattuna lumeeseen, muttei estä toimintakyvyn heikkenemistä, ja hyöty-haittasuhde esimerkiksi beeta-interferoniin verrattuna on epävarma «Fingolimod compared with placebo is effective in reducing inflammatory disease activity, measured by relapses and MRI activity, but is not effective in preventing disability worsening. The evidence on the risk/benefit profile when compared with im.»A.
- Ponesimodi vähentää pahenemisvaiheiden määrää ja uusia MK-muutoksia verrattuna teriflunomidiin sekä vähentää uusia varjoainetehosteisia MK-muutoksia verrattuna lumeeseen «Ponesimod at the dose of 20 mg daily reduces annualized relapse rate and the number of combined unique active lesions when compared with teriflunomide. Ponesimod also reduces the number of new T1 Gd+ lesions when compared with placebo.»A.
- Siponimodi saattaa vähentää toimintakyvyn heikkenemistä ja MK-muutosten tilavuutta toissijaisesti etenevässä MS-taudissa «Siponimod may decrease the 3-month confirmed disease progression and the volume of T2 lesions in patients with secondary progressive multiple sclerosis.»C. Lääkettä ei ole saatavilla Suomessa.
- Fingolimodilla on käyttöaihe erittäin aktiiviseen MS-tautiin, ponesimodilla aaltomaiseen aktiiviseen MS-tautiin.
Hoidon toteutus
- Valmiste otetaan suun kautta kerran päivässä.
- Hoidon aloituksesta, lääkeannostelusta, hoidon seurannasta ja vasta-aiheista, ks. valmisteyhteenvedot.
- Kardiologin konsultaatiota pyydetään, jos potilaalla on sydänperäisiä riskitekijöitä (sairas sinus -oireyhtymä, AV-johtumisen häiriö tai oireinen bradykardia: syke < 55/min) tai lääkityksenä beetasalpaaja tai verapamiili.
- Silmälääkärin konsultaatiota pyydetään, jos potilaalla on diabetes tai hän on sairastanut uveiitin.
- Fingolimodin ensimmäisen tabletin oton yhteydessä potilasta on seurattava neurologian
poliklinikassa 6 tuntia. Seurannan yhteydessä tarkkaillaan sykettä ja verenpainetta. Ponesimodia
käytettäessä tätä seurantaa ei tarvita, jos potilaalla ei ole tiedossa sydänsairautta
(ks. valmisteyhteenveto).
- EKG tarkastetaan ennen hoidon aloitusta ja uudelleen 6 tunnin kohdalla.
- Jos sydänoireita (bradykardiaa tai eteis-kammiojohtumisen häiriöitä) esiintyy seurannan jälkeen, potilaan seurantaa jatketaan sairaalaoloissa yön yli.
- Jos lääkitykseen tulee 2 viikon tauko, aloitus on tehtävä uudelleen poliklinikassa 6 tunnin seurannassa.
- Jos lymfosyyttipitoisuus on < 0,2 E9/l, pidetään viikon lääketauko ja mitataan TVK uudelleen. Jos arvo on taas normaali, lääkitystä jatketaan 2 viikon sisällä ilman uutta aloitusseurantaa.
- Silmälääkärin konsultaatio tai OCT tehdään noin 4 kuukauden kuluttua hoidon aloituksesta.
Tärkeimmät haittavaikutukset
- Fingolimodin aloittamista tulee harkita tarkkaan ja rajata sen käyttö erityistilanteisiin huomioiden lääkkeen lopetukseen liittyvä rebound-riski (ks. kohta Lääkityksen lopetukseen liittyvä rebound «A3»4). Ponesimodin rebound-riskistä ei ole kertynyt riittävästi tietoa.
- Sfingosiini-1-fosfaattireseptorin antagonistien tärkeimpiä haittavaikutuksia ovat
- fingolimodin ensimmäisen annoksen oton yhteydessä bradykardia
- maksa-arvojen suureneminen
- makulaturvotuksen riski, joka on yleisesti ottaen pieni (0,4 %), mutta suurentunut diabeetikoilla ja potilailla, joilla on aiemmin todettu uveiitti.
- FDA:n haittavaikutusrekisterin mukaan vuosina 2015–2017 PML-tapauksia fingolimodia käyttäneillä oli raportoitu 87 ja korjatuksi PML-riskisuhteeksi (OR) arvioitiin 4,98 (95 % luottamusväli 3,64–6,81) «Cohen JA, Barkhof F, Comi G, ym. Oral fingolimod o...»77.
- Ihoa on seurattava fingolimodin aikana säännöllisesti ihosyöpäriskin vuoksi.
Alemtutsumabi
Kliininen teho
- Alemtutsumabin tehoa RRMS:ssä beetainterferoni 1a:han verrattuna on tutkittu 3 satunnaistetussa kontrolloidussa 2–3 vuoden tutkimuksessa «CAMMS223 Trial Investigators, Coles AJ, Compston D...»78, «Cohen JA, Coles AJ, Arnold DL, ym. Alemtuzumab ver...»79, «Coles AJ, Twyman CL, Arnold DL, ym. Alemtuzumab fo...»80.
- Alemtutsumabi saattaa vähentää pahenemisvaiheen riskiä ja toimintakyvyn heikkenemistä aaltomaisessa MS-taudissa beeta-interferoniin verrattuna, mutta luotettava näyttö puuttuu «Alemtuzumab is better than interferon beta-1a for relapse-free survival, sustained disease progression-free survival and MRI lesions at 24 months in multiple sclerosis. However, adverse events are more common for alemtuzumab.»A.
Hoidon toteutus
- Ensimmäinen hoitojakso annetaan 5 peräkkäisenä päivänä ja toinen hoitojakso vuoden kuluttua 3 peräkkäisenä päivänä laskimonsisäisinä infuusioina.
- Hoidon aloituksesta, lääkeannostelusta, hoidon seurannasta ja vasta-aiheista ks. valmisteyhteenveto.
- Viiden vuoden säännöllisen turvaseurannan tarpeesta on kerrottava potilaalle selkeästi ennen hoidon aloitusta, ja hänen on sitouduttava siihen.
- Hoitoon liittyvistä vakavien haittavaikutusten riskistä, kuten autoimmuunisairauksista ja tulehduksista, on keskusteltava potilaan kanssa ennen hoidon aloitusta.
- Infektioprofylaksi
- Herpesinfektion ehkäisemiseksi käytetään esimerkiksi valasikloviiriä 500 mg 2 kertaa päivässä 4 viikon ajan infuusioiden jälkeen.
- Listerioosin ehkäisemiseksi tulee 2–3 viikkoa ennen infuusioita ja 4 viikkoa niiden jälkeen välttää ruoka-aineita, joihin liittyy listeriariski «Holmøy T, von der Lippe H, Leegaard TM. Listeria m...»81.
Tärkeimmät haittavaikutukset
- Euroopan lääkevirasto (EMA) suoritti 2019 alemtutsumabin turvallisuusarvioinnin, koska siihen on yhdistetty muun muassa sydän- ja verisuoni- sekä immuunijärjestelmän toimintaan liittyviä haittoja ja myös joitakin kuolemantapauksia on raportoitu näihin liittyen. Tämän vuoksi aloitusta tulee harkita erityisen tarkkaan.
- Arvion perusteella alemtutsumabia ei suositella potilaille, joilla on
- aiemmin ollut aivohalvaus
- huonossa hoitotasapainossa oleva verenpainetauti
- koagulopatia tai käytössä veren hyytymiseen vaikuttava lääkitys
- sairastettu kaulavaltimon dissekaatio
- sepelvaltimotauti tai sairastettu sydäninfarkti
- muita samanaikaisia autoimmuunisairauksia.
- Infuusioreaktiot, joita tutkimuksissa ilmenee noin 90 %:lla, ovat päänsärky, ihottuma, kuumeilu, pahoinvointi, urtikaria, kutina ja unettomuus.
- Vakavimmat haittavaikutukset liittyvät autoimmuunitauteihin.
- Kilpirauhassairauksia kehittyy noin 40 %:lle hoidetuista «Pariani N, Willis M, Muller I, ym. Alemtuzumab-Ind...»82. Kilpirauhasen liika- tai vajaatoiminta voi kehittyä vielä 5 vuotta viimeisen infuusion jälkeen. Noin 70 %:lle näistä ilmaantuu Basedowin tauti.
- Immunologista trombosytopeniaa on havaittu 0,8–2,8 %:lla kolmessa eri tutkimuksessa «CAMMS223 Trial Investigators, Coles AJ, Compston D...»78, «Cohen JA, Coles AJ, Arnold DL, ym. Alemtuzumab ver...»79, «Coles AJ, Twyman CL, Arnold DL, ym. Alemtuzumab fo...»80.
- Neljällä potilaalla on raportoitu tyvikalvovasta-aineglomerulonefriitti (Goodpasturen oireyhtymä).
- Vakavia infektioita on raportoitu noin kaksi kertaa enemmän kuin beetainterferonilla hoidetuilla «Cohen JA, Coles AJ, Arnold DL, ym. Alemtuzumab ver...»79, «Coles AJ, Twyman CL, Arnold DL, ym. Alemtuzumab fo...»80.
- Haittatapahtumina on raportoitu akuutteja kivettömiä sappitietulehduksia «Croteau D, Flowers C, Kulick CG, ym. Acute acalcul...»83 ja Suomessa ja Englannissa myös kaksi hemofagosyyttistä lymfohistiosytoositapausta «Saarela M, Senthil K, Jones J, ym. Hemophagocytic ...»84.
Mitoksantroni
Kliininen teho
- Mitoksantronin tehoa on tutkittu sekä RRMS- että SPMS-taudeissa kolmessa satunnaistetussa lume- tai aktiivilääke (metyyliprednisoloni) -kontrolloidussa 2–3 vuoden tutkimuksessa (n = 294) «Hartung HP, Gonsette R, König N, ym. Mitoxantrone ...»85, «Millefiorini E, Gasperini C, Pozzilli C, ym. Rando...»86, «van de Wyngaert FA, Beguin C, D'Hooghe MB, ym. A d...»87.
- Mitoksantroni saattaa hidastaa taudin etenemistä, vähentää pahenemisvaiheiden määrää ja vähentää aktiivisten magneettikuvausmuutosten määrää aaltomaisessa ja etenevässä MS-taudissa 2 vuoden seurannassa «Mitoksantroni saattaa hidastaa taudin etenemistä, vähentää pahenemisvaiheiden määrää ja vähentää aktiivisten magneettikuvausmuutosten määrää aaltomaisessa ja etenevässä MS-taudissa 2 vuoden seurannassa.»C.
- Mitoksantronin käyttöaiheena on hyvin aktiivisen, aaltomaisen MS-taudin hoito, kun sairaus johtaa nopeasti toimintakyvyttömyyteen eikä muita hoitokeinoja ole.
Hoidon toteutus
- Valmiste annetaan laskimonsisäisenä infuusiona, esimerkiksi 3 kuukauden välein 1–3 kertaa lääkkeen siedettävyys huomioiden. Elinikäinen kokonaisannos on 120 mg.
- Hoidon aloituksesta, lääkeannostelusta, hoidon seurannasta ja vasta-aiheista ks. valmisteyhteenveto.
- EKG ja sydämen kaikukuvaustutkimus on syytä tehdä ennen hoidon aloitusta.
Tärkeimmät haittavaikutukset
- Mitoksantroni voi olla sydäntoksinen, minkä lisäksi se suurentaa akuutin leukemian riskiä.
- Uusimmassa katsauksessa leukemiariski oli 0,7 % «Ellis R, Brown S, Boggild M. Therapy-related acute...»88.
Kantasolusiirto
- Kantasolusiirtoa ei ole toistaiseksi Suomessa annettu MS-taudissa. Työryhmän käsityksen
mukaan nykyisin käytössä olevilla korkeatehoisilla MS-lääkkeillä tulehduksellinen
tautiaktiivisuus saadaan useimmiten talttumaan ja kantasolusiirron rooli MS-taudin
hoidossa on toissijainen.
- Havainnoiva tutkimus selvitti autologisen kantasolusiirron erittäin aktiiviseen aaltomaiseen MS-tautiin saaneiden potilaiden (n = 167) pahenemisvaiheiden määrää ja EDSS-pisteiden pysyvää muutosta verrattuna fingolimodin (n = 2 558), natalitsumabin (n = 1 490) ja okrelitsumabin (n = 700) käyttäjiin. Okrelitsumabin ja kantasolusiirron teho oli näillä päätemuuttujilla sama, natalitsumabin teho oli hieman heikompi ja fingolimodin teho selvästi heikompi «Kalincik T, Sharmin S, Roos I, ym. Comparative Eff...»89.
- Kantasolusiirrossa sytostaattiyhdistelmällä poistetaan immunologinen muisti ja autologisella kantasolusiirrolla tuodaan kehoon uusien immuunisolujen alku.
- Kantasolusiirto saattaa vähentää uusien MK-muutosten määrää aaltomaista ja toissijaisesti etenevää MS-tautia sairastavilla, mutta näyttö pitkäaikaisesta hyödystä ja turvallisuudesta on puutteellista «Stem cell transplantation seems to decrease the number of new lesions in MRI and the number of relapses for patients with relapsing-remitting or secondary progressive multiple sclerosis, but the evidence for long-term effect and safety is insufficient.»C.
- Hyvin aggressiivinen fulminantti demyelinaatio, hallitsematon varhaisella aikuisiällä alkava sairaus on harvinainen MS-taudin ilmentymä. Tätä tautimuotoa sairastavat potilaat saattaisivat hyötyä kantasolusiirrosta, jos korkeatehoisimmat lääkkeet ovat tehottomia «Sharrack B, Saccardi R, Alexander T, ym. Autologou...»90.
- Etenevässä MS-taudissa kantasolusiirtoa ei suositella «Sharrack B, Saccardi R, Alexander T, ym. Autologou...»90.
- Havainnoivassa tutkimuksessa toissijaisesti etenevässä MS-taudissa kantasolusiirto vähensi pysyvän toimintakyvyn heikkenemistä 5 vuoden seurannassa (HR 0,50; 95 % luottamusväli = 0,31–0,81; p = 0,005), joten luotettavaa kaksoissokkoutettua tutkimustietoa tarvitaan «Boffa G, Signori A, Massacesi L, ym. Hematopoietic...»91.
- Kantasolusiirtoihin liittyy vakavia haittatapahtumia, ennen kaikkea infektioita. Ruotsalaisessa
havainnoivassa tutkimuksessa kuumeinen neutropenia todettiin 28 potilaalla 69 potilaasta
(41 %) 100 päivän kuluessa toimenpiteestä «Zhukovsky C, Sandgren S, Silfverberg T, ym. Autolo...»92 ja infektioiden ilmaantuvuus oli 139 potilaan tutkimuksessa 108/1 000 henkilövuotta
(95 % luottamusväli 75–150) «Alping P, Burman J, Lycke J, ym. Safety of Alemtuz...»93. Hoitoon liittyvä kuolleisuus 100 päivän kuluessa on 0,3 % ja 5 vuoden kuluessa 4
% alle 60-vuotiailla MS-potilailla «Nabizadeh F, Pirahesh K, Rafiei N, ym. Autologous ...»94.
- Myöhäisvaiheen haittoja voivat olla myös amenorrea, sekundaarinen autoimmuniteetti ja lisääntynyt syöpäriski. Potilaalle tulee antaa kattavat mikrobiprofylaksit ja rokotukset kantasolusiirron jälkeen (ks. Rokotukset «A2»3) «Sharrack B, Saccardi R, Alexander T, ym. Autologou...»90.
- Pitkän aikavälin (>15 v) haittavaikutuksista ei vielä ole riittävästi tietoa.
- Kantasolusiirron jälkeinen seuranta arvioidaan yksilöllisesti.
Aaltomaisen MS-taudin kuvantamisseuranta
- Magneettikuvauksia tarvitaan MS-diagnoosin jälkeen tautiaktiivisuuden seurantaan, koska MK osoittaa tautiaktiivisuuden herkemmin ja objektiivisemmin kuin kliininen oire «Wattjes MP, Ciccarelli O, Reich DS, ym. 2021 MAGNI...»5.
- Lääkehoidon vuosittainen MK-seuranta painottuu taudin immunologisesti aktiivisimpaan aikaan, joka on yleensä noin 3–5 vuotta diagnoosista «Wattjes MP, Ciccarelli O, Reich DS, ym. 2021 MAGNI...»5.
- Kuusi kuukautta lääkehoidon aloituksesta tulee tehdä lähtötason MK varjoaineella (baseline), koska lääkkeiden teho on saavutettu siihen mennessä.
- Mikäli 6 kuukauden kohdalla otetussa lähtötason MK:ssa on tehostuva muutos, lääkehoidon teho ei ole riittävä ja lääke tulee vaihtaa. Seuraavat MK-seurannat tehdään 6–12 kuukauden kuluttua uuden lääkkeen aloituksesta ja sen jälkeen vuoden välein 3–5 vuoden ajan «Wattjes MP, Ciccarelli O, Reich DS, ym. 2021 MAGNI...»5.
- Mikäli edelliseen MK:aan verrattuna havaitaan vähintään kaksi uutta kirkassignaalista muutosta tai yksi varjoaineella tehostuva muutos, lääke tulee vaihtaa.
- Ensimmäisen vuoden aikana pään MK tehdään varjoainetehosteisena, mutta sen jälkeen sen rutiinimainen käyttö ei ole suositeltavaa. Myöhemmin varjoaineen tarpeen voi arvioida yksilöllisesti erityisesti pahenemisvaiheiden ilmaantumisen perusteella.
- Mikäli MK-seurannassa ilmenee tehostuvia muutoksia myöhemmin, MS-lääkityksen tehostusta on harkittava, vaikka tunnistettavia kliinisiä pahenemisvaiheita ei olisi havaittu.
- Varjoainetehostetta ei tule käyttää rutiinimaisesti
- hoidon seurannassa 1 vuoden jälkeen
- alle 6 kuukautta edellisestä Gd-kuvauksesta
- raskaana oleville koskaan
- PML-seulontaan.
- Selkäytimen rutiinimaista MK-seurantaa ei suositeta hoidon seurannassa.
- Euroopan lääkevirasto (EMA) suosittaa vain kelatoivan gadolinium-varjoaineen käyttöä pienin annoksin «European Medicines Agency. Gadolinium-containing c...»95.
- Seurantakuvissa leptomeningeaalista varjoainetehostumista voi tavata SPMS-taudissa useammin kuin muissa MS-muodoissa, mutta löydös voi olla aihe erotusdiagnostisiin tutkimuksiin «Filippi M, Preziosa P, Langdon D, ym. Identifying ...»96.
- Natalitsumabihoidossa JCV-positiivisilla (JCV-indeksi > 0,9) MK tehdään 3–4 kuukauden
välein.
- MK suositellaan tehtäväksi vielä 9–12 kuukautta natalitsumabin lopetuksen jälkeen suuren PML-riskin potilaille (JCV-tiitterin indeksi > 0,9, hoidon kesto ≥ 18 kuukautta tai taustalla immunosuppressiivisia hoitoja).
Lääkehoidon erityistilanteita
Lääkevaihdot
- Jos kohtalaisen tehon MS-taudin lääke aiheuttaa haittavaikutuksia tai menettää tehonsa vasta-ainemuodostuksen vuoksi, suositellaan sen vaihtamista kohtalaisen tai korkean tehon aaltomaisen MS-taudin lääkkeeseen.
- Mikäli lääkityksen täysi teho on saavutettu ja esiintyy edelleen kliinistä tai magneettikuvauksella todettavaa tautiaktiivisuutta (ks. Tautiaktiivisuuden arviointi «A5»6), suositellaan lääkkeen vaihtamista korkeatehoiseen MS-taudin lääkkeeseen (ks. Aaltomaisen MS-taudin hoidon aloitus ja seuranta «A6»7).
- Lääkevaihtojen turvaväleistä ei ole tutkittua tietoa, ja ne perustuvat asiantuntijaryhmien suosituksiin «Bigaut K, Cohen M, Durand-Dubief F, ym. How to swi...»97. Taulukkoon «Eri valmisteiden turvavälit ennen uutta hoitoa....»1 on koottu työryhmän suositus turvaväleistä.
- Lääkevaihdoissa tulee huomioida vaihdettavan lääkkeen vaikutuksen kesto ja mahdolliset farmakodynaamiset ja immuunijärjestelmään kohdistuvat yhteisvaikutukset seuraavaksi aloitettavan lääkkeen kanssa «Wiendl H, Gold R, Berger T, ym. Multiple Sclerosis...»26.
- Vaihto kohtalaisen tehon lääkkeestä toiseen kohtalaisen tehon lääkkeeseen tai korkeatehoiseen lääkkeeseen tehdään ilman turvaväliä.
- Okrelitsumabin, ofatumumabin, rituksimabin ja mitoksantronin voi vaihtaa kohtalaisen
tehon lääkkeeseen 3 kuukauden tauon jälkeen.
- Ofatumumabilla on hieman lyhyempi puoliintumisaika kuin okrelitsumabilla ja rituksimabilla, mutta sen vaikutus CD20-soluihin kestää noin 24 viikkoa ja työryhmä suosittaa myös sitä vaihdettaessa 3 kuukauden turvaväliä «Bigaut K, Cohen M, Durand-Dubief F, ym. How to swi...»97.
- Fingolimodin ja natalitsumabin vaihtamista suositellaan rebound-riskin vuoksi vain toiseen korkeatehoiseen lääkkeeseen. Näiden valmisteiden vaihtaminen suoraan kladribiiniin ei kuitenkaan ole suositeltavaa (ks. Lääkityksen lopetukseen liittyvä rebound «A3»4).
- Jos korkeatehoinen lääke vaihdetaan toiseen korkeatehoiseen lääkkeeseen, suositellaan
fingolimodin ja natalitsumabin vaihdossa toiseen lääkkeeseen korkeintaan 1 kuukauden
(ks. kohta Rebound «A3»4), okrelitsumabin vaihdossa 3 kuukauden ja mitoksantronin vaihdossa 6 kuukauden turvaväliä
«Bigaut K, Cohen M, Durand-Dubief F, ym. How to swi...»97.
- Jos mahdollista, lymfosyyttipitoisuuden tulisi olla > 0,8 × 109/l ennen uuden lääkkeen aloitusta, mutta rebound-riskin aiheuttavien lääkkeiden kohdalla lymfopenian tämän asteista korjautumista ei aina voida odottaa.
| Vaihdettava lääkeaine | Vaihto kohtalaisen tehon lääkkeeseen | Vaihto korkeatehoiseen lääkkeeseen |
|---|---|---|
| Jos mahdollista, lymfosyyttipitoisuuden tulisi olla > 0,8 × 109/l ennen uuden lääkkeen aloitusta. Natalitsumabin kohdalla PML:n sulkeminen pois ennen uuden lääkkeen aloitusta (aivojen MK ja tarvittaessa tarvittaessa likvorin PoVNh-osoitus). Natalitsumabin vaihdon jälkeen aivojen MK 3–6 kuukauden välein ensimmäisen vuoden ajan, jos JCV-indeksi ≥ 0,9 ja hoidon kesto yli 18 kuukautta. |
||
| Beetainterferonit | Ei taukoa | Ei taukoa |
| Dimetyylifumaraatti tai diroksimeelifumaraatti | Ei taukoa | Ei taukoa |
| Glatirameeriasetaatti | Ei taukoa | Ei taukoa |
| Teriflunomidi | Ei taukoa (nopeutettu eliminaatio) | Ei taukoa (nopeutettu eliminaatio) |
| Alemtutsumabi | Yksilöllisen harkinnan mukaan | Yksilöllisen harkinnan mukaan |
| Fingolimodi | Ei taukoa | ≤ 1 kk |
| Ponesimodi | 1 vk | 1 vk |
| Kladribiini | Yksilöllisen harkinnan mukaan | Yksilöllisen harkinnan mukaan |
| Mitoksantroni | 3 kk | 6 kk |
| Natalitsumabi | Ei taukoa | 1 kk |
| Ofatumumabi | 3 kk | 3 kk |
| Okrelitsumabi | 3 kk | 3 kk |
| Rituksimabi | 3 kk | 3 kk |
Lääkityksen lopetukseen liittyvä rebound (elämän voimakkain tautiaktiivisuus)
- Rebound-ilmiöllä tarkoitetaan merkittävää tautiaktiivisuuden lisääntymistä hoidon lopetuksen jälkeen verrattuna lääkitystä edeltäneeseen tasoon tai erittäin vaikea-asteista pahenemisvaihetta, jossa EDSS-pistemäärä suurenee vähintään 2 pisteellä ja aivojen MK:ssa nähdään vähintään 5 Gd-tehostuvaa muutosta.
- Rebound-riski on vain niillä lääkkeillä, jotka vaikuttavat lymfosyyttien kulkuun periferiasta keskushermostoon (natalitsumabi ja fingolimodi). On kuitenkin todennäköistä, että ilmiö on niin sanottu luokkavaikutus ja voi tapahtua myös ponesimodin lopettamisen jälkeen.
- Reboundin ilmaantuvuus natalitsumabin lopettamisen jälkeen on 10–30 % «Sorensen PS, Koch-Henriksen N, Petersen T, ym. Rec...»98, «Lo Re M, Capobianco M, Ragonese P, ym. Natalizumab...»99, «Mustonen T, Rauma I, Hartikainen P, ym. Corrigendu...»100, «Ladeira F, Braz L, Salgado P, ym. A multicenter, n...»101, «Fuentes-Rumí L, Hernández-Clares R, Carreón-Guarni...»102, ja rebound ilmaantuu 8–24 viikkoa lääkkeen lopettamisesta «González-Suarez I, Rodríguez de Antonio L, Orviz A...»103, «Prosperini L, Kinkel RP, Miravalle AA, ym. Post-na...»50, «Hua LH, Harris H, Conway D, ym. Disease activity o...»104, «Roos I, Malpas C, Leray E, ym. Disease Reactivatio...»105.
- Reboundin ilmaantuvuus fingolimodin lopettamisen jälkeen on 10–25 % «Hatcher SE, Waubant E, Nourbakhsh B, ym. Rebound S...»106, «Evangelopoulos ME, Miclea A, Schrewe L, ym. Freque...»107, «Frau J, Sormani MP, Signori A, ym. Clinical activi...»108, «Uygunoglu U, Tutuncu M, Altintas A, ym. Factors Pr...»109, «Fragoso YD, Adoni T, Gomes S, ym. Severe Exacerbat...»110, «Goncuoglu C, Tuncer A, Bayraktar-Ekincioglu A, ym....»111, «Framke E, Pontieri L, Bramow S, ym. Rebound of cli...»112, ja rebound ilmaantuu 4–16 viikkoa lääkkeen lopettamisesta «Roos I, Malpas C, Leray E, ym. Disease Reactivatio...»105, «Hatcher SE, Waubant E, Nourbakhsh B, ym. Rebound S...»106, «Fragoso YD, Adoni T, Gomes S, ym. Severe Exacerbat...»110.
- Fingolimodin lopettamisen jälkeen raskautta suunnittelevilla naisilla saattaa olla
erityinen rebound-riski.
- 40 % naisista, jotka lopettivat fingolimodin raskaussuunnitelman vuoksi, sai reboundin «Sepúlveda M, Montejo C, Llufriu S, ym. Rebound of ...»113, ja 22 % naisista, jotka lopettivat fingolimodin raskaussuunnitelman vuoksi, sai relapsin raskauden aikana ja 44 % lapsivuodeaikana. Raskaudenaikainen relapsi korreloi synnytyksen jälkeiseen relapsitaajuuteen «Bianco A, Lucchini M, Totaro R, ym. Disease Reacti...»114.
- Reboundin riskitekijät natalitsumabin lopettamisen jälkeen ovat suuri relapsitaajuus ennen natalitsumabin aloittamista «Lo Re M, Capobianco M, Ragonese P, ym. Natalizumab...»99, «Prosperini L, Kinkel RP, Miravalle AA, ym. Post-na...»50, «Roos I, Malpas C, Leray E, ym. Disease Reactivatio...»105, «Iaffaldano P, Lucisano G, Pozzilli C, ym. Fingolim...»115, «Auer M, Zinganell A, Hegen H, ym. Experiences in t...»116, nuori ikä «Prosperini L, Kinkel RP, Miravalle AA, ym. Post-na...»50, pitkä lääketauko «Lo Re M, Capobianco M, Ragonese P, ym. Natalizumab...»99, «Mustonen T, Rauma I, Hartikainen P, ym. Corrigendu...»100, «Iaffaldano P, Lucisano G, Pozzilli C, ym. Fingolim...»115, «Kappos L, Radue EW, Comi G, ym. Switching from nat...»117, suuri EDSS-pistemäärä natalitsumabin aloitusvaiheessa «Vidal-Jordana A, Tintoré M, Tur C, ym. Significant...»118 ja EDSS-progressio hoidon aikana «Vidal-Jordana A, Tintoré M, Tur C, ym. Significant...»118. Lisäksi riskitekijöitä ovat oheissairaudet «Iaffaldano P, Lucisano G, Pozzilli C, ym. Fingolim...»115, tautiaktiivisuus hoidon aikana «Sorensen PS, Koch-Henriksen N, Petersen T, ym. Rec...»98, «Iaffaldano P, Lucisano G, Pozzilli C, ym. Fingolim...»115, «Vidal-Jordana A, Tintoré M, Tur C, ym. Significant...»118, neutraloivat vasta-aineet «Sorensen PS, Koch-Henriksen N, Petersen T, ym. Rec...»98 ja lyhyt hoidon kesto «Lo Re M, Capobianco M, Ragonese P, ym. Natalizumab...»99, «Prosperini L, Kinkel RP, Miravalle AA, ym. Post-na...»50, joten natalitsumabi- ja fingolimodihoito tulisi aina suunnitella pitkäkestoiseksi.
- Reboundin riskitekijät fingolimodin lopettamisen jälkeen ovat suuri relapsitaajuus ennen hoidon aloitusta «Roos I, Malpas C, Leray E, ym. Disease Reactivatio...»105, «Hatcher SE, Waubant E, Nourbakhsh B, ym. Rebound S...»106, «Nygaard GO, Torgauten H, Skattebøl L, ym. Risk of ...»119, pieni lymfosyyttipitoisuus hoidon aloitus- «Sepúlveda M, Montejo C, Llufriu S, ym. Rebound of ...»113 tai lopetusvaiheessa, pitkä lääketauko «Goncuoglu C, Tuncer A, Bayraktar-Ekincioglu A, ym....»111, naissukupuoli «Framke E, Pontieri L, Bramow S, ym. Rebound of cli...»112 ja nuori ikä «Goncuoglu C, Tuncer A, Bayraktar-Ekincioglu A, ym....»111, «Framke E, Pontieri L, Bramow S, ym. Rebound of cli...»112, «Nygaard GO, Torgauten H, Skattebøl L, ym. Risk of ...»119.
- Kummankin lääkkeen lopettamisen jälkeen lääketauko tulisi pitää mahdollisimman lyhyenä, käytännössä enintään kuukauden mittaisena «Roos I, Malpas C, Leray E, ym. Disease Reactivatio...»105, «Leurs CE, van Kempen ZL, Dekker I, ym. Switching n...»120.
- Immunostimulanttien aloitus ei estä reboundin ilmaantumista «Sellner J, Rommer PS. A review of the evidence for...»121.
- Dimetyylifumaraatti saattaa olla riittävä niille, joilla oli vähän pahenemisvaiheita ennen hoidon aloitusta, ei ollut tautiaktiivisuutta hoidon aikana eikä mitään muuta lääkevaihtoehtoa ole käytettävissä «Sellner J, Rommer PS. A review of the evidence for...»121, «Cohan SL, Moses H, Calkwood J, ym. Clinical outcom...»122.
- Pääsääntöisesti tulee kuitenkin vaihtaa nopeasti vaikuttavaan korkeatehoiseen lääkkeeseen «Hersh CM, Harris H, Conway D, ym. Effect of switch...»123, joilla tässä yhteydessä tarkoitetaan rituksimabia, okrelitsumabia «Lo Re M, Capobianco M, Ragonese P, ym. Natalizumab...»99, «Nygaard GO, Torgauten H, Skattebøl L, ym. Risk of ...»119, «Hersh CM, Harris H, Conway D, ym. Effect of switch...»123, «Alping P, Frisell T, Novakova L, ym. Rituximab ver...»124, «Langer-Gould AM. Pregnancy and Family Planning in ...»125 tai alemtutsumabia «Federle L, Puthenparampil M, Stenta G, ym. Alemtuz...»126, «Huhn K, Bayas A, Doerck S, ym. Alemtuzumab as resc...»127, «Alcalá C, Gascón F, Pérez-Miralles F, ym. Treatmen...»128.
- Ofatumumabi käyttäytynee samoin kuin muut CD20-monoklonaaliset vasta-aineet, mutta sen tehosta reboundin estossa ei ole toistaiseksi tutkimustietoa.
- Natalitsumabin jälkeen voidaan harkita myös fingolimodia «Iaffaldano P, Lucisano G, Pozzilli C, ym. Fingolim...»115, «Capobianco M, di Sapio A, Malentacchi M, ym. No im...»129, ja vastaavasti natalitsumabi on suositeltava vaihtoehto fingolimodin jälkeen JCV-vasta-aine-negatiivisilla «Zhu C, Zhou Z, Roos I, ym. Comparing switch to ocr...»130.
- Kladribiini ei estä fingolimodin jälkeistä reboundia yhtä tehokkaasti kuin rituksimabi, okrelitsumabi tai natalitsumabi «Nygaard GO, Torgauten H, Skattebøl L, ym. Risk of ...»119, «Zhu C, Zhou Z, Roos I, ym. Comparing switch to ocr...»130.
- Kortisoni ei vähennä natalitsumabin jälkeisen reboundin riskiä «Vidal-Jordana A, Tintoré M, Tur C, ym. Significant...»118, «Sellner J, Rommer PS. A review of the evidence for...»121, «Borriello G, Prosperini L, Marinelli F, ym. Observ...»131, «Magraner MJ, Coret F, Navarré A, ym. Pulsed steroi...»132, eikä sen tehosta fingolimodin lopettamisen jälkeisen reboundin estossa ole tietoa «Berger B, Baumgartner A, Rauer S, ym. Severe disea...»133, «Sánchez P, Meca-Lallana V, Vivancos J. Tumefactive...»134.
Raskaus ja imetys
- MS-tauti ei vaikuta haitallisesti raskaudenkulkuun tai kehittyvään sikiöön.
- Raskaussuunnitelmista on keskusteltava potilaan kanssa heti diagnoosin jälkeen ja ne on otettava huomioon hoidon valinnassa mahdollisuuksien mukaan.
- Raskaussuunnitelmat eivät saa viivästyttää taudinkulkuun vaikuttavien hoitojen aloitusta.
- Ehkäisyvalmisteet ovat turvallisia MS-potilailla «Otero-Romero S, Carbonell-Mirabent P, Midaglia L, ...»135. Yhdistelmäehkäisyvalmisteisiin liittyy suurentunut tukosriski erityisesti, jos liikuntakyky on heikentynyt. Lääkkeiden mahdolliset haittavaikutukset (esim GI-oireet ja imeytyminen) sekä potilaan käyttämien lääkkeiden yhteisvaikutukset tulee arvioida.
- Lapsettomuushoidot eivät lisää pahenemisvaiheiden riskiä MS-tautia sairastavilla naisilla «Mainguy M, Tillaut H, Degremont A, ym. Assessing t...»136.
- Foolihappolisä (yli 3 kuukautta ennen ehkäisyn lopettamista) ja riittävä D-vitamiinisubstituutio kuuluvat raskauden suunnitteluun «Krysko KM, Dobson R, Alroughani R, ym. Family plan...»137.
- MS-taudin hoidossa raskauden aikana on löydettävä paras tasapaino äidin ja sikiön tai vastasyntyneen terveyden suhteen.
- Raskauden toisella ja kolmannella kolmanneksella on useimmiten MS-tautia rauhoittava vaikutus «Confavreux C, Hutchinson M, Hours MM, ym. Rate of ...»138. Pahenemisvaiheiden riski pienenee merkittävästi viimeiseen raskauskolmannekseen asti, mutta suurenee synnytyksen jälkeen. Pahenemisvaiheiden riski on suurin raskauden jälkeisten kolmen ensimmäisen kuukauden aikana.
- Imetys ei merkittävästi vaikuta MS-taudin aktiivisuuteen «Portaccio E, Amato MP. Breastfeeding and post-part...»139.
- Imetyksen aikana on turvallista käyttää CD20-monoklonaalisia vasta-aineita (imetys sallittu 4 tuntia infuusiosta), beetainterferoneja, glatirameeriasetaattia ja natalitsumabia.
- MS-taudin immunomodulatiivisten hoitojen varoajat ennen raskautta vaihtelevat (taulukko
«Eri valmisteiden turvavälit ennen suunnitellun raskauden alkua ja valmisteiden käyttö
imetyksen aikana ....»2). Osaan lääkkeistä liittyvä mahdollinen rebound-ilmiö on huomioitava hoidon suunnittelussa
(ks. kohta Lääkityksen lopetukseen liittyvä rebound «A3»4).
- Beetainterferonien ja glatirameeriasetaatin käyttöä voi jatkaa läpi raskauden.
- Natalitsumabia voi jatkaa viimeiseen raskauskolmannekseen tai harkita sen vaihtamista toiseen korkeatehoiseen lääkehoitoon ennen raskausyritystä rebound-riski huomioiden.
- Dimetyylifumaraattia, diroksimetyylifumaraattia ja ofatumumabia voi jatkaa positiiviseen raskaustestiin asti.
- Teriflunomidin kohdalla suositellaan nopeutettua eliminaatiota esimerkiksi kolestyramiinilla ennen ehkäisyn pois jättämistä, ja lääkepitoisuuden tulee olla veressä mittaamattoman pieni kaksi kertaa.
- Muiden lääkkeiden varoajat ovat eripituiset. Ks. valmisteyhteenveto.
- Rebound-ilmiön ennaltaehkäisy on keskeistä raskautta suunniteltaessa (ks. kohta Rebound
«A3»4) «Yeh WZ, Widyastuti PA, Van der Walt A, ym. Nataliz...»140, «Razaz N, Piehl F, Frisell T, ym. Disease activity ...»141, «Kümpfel T, Thiel S, Meinl I, ym. Anti-CD20 therapi...»142.
- Natalitsumabin ja fingolimodin vaihtaminen ennen raskausyritystä CD20-monoklonaaliseen vasta-aineeseen tai natalitsumabin jatkaminen raskausaikana vähentävät rebound-relapsin riskiä merkittävästi. Mikäli natalitsumabia jatketaan raskauden viimeiseen kolmannekseen, vastasyntyneen verenkuva tulee tarkistaa ja elävien heikennettyjen rokotteiden antamista lykätä «Krysko KM, Dobson R, Alroughani R, ym. Family plan...»137.
- Raskaudenaikaisen pahenemisvaiheen hoidossa käytetään metyyliprednisolonia (ks. Pahenemisvaihe ja sen hoito «A7»8). Plasmafereesiä voidaan harkita, jos kortisonille ei saada vastetta. Immunoglobuliineja käytetään vain erityistilanteissa.
- Käyttökokemuksen myötä tieto lääkkeiden käytöstä raskauden ja imetyksen aikana lisääntyy. Terveysportin raskaus ja imetys -tietokannoissa on kattava kooste käytössä olevien immunomoduloivien ja immunosuppressiivisten lääkkeiden turvallisuudesta raskauden ja imetyksen aikana. (Tietokantoihin tarvitaan käyttöoikeudet; Gravbase ja Lactbase, «https://www.terveysportti.fi/apps/raim/»4).
- Magneettitutkimusta ei suositella raskauden aikana. Jos se kuitenkin terveydellisistä syistä on välttämätöntä, Gd-varjoainetta ei tule käyttää «Ray JG, Vermeulen MJ, Bharatha A, ym. Association ...»143. Raskauden jälkeen kuvantamisessa voidaan käyttää Gd-varjoainetta ja imetystä voidaan jatkaa, vaikka varjoaine erittyy vähäisissä määrin äidinmaitoon «American College of Radiology. ACR Committee on Dr...»144.
| Vaikuttava lääkeaine | Aika viimeisestä annoksesta ehkäisyn pois jättämiseen, kun raskaustoive | Imetys mahdollinen lääkkeen käytön aikana |
|---|---|---|
| 1 > 5 eliminaation puoliintumisaikaa | ||
| Beetainterferonit | Ei ole vasta-aiheinen raskauden aikana | Kyllä |
| Dimetyylifumaraatti tai diroksimeelifumaraatti | Lopetus, kun raskaustesti on positiivinen | Ei |
| Glatirameeriasetaatti | Ei ole vasta-aiheinen raskauden aikana | Kyllä |
| Teriflunomidi | Nopeutetun eliminaation jälkeen. 24 kk ilman eliminaatiota. | Ei |
| Alemtutsumabi | 4 kk | Ei (imetyksen voi aloittaa 4 kk infuusion jälkeen) |
| Fingolimodi1 | 2 kk | Ei |
| Ponesimodi1 | 1 vk | Ei |
| Kladribiini | 6 kk | Ei (imetyksen voi aloittaa 1 vk viimeisestä annoksesta) |
| Mitoksantroni | 6 kk | Ei |
| Natalitsumabi | Valmisteen käyttöä voi jatkaa raskausviikolle 34 (pidennetty annosväli) ja sen voi aloittaa uudelleen 1–2 viikkoa synnytyksen jälkeen. Uudelleenaloitus siten, ettei tule yli 8 viikon taukoa. | Kyllä |
| Ofatumumabi | Lopetus, kun raskaustesti on positiivinen | Kyllä |
| Okrelitsumabi | 3 kk | Kyllä |
| Rituksimabi | 3 kk | Kyllä |
Ensisijaisesti etenevän MS-taudin lääkehoito
- Okrelitsumabilla on käyttöaihe ensisijaisesti etenevän MS-taudin hoitoon. Sen aloittamista
voidaan harkita taudin varhaisessa vaiheessa, jos MK:ssa havaitaan tulehduksellista
aktiivisuutta.
- Okrelitsumabi saattaa hidastaa liikunta- ja toimintakyvyn heikentymistä ja vähentää magneettikuvauksella (MK) arvioitavaa taudin aktiivisuutta primaarisesti etenevässä MS-taudissa lumeeseen verrattuna «Okrelitsumabi saattaa hidastaa liikunta- ja toimintakyvyn heikentymistä sekä vähentää magneettikuvauksella (MK) arvioitavaa taudin aktiivisuutta primaaristi etenevässä MS-taudissa lumeeseen verrattuna.»C.
- Fingolimodi ei ilmeisesti hidasta taudin etenemistä suoraan etenevässä MS-taudissa «Oral fingolimod, 0.5 mg daily for 36 months compared to placebo, appears not to slow disease progression in patients with primary progressive multiple sclerosis, when measured with the time to confirmed disability progression as a composite outcome or as an EDSS score change.»B.
- EDSS-arvon tulee hoitoa aloitettaessa olla ≤ 6,5.
- Hoidon tehoa on syytä arvioida tarkkaan. Tehon arvioinnissa fysioterapeutin arvio
liikuntakyvystä kerran vuodessa on hyödyksi. Hoito tulisi lopettaa, mikäli toimintakyvyn
heikkeneminen ei hidastu, ja viimeistään, kun kävelykyky on menetetty.
- MK-seurannasta ei tässä potilasryhmässä ole pääsääntöisesti hyötyä.
Immunologisen lääkityksen lopettaminen
Toissijaisesti etenevä MS-tauti
- Immunologista lääkehoitoa voidaan käyttää, jos pahenemisvaiheita vielä esiintyy toissijaisesti etenevän vaiheen aikana.
- Lääkehoito tulee lopettaa viimeistään, jos EDSS-pisteitä on 7 tai enemmän pysyvänä jäännösoireena.
- Natalitsumabi ei vähennä toimintakyvyn heikentymistä toissijaisesti etenevässä MS-taudissa «Natalitsumabi ei vähennä toimintakyvyn heikentymistä toissijaisesti etenevässä MS-taudissa.»A.
- Jos tautiin liittyvä haitta liikunta- ja toimintakyvyssä etenee selvästi vuosien aikana ilman akuutteja pahenemisvaiheita eikä pään MK:ssa ole uusia T2- tai Gd-tehosteisia muutoksia, suositellaan harkitsemaan lääkityksen lopettamista.
Aaltomainen MS-tauti ja iän huomiointi
- Pahenemisvaiheet ovat hyvin harvinaisia yli 60-vuotiailla «Tremlett H, Zhao Y, Joseph J, ym. Relapses in mult...»145, «Hua LH, Fan TH, Conway D, ym. Discontinuation of d...»146.
- Immunologisen lääkehoidon teho heikkenee voimakkaasti ikääntymisen myötä: meta-analyysissä mikään MS-taudin lääkehoito ei ollut tehokas yli 53-vuotiailla ja korkeatehoiset lääkkeet pystyivät hidastamaan toimintakyvyn heikkenemistä vähemmän tehokkaisiin lääkkeisiin nähden vain alle 40-vuotiailla «Weideman AM, Tapia-Maltos MA, Johnson K, ym. Meta-...»37.
- Hoidossa on huomioitava lääkitykseen liittyvä infektioriski ja ikään liittyvä syöpäriskin
suureneminen «Atula S, Laakso S, Nevala R, Järvinen E. MS-taudin...»147, «Prosperini L, Haggiag S, Tortorella C, ym. Age-rel...»148.
- Vaikeahoitoisen infektion riski suurenee 8,5-kertaiseksi rituksimabihoidossa, kun EDSS-pisteitä on vähintään 7 «Vollmer BL, Wallach AI, Corboy JR, ym. Serious saf...»42.
- Immunologisen lääkehoidon lopettamisesta yli 55-vuotiailla on tehty satunnaistettu, yksöissokkoutettu non-inferioriteettitutkimus (DISCOMS). Potilailla ei ollut pahenemisvaihetta edeltävien 5 vuoden aikana eikä uusia MK-muutoksia edeltävien 3 vuoden aikana. Ensisijaiseksi päätetapahtumaksi oli valittu uusi MK-leesio tai pahenemisvaihe, joita lääkityksen lopettaneille tuli enemmän (12,2 % vs 4,7 % potilaista; 2 vuoden seuranta-aika). Kun tarkasteltiin suoraan pahenemisvaiheen riskiä, lääkityksen lopettaneiden ryhmä ei eronnut merkitsevästi lääkehoitoa jatkaneista «Corboy JR, Fox RJ, Kister I, ym. Risk of new disea...»149.
- Stabiilissa aaltomaisessa MS-taudissa tulee iäkkäämpien (yli 55–60 vuotta) potilaiden kanssa harkita yksilöllisesti sopivin aika lääkityksen lopetukseen «Vaughn CB, Jakimovski D, Kavak KS, ym. Epidemiolog...»150.
- Taudin aiempi aktiivisuus on otettava huomioon tilannetta arvioitaessa.
- Pään MK voidaan ottaa epäselvässä tilanteessa tukemaan hoitopäätöstä. Kuvantaminen juuri ennen lääkityksen lopetusta (myös ajankohtaisen tautiaktiivisuuden arvioimiseksi) ja 6–12 kuukautta lääkkeettömän jakson jälkeen voi auttaa tilanteen arvioimisessa: uudet T2-leesiot tukevat lääkehoidon palauttamista.
- Immunomoduloiva hoito voidaan aloittaa uudelleen, jos hoidon lopettamisen jälkeen ilmenee uusia pahenemisvaiheita.
Pahenemisvaihe ja sen hoito
- MS-taudin pahenemisvaihe on keskushermoston tulehduksellisesta reaktiosta johtuva uusi neurologinen oire tai vanhan oireen merkittävä paheneminen, joka alkaa vähitellen muutaman päivän aikana. Tavanomaisesti oireet lisääntyvät noin kahden viikon ajan, minkä jälkeen ne lievittyvät ja yleensä ohittuvat kuukauden kuluessa täysin tai osittain.
- Erilaiset elimistön stressitilanteet, kuten tulehdukset (hammastulehdus, nuhakuume, mahatauti, virtsatietulehdus) ja muu sairastaminen voivat altistaa pahenemisvaiheelle «McDonald WI, Compston A, Edan G, ym. Recommended d...»151.
- Tavallisia pahenemisvaiheen oireita ovat esimerkiksi toisen silmän näön heikkeneminen ja liikutteluarkuus, yhden tai useamman raajan lihasheikkous ja tuntohäiriöt, kaksoiskuvat, tasapainon ylläpitämisen vaikeus ja kömpelyys «Kuusisto H, Elovaara I MS-taudin pahenemisvaiheen ...»152.
- Pelkkä uupuminen ei herätä epäilyä pahenemisvaiheesta.
- Kehonlämmön noustessa esimerkiksi kuumeessa, kesähelteellä tai saunomisen yhteydessä hermojen johtonopeus hidastuu ja neurologiset oireet saattavat voimistua. Kyseessä on fysiologinen niin sanottu Uthoffin ilmiö, joka ei tarkoita pahenemisvaihetta «McDonald WI, Compston A, Edan G, ym. Recommended d...»151.
- Pikkuhiljaa kuukausien aikana lisääntyvä toimintakyvyn heikkeneminen ei myöskään ole tulehdusaktiivisuudesta johtuva pahenemisvaihe, vaan johtuu ensisijaisesti keskushermoston degeneratiivisista muutoksista «Noseworthy JH, Lucchinetti C, Rodriguez M, ym. Mul...»153.
- Akuutin pahenemisvaiheen lääkehoito lyhentää oireiden kestoa «Barnes MP, Bateman DE, Cleland PG, ym. Intravenous...»154, «Beck RW, Cleary PA, Anderson MM Jr, ym. A randomiz...»155. Hoitoa tulee harkita, jos potilaan toimintakyky on merkittävästi heikentynyt, esimerkiksi visus on alle 0,5 tai kävelykyky on oleellisesti huonontunut.
- Ensisijainen hoito on suuriannoksinen metyyliprednisolonihoito. Hoito toteutetaan antamalla laskimoon tai suun kautta 1 000 mg metyyliprednisolonia 3 (–5) päivän ajan. Hoidon tehossa tai turvallisuudessa ei ole havaittu antoreitistä tai annoksen suuruudesta riippuvia eroja, kunhan annos on vähintään 500 mg 3 päivän ajan tai enintään 2 000 mg 5 päivän ajan «Kuusisto H, Elovaara I MS-taudin pahenemisvaiheen ...»152, «Oliveri RL, Valentino P, Russo C, ym. Randomized t...»156.
- Ensimmäinen hoitokerta (tai ainakin ensimmäinen yö) toteutetaan psykoosivaaran vuoksi valvotusti sairaalassa.
- Ennen hoidon toteutusta suljetaan pois akuutit infektiot. Samanaikainen alempien virtsateiden infektio ei yleensä ole este hoidolle, mutta hoito annetaan antibioottisuojassa.
- Plasmanvaihtoa voidaan harkita rajuoireisen pahenemisvaiheen yhteydessä kortisonipulssihoidon jälkeen, jos kortisonipulssihoidosta ei tule alkavaa vastetta oirekuvaan. Plasmanvaihto tehdään esimerkiksi joka toinen päivä ja yhteensä 1–1,5 veritilavuuden vaihto tehdään 5–7 kertaa «Cortese I, Chaudhry V, So YT, ym. Evidence-based g...»157, «Frohman EM, Wingerchuk DM. Clinical practice. Tran...»158.
Oireenmukainen hoito
- MS-taudin aiheuttamia jäännösoireita lievitetään kuten näitä oireita hoidetaan muissakin sairauksissa «MS-tautia sairastavan hoitoketju. Terveysportti -H...»159.
- Spastisuus: Spastisuuden optimaalinen arviointi ja hoito edellyttävät moniammatillisuutta ja sekä lääkkeettömien että lääkehoitojen hyödyntämistä. Vaikeassa spastisuudessa intratekaalinen baklofeenihoito voi auttaa «Otero-Romero S, Sastre-Garriga J, Comi G, ym. Phar...»160, «Multiple sclerosis in adults: management. London: ...»161, «Smith KA, Piehl F, Olsson T, ym. Spasticity treatm...»162, «Filippini G, Minozzi S, Borrelli F, ym. Cannabis a...»163. Kannabinoidilla (Sativex) on myyntilupa spastisuuden hoitoon MS-taudissa, ja aloitusharkinnan tekee erikoislääkäri.
- Masennus: MS-tautia sairastavan masennusta hoidetaan samoin periaattein kuin muillakin (ks. Käypä hoito -suositus Depressio «Depressio»4, «Depressio. Käypä hoito -suositus. Suomalaisen Lääk...»164).
- Kipu: Ennen hoidon määrittelyä on tärkeää selvittää kivun tausta: onko kyseessä neuropaattinen kipu vai tuki- ja liikuntaelimistön kipu. MS-taudissa neuropaattinen kipu tulee hoitaa tavanomaisten suositusten mukaisesti. Liikuntaelimistön kipu on usein seurausta liikkumattomuudesta, spastisuudesta tai asentovirheistä, ja tällöin tulisi keskittyä näiden syiden hoitoon «Multiple sclerosis in adults: management. London: ...»161.
- Virtsaamishäiriöt: MS-tautiin liittyy sekä virtsan varastoimisen että tyhjentämisen ongelmia, usein molempia samanaikaisesti. Häiriön syy on selvitettävä, ja hoito suunnitellaan syyn mukaisesti. Hoidossa optimaalisin hyöty saavutetaan moniammatillisesti yhdistämällä lääkkeettömät, farmakologiset ja muut urologiset hoidot «Vecchio M, Chiaramonte R, DI Benedetto P. Manageme...»165.
- Ummetus: Kroonisen ummetuksen tavanomaista hoitoa voidaan käyttää ja joskus voidaan tarvita useamman lääkkeen yhdistelmää. Laktuloosia kannattaa välttää vaikeassa suolen motiliteettihäiriössä, koska se voi fermentoituessaan aiheuttaa kaasuvaivoja ja teho voi jäädä heikoksi «Preziosi G, Gordon-Dixon A, Emmanuel A. Neurogenic...»166.
- Unihäiriöt: Suositellaan ensisijaisesti lääkkeettömiä hoitoja tai syyn mukaista lääkehoitoa (ks. Käypä hoito -suositus Unettomuus «Unettomuus»5), «Unettomuus. Käypä hoito -suositus. Suomalaisen Lää...»167.
- Kävelyvaikeus: Fampridiinia voidaan harkita. Lääke ei ole korvattava, ja se on hinnaltaan korkea. Kävelynopeudessa tulisi nähdä vähintään 25 %:n parannus 2 viikon lääkkeen käytön jälkeen «Ghorbanpour S, Rahimibarghani S, Rohani S, ym. Fam...»168.
- Uupumus: Kaikki uupumus ei ole MS-taudista johtuvaa, ja on hyvä sulkea pois uniapnea, masennus, (antikolinergisten) lääkkeiden aiheuttama väsymys tai esimerkiksi yöllinen tiheävirtsaisuus päiväaikaisen uupumuksen taustalta. Liikunnalla on osoitettu olevan vaste MS-potilaiden uupumuksen hoidossa «Liikunta ilmeisesti vähentää MS-tautiin liittyvää uupumusta.»B, «Pilates saattaa vähentää MS-tautia sairastavan kokemaa uupumusta ja parantaa fyysistä toimintakykyä ja elämänlaatua yhtä paljon kuin muut liikuntamuodot.»C. Lumelääkkeeseen verrattuna modafiniili ei vähennä MS-tautia sairastavan potilaan uupumusta «Lumelääkkeeseen verrattuna modafiniili ei vähennä MS-tautia sairastavan potilaan uupumusta.»A, eikä sitä tule käyttää (ks. Vältä viisaasti -suositus «Modafiniili MS-tautiin liittyvän uupumuksen hoidossa»7). Bupropionia ja venlafaksiinia voidaan kokeilla, ja myös amantadiinia on käytetty uupumuksen hoitoon MS-taudissa.
Rokotukset
- Rokotusten yhteyttä MS-taudin tai sen pahenemisvaiheiden riskiin ei ole voitu osoittaa «Otero-Romero S, Lebrun-Frénay C, Reyes S, ym. ECTR...»169.
- MS-tautiin sairastuneen rokotustilanne tulisi tarkistaa ja päivittää mahdollisimman pian MS-diagnoosin vahvistamisen jälkeen «Otero-Romero S, Lebrun-Frénay C, Reyes S, ym. ECTR...»169. Rokotussuositukset on koottu taulukkoon «MS-potilaan rokotukset....»3.
- Kaikille MS-potilaille suositellaan kansallisen rokotusohjelman mukaisia rokotuksia.
- Jos rokotusohjelman mukaisia rokotuksia puuttuu, inaktivoidut rokotteet tulisi antaa vähintään 2 viikkoa ja elävät heikennetyt rokotteet (kuten MPR- ja vesirokkorokote) 4–6 viikkoa ennen lääkehoidon aloitusta.
- Eläviä heikennettyjä rokotteita ei tule antaa MS-taudin lääkehoitojen aikana.
- Keltakuumerokote on elävä heikennetty rokote. Pienessä 7 potilaan sarjassa siihen liittyi pahenemisvaihe 5 potilaalla «Farez MF, Correale J. Yellow fever vaccination and...»170. Suurentunutta pahenemisvaiheen riskiä ei myöhemmässä 128 potilaan rekisteriaineistossa voitu vahvistaa, mutta rokottamisen riski-hyötysuhdetta tulee tapauskohtaisesti harkita «Papeix C, Mazoyer J, Maillart E, ym. Multiple scle...»171.
- Vesirokkoviruksen (VZV) vasta-aineet on määritettävä ennen hoidon aloittamista alemtutsumabilla, fingolimodilla, kladribiinilla, natalitsumabilla, ofatumumabilla, okrelitsumabilla, ponesimodilla tai rituksimabilla. Potilaiden, joilla on negatiivinen tai heikosti positiivinen vasta-ainetaso, ja potilaiden, joilla ei ole selvää näyttöä aiemmasta altistumisesta, tulee saada immunisointi elävällä heikennetyllä vesirokkorokotteella 4–6 viikkoa ennen lääkehoidon aloittamista «Reyes S, Ramsay M, Ladhani S, ym. Protecting peopl...»172.
- Pneumokokkikonjugaattirokote suositellaan annettavaksi kaikille yli 50-vuotiaille MS-potilaille, joilla EDSS-pisteitä on yli 6, sekä jos aloitetaan korkeatehoinen MS-taudin lääkehoito. Rekombinanttia vyöruusurokotusta tulee harkita yli 50-vuotiaille ja korkeatehoisia MS-taudin lääkehoitoja aloittaville. Hepatiitti-B-rokotusta suositellaan, jos aloitetaan korkeatehoinen lääkehoito ja potilas kuuluu B-hepatiitin riskiryhmiin ja on HBsAg- ja HBcAb-negatiivinen «Otero-Romero S, Lebrun-Frénay C, Reyes S, ym. ECTR...»169, «Reyes S, Ramsay M, Ladhani S, ym. Protecting peopl...»172
- Kortisonipulssihoidon jälkeen suositellaan odottamaan 3 kuukautta ennen elävillä heikennetyillä viruksilla (MPR, VZV) rokottamista ja 4 viikkoa ennen inaktivoiduilla rokotteilla rokottamista «Ciotti JR, Valtcheva MV, Cross AH. Effects of MS d...»173.
- MS-taudin taudinkulkuun vaikuttavat lääkkeet eivät rajoita inaktivoitujen rokotteiden
käyttöä, mutta ne voivat heikentää rokotteiden tehoa.
- Beetainterferoni ja dimetyylifumaraatti vaikuttavat vähiten erityyppisten rokotteiden tehoon. Natalitsumabi, glatirameeriasetaatti ja teriflunomidi heikentävät hieman influenssarokotteen, mutta eivät merkittävästi koronarokotteiden tai tetanusrokotteen tehoa.
- Voimakkaimmin heikentyneitä vasteita eri rokotteille on todettu rituksimabilla, okrelitsumabilla ja fingolimodilla hoidetuilla potilailla. Pidennetty infuusioväli parantaa rokotevastetta rituksimabia käyttävillä potilailla «Asplund Högelin K, Ruffin N, Pin E, ym. B-cell rep...»174. Uusimmista lääkkeistä, kuten ofatumumabista ja ponesimodista, on vielä vähän tutkittua tietoa «Gold R, Fätkenheuer G, Hartung HP, ym. Vaccination...»175, «Faissner S, Heitmann N, Plaza-Sirvent C, ym. Immun...»176. Tehosterokotteet saattavat parantaa vasta-ainemuodostusta sekä korona- että influenssarokotteelle «Gold R, Fätkenheuer G, Hartung HP, ym. Vaccination...»175, «Sormani MP, Inglese M, Schiavetti I, ym. Effect of...»177, «Olberg HK, Eide GE, Cox RJ, ym. Antibody response ...»178.
- Kladribiini- ja alemtutsumabihoidon jälkeen tarvittavat rokotukset suositellaan ajoitettavaksi siten, että lymfosyyttipitoisuudet ovat palautuneet, jolloin normaaleiden vasteiden muodostuminen on mahdollista.
- Kantasolusiirtopotilaat menettävät aiemmat rokotevasteet ja tarvitsevat kokonaan uudelleen rakennetun rokotusohjelman «Gold R, Fätkenheuer G, Hartung HP, ym. Vaccination...»175.
- Rokotevasteen optimoimiseksi rokotus muutamaa viikkoa ennen seuraavaa CD20-monoklonaalisen lääkkeen infuusiota on suositeltavampi kuin rokotus juuri infuusion jälkeen. Kuitenkin T-soluvälitteinen rokotevaste säilyy näiden hoitojen aikana, eikä hoidon viivästäminen usealla kuukaudella ole perusteltua.
| * alemtutsumabi, fingolimodi, kladribiini, natalitsumabi, ofatumumabi, okrelitsumabi,
ponesimodi tai rituksimabi ** Teho saattaa olla heikentynyt erityisesti B-solulääkkeillä ja sfingosiinireseptorin estäjillä hoidetuilla potilailla, tarvittaessa vasta-ainemääritys ja/tai tehosteannos rokotetta. *** Pneumokokkirokote kuuluu kansalliseen rokoteohjelmaan rituksimabia ja okrelitsumabia saavilla potilailla |
|
| Ennen lääkehoidon aloitusta suositeltavat | |
|---|---|
| Aikuisten kansallisen rokotusohjelman mukaiset rokotteet | Inaktivoidut ≥ 2 viikkoa ennen Elävät heikennetyt ≥ 4–6 viikkoa ennen |
| Vesirokkorokote (jos ei VZV-vasta-aineita) | ≥ 4–6 viikkoa ennen hoidon aloittamista korkeatehoisilla lääkkeillä* |
| Pneumokokkikonjugaattirokote (20-valenttinen)*** | Yli 50-vuotiaat potilaat, joilla EDSS-pisteitä yli 6, korkeatehoisia lääkkeitä aloittavat |
| Ennen lääkehoidon aloitusta harkittavat | |
| Rekombinantti vyöruusurokote | Yli 50-vuotiaat, korkeatehoisia lääkehoitoja aloittavat |
| Hepatiitti B -rokote | Hepatiitti B -riskiryhmät, korkeatehoisia lääkehoitoja aloittavat |
| Lääkehoidon aikana suositeltavat | |
| Kurkkumätä-jäykkäkouristusrokote (dT) | Lääkehoidosta riippumatta** perussarjan saaneelle 45 ja 65 vuoden iässä ja sen jälkeen 10 vuoden välein |
| Influenssarokote vuosittain | Lääkehoidosta riippumatta** |
| Elävät heikennetyt EI ANNETA | Lääkehoidosta riippumatta |
Lasten MS-tauti
- Lasten MS-tauti (pediatric onset MS) tarkoittaa sairauden puhkeamista alle 18-vuotiaana.
- Lasten MS-tauti on harvinainen.
- Länsimaissa noin 5 % MS-potilaista saa diagnoosin alle 18-vuotiaana, ja ilmaantuvuus tässä ikäryhmässä on 0,2–2,85/100 000 «Alroughani R, Boyko A. Pediatric multiple sclerosi...»179, «Waldman A, Ness J, Pohl D, ym. Pediatric multiple ...»180.
- Vain alle 1 %:lla MS-potilaista ensioireet tulevat alle 10-vuotiaana «Waldman A, Ness J, Pohl D, ym. Pediatric multiple ...»180.
- Lasten MS-taudin diagnostiikka ja hoito on keskitetty yliopistollisiin sairaaloihin.
- Kansallista MS-rekisteriä tulisi käyttää myös lasten MS-taudin seurannassa.
- McDonaldin vuoden 2017 diagnostiset kriteerit toimivat hyvin myös lapsilla.
- Kahdessa eri aineistossa ennusteellinen osuvuus oli 71–87 %, tarkkuus noin 95 % ja herkkyys 71–84 % «Hacohen Y, Brownlee W, Mankad K, ym. Improved perf...»181, «Fadda G, Brown RA, Longoni G, ym. MRI and laborato...»182.
- Erotusdiagnostiikassa varsinkin MOG-vasta-ainepositiiviset demyelinaatiosairaudet (MOGAD) on tärkeää huomioida.
- Lasten MS-tautityyppi on yli 97 %:lla aaltomainen.
- Lasten MS-tauti on tulehduksellisesti aktiivisempi kuin aikuisten.
- Ensimmäisessä MK:ssa voidaan todeta enemmän muutoksia aikuispotilaisiin verrattuna «Waubant E, Chabas D, Okuda DT, ym. Difference in d...»183, ja pahenemisvaiheita esiintyy 2–3 kertaa useammin «Benson LA, Healy BC, Gorman MP, ym. Elevated relap...»184.
- Taudin alkuvaiheessa esiintyy aikuisia harvemmin jäännösoireita, minkä ajatellaan johtuvan aivojen paremmasta kyvystä tuottaa myeliinia ja kehittyvien aivojen suuremmasta muovautuvuudesta «Chitnis T, Aaen G, Belman A, ym. Improved relapse ...»185.
- Lapsena MS-tautiin sairastuneilla tyypillinen odotettu aivotilavuus voi jäädä aikuisiällä saavuttamatta «Aubert-Broche B, Fonov V, Narayanan S, ym. Onset o...»186 ja kognitiivisia vaikeuksia voi esiintyä jo taudin alkuvaiheessa «Amato MP, Goretti B, Ghezzi A, ym. Cognitive and p...»187.
- MS-tauti etenee lapsilla hitaammin kuin aikuisilla, mutta koska tauti alkaa varhaisemmalla iällä, EDSS 6,0 -tason toimintakyvyn heikentymä saavutetaan keskimäärin 10 vuotta aikuispotilaita aiemmin (45 vuoden iässä vs 54 vuoden iässä) «Ghezzi A, Pozzilli C, Liguori M, ym. Prospective s...»188, «Renoux C, Vukusic S, Mikaeloff Y, ym. Natural hist...»189, «Harding KE, Liang K, Cossburn MD, ym. Long-term ou...»190.
- Aikainen, riittävän tehokkaan lääkehoidon aloitus on tärkeää myös tässä ikäryhmässä
«Sandesjö F, Wassmer E, Deiva K, ym. Current intern...»191.
- Toistaiseksi ainoa virallinen asiantuntijatyöryhmän suositus annettiin vuonna 2012, jolloin suositeltiin glatirameeriasetaatin tai beetainterferonin aloitusta «Chitnis T, Tenembaum S, Banwell B, ym. Consensus s...»192.
- Suurin osa lasten MS-taudin lääkehoidon kokemuksista on saatu avoimista tutkimuksista
«Chitnis T, Tenembaum S, Banwell B, ym. Consensus s...»192.
- Dimetyylifumaraatin avoimessa toisen vaiheen tutkimuksessa (FOCUS, jatkoseuranta CONNECTED) todettiin, että lääke on turvallinen myös lapsilla ja nuorilla (paino yli 30 kg) ja teho vastasi aikuispotilailla todettua tehoa «Alroughani R, Das R, Penner N, ym. Safety and Effi...»193, «Alroughani R, Huppke P, Mazurkiewicz-Beldzinska M,...»194.
- Satunnaistettuja lumekontrolloituja lääketutkimuksiakin on tehty:
- 2018 julkaistussa PARADIGMS-tutkimuksessa todettiin fingolimodin vähentävän vuosittaisten relapsien määrää 82 % beetainterferoniin verrattuna tässä ikäryhmässä «Chitnis T, Arnold DL, Banwell B, ym. Trial of Fing...»195.
- 2021 julkaistussa TERIKIDS-tutkimuksessa teriflunomidi vähensi vuosittaisten relapsien määrää 34 % lumeeseen verrattuna, mutta ero ei ollut tilastollisesti merkitsevä «Chitnis T, Banwell B, Kappos L, ym. Safety and eff...»196.
- Euroopan lääkeviranomaiset ovat hyväksyneet beetainterferonin käytettäväksi 2 vuoden iästä ja glatirameeriasetaatin 12 vuoden iästä alkaen sekä fingolimodin ja teriflunomidin 10 vuoden iästä alkaen.
- Fingolimodin lopettamiseen liittyvä rebound-riski tulee tiedostaa (ks. Rebound «A3»4). Fingolimodia on käytettävä erittäin harkiten tytöillä, joilla voi olla raskaussuunnitelmia, joiden vuoksi lääke on aina lopetettava.
- Viimeistään murrosiässä alaikäiset vertautuvat immuunipuolustusjärjestelmänsä ja painonsa
osalta aikuisiin, jolloin voidaan pääsääntöisesti käyttää MS-lääkkeitä samoin periaattein
kuin aikuisilla. Tätä nuorempien lääkityksessä on käytettävä yksilöllistä harkintaa,
mikäli virallista hyväksyntää ei ole.
- Esimerkiksi natalitsumabista ja rituksimabista on runsaasti havainnoivia tutkimuksia, joissa haittavaikutusprofiilit ja tehokkuus eivät ole eronneet aikuisista «Krysko KM, Graves J, Rensel M, ym. Use of newer di...»197, «Ghezzi A, Banwell B, Bar-Or A, ym. Rituximab in pa...»198, «Kornek B, Aboul-Enein F, Rostasy K, ym. Natalizuma...»199.
MS-tautia sairastavan ammatillinen ja lääkinnällinen kuntoutus
- Suomessa kaikista MS-tautiin liittyvistä yhteiskunnallisista kustannuksista 37 % liittyy työkyvyttömyyseläkkeiden aiheuttamiin tuotannonmenetyksiin «Ruutiainen J, Viita AM, Hahl J, ym. Burden of illn...»200.
- Ruotsissa vuosina 2001–2012 MS-diagnoosin saaneista työkyvyttömyyseläkkeellä oli vuoden kuluttua 12 % ja 11 vuoden kuluttua 55 %. Samanikäisen ja samaa sukupuolta olevan vertailuväestön vastaavat luvut olivat 7 % ja 9 % «Landfeldt E, Castelo-Branco A, Svedbom A, ym. Sick...»201. Suomalaisessa tutkimuksessa ennen vuotta 1995 MS-diagnoosin saaneet siirtyivät työkyvyttömyyseläkkeelle keskimäärin 8,3 vuotta diagnoosista, kun taas vuoden 1995 jälkeen diagnoosin saaneet keskimäärin 11,1 vuoden kuluttua «Heinonen T, Castrén E, Luukkaala T, ym. The retire...»202.
- MS-potilaan selviytymistä työelämässä voidaan edistää kuntoutuksella, lääkehoidolla ja työjärjestelyillä «Heinonen T, Castrén E, Luukkaala T, ym. The retire...»202, «Wickström A, Fagerström M, Wickström L, ym. The im...»203.
- Kuntoutus on osa MS-taudin kokonaisvaltaista hoitoa, jonka tavoitteena on kohentaa työ- ja toimintakykyä «Ruutiainen J, Wikström J, Sivenius J. Etenevät neu...»204, «Amatya B, Khan F, Galea M. Rehabilitation for peop...»205, «Abou L, Qin K, Alluri A, ym. The effectiveness of ...»206, «Binshalan T, Nair KPS, McNeill A. The Effectivenes...»207, «Centonze D, Leocani L, Feys P. Advances in physica...»208.
Ammatillinen kuntoutus
- Ammatillinen kuntoutus tarkoittaa niitä keinoja, joilla kuntoutujaa voidaan tukea työssä.
- MS-potilaan hyvää selviytymistä työelämässä ennustavat aaltomainen taudinkulku, korkea koulutustaso ja fyysisesti kevyt työ «Messmer Uccelli M, Specchia C, Battaglia MA, ym. F...»209.
- Suomalaisessa tutkimuksessa varhaisen eläköitymisen riskitekijöiksi tunnistettiin korkeampi ikä sairauden diagnoosihetkellä ja miessukupuoli. Lisäksi aaltomaista MS-tautia sairastavien varhaisen eläköitymisen riskiä lisää se, että sairastavalla ei ole koskaan ollut käytössä taudinkulkua muuntavaa lääkitystä «Heinonen T, Castrén E, Luukkaala T, ym. The retire...»202.
- Suomalaisessa aineistossa havaittiin, että MS-tautia sairastavat ohjautuvat edelleen harvoin neuropsykologisen tai ammatillisen kuntoutuksen piiriin «Castrén E, Heinonen T, Mäkinen K, ym. The rate of ...»210.
- Työssä käyvien MS-potilaiden työkyvyn arvioinnissa työterveyshuollon ja perus- tai erikoissairaanhoidon tulee tehdä yhteistyötä: hoitava neurologi tai terveyskeskuslääkäri arvioi sairauden ennustetta ja vaikutusta työntekijän toimintakykyyn tarvittaessa moniammatillisesti ja työolot tunteva työterveyslääkäri työntekijän jäljellä olevaa työkykyä suhteessa työn vaatimuksiin «Työterveyshuoltolaki 1383/2001, https://www.finlex...»211.
- Lausunnot viranomaisille MS-tautia sairastavan työkyvystä ja ammatillisesta kuntoutuksesta tehdään työterveyshuollosta silloin kun potilaalla sellainen on ja muissa tapauksissa (mm. työttömät, opiskelijat, vanhempainvapaalla olevat sekä yksityisyrittäjät) perusterveydenhuollosta tai erikoissairaanhoidosta.
- Työterveyshuolto tulee kytkeä MS-tautia sairastavan terveydentilan seurantaan mahdollisimman varhain.
- Työn mukauttaminen tulee ottaa huomioon ajoissa. Hyvin yksinkertaiset asiat, kuten kulkemisen esteettömyys, työtilojen viileys ja WC-tilojen hyvä käytettävyys sekä etätyön mahdollisuus voivat olla ratkaisevia työkyvyn ylläpitämisessä.
- Kuntoutustarpeiden selvittämisessä kannattaa toimia ripeästi ja ottaa huomioon erilaiset ammatillisen kuntoutuksen mahdollisuudet työkyvyn ylläpitämiseksi. Erityisesti työkyvyttömyyden pitkittyessä on tärkeää arvioida työntekijän mahdollisuuksia palata työhön.
- Jos potilaan työkykyä ei työn mukauttamisen ja kuntoutustoimien avulla saada kohennetuksi kokopäivätyön vaatimusten mukaiseksi, lyhennetty työaika osatyökyvyttömyyseläkkeen tai vammaistuen avulla on usein oikea ratkaisu.
Lääkinnällinen kuntoutus
- Lääkinnälliseen kuntoutukseen kuuluvat:
- kuntoutusneuvonta ja -ohjaus
- toiminta- ja työkyvyn sekä kuntoutustarpeen arviointi
- kuntoutustutkimus, jonka avulla selvitetään kuntoutusmahdollisuuksia
- toimintakyvyn parantamiseen ja ylläpitämiseen tähtäävät terapiat ja muut tarvittavat toimenpiteet
- apuvälinepalvelut
- sopeutumisvalmennus
- kuntoutusjaksot laitos- tai avohoidossa.
- Lääkinnällisen kuntoutuksen järjestämisvastuu on hyvinvointialueilla «Terveydenhuoltolaki 30.12.2010/1326, https://www.f...»212, «Valtakunnaliset lääkinnällisen kuntoutuksen ohjaam...»213. Kuntoutuksen tuottajana sen sijaan voivat toimia perusterveydenhuolto, erikoissairaanhoito, yksityinen sektori ja kolmas sektori.
- Kuntoutussuunnitelma laaditaan yhdessä potilaan kanssa ja mahdollisuuksien mukaan moniammatillisessa työryhmässä.
- Kela järjestää lakisääteisesti alle 65-vuotiaan MS-potilaan vaativan lääkinnällisen kuntoutuksen, kun sen yleiset myöntökriteerit täyttyvät, sekä harkinnanvaraista kuntoutusta «Laki Kansaneläkelaitoksen kuntoutusetuuksista ja k...»214.
- MS-potilaan kuntoutusketjuun kuuluvat hyvä ensitieto sairaudesta, riittävä ja oikea-aikainen sopeutumisvalmennus, liikuntaneuvonta sekä yksilöllinen ja moniammatillinen havaittujen tarpeiden mukainen kuntoutus. Kuntoutus voidaan toteuttaa yksilö- tai ryhmäkuntoutuksena kuntoutujan yksilöllisten tarpeiden mukaan.
- Selkeän kuntoutustavoitteen sopiminen ja sen saavuttamisen arviointi yhdessä kuntoutuksesta vastaavan ja kuntoutujan kanssa on keskeistä.
- Kuntoutussuunnitelman tulee perustua sairauden aiheuttamaan toimintakyvyn heikkenemiseen sekä potilaan kuntoutuvuuteen. Kuntoutukselle tulee asettaa arjessa merkitykselliset, potilaan omaa osallistumista ilmentävät tavoitteet. Lääkinnällisen kuntoutuksen tuloksia tulee arvioida säännöllisesti. Vaikuttamattomaksi osoittautuvaa lääkinnällistä kuntoutusta ei tule jatkaa. Pitkälle edenneessä sairaudessa kuntouttavan hoitotyön merkitys korostuu.
- Liikunta ilmeisesti parantaa MS-tautia sairastavan motorista toimintakykyä «Liikunta ilmeisesti parantaa MS-tautia sairastavan motorista toimintakykyä.»B ja vähentää MS-tautiin liittyvää uupumusta «Liikunta ilmeisesti vähentää MS-tautiin liittyvää uupumusta.»B. Liikuntamuotojen välillä ei todennäköisesti ole merkittäviä eroja. Pilates saattaa vähentää MS-tautia sairastavan kokemaa uupumusta ja parantaa fyysistä toimintakykyä ja elämänlaatua yhtä paljon kuin muut liikuntamuodot «Pilates saattaa vähentää MS-tautia sairastavan kokemaa uupumusta ja parantaa fyysistä toimintakykyä ja elämänlaatua yhtä paljon kuin muut liikuntamuodot.»C.
- Robottiavusteinen kävelyharjoittelu lisää kävelykykyä lyhyellä aikavälillä yhtä paljon kuin perinteinen kävelyharjoittelu sellaisilla MS-tautia sairastavilla henkilöillä, joiden toimintakyky on selkeästi heikentynyt «Robottiavusteinen kävelyharjoittelu parantaa kävelykykyä lyhyellä aikavälillä yhtä paljon kuin perinteinen kävelyharjoittelu sellaisilla MS-tautia sairastavilla henkilöillä, joiden toimintakyky on selkeästi heikentynyt.»A.
- Yksilöllinen fysioterapia saattaa kohentaa ja pitää yllä MS-potilaan toimintakykyä, ainakin jos sairaudesta on selkeää toiminnallista haittaa «Sosiaali- ja terveysturvan tutkimuksia 161. Toim. ...»215.
- Lantionpohjan lihasharjoittelu ilmeisesti vähentää MS-tautiin liittyviä virtsaamisoireita, kuten virtsankarkailua ja yliaktiivisen virtsarakon oireita, sekä näiden haittaavuutta harjoittelemattomuuteen verrattuna «Lantionpohjan lihasharjoittelu ilmeisesti vähentää MS-tautiin liittyviä virtsaamisoireita, kuten virtsankarkailua ja yliaktiivisen virtsarakon oireita, sekä näiden haittaavuutta harjoittelemattomuuteen verrattuna.»B.
- Moniammatillinen laitoskuntoutus saattaa parantaa toimintakyvyltään heikentyneen MS-potilaan fyysistä toimintakykyä lyhyellä aikavälillä verrattuna siihen, ettei potilas osallistu mihinkään kuntoutukseen «Moniammatillinen laitoskuntoutus saattaa parantaa toimintakyvyltään heikentyneen MS-potilaan fyysistä toimintakykyä lyhyellä aikavälillä verrattuna siihen, ettei potilas osallistu mihinkään kuntoutukseen.»C.
- Teknologisiin sovelluksiin perustuva etäkuntoutus ilmeisesti parantaa MS-tautia sairastavien henkilöiden fyysistä aktiivisuutta ja motorista toimintakykyä «Teknologisiin sovelluksiin perustuva etäkuntoutus ilmeisesti parantaa MS-tautia sairastavien henkilöiden fyysistä aktiivisuutta ja motorista toimintakykyä.»B.
- Neuropsykologinen kuntoutus saattaa kohentaa kognitiivista suoritusta ja vähentää kognitiivisia oireita MS-taudissa «Neuropsykologinen kuntoutus saattaa kohentaa kognitiivista suoritusta ja vähentää kognitiivisia oireita MS-taudissa.»C. Kuntoutusta voidaan toteuttaa ainakin osittain etämuotoisesti «Lampit A, Heine J, Finke C, ym. Computerized Cogni...»216.
- Toimintaterapia saattaa parantaa yläraajan toimintaa potilailla, joilla on MS-tauti «Toimintaterapia saattaa parantaa yläraajan toimintaa potilailla, joilla on MS-tauti.»C.
- Muiden terapiamuotojen vaikuttavuudesta MS-tautia sairastavan kuntoutuksessa ei ole näyttöä.
MS-taudin omahoito
- Tupakointi on sekä MS-tautiin sairastumisen että taudin etenemisen riskitekijä «Wu J, Olsson T, Hillert J, ym. Influence of oral t...»217. Myös passiivinen tupakointi lisää MS-taudin etenemisen riskiä «Wu J, Olsson T, Hillert J, ym. Influence of oral t...»217. Tupakasta vieroitus on tämän vuoksi keskeinen osa MS-taudin hoitoa. Jos tupakointi lopetetaan, MS-taudin etenemisen riski pienenee ja on samansuuruinen kuin koskaan tupakoimattomilla MS-potilailla «Rodgers J, Friede T, Vonberg FW, ym. The impact of...»218. Tupakoinnin kielteinen vaikutus MS-tautiin ei johdu nikotiinista, joten MS-tautia sairastava voi tarvittaessa käyttää nikotiinivalmisteita tupakasta vieroitukseen «Wu J, Olsson T, Hillert J, ym. Influence of oral t...»217, (ks. Käypä hoito -suositus Tupakka- ja nikotiiniriippuvuuden ehkäisy ja hoito «Tupakka- ja nikotiiniriippuvuuden ehkäisy ja hoito»6), «Tupakka- ja nikotiiniriippuvuuden ehkäisy ja hoito...»219.
- D-vitamiinin vaje on tunnistettu MS-taudin riskitekijäksi «Munger KL, Hongell K, Åivo J, ym. 25-Hydroxyvitami...»220. Havainnoivissa tutkimuksissa pieni seerumin D-vitamiinipitoisuus on ollut yhteydessä suurentuneeseen pahenemisvaiheiden riskiin «Ascherio A, Munger KL, White R, ym. Vitamin D as a...»221. D-vitamiinilisä saattaa vähentää aaltomaisen MS-taudin magneettikuvauksella todettavaa tautiaktiviteettia «D-vitamiinilisä saattaa vähentää aaltomaisen MS-taudin magneettikuvauksella todettavaa tautiaktiviteettia.»C.
- MS-tautiin liittyy suurentunut osteoporoosiin riski, ja D-vitamiinin vaje on yksi osteoporoosin riskitekijä «Åivo J, Kurki S, Sumelahti ML, ym. Risk of osteopo...»222. MS-tautiin sairastuneen D-vitamiinipitoisuus on suositeltavaa määrittää ja hoitaa D-vitamiinin vaje (kalsidioli D-25 alle 50 nmol/l) «Boltjes R, Knippenberg S, Gerlach O, ym. Vitamin D...»223. Osteoporoosia sairastavien kalsidiolin tavoitepitoisuudeksi on asetettu 75–120 nmol/l (ks. Käypä hoito -suositus Osteoporoosi «Osteoporoosi»7), «Osteoporoosi. Käypä hoito -suositus. Suomalaisen L...»224.
- D-vitamiinin suositusannos on 50 µg/vrk. Annos oli suomalaisilla MS-potilailla tehdyn tutkimuksen perusteella turvallinen ja suurensi useimpien potilaiden kalsidiolipitoisuuden suositellulle tasolle «Soilu-Hänninen M, Åivo J, Lindström BM, ym. A rand...»225. Viranomaiset ovat asettaneet turvallisen päiväsaannin rajaksi 100 µg/vrk «Paakkari I. D-vitamiini. www.terveyskirjasto.fi. L...»226.
- Säännöllinen liikunta on omahoidon kulmakivi. Tutkimusnäytön perusteella MS-potilaan tulisi liikkua vähintään yleisten terveyssuositusten mukaisesti eli kolmesti viikossa vähintään 30 minuutin ajan. Suurenkaan liikuntamäärän ei tiedetä pahentavan MS-tautia. Liikunta voi parantaa MS-tautia sairastavan fyysistä toimintakykyä sekä vähentää uupumusta (ks. kohta Lääkinnällinen kuntoutus «A8»9). Liikunnan aikana ruumiin lämpötila voi nousta ja osalla potilaista voi ilmaantua Uthoffin oire, jossa vanhat neurologiset puutosoireet korostuvat väliaikaisesti. Ilmiö on harmiton ja ohittuu, kun ruumiinlämpö laskee. Liikuntamuotojen välillä ei todennäköisesti ole merkittäviä eroja (ks. kohta Lääkinnällinen kuntoutus «A8»9). Oleellista on löytää potilaalle mieluinen liikuntamuoto.
- MS-tauti saattaa vaikuttaa suun terveyteen ja suun terveys MS-tautiin. Tuoreessa katsauksessa MS-tautia sairastavilla on todettu olevan heikentynyt suun hygienia ja sen myötä lisääntynyt hampaiden reikiintymisen ja ientulehduksen riski. Hoitamattomana edelliset lisäävät riskiä sairastua suun tukikudoksen tulehdukseen eli parodontiittiin «Manchery N, Henry JD, Nangle MR. A systematic revi...»227. Suun tulehdukset saattavat altistaa pahenemisvaiheille. MS-tautia sairastavan tulisi huolehtia päivittäisestä hampaiden ja hammasvälien mekaanisesta puhdistamisesta ja säännönmukaisesta hammaskiven poistosta.
- MS-tautiin ei ole olemassa tiettyä ruokavaliohoitoa, eikä ruokavaliolla voida nykyisen tutkimusnäytön perusteella suoraan vaikuttaa taudinkulkuun.
Taloudellista tietoa
- Ks. Aktiivisen aaltomaisen MS-taudin Kelan erityiskorvattavien lääkkeiden vaikuttavuus verrattuna lumelääkkeeseen ja vuosihinta «hoi36070a.pdf»1, lisätietoa «The effectiveness and costs of disease-modifying therapies for relapsing-remitting multiple sclerosis»2 ja opasvideo taulukon lukemisesta «Hoitovasteen kustannukset Käypä hoito -suosituksissa: näin luen taulukoita (video)»8.
- Pääsääntöisesti lääkkeiden valinnassa on syytä käyttää edullisinta valmistetta eikä lääkemääräyksiin ole syytä tehdä vaihtokieltomerkintää.
Suomalaisen Lääkäriseuran Duodecimin ja Suomen Neurologisen Yhdistyksen asettama työryhmä
MS-tauti Käypä hoito -suosituksen historiatiedot «MS-tauti, Käypä hoito -suosituksen historiatiedot»9.
Puheenjohtaja:
Hanna Kuusisto, professori, neurologian erikoislääkäri, ylilääkäri; Tays neurologian klinikka
Kokoava kirjoittaja:
Sini Laakso, LT, neurologian erikoislääkäri, Suomen Akatemian kliininen tutkija; HUS Aivokeskus, neurologian klinikka ja Helsingin yliopisto, translationaalisen immunologian tutkimusohjelma
Jäsenet:
Jutta Aartola, LL, yleislääketieteen erikoislääkäri; Rovaniemen terveyskeskus ja kuntoutussairaala
Sari Atula, dosentti, neurologian erikoislääkäri, ylilääkäri; HUS Aivokeskus, neurologian klinikka ja Suomalainen Lääkäriseura Duodecim
Päivi Hartikainen, dosentti, neurologian erikoislääkäri, osastonylilääkäri; KYS Neurokeskus, neurologian klinikka
Krista Nuotio, LT, neurologian erikoislääkäri, osastonlääkäri, Käypä hoito -toimittaja; HUS Aivokeskus, neurologian klinikka ja Suomalainen Lääkäriseura Duodecim
Mervi Ryytty LT, neurologian erikoislääkäri; OYS neurologian klinikka ja Oulun yliopisto
Jukka Saarinen, dosentti, neurologian erikoislääkäri, ylilääkäri; Vaasan keskussairaala, neurologian klinikka
Merja Soilu-Hänninen, dosentti, neurologian erikoislääkäri, vastuualuejohtaja, ylilääkäri; Tyks Neurokeskus
Asiantuntijat:
Otto Rinne, työterveyshuollon erikoislääkäri; Mehiläinen Oulu
Mia Westerholm-Ormio, LT, lastenneurologian erikoislääkäri, apulaisylilääkäri HYKSin lasten ja nuorten sairaala
Sidonnaisuudet
Sidonnaisuusilmoitukset on kerätty 6.2.2024 julkaistun suosituksen laatimisen yhteydessä.
Jutta Aartola: Sivutoimet: vs. kuntoutusylilääkäri; alueelliset kuntoutuspalvelut, Lapin hyvinvointialue. Koulutus-, konsultointi- ja asiantuntijatoimintaa: Chiesi, advisory board. Luottamustoimet terveydenhuollon alalla: Terveyden ja hyvinvoinnin jaoston jäsen, Rovaniemen kaupunki 2020–2021. Muut sidonnaisuudet: Orion Oy, osakkeenomistaja.
Sari Atula: Sivutoimet: Kustannus Oy Duodecim, tuntityöt; TELK, varajäsen; liikenne- ja potilasvahinkolautakunta, varajäsen. Tutkimusrahoitus: MS-säätiö, klinikkarahoitus. Koulutus-, konsultointi ja asiantuntijatoimintaa: Luennot: Novartis, Merck, Biogen, UCB Pharma. Asiantuntijatyöt: Biogen, UCB Pharma, Roche, Sanofi, Merck, Alexion, Dianthus. Korvaukset kongressi- ja seminaarikuluista: Merck. Ohjaushankkeet: Suomalaisen MS-laaturekisterin ohjausryhmän jäsen.
Päivi Hartikainen: Sivutoimet: yksityisvastaanotto, neurologia; Mehiläinen. Koulutus-, konsultointi- ja asiantuntijatoimintaa: Biogen, BMS, Merck, Novartis, Roche, Sanofi. Luottamustoimet terveydenhuollon alalla: Duodecim, Käypä hoito -työryhmä MS-tauti. Ohjaushankkeet: MS-taudin laaturekisteri,liikehäiriötautien ja ALS:n laaturekisterien kehittäminen.
Hanna Kuusisto: Sivutoimet: asiakas- ja potilasturvallisuuden professori; Itä-Suomen yliopisto, tutkija; Oma-Häme. Tutkimusrahoitus: Suomen Akatemia Strategisen tutkimuksen neuvosto, Proshade-hanke, Valtion tutkimusrahoitus Pirha. Koulutus-, konsultointi- ja asiantuntijatoimintaa: Merck, Sanofi-Genzyme, Roche, Teva, Celgene, Jansen Cilag, Biogen, Sandoz. Korvaukset kongressi- ja seminaarikuluista: Merck. Luottamustoimet terveydenhuollon alalla: Terveyskylä, Aivotalon koordinaatioryhmän jäsen; TerveyskyläPRO, neurologian- ja neurokirurgian virtuaalikeskuksen kansallisen työryhmän jäsen; Duodecim, MS-tauti Käypä hoito -työryhmän puheenjohtaja. Ohjaushankkeet: Terveyskylän Aivotalon MS-talon ohjausryhmän jäsen, MS-laaturekisterin ohjausryhmän jäsen, Myastenia Gravis -laaturekisterin ohjausryhmän jäsen. Muut sidonnaisuudet: osallistunut kliinisiin lääketutkimuksiin, Sanofi.
Sini Laakso: Sivutoimet: itsenäinen ammatinharjoittaja; Aava Kamppi, yliopistotutkija; Helsingin yliopisto. Tutkimusrahoitus: Suomen Akatemia (kliininen tutkija), Finska Läkaresällskapet, MS-säätiö, Valtion tutkimusrahoitus (HUS). Koulutus-, konsultointi- ja asiantuntijatoimintaa: Koulutustoiminta: Argenx, Biogen, Janssen, Merck, Novartis, Roche. Asiantuntijatoiminta: Argenx, Novartis, Roche, Sanofi, UCB Pharma. Korvaukset kongressi- ja seminaarikuluista: Meck, Novartis. Luottamustoimet terveydenhuollon alalla: Duodecim, MS-tauti Käypä hoito -työryhmän kokoava kirjoittaja. Ohjaushankkeet: MS-taudin kansallisen laaturekisterin ohjausryhmä, Myasthenia graviksen kansallisen laaturekisterin ohjausryhmä. Muut sidonnaisuudet: investigator kliinisessä seurantatutkimuksessa Clarion (Merck); subinvestigator kliinisessä lääketutkimuksessa Fenhance (Roche).
Krista Nuotio: Sivutoimet: Osastonlääkäri HUS neurologia, Peijaksen sairaala. Yksityisvastaanotto Terveystalolla (Kamppi ja Leppävaara). Luottamustoimet terveydenhuollon alalla: Helsingin lääkäripäivien ohjelmatyöryhmän jäsen.
Mervi Ryytty: Sivutoimet: neurologian erikoislääkäri; Oulun yliopistollinen sairaala, neurologian klinikka. Tutkimusrahoitus: Sitra. Koulutus-, konsultointi- ja asiantuntijatoimintaa: Merck, Biogen, Novartis, Sanofi, Roche. Korvaukset kongressi- ja seminaarikuluista: Roche, Novartis. Luottamustoimet terveydenhuollon alalla: Duodecim MS-tauti Käypä hoito -työryhmän jäsen, suomalaisen MS-laaturekisterin ohjausryhmän jäsen, Terveyskylä (MS-aivotalo), Ectrims Council -jäsen, ammatillinen jatkokoulutustoimikunta (vpj, OY), valtakunnallinen ammatillinen jatkokoulutustoimikunta, alueellinen neuvottelukunta (OY, OYS-erva), STM:n koordinaatiojaosto.
Jukka Saarinen: Tutkimusrahoitus: Bayer, Sanofi. Koulutus-, konsultointi- ja asiantuntijatoimintaa: Actelion, Bayer, Biogen-Idec, Bristol Myers Squibb, Merck, Novartis, Roche, Sanofi, Roche, Teva. Korvaukset kongressi- ja seminaarikuluista: Bayer, Biogen-Idec, Sanofi-Genzyme, Merck, Novartis, Roche, Sanofi, Takeda, Teva. Luottamustoimet terveydenhuollon alalla: Suomen neurologinen yhdistys; Duodecim, MS-tauti Käypä hoito -työryhmän jäsen.
Merja Soilu-Hänninen: Tutkimusrahoitus: Biogen Idec. Koulutus-, konsultointi- ja asiantuntijatoimintaa: Biogen, Cellgene, Merck, Novartis, Roche, Sanofi-Genzyme, Teva, Sandoz. Korvaukset kongressi- ja seminaarikuluista: Biogen, Cellgene, Merck, Novartis, Roche, Sanofi-Genzyme, Teva. Luottamustoimet terveydenhuollon alalla: Suomen Neurologinen Yhdistys; Duodecim, MS-tauti Käypä hoito -työryhmän jäsen. Ohjaushankkeet: Suomen MS-rekisterin kansallinen ohjausryhmä. Muut sidonnaisuudet: Sanofi-Genzyme, Merck, Turun Lääkärikolmio.
Kirjallisuusviite
MS-tauti. Käypä hoito -suositus. Suomalaisen Lääkäriseuran Duodecimin ja Suomen Neurologinen Yhdistys ry:n asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim, 2024 (viitattu pp.kk.vvvv). Saatavilla internetissä: www.kaypahoito.fi
Tarkemmat viittausohjeet: «http://www.kaypahoito.fi/web/kh/viittaaminen»5
Vastuun rajaus
Käypä hoito -suositukset ja Vältä viisaasti -suositukset ovat asiantuntijoiden laatimia yhteenvetoja yksittäisten sairauksien diagnostiikan ja hoidon vaikuttavuudesta. Suositukset toimivat lääkärin tai muun terveydenhuollon ammattilaisen päätöksenteon tukena hoitopäätöksiä tehtäessä. Ne eivät korvaa lääkärin tai muun terveydenhuollon ammattilaisen omaa arviota yksittäisen potilaan parhaasta mahdollisesta diagnostiikasta, hoidosta ja kuntoutuksesta hoitopäätöksiä tehtäessä.
Tiedonhakukäytäntö
Systemaattinen kirjallisuushaku on hoitosuosituksen perusta. Lue lisää artikkelista khk00007
Kirjallisuutta
- Ruutiainen J, Tienari P. MS-tauti ja muut demyelinaatiosairaudet. Kirjassa: Neurologia, toimittaneet Soinila S, Kaste M, Somer H. Duodecim 2006;379-94
- Thompson AJ, Banwell BL, Barkhof F, ym. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol 2018;17(2):162-173 «PMID: 29275977»PubMed
- Ziemssen T, Bhan V, Chataway J, ym. Secondary Progressive Multiple Sclerosis: A Review of Clinical Characteristics, Definition, Prognostic Tools, and Disease-Modifying Therapies. Neurol Neuroimmunol Neuroinflamm 2023;10(1): «PMID: 36414428»PubMed
- Miller DH, Leary SM. Primary-progressive multiple sclerosis. Lancet Neurol 2007;6(10):903-12 «PMID: 17884680»PubMed
- Wattjes MP, Ciccarelli O, Reich DS, ym. 2021 MAGNIMS-CMSC-NAIMS consensus recommendations on the use of MRI in patients with multiple sclerosis. Lancet Neurol 2021;20(8):653-670 «PMID: 34139157»PubMed
- Abdelhak A, Hottenrott T, Mayer C, ym. CSF profile in primary progressive multiple sclerosis: Re-exploring the basics. PLoS One 2017;12(8):e0182647 «PMID: 28797088»PubMed
- Rovira À, Wattjes MP, Tintoré M, ym. Evidence-based guidelines: MAGNIMS consensus guidelines on the use of MRI in multiple sclerosis-clinical implementation in the diagnostic process. Nat Rev Neurol 2015;11(8):471-82 «PMID: 26149978»PubMed
- Filippi M, Preziosa P, Arnold DL, ym. Present and future of the diagnostic work-up of multiple sclerosis: the imaging perspective. J Neurol 2023;270(3):1286-1299 «PMID: 36427168»PubMed
- Sati P, Oh J, Constable RT, ym. The central vein sign and its clinical evaluation for the diagnosis of multiple sclerosis: a consensus statement from the North American Imaging in Multiple Sclerosis Cooperative. Nat Rev Neurol 2016;12(12):714-722 «PMID: 27834394»PubMed
- Castellaro M, Tamanti A, Pisani AI, ym. The Use of the Central Vein Sign in the Diagnosis of Multiple Sclerosis: A Systematic Review and Meta-analysis. Diagnostics (Basel) 2020;10(12): «PMID: 33260401»PubMed
- Harrison DM, Oh J, Roy S, ym. Thalamic lesions in multiple sclerosis by 7T MRI: Clinical implications and relationship to cortical pathology. Mult Scler 2015;21(9):1139-50 «PMID: 25583851»PubMed
- Polman CH, Reingold SC, Banwell B, ym. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann Neurol 2011;69(2):292-302 «PMID: 21387374»PubMed
- Boscá I, Magraner MJ, Coret F, ym. The risk of relapse after a clinically isolated syndrome is related to the pattern of oligoclonal bands. J Neuroimmunol 2010;226(1-2):143-6 «PMID: 20538349»PubMed
- Bernitsas E, Khan O, Razmjou S, ym. Cerebrospinal fluid humoral immunity in the differential diagnosis of multiple sclerosis. PLoS One 2017;12(7):e0181431 «PMID: 28727770»PubMed
- Cole SR, Beck RW, Moke PS, ym. The predictive value of CSF oligoclonal banding for MS 5 years after optic neuritis. Optic Neuritis Study Group. Neurology 1998;51(3):885-7 «PMID: 9748050»PubMed
- Imrell K, Landtblom AM, Hillert J, ym. Multiple sclerosis with and without CSF bands: clinically indistinguishable but immunogenetically distinct. Neurology 2006;67(6):1062-4 «PMID: 17000979»PubMed
- McLean BN, Luxton RW, Thompson EJ. A study of immunoglobulin G in the cerebrospinal fluid of 1007 patients with suspected neurological disease using isoelectric focusing and the Log IgG-Index. A comparison and diagnostic applications. Brain 1990;113 ( Pt 5)():1269-89 «PMID: 2245296»PubMed
- Link H, Kostulas V. Utility of isoelectric focusing of cerebrospinal fluid and serum on agarose evaluated for neurological patients. Clin Chem 1983;29(5):810-5 «PMID: 6839458»PubMed
- Giles PD, Heath JP, Wroe SJ. Oligoclonal bands and the IgG index in multiple sclerosis: uses and limitations. Ann Clin Biochem 1989;26 ( Pt 4)():1317-23 «PMID: 2764482»PubMed
- Sola P, Mandrioli J, Simone AM, ym. Primary progressive versus relapsing-onset multiple sclerosis: presence and prognostic value of cerebrospinal fluid oligoclonal IgM. Mult Scler 2011;17(3):303-11 «PMID: 21078694»PubMed
- Lublin FD, Reingold SC, Cohen JA, ym. Defining the clinical course of multiple sclerosis: the 2013 revisions. Neurology 2014;83(3):278-86 «PMID: 24871874»PubMed
- Solomon AJ, Pettigrew R, Naismith RT, ym. Challenges in multiple sclerosis diagnosis: Misunderstanding and misapplication of the McDonald criteria. Mult Scler 2021;27(2):250-258 «PMID: 32162581»PubMed
- Thompson AJ, Baranzini SE, Geurts J, ym. Multiple sclerosis. Lancet 2018;391(10130):1622-1636 «PMID: 29576504»PubMed
- Banwell B, Bennett JL, Marignier R, ym. Diagnosis of myelin oligodendrocyte glycoprotein antibody-associated disease: International MOGAD Panel proposed criteria. Lancet Neurol 2023;22(3):268-282 «PMID: 36706773»PubMed
- Maunula A, Martola J, Atula S, ym. Incidental demyelination in magnetic resonance imaging and 10-year risk of multiple sclerosis: A data lake cohort study. Eur J Neurol 2023;30(8):2376-2384 «PMID: 37158298»PubMed
- Wiendl H, Gold R, Berger T, ym. Multiple Sclerosis Therapy Consensus Group (MSTCG): position statement on disease-modifying therapies for multiple sclerosis (white paper). Ther Adv Neurol Disord 2021;14():17562864211039648 «PMID: 34422112»PubMed
- Medicinrådets behandlingsvejledning vedrørende lægemidler til attakvis multipel sklerose. Medicinrådet. 2022. PDF-dokumentti. viitattu 9.12.2022. https://medicinraadet.dk/media/ezamqbey/medicinr%C3%A5dets-behandlingsvejledning-vedr%C3%B8rende-l%C3%A6gemidler-til-attakvis-multipel-sklerose-version-2-0-adlegacy.pdf «https://medicinraadet.dk/media/ezamqbey/medicinr%C3%A5dets-behandlingsvejledning-vedr%C3%B8rende-l%C3%A6gemidler-til-attakvis-multipel-sklerose-version-2-0-adlegacy.pdf»6
- Minneboo A, Barkhof F, Polman CH, ym. Infratentorial lesions predict long-term disability in patients with initial findings suggestive of multiple sclerosis. Arch Neurol 2004;61(2):217-21 «PMID: 14967769»PubMed
- Tintore M, Rovira A, Arrambide G, ym. Brainstem lesions in clinically isolated syndromes. Neurology 2010;75(21):1933-8 «PMID: 21098409»PubMed
- Cordonnier C, de Seze J, Breteau G, ym. Prospective study of patients presenting with acute partial transverse myelopathy. J Neurol 2003;250(12):1447-52 «PMID: 14673577»PubMed
- Kurtzke JF. Rating neurologic impairment in multiple sclerosis: an expanded disability status scale (EDSS). Neurology 1983;33(11):1444-52 «PMID: 6685237»PubMed
- Laakso SM, Viitala M, Kuusisto H, ym. Multiple sclerosis in Finland 2018-Data from the national register. Acta Neurol Scand 2019;140(5):303-311 «PMID: 31271648»PubMed
- Filippi M, Amato MP, Centonze D, ym. Early use of high-efficacy disease‑modifying therapies makes the difference in people with multiple sclerosis: an expert opinion. J Neurol 2022;269(10):5382-5394 «PMID: 35608658»PubMed
- Stankiewicz JM, Weiner HL. An argument for broad use of high efficacy treatments in early multiple sclerosis. Neurol Neuroimmunol Neuroinflamm 2020;7(1): «PMID: 31757815»PubMed
- Scalfari A, Neuhaus A, Daumer M, ym. Onset of secondary progressive phase and long-term evolution of multiple sclerosis. J Neurol Neurosurg Psychiatry 2014;85(1):67-75 «PMID: 23486991»PubMed
- Chalmer TA, Baggesen LM, Nørgaard M, ym. Early versus later treatment start in multiple sclerosis: a register-based cohort study. Eur J Neurol 2018;25(10):1262-e110 «PMID: 29847005»PubMed
- Weideman AM, Tapia-Maltos MA, Johnson K, ym. Meta-analysis of the Age-Dependent Efficacy of Multiple Sclerosis Treatments. Front Neurol 2017;8():577 «PMID: 29176956»PubMed
- Hauser SL, Bar-Or A, Comi G, ym. Ocrelizumab versus Interferon Beta-1a in Relapsing Multiple Sclerosis. N Engl J Med 2017;376(3):221-234 «PMID: 28002679»PubMed
- Hauser SL, Bar-Or A, Cohen JA, ym. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med 2020;383(6):546-557 «PMID: 32757523»PubMed
- Svenningsson A, Frisell T, Burman J, ym. Safety and efficacy of rituximab versus dimethyl fumarate in patients with relapsing-remitting multiple sclerosis or clinically isolated syndrome in Sweden: a rater-blinded, phase 3, randomised controlled trial. Lancet Neurol 2022;21(8):693-703 «PMID: 35841908»PubMed
- Starvaggi Cucuzza C, Longinetti E, Ruffin N, ym. Sustained Low Relapse Rate With Highly Variable B-Cell Repopulation Dynamics With Extended Rituximab Dosing Intervals in Multiple Sclerosis. Neurol Neuroimmunol Neuroinflamm 2023;10(1): «PMID: 36411076»PubMed
- Vollmer BL, Wallach AI, Corboy JR, ym. Serious safety events in rituximab-treated multiple sclerosis and related disorders. Ann Clin Transl Neurol 2020;7(9):1477-1487 «PMID: 32767531»PubMed
- Fox RJ, Miller DH, Phillips JT, ym. Placebo-controlled phase 3 study of oral BG-12 or glatiramer in multiple sclerosis. N Engl J Med 2012;367(12):1087-97 «PMID: 22992072»PubMed
- Kappos L, Gold R, Miller DH, ym. Efficacy and safety of oral fumarate in patients with relapsing-remitting multiple sclerosis: a multicentre, randomised, double-blind, placebo-controlled phase IIb study. Lancet 2008;372(9648):1463-72 «PMID: 18970976»PubMed
- Gold R, Kappos L, Arnold DL, ym. Placebo-controlled phase 3 study of oral BG-12 for relapsing multiple sclerosis. N Engl J Med 2012;367(12):1098-107 «PMID: 22992073»PubMed
- Gold R, Arnold DL, Bar-Or A, ym. Long-term effects of delayed-release dimethyl fumarate in multiple sclerosis: Interim analysis of ENDORSE, a randomized extension study. Mult Scler 2017;23(2):253-265 «PMID: 27207449»PubMed
- Naismith RT, Wundes A, Ziemssen T, ym. Diroximel Fumarate Demonstrates an Improved Gastrointestinal Tolerability Profile Compared with Dimethyl Fumarate in Patients with Relapsing-Remitting Multiple Sclerosis: Results from the Randomized, Double-Blind, Phase III EVOLVE-MS-2 Study. CNS Drugs 2020;34(2):185-196 «PMID: 31953790»PubMed
- Butzkueven H, Kappos L, Wiendl H, ym. Long-term safety and effectiveness of natalizumab treatment in clinical practice: 10 years of real-world data from the Tysabri Observational Program (TOP). J Neurol Neurosurg Psychiatry 2020;91(6):660-668 «PMID: 32234967»PubMed
- Bigaut K, Fabacher T, Kremer L, ym. Long-term effect of natalizumab in patients with RRMS: TYSTEN cohort. Mult Scler 2021;27(5):729-741 «PMID: 32643521»PubMed
- Prosperini L, Kinkel RP, Miravalle AA, ym. Post-natalizumab disease reactivation in multiple sclerosis: systematic review and meta-analysis. Ther Adv Neurol Disord 2019;12():1756286419837809 «PMID: 30956686»PubMed
- Joly M, Conte C, Cazanave C, ym. Progressive multifocal leukoencephalopathy: epidemiology and spectrum of predisposing conditions. Brain 2023;146(1):349-358 «PMID: 35779271»PubMed
- Ho PR, Koendgen H, Campbell N, ym. Risk of natalizumab-associated progressive multifocal leukoencephalopathy in patients with multiple sclerosis: a retrospective analysis of data from four clinical studies. Lancet Neurol 2017;16(11):925-933 «PMID: 28969984»PubMed
- Ryerson LZ, Foley J, Chang I, ym. Risk of natalizumab-associated PML in patients with MS is reduced with extended interval dosing. Neurology 2019;93(15):e1452-e1462 «PMID: 31515290»PubMed
- Plavina T, Subramanyam M, Bloomgren G, ym. Anti-JC virus antibody levels in serum or plasma further define risk of natalizumab-associated progressive multifocal leukoencephalopathy. Ann Neurol 2014;76(6):802-12 «PMID: 25273271»PubMed
- Rigau V, Mania A, Béfort P, ym. Lethal multiple sclerosis relapse after natalizumab withdrawal. Neurology 2012;79(22):2214-6 «PMID: 23100404»PubMed
- Clerico M, Artusi CA, Liberto AD, ym. Natalizumab in Multiple Sclerosis: Long-Term Management. Int J Mol Sci 2017;18(5): «PMID: 28468254»PubMed
- Polman CH, O'Connor PW, Havrdova E, ym. A randomized, placebo-controlled trial of natalizumab for relapsing multiple sclerosis. N Engl J Med 2006;354(9):899-910 «PMID: 16510744»PubMed
- O'Connor P, Goodman A, Kappos L, ym. Long-term safety and effectiveness of natalizumab redosing and treatment in the STRATA MS Study. Neurology 2014;83(1):78-86 «PMID: 24898925»PubMed
- Calabresi PA, Giovannoni G, Confavreux C, ym. The incidence and significance of anti-natalizumab antibodies: results from AFFIRM and SENTINEL. Neurology 2007;69(14):1391-403 «PMID: 17761550»PubMed
- de Stefano N, Barkhof F, Montalban X, ym. Early Reduction of MRI Activity During 6 Months of Treatment With Cladribine Tablets for Highly Active Relapsing Multiple Sclerosis: MAGNIFY-MS. Neurol Neuroimmunol Neuroinflamm 2022;9(4): «PMID: 35701185»PubMed
- Centonze D, Amato MP, Brescia Morra V, ym. Multiple sclerosis patients treated with cladribine tablets: expert opinion on practical management after year 4. Ther Adv Neurol Disord 2023;16():17562864231183221 «PMID: 37434878»PubMed
- Nabizadeh F, Mohamadi M, Rahmani S, ym. Safety and efficacy of cladribine in multiple sclerosis: a systematic review and meta-analysis. Neurol Sci 2023;44(9):3045-3057 «PMID: 37062787»PubMed
- Giovannoni G, Soelberg Sorensen P, Cook S, ym. Safety and efficacy of cladribine tablets in patients with relapsing-remitting multiple sclerosis: Results from the randomized extension trial of the CLARITY study. Mult Scler 2018;24(12):1594-1604 «PMID: 28870107»PubMed
- Giovannoni G, Comi G, Cook S, ym. A placebo-controlled trial of oral cladribine for relapsing multiple sclerosis. N Engl J Med 2010;362(5):416-26 «PMID: 20089960»PubMed
- Rauma I, Viitala M, Kuusisto H, ym. Finnish multiple sclerosis patients treated with cladribine tablets: a nationwide registry study. Mult Scler Relat Disord 2022;61():103755 «PMID: 35483129»PubMed
- Calabresi PA, Kieseier BC, Arnold DL, ym. Pegylated interferon β-1a for relapsing-remitting multiple sclerosis (ADVANCE): a randomised, phase 3, double-blind study. Lancet Neurol 2014;13(7):657-65 «PMID: 24794721»PubMed
- Coyle PK, Shang S, Xiao Z, ym. Matching-adjusted comparisons demonstrate better clinical outcomes with SC peginterferon beta-1a every two weeks than with SC interferon beta-1a three times per week. Mult Scler Relat Disord 2018;22():134-138 «PMID: 29679749»PubMed
- Drago F, Brusati C, Mancardi G, ym. Localized lipoatrophy after glatiramer acetate injection in patients with remitting-relapsing multiple sclerosis. Arch Dermatol 1999;135(10):1277-8 «PMID: 10522686»PubMed
- O'Connor P, Wolinsky JS, Confavreux C, ym. Randomized trial of oral teriflunomide for relapsing multiple sclerosis. N Engl J Med 2011;365(14):1293-303 «PMID: 21991951»PubMed
- Confavreux C, O'Connor P, Comi G, ym. Oral teriflunomide for patients with relapsing multiple sclerosis (TOWER): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Neurol 2014;13(3):247-56 «PMID: 24461574»PubMed
- Vermersch P, Czlonkowska A, Grimaldi LM, ym. Teriflunomide versus subcutaneous interferon beta-1a in patients with relapsing multiple sclerosis: a randomised, controlled phase 3 trial. Mult Scler 2014;20(6):705-16 «PMID: 24126064»PubMed
- Freedman MS, Wolinsky JS, Wamil B, ym. Teriflunomide added to interferon-β in relapsing multiple sclerosis: a randomized phase II trial. Neurology 2012;78(23):1877-85 «PMID: 22622860»PubMed
- NCT01252355. Efficacy and Safety of Teriflunomide in Patients with Relapsing Multiple Sclerosis and Treated with Interferon-beta (TERACLES). www.clinicaltrials.gov/ct2/show/results/NCT01252355 (assessed 12 January 2016) «http://www.clinicaltrials.gov/ct2/show/results/NCT01252355»7
- Freedman MS, Wolinsky JS, Truffinet P, ym. A randomized trial of teriflunomide added to glatiramer acetate in relapsing multiple sclerosis. Mult Scler J Exp Transl Clin 2015;1():2055217315618687 «PMID: 28607708»PubMed
- Kappos L, Fox RJ, Burcklen M, ym. Ponesimod Compared With Teriflunomide in Patients With Relapsing Multiple Sclerosis in the Active-Comparator Phase 3 OPTIMUM Study: A Randomized Clinical Trial. JAMA Neurol 2021;78(5):558-567 «PMID: 33779698»PubMed
- Miller AE, Olsson TP, Wolinsky JS, ym. Long-term safety and efficacy of teriflunomide in patients with relapsing multiple sclerosis: Results from the TOWER extension study. Mult Scler Relat Disord 2020;46():102438 «PMID: 32911306»PubMed
- Cohen JA, Barkhof F, Comi G, ym. Oral fingolimod or intramuscular interferon for relapsing multiple sclerosis. N Engl J Med 2010;362(5):402-15 «PMID: 20089954»PubMed
- CAMMS223 Trial Investigators, Coles AJ, Compston DA, ym. Alemtuzumab vs. interferon beta-1a in early multiple sclerosis. N Engl J Med 2008;359(17):1786-801 «PMID: 18946064»PubMed
- Cohen JA, Coles AJ, Arnold DL, ym. Alemtuzumab versus interferon beta 1a as first-line treatment for patients with relapsing-remitting multiple sclerosis: a randomised controlled phase 3 trial. Lancet 2012;380(9856):1819-28 «PMID: 23122652»PubMed
- Coles AJ, Twyman CL, Arnold DL, ym. Alemtuzumab for patients with relapsing multiple sclerosis after disease-modifying therapy: a randomised controlled phase 3 trial. Lancet 2012;380(9856):1829-39 «PMID: 23122650»PubMed
- Holmøy T, von der Lippe H, Leegaard TM. Listeria monocytogenes infection associated with alemtuzumab - - a case for better preventive strategies. BMC Neurol 2017;17(1):65 «PMID: 28376817»PubMed
- Pariani N, Willis M, Muller I, ym. Alemtuzumab-Induced Thyroid Dysfunction Exhibits Distinctive Clinical and Immunological Features. J Clin Endocrinol Metab 2018;103(8):3010-3018 «PMID: 29878256»PubMed
- Croteau D, Flowers C, Kulick CG, ym. Acute acalculous cholecystitis: A new safety risk for patients with MS treated with alemtuzumab. Neurology 2018;90(18):e1548-e1552 «PMID: 29602912»PubMed
- Saarela M, Senthil K, Jones J, ym. Hemophagocytic lymphohistiocytosis in 2 patients with multiple sclerosis treated with alemtuzumab. Neurology 2018;90(18):849-851 «PMID: 29602914»PubMed
- Hartung HP, Gonsette R, König N, ym. Mitoxantrone in progressive multiple sclerosis: a placebo-controlled, double-blind, randomised, multicentre trial. Lancet 2002;360(9350):2018-25 «PMID: 12504397»PubMed
- Millefiorini E, Gasperini C, Pozzilli C, ym. Randomized placebo-controlled trial of mitoxantrone in relapsing-remitting multiple sclerosis: 24-month clinical and MRI outcome. J Neurol 1997;244(3):153-9 «PMID: 9050955»PubMed
- van de Wyngaert FA, Beguin C, D'Hooghe MB, ym. A double-blind clinical trial of mitoxantrone versus methylprednisolone in relapsing, secondary progressive multiple sclerosis. Acta Neurol Belg 2001;101(4):210-6 «PMID: 11851027»PubMed
- Ellis R, Brown S, Boggild M. Therapy-related acute leukaemia with mitoxantrone: four years on, what is the risk and can it be limited? Mult Scler 2015;21(5):642-5 «PMID: 25013152»PubMed
- Kalincik T, Sharmin S, Roos I, ym. Comparative Effectiveness of Autologous Hematopoietic Stem Cell Transplant vs Fingolimod, Natalizumab, and Ocrelizumab in Highly Active Relapsing-Remitting Multiple Sclerosis. JAMA Neurol 2023;80(7):702-713 «PMID: 37437240»PubMed
- Sharrack B, Saccardi R, Alexander T, ym. Autologous haematopoietic stem cell transplantation and other cellular therapy in multiple sclerosis and immune-mediated neurological diseases: updated guidelines and recommendations from the EBMT Autoimmune Diseases Working Party (ADWP) and the Joint Accreditation Committee of EBMT and ISCT (JACIE). Bone Marrow Transplant 2020;55(2):283-306 «PMID: 31558790»PubMed
- Boffa G, Signori A, Massacesi L, ym. Hematopoietic Stem Cell Transplantation in People With Active Secondary Progressive Multiple Sclerosis. Neurology 2023;100(11):e1109-e1122 «PMID: 36543569»PubMed
- Zhukovsky C, Sandgren S, Silfverberg T, ym. Autologous haematopoietic stem cell transplantation compared with alemtuzumab for relapsing-remitting multiple sclerosis: an observational study. J Neurol Neurosurg Psychiatry 2021;92(2):189-194 «PMID: 33106366»PubMed
- Alping P, Burman J, Lycke J, ym. Safety of Alemtuzumab and Autologous Hematopoietic Stem Cell Transplantation Compared to Noninduction Therapies for Multiple Sclerosis. Neurology 2021;96(11):e1574-e1584 «PMID: 33514645»PubMed
- Nabizadeh F, Pirahesh K, Rafiei N, ym. Autologous Hematopoietic Stem-Cell Transplantation in Multiple Sclerosis: A Systematic Review and Meta-Analysis. Neurol Ther 2022;11(4):1553-1569 «PMID: 35902484»PubMed
- European Medicines Agency. Gadolinium-containing contrast agents. https://www.ema.europa.eu/en/medicines/human/referrals/ gadolinium-containing-contrast-agents (accessed June 19, 2019; Magnims 2021) «https://www.ema.europa.eu/en/medicines/human/referrals/ gadolinium-containing-contrast-agents»8
- Filippi M, Preziosa P, Langdon D, ym. Identifying Progression in Multiple Sclerosis: New Perspectives. Ann Neurol 2020;88(3):438-452 «PMID: 32506714»PubMed
- Bigaut K, Cohen M, Durand-Dubief F, ym. How to switch disease-modifying treatments in multiple sclerosis: Guidelines from the French Multiple Sclerosis Society (SFSEP). Mult Scler Relat Disord 2021;53():103076 «PMID: 34161898»PubMed
- Sorensen PS, Koch-Henriksen N, Petersen T, ym. Recurrence or rebound of clinical relapses after discontinuation of natalizumab therapy in highly active MS patients. J Neurol 2014;261(6):1170-7 «PMID: 24728334»PubMed
- Lo Re M, Capobianco M, Ragonese P, ym. Natalizumab Discontinuation and Treatment Strategies in Patients with Multiple Sclerosis (MS): A Retrospective Study from Two Italian MS Centers. Neurol Ther 2015;4(2):147-57 «PMID: 26647006»PubMed
- Mustonen T, Rauma I, Hartikainen P, ym. Corrigendum to "Risk factors for reactivation of clinical disease activity in multiple sclerosis after natalizumab cessation" [Multiple Sclerosis and Related Disorders 38 (2020) 101498]. Mult Scler Relat Disord 2020;41():102107 «PMID: 32571611»PubMed
- Ladeira F, Braz L, Salgado P, ym. A multicenter, non-interventional study to evaluate the disease activity in Multiple Sclerosis after withdrawal of Natalizumab in Portugal. Clin Neurol Neurosurg 2019;184():105390 «PMID: 31306895»PubMed
- Fuentes-Rumí L, Hernández-Clares R, Carreón-Guarnizo E, ym. Prevention of rebound effect after natalizumab withdrawal in multiple sclerosis. Study of two high-dose methylprednisolone schedules. Mult Scler Relat Disord 2020;44():102311 «PMID: 32593958»PubMed
- González-Suarez I, Rodríguez de Antonio L, Orviz A, ym. Catastrophic outcome of patients with a rebound after Natalizumab treatment discontinuation. Brain Behav 2017;7(4):e00671 «PMID: 28413713»PubMed
- Hua LH, Harris H, Conway D, ym. Disease activity outcomes with different washout periods after switching from natalizumab to an alternative disease-modifying therapy. J Neurol 2020;267(8):2214-2220 «PMID: 32270292»PubMed
- Roos I, Malpas C, Leray E, ym. Disease Reactivation After Cessation of Disease-Modifying Therapy in Patients With Relapsing-Remitting Multiple Sclerosis. Neurology 2022;99(17):e1926-e1944 «PMID: 35977837»PubMed
- Hatcher SE, Waubant E, Nourbakhsh B, ym. Rebound Syndrome in Patients With Multiple Sclerosis After Cessation of Fingolimod Treatment. JAMA Neurol 2016;73(7):790-4 «PMID: 27135594»PubMed
- Evangelopoulos ME, Miclea A, Schrewe L, ym. Frequency and clinical characteristics of Multiple Sclerosis rebounds after withdrawal of Fingolimod. CNS Neurosci Ther 2018;24(10):984-986 «PMID: 29898493»PubMed
- Frau J, Sormani MP, Signori A, ym. Clinical activity after fingolimod cessation: disease reactivation or rebound? Eur J Neurol 2018;25(10):1270-1275 «PMID: 29851435»PubMed
- Uygunoglu U, Tutuncu M, Altintas A, ym. Factors Predictive of Severe Multiple Sclerosis Disease Reactivation After Fingolimod Cessation. Neurologist 2018;23(1):12-16 «PMID: 29266038»PubMed
- Fragoso YD, Adoni T, Gomes S, ym. Severe Exacerbation of Multiple Sclerosis Following Withdrawal of Fingolimod. Clin Drug Investig 2019;39(9):909-913 «PMID: 31152369»PubMed
- Goncuoglu C, Tuncer A, Bayraktar-Ekincioglu A, ym. Factors associated with fingolimod rebound: A single center real-life experience. Mult Scler Relat Disord 2021;56():103278 «PMID: 34655957»PubMed
- Framke E, Pontieri L, Bramow S, ym. Rebound of clinical disease activity after fingolimod discontinuation? A nationwide cohort study of patients in Denmark. J Neurol Neurosurg Psychiatry 2022;(): «PMID: 36171103»PubMed
- Sepúlveda M, Montejo C, Llufriu S, ym. Rebound of multiple sclerosis activity after fingolimod withdrawal due to planning pregnancy: Analysis of predisposing factors. Mult Scler Relat Disord 2020;38():101483 «PMID: 31734621»PubMed
- Bianco A, Lucchini M, Totaro R, ym. Disease Reactivation after Fingolimod Discontinuation in Pregnant Multiple Sclerosis Patients. Neurotherapeutics 2021;18(4):2598-2607 «PMID: 34494237»PubMed
- Iaffaldano P, Lucisano G, Pozzilli C, ym. Fingolimod versus interferon beta/glatiramer acetate after natalizumab suspension in multiple sclerosis. Brain 2015;138(Pt 11):3275-86 «PMID: 26362907»PubMed
- Auer M, Zinganell A, Hegen H, ym. Experiences in treatment of multiple sclerosis with natalizumab from a real-life cohort over 15 years. Sci Rep 2021;11(1):23317 «PMID: 34857795»PubMed
- Kappos L, Radue EW, Comi G, ym. Switching from natalizumab to fingolimod: A randomized, placebo-controlled study in RRMS. Neurology 2015;85(1):29-39 «PMID: 26024899»PubMed
- Vidal-Jordana A, Tintoré M, Tur C, ym. Significant clinical worsening after natalizumab withdrawal: Predictive factors. Mult Scler 2015;21(6):780-5 «PMID: 25392320»PubMed
- Nygaard GO, Torgauten H, Skattebøl L, ym. Risk of fingolimod rebound after switching to cladribine or rituximab in multiple sclerosis. Mult Scler Relat Disord 2022;62():103812 «PMID: 35462167»PubMed
- Leurs CE, van Kempen ZL, Dekker I, ym. Switching natalizumab to fingolimod within 6 weeks reduces recurrence of disease activity in MS patients. Mult Scler 2018;24(11):1453-1460 «PMID: 28823223»PubMed
- Sellner J, Rommer PS. A review of the evidence for a natalizumab exit strategy for patients with multiple sclerosis. Autoimmun Rev 2019;18(3):255-261 «PMID: 30639651»PubMed
- Cohan SL, Moses H, Calkwood J, ym. Clinical outcomes in patients with relapsing-remitting multiple sclerosis who switch from natalizumab to delayed-release dimethyl fumarate: A multicenter retrospective observational study (STRATEGY). Mult Scler Relat Disord 2018;22():27-34 «PMID: 29524759»PubMed
- Hersh CM, Harris H, Conway D, ym. Effect of switching from natalizumab to moderate- vs high-efficacy DMT in clinical practice. Neurol Clin Pract 2020;10(6):e53-e65 «PMID: 33510948»PubMed
- Alping P, Frisell T, Novakova L, ym. Rituximab versus fingolimod after natalizumab in multiple sclerosis patients. Ann Neurol 2016;79(6):950-8 «PMID: 27038238»PubMed
- Langer-Gould AM. Pregnancy and Family Planning in Multiple Sclerosis. Continuum (Minneap Minn) 2019;25(3):773-792 «PMID: 31162316»PubMed
- Federle L, Puthenparampil M, Stenta G, ym. Alemtuzumab as rescue therapy in case of multiple sclerosis rebound following Natalizumab break: Clinical case and literature review. Mult Scler Relat Disord 2019;30():262-264 «PMID: 30851640»PubMed
- Huhn K, Bayas A, Doerck S, ym. Alemtuzumab as rescue therapy in a cohort of 50 relapsing-remitting MS patients with breakthrough disease on fingolimod: a multi-center observational study. J Neurol 2018;265(7):1521-1527 «PMID: 29696498»PubMed
- Alcalá C, Gascón F, Pérez-Miralles F, ym. Treatment with alemtuzumab or rituximab after fingolimod withdrawal in relapsing-remitting multiple sclerosis is effective and safe. J Neurol 2019;266(3):726-734 «PMID: 30661133»PubMed
- Capobianco M, di Sapio A, Malentacchi M, ym. No impact of current therapeutic strategies on disease reactivation after natalizumab discontinuation: a comparative analysis of different approaches during the first year of natalizumab discontinuation. Eur J Neurol 2015;22(3):585-7 «PMID: 24995482»PubMed
- Zhu C, Zhou Z, Roos I, ym. Comparing switch to ocrelizumab, cladribine or natalizumab after fingolimod treatment cessation in multiple sclerosis. J Neurol Neurosurg Psychiatry 2022;93(12):1330-1337 «PMID: 36261289»PubMed
- Borriello G, Prosperini L, Marinelli F, ym. Observations during an elective interruption of natalizumab treatment: a post-marketing study. Mult Scler 2011;17(3):372-5 «PMID: 21148264»PubMed
- Magraner MJ, Coret F, Navarré A, ym. Pulsed steroids followed by glatiramer acetate to prevent inflammatory activity after cessation of natalizumab therapy: a prospective, 6-month observational study. J Neurol 2011;258(10):1805-11 «PMID: 21625938»PubMed
- Berger B, Baumgartner A, Rauer S, ym. Severe disease reactivation in four patients with relapsing-remitting multiple sclerosis after fingolimod cessation. J Neuroimmunol 2015;282():118-22 «PMID: 25903738»PubMed
- Sánchez P, Meca-Lallana V, Vivancos J. Tumefactive multiple sclerosis lesions associated with fingolimod treatment: Report of 5 cases. Mult Scler Relat Disord 2018;25():95-98 «PMID: 30056362»PubMed
- Otero-Romero S, Carbonell-Mirabent P, Midaglia L, ym. Oral contraceptives do not modify the risk of a second attack and disability accrual in a prospective cohort of women with a clinically isolated syndrome and early multiple sclerosis. Mult Scler 2022;28(6):950-957 «PMID: 34841948»PubMed
- Mainguy M, Tillaut H, Degremont A, ym. Assessing the Risk of Relapse Requiring Corticosteroids After In Vitro Fertilization in Women With Multiple Sclerosis. Neurology 2022;99(17):e1916-e1925 «PMID: 35953288»PubMed
- Krysko KM, Dobson R, Alroughani R, ym. Family planning considerations in people with multiple sclerosis. Lancet Neurol 2023;22(4):350-366 «PMID: 36931808»PubMed
- Confavreux C, Hutchinson M, Hours MM, ym. Rate of pregnancy-related relapse in multiple sclerosis. Pregnancy in Multiple Sclerosis Group. N Engl J Med 1998;339(5):285-91 «PMID: 9682040»PubMed
- Portaccio E, Amato MP. Breastfeeding and post-partum relapses in multiple sclerosis patients. Mult Scler 2019;25(9):1211-1216 «PMID: 30793658»PubMed
- Yeh WZ, Widyastuti PA, Van der Walt A, ym. Natalizumab, Fingolimod and Dimethyl Fumarate Use and Pregnancy-Related Relapse and Disability in Women With Multiple Sclerosis. Neurology 2021;96(24):e2989-e3002 «PMID: 33879599»PubMed
- Razaz N, Piehl F, Frisell T, ym. Disease activity in pregnancy and postpartum in women with MS who suspended rituximab and natalizumab. Neurol Neuroimmunol Neuroinflamm 2020;7(6): «PMID: 33087582»PubMed
- Kümpfel T, Thiel S, Meinl I, ym. Anti-CD20 therapies and pregnancy in neuroimmunologic disorders: A cohort study from Germany. Neurol Neuroimmunol Neuroinflamm 2021;8(1): «PMID: 33334856»PubMed
- Ray JG, Vermeulen MJ, Bharatha A, ym. Association Between MRI Exposure During Pregnancy and Fetal and Childhood Outcomes. JAMA 2016;316(9):952-61 «PMID: 27599330»PubMed
- American College of Radiology. ACR Committee on Drugs and Contrast Media: ACR manual on contrast media. April, 2022. https://www.acr.org/-/media/ACR/files/clinical-resources/contrast_ media.pdf (accessed Aug 26, 2022). «https://www.acr.org/-/media/ACR/files/clinical-resources/contrast_ media.pdf»9
- Tremlett H, Zhao Y, Joseph J, ym. Relapses in multiple sclerosis are age- and time-dependent. J Neurol Neurosurg Psychiatry 2008;79(12):1368-74 «PMID: 18535026»PubMed
- Hua LH, Fan TH, Conway D, ym. Discontinuation of disease-modifying therapy in patients with multiple sclerosis over age 60. Mult Scler 2019;25(5):699-708 «PMID: 29557704»PubMed
- Atula S, Laakso S, Nevala R, Järvinen E. MS-taudin ja sen lääkehoitojen vaikutus syöpäriskiin. Duodecim 2022;138:1595-1602
- Prosperini L, Haggiag S, Tortorella C, ym. Age-related adverse events of disease-modifying treatments for multiple sclerosis: A meta-regression. Mult Scler 2021;27(9):1391-1402 «PMID: 33104449»PubMed
- Corboy JR, Fox RJ, Kister I, ym. Risk of new disease activity in patients with multiple sclerosis who continue or discontinue disease-modifying therapies (DISCOMS): a multicentre, randomised, single-blind, phase 4, non-inferiority trial. Lancet Neurol 2023;22(7):568-577 «PMID: 37353277»PubMed
- Vaughn CB, Jakimovski D, Kavak KS, ym. Epidemiology and treatment of multiple sclerosis in elderly populations. Nat Rev Neurol 2019;15(6):329-342 «PMID: 31000816»PubMed
- McDonald WI, Compston A, Edan G, ym. Recommended diagnostic criteria for multiple sclerosis: guidelines from the International Panel on the diagnosis of multiple sclerosis. Ann Neurol 2001;50(1):121-7 «PMID: 11456302»PubMed
- Kuusisto H, Elovaara I MS-taudin pahenemisvaiheen hoito. Suomen Lääkäril 2003;5849-59:5043-5046
- Noseworthy JH, Lucchinetti C, Rodriguez M, ym. Multiple sclerosis. N Engl J Med 2000;343(13):938-52 «PMID: 11006371»PubMed
- Barnes MP, Bateman DE, Cleland PG, ym. Intravenous methylprednisolone for multiple sclerosis in relapse. J Neurol Neurosurg Psychiatry 1985;48(2):157-9 «PMID: 2984332»PubMed
- Beck RW, Cleary PA, Anderson MM Jr, ym. A randomized, controlled trial of corticosteroids in the treatment of acute optic neuritis. The Optic Neuritis Study Group. N Engl J Med 1992;326(9):581-8 «PMID: 1734247»PubMed
- Oliveri RL, Valentino P, Russo C, ym. Randomized trial comparing two different high doses of methylprednisolone in MS: a clinical and MRI study. Neurology 1998;50(6):1833-6 «PMID: 9633736»PubMed
- Cortese I, Chaudhry V, So YT, ym. Evidence-based guideline update: Plasmapheresis in neurologic disorders: report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Neurology 2011;76(3):294-300 «PMID: 21242498»PubMed
- Frohman EM, Wingerchuk DM. Clinical practice. Transverse myelitis. N Engl J Med 2010;363(6):564-72 «PMID: 20818891»PubMed
- MS-tautia sairastavan hoitoketju. Terveysportti -Hoitoketjut, Varsinais-Suomen sairaanhoitopiiri hoitoketjut. 25.8.2021, https://www.terveysportti.fi/apps/dtk/ltk/article/shp01352/search/shp01352 «https://www.terveysportti.fi/apps/dtk/ltk/article/shp01352/search/shp01352»10
- Otero-Romero S, Sastre-Garriga J, Comi G, ym. Pharmacological management of spasticity in multiple sclerosis: Systematic review and consensus paper. Mult Scler 2016;22(11):1386-1396 «PMID: 27207462»PubMed
- Multiple sclerosis in adults: management. London: National Institute for Health and Care Excellence (NICE); 2022 Jun 22. «PMID: 36279391»PubMed
- Smith KA, Piehl F, Olsson T, ym. Spasticity treatment patterns among people with multiple sclerosis: a Swedish cohort study. J Neurol Neurosurg Psychiatry 2023;94(5):337-348 «PMID: 36539267»PubMed
- Filippini G, Minozzi S, Borrelli F, ym. Cannabis and cannabinoids for symptomatic treatment for people with multiple sclerosis. Cochrane Database Syst Rev 2022;5(5):CD013444 «PMID: 35510826»PubMed
- Depressio. Käypä hoito -suositus. Suomalaisen Lääkäriseuran Duodecimin ja Suomen Psykiatriyhdistys ry:n asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim, 2023 (viitattu 16.8.2023). Saatavilla internetissä: www.kaypahoito.fi
- Vecchio M, Chiaramonte R, DI Benedetto P. Management of bladder dysfunction in multiple sclerosis: a systematic review and meta-analysis of studies regarding bladder rehabilitation. Eur J Phys Rehabil Med 2022;58(3):387-396 «PMID: 35102733»PubMed
- Preziosi G, Gordon-Dixon A, Emmanuel A. Neurogenic bowel dysfunction in patients with multiple sclerosis: prevalence, impact, and management strategies. Degener Neurol Neuromuscul Dis 2018;8():79-90 «PMID: 30584387»PubMed
- Unettomuus. Käypä hoito -suositus. Suomalaisen Lääkäriseuran Duodecimin ja Suomen Unitutkimusseura ry:n asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim, 2023 (viitattu 16.8.2023). Saatavilla internetissä: www.kaypahoito.fi
- Ghorbanpour S, Rahimibarghani S, Rohani S, ym. Fampridine for gait imbalance in patients with multiple sclerosis (MS): a systematic review and meta-analysis. Neurol Sci 2023;44(9):3059-3069 «PMID: 37055710»PubMed
- Otero-Romero S, Lebrun-Frénay C, Reyes S, ym. ECTRIMS/EAN consensus on vaccination in people with multiple sclerosis: Improving immunization strategies in the era of highly active immunotherapeutic drugs. Mult Scler 2023;29(8):904-925 «PMID: 37293841»PubMed
- Farez MF, Correale J. Yellow fever vaccination and increased relapse rate in travelers with multiple sclerosis. Arch Neurol 2011;68(10):1267-71 «PMID: 21670384»PubMed
- Papeix C, Mazoyer J, Maillart E, ym. Multiple sclerosis: Is there a risk of worsening after yellow fever vaccination? Mult Scler 2021;27(14):2280-2283 «PMID: 33870792»PubMed
- Reyes S, Ramsay M, Ladhani S, ym. Protecting people with multiple sclerosis with vaccination. Pract Neurol 2020;20:435-45
- Ciotti JR, Valtcheva MV, Cross AH. Effects of MS disease-modifying therapies on responses to vaccinations: A review. Mult Scler Relat Disord 2020;45():102439 «PMID: 32769063»PubMed
- Asplund Högelin K, Ruffin N, Pin E, ym. B-cell repopulation dynamics and drug pharmacokinetics impact SARS-CoV-2 vaccine efficacy in anti-CD20-treated multiple sclerosis patients. Eur J Neurol 2022;29(11):3317-3328 «PMID: 35808856»PubMed
- Gold R, Fätkenheuer G, Hartung HP, ym. Vaccination in multiple sclerosis patients treated with highly effective disease-modifying drugs: an overview with consideration of cladribine tablets. Ther Adv Neurol Disord 2021;14():17562864211019598 «PMID: 34671422»PubMed
- Faissner S, Heitmann N, Plaza-Sirvent C, ym. Immune response in ofatumumab treated multiple sclerosis patients after SARS-CoV-2 vaccination. Front Immunol 2022;13():980526 «PMID: 36119053»PubMed
- Sormani MP, Inglese M, Schiavetti I, ym. Effect of SARS-CoV-2 mRNA vaccination in MS patients treated with disease modifying therapies. EBioMedicine 2021;72():103581 «PMID: 34563483»PubMed
- Olberg HK, Eide GE, Cox RJ, ym. Antibody response to seasonal influenza vaccination in patients with multiple sclerosis receiving immunomodulatory therapy. Eur J Neurol 2018;25(3):527-534 «PMID: 29205701»PubMed
- Alroughani R, Boyko A. Pediatric multiple sclerosis: a review. BMC Neurol 2018;18(1):27 «PMID: 29523094»PubMed
- Waldman A, Ness J, Pohl D, ym. Pediatric multiple sclerosis: Clinical features and outcome. Neurology 2016;87(9 Suppl 2):S74-81 «PMID: 27572865»PubMed
- Hacohen Y, Brownlee W, Mankad K, ym. Improved performance of the 2017 McDonald criteria for diagnosis of multiple sclerosis in children in a real-life cohort. Mult Scler 2020;26(11):1372-1380 «PMID: 31317829»PubMed
- Fadda G, Brown RA, Longoni G, ym. MRI and laboratory features and the performance of international criteria in the diagnosis of multiple sclerosis in children and adolescents: a prospective cohort study. Lancet Child Adolesc Health 2018;2(3):191-204 «PMID: 30169254»PubMed
- Waubant E, Chabas D, Okuda DT, ym. Difference in disease burden and activity in pediatric patients on brain magnetic resonance imaging at time of multiple sclerosis onset vs adults. Arch Neurol 2009;66(8):967-71 «PMID: 19667217»PubMed
- Benson LA, Healy BC, Gorman MP, ym. Elevated relapse rates in pediatric compared to adult MS persist for at least 6 years. Mult Scler Relat Disord 2014;3(2):186-93 «PMID: 25878006»PubMed
- Chitnis T, Aaen G, Belman A, ym. Improved relapse recovery in paediatric compared to adult multiple sclerosis. Brain 2020;143(9):2733-2741 «PMID: 32810215»PubMed
- Aubert-Broche B, Fonov V, Narayanan S, ym. Onset of multiple sclerosis before adulthood leads to failure of age-expected brain growth. Neurology 2014;83(23):2140-6 «PMID: 25378667»PubMed
- Amato MP, Goretti B, Ghezzi A, ym. Cognitive and psychosocial features of childhood and juvenile MS. Neurology 2008;70(20):1891-7 «PMID: 18474844»PubMed
- Ghezzi A, Pozzilli C, Liguori M, ym. Prospective study of multiple sclerosis with early onset. Mult Scler 2002;8(2):115-8 «PMID: 11990867»PubMed
- Renoux C, Vukusic S, Mikaeloff Y, ym. Natural history of multiple sclerosis with childhood onset. N Engl J Med 2007;356(25):2603-13 «PMID: 17582070»PubMed
- Harding KE, Liang K, Cossburn MD, ym. Long-term outcome of paediatric-onset multiple sclerosis: a population-based study. J Neurol Neurosurg Psychiatry 2013;84(2):141-7 «PMID: 23154123»PubMed
- Sandesjö F, Wassmer E, Deiva K, ym. Current international trends in the treatment of multiple sclerosis in children-Impact of the COVID-19 pandemic. Mult Scler Relat Disord 2021;56():103277 «PMID: 34624643»PubMed
- Chitnis T, Tenembaum S, Banwell B, ym. Consensus statement: evaluation of new and existing therapeutics for pediatric multiple sclerosis. Mult Scler 2012;18(1):116-27 «PMID: 22146610»PubMed
- Alroughani R, Das R, Penner N, ym. Safety and Efficacy of Delayed-Release Dimethyl Fumarate in Pediatric Patients With Relapsing Multiple Sclerosis (FOCUS). Pediatr Neurol 2018;83():19-24 «PMID: 29681490»PubMed
- Alroughani R, Huppke P, Mazurkiewicz-Beldzinska M, ym. Delayed-Release Dimethyl Fumarate Safety and Efficacy in Pediatric Patients With Relapsing-Remitting Multiple Sclerosis. Front Neurol 2020;11():606418 «PMID: 33473248»PubMed
- Chitnis T, Arnold DL, Banwell B, ym. Trial of Fingolimod versus Interferon Beta-1a in Pediatric Multiple Sclerosis. N Engl J Med 2018;379(11):1017-1027 «PMID: 30207920»PubMed
- Chitnis T, Banwell B, Kappos L, ym. Safety and efficacy of teriflunomide in paediatric multiple sclerosis (TERIKIDS): a multicentre, double-blind, phase 3, randomised, placebo-controlled trial. Lancet Neurol 2021;20(12):1001-1011 «PMID: 34800398»PubMed
- Krysko KM, Graves J, Rensel M, ym. Use of newer disease-modifying therapies in pediatric multiple sclerosis in the US. Neurology 2018;91(19):e1778-e1787 «PMID: 30333163»PubMed
- Ghezzi A, Banwell B, Bar-Or A, ym. Rituximab in patients with pediatric multiple sclerosis and other demyelinating disorders of the CNS: Practical considerations. Mult Scler 2021;27(12):1814-1822 «PMID: 32552353»PubMed
- Kornek B, Aboul-Enein F, Rostasy K, ym. Natalizumab therapy for highly active pediatric multiple sclerosis. JAMA Neurol 2013;70(4):469-75 «PMID: 23420110»PubMed
- Ruutiainen J, Viita AM, Hahl J, ym. Burden of illness in multiple sclerosis (DEFENSE) study: the costs and quality-of-life of Finnish patients with multiple sclerosis. J Med Econ 2016;19(1):21-33 «PMID: 26360615»PubMed
- Landfeldt E, Castelo-Branco A, Svedbom A, ym. Sick leave and disability pension before and after diagnosis of multiple sclerosis. Mult Scler 2016;22(14):1859-1866 «PMID: 27650517»PubMed
- Heinonen T, Castrén E, Luukkaala T, ym. The retirement rate due to multiple sclerosis has decreased since 1995- A retrospective study in a Finnish central hospital. Mult Scler Relat Disord 2020;45():102360 «PMID: 32688302»PubMed
- Wickström A, Fagerström M, Wickström L, ym. The impact of adjusted work conditions and disease-modifying drugs on work ability in multiple sclerosis. Mult Scler 2017;23(8):1137-1147 «PMID: 27758955»PubMed
- Ruutiainen J, Wikström J, Sivenius J. Etenevät neurologiset sairaudet. Kirjassa: Kuntoutus (Rissanen P, Kallanranta T, Suikkanen A) 2.p. Kustannus Oy Duodecim; Jyväskylä 2008;235-50
- Amatya B, Khan F, Galea M. Rehabilitation for people with multiple sclerosis: an overview of Cochrane Reviews. Cochrane Database Syst Rev 2019;1(1):CD012732 «PMID: 30637728»PubMed
- Abou L, Qin K, Alluri A, ym. The effectiveness of physical therapy interventions in reducing falls among people with multiple sclerosis: A systematic review and meta-analysis. J Bodyw Mov Ther 2022;29():74-85 «PMID: 35248292»PubMed
- Binshalan T, Nair KPS, McNeill A. The Effectiveness of Physiotherapy Interventions for Mobility in Severe Multiple Sclerosis: A Systematic Review and Meta-Analysis. Mult Scler Int 2022;2022():2357785 «PMID: 35860179»PubMed
- Centonze D, Leocani L, Feys P. Advances in physical rehabilitation of multiple sclerosis. Curr Opin Neurol 2020;33(3):255-261 «PMID: 32304436»PubMed
- Messmer Uccelli M, Specchia C, Battaglia MA, ym. Factors that influence the employment status of people with multiple sclerosis: a multi-national study. J Neurol 2009;256(12):1989-96 «PMID: 19582536»PubMed
- Castrén E, Heinonen T, Mäkinen K, ym. The rate of neuropsychological assessments in multiple sclerosis has increased-A retrospective study in a Finnish Central Hospital. Acta Neurol Scand 2020;141(2):156-161 «PMID: 31585023»PubMed
- Työterveyshuoltolaki 1383/2001, https://www.finlex.fi/fi/laki/ajantasa/2001/20011383 «https://www.finlex.fi/fi/laki/ajantasa/2001/20011383»11
- Terveydenhuoltolaki 30.12.2010/1326, https://www.finlex.fi/fi/laki/ajantasa/2010/20101326 «https://www.finlex.fi/fi/laki/ajantasa/2010/20101326»12
- Valtakunnaliset lääkinnällisen kuntoutuksen ohjaamisen perusteet 2022. Opas terveyden- ja sosiaalihuollon ammattilaisille ja kuntoutuksen parissa työskenteleville. Sosiaali ja terveysministeriön julkaisuja 2022:17 http://urn.fi/URN:ISBN:978-952-00-5423-6 «http://urn.fi/URN:ISBN:978-952-00-5423-6»13
- Laki Kansaneläkelaitoksen kuntoutusetuuksista ja kuntoutusrahaetuuksista. 15.7.2005/566. https://www.finlex.fi/fi/laki/ajantasa/2005/20050566 «https://www.finlex.fi/fi/laki/ajantasa/2005/20050566»14
- Sosiaali- ja terveysturvan tutkimuksia 161. Toim. Sjögren T, Rintala A, Paltamaa J, Korpi H. Fysioterapian vaikuttavuus ja merkityksellisyys aivoverenkiertohäiriötä ja multippeliskleroosia sairastaville kuntoutujille: Järjestelmälliset kirjallisuuskatsaukset kävelyn ja tasapainon meta-analyyseista ja fysioterapian koetun merkityksellisyyden metasynteeseistä. Kela 2022, http://hdl.handle.net/10138/350735 «http://hdl.handle.net/10138/350735»15
- Lampit A, Heine J, Finke C, ym. Computerized Cognitive Training in Multiple Sclerosis: A Systematic Review and Meta-analysis. Neurorehabil Neural Repair 2019;33(9):695-706 «PMID: 31328637»PubMed
- Wu J, Olsson T, Hillert J, ym. Influence of oral tobacco versus smoking on multiple sclerosis disease activity and progression. J Neurol Neurosurg Psychiatry 2023;94(8):589-596 «PMID: 37001984»PubMed
- Rodgers J, Friede T, Vonberg FW, ym. The impact of smoking cessation on multiple sclerosis disease progression. Brain 2022;145(4):1368-1378 «PMID: 34623418»PubMed
- Tupakka- ja nikotiiniriippuvuuden ehkäisy ja hoito. Käypä hoito -suositus. Käypä hoito -suositus. Suomalaisen Lääkäriseuran Duodecimin ja Suomen Yleislääketieteen yhdistyksen asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim, 2018 (viitattu 4.5.2023). Saatavilla internetissä: www.kaypahoito.fi
- Munger KL, Hongell K, Åivo J, ym. 25-Hydroxyvitamin D deficiency and risk of MS among women in the Finnish Maternity Cohort. Neurology 2017;89(15):1578-1583 «PMID: 28904091»PubMed
- Ascherio A, Munger KL, White R, ym. Vitamin D as an early predictor of multiple sclerosis activity and progression. JAMA Neurol 2014;71(3):306-14 «PMID: 24445558»PubMed
- Åivo J, Kurki S, Sumelahti ML, ym. Risk of osteoporotic fractures in multiple sclerosis patients in southwest Finland. Acta Neurol Scand 2017;135(5):516-521 «PMID: 27334254»PubMed
- Boltjes R, Knippenberg S, Gerlach O, ym. Vitamin D supplementation in multiple sclerosis: an expert opinion based on the review of current evidence. Expert Rev Neurother 2021;21(6):715-725 «PMID: 34058936»PubMed
- Osteoporoosi. Käypä hoito -suositus. Suomalaisen Lääkäriseuran Duodecimin, Suomen Endokrinologiyhdistyksen, Suomen Gynekologiyhdistyksen ja Suomen Geriatrit ry:n asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim, 2020 (viitattu 1.5.2023). Saatavilla internetissä: www.kaypahoito.fi
- Soilu-Hänninen M, Åivo J, Lindström BM, ym. A randomised placebo-controlled trial with vitamin D3 as an add on treatment to interferon b-1b in patients with multiple sclerosis. J Neurol Neurosurg Psychiatry 2012;83:565-71
- Paakkari I. D-vitamiini. www.terveyskirjasto.fi. Lääkärikirja Duodecim. Kustannus Oy Duodecim 21.3.2022
- Manchery N, Henry JD, Nangle MR. A systematic review of oral health in people with multiple sclerosis. Community Dent Oral Epidemiol 2020;48(2):89-100 «PMID: 31815299»PubMed

