Astma
Hur kan man hänvisa till God medicinsk praxis-rekommendationen? «K1»1
Den här svenskspråkiga God medicinsk praxis-rekommendationen har översatts från den finska God medicinsk praxis-rekommendationen (Käypä hoito -suositus Astma «Astma»1). Om det finns skillnader i texterna gäller den uppdaterade finskspråkiga versionen.
Huvudsakligen finns evidenssammandragen och bakgrundsmaterialen samt internetlänkarna på finska.
Centrala rekommendationer
- Astma är en kronisk lungsjukdom som kännetecknas av ökad bronkiell hyperreaktivitet (bronkkonstriktion) och en inflammation i luftrörens slemhinna som vanligen är förknippad med denna hyperreaktivitet.
- Vanliga symtom på astma är hosta, slemutsöndring, tryckkänsla i bröstet, andnöd och vinande utandning. Astmasymtomen är ofta varierande och framträder ibland i form av episoder av plötsliga försämringar.
- Astmadiagnosen ställs genom att påvisa varierande eller läkemedelsreversibel luftrörsförträngning (bronkkonstriktion) i kombination med symtom som är typiska för astma. I diagnostiken för småbarn används impulsoscillometri och från och med skolåldern vanligen spirometri och uppföljning av PEF-värdet. Se video «PEF-seurannan merkitys ja tulkinta (video)»1. Vid behov görs belastningsprov eller provokationstest.
- Målet för behandlingen av astma är symtomfrihet, normal lungfunktion och förhindrande av försämringsskov (exacerbationer).
- Syftet med denna vårdrekommendation är att förebygga astmarelaterad försämring av funktionsförmågan, arbetsoförmåga och dödsfall.
- Målet är dessutom att minska de biverkningar som är förknippade med excessiv kortikosteroidbehandling genom att i regel använda små och medelhöga inhalationskortikosteroiddoser, genom att avstå från regelbunden användning av kortikosteroider oralt och genom att förkorta orala kortikosteroidkurer vid behandling av försämringsskov.
- Det viktigaste vid läkemedelsbehandling av astma är att dämpa astmainflammationen genom behandling med inhalationskortikosteroider (ICS). En bronkdilaterande beta2-agonist används vid behov för behandling av symtomen.
- Läkemedelsbehandlingen av astma justeras enligt hur väl astman är under kontroll. Om inhalationskortikosteroiddosen inte räcker till för att hålla symtomen under kontroll, inleds parallellt med den ett eller flera tilläggsläkemedel: långverkande beta2-agonist, leukotrienblockerare eller långverkande antikolinergikum. Vid egenvård av astmaskov har man övergett rutinmässig ökning av inhalationskortikosteroiddosen. Se videon «Hengitettävän kortikosteroidin annoksen säätely flunssien aikana (video)»2.
- Utredningen och behandlingen av svår astma sker inom specialsjukvården.
Huvudansvaret för diagnostiken och behandlingen av astma hos barn under skolåldern ligger hos specialsjukvården. Diagnostiska undersökningar av barn under 12 år bör ordnas enligt den regionala nivåstrukturerade vården på en mottagning ledd av specialistläkare antingen inom primärvården eller specialsjukvården. För barn och ungdomar i åldern 12–18 år avtalas arbetsfördelningen lokalt. För vuxna ligger huvudansvaret för diagnostiken och vården hos primärvården och företagshälsovården.
Mål och målgrupper
- Målet är god astmavård och enhetlig praxis. Syftet med behandlingen är att lindra patienternas symtom så mycket som möjligt och att trygga en åldersanpassad funktions- och arbetsförmåga.
- Centrala metoder är långvarig sjukdomskontroll och förhindrande av försämringsskov (exacerbationer).
- Målgruppen utgörs av de yrkesutbildade personer inom hälso- och sjukvården som deltar i behandlingen av astma.
Definition och patofysiologi
- Astma är en kronisk lungsjukdom vars huvudsakliga kännetecken är varierande luftrörsförträngning på grund av hyperreaktivitet och funktionsstörning i luftrörens glatta muskulatur samt underliggande kronisk inflammation i bronkslemhinnan «Global Initiative for Asthma (GINA). Global Strate...»1. I tidiga skeden av slemhinneinflammationen kan hyperreaktivitet och bronkkonstriktionsbenägenheten saknas.
- De typiska astmasymtomen är varierande grad av andnöd och vinande utandning (på grund av varierande grad av luftrörförträngning) samt tryckkänsla i bröstet, slemutsöndring och hosta «Global Initiative for Asthma (GINA). Global Strate...»1.
- Astma har olika manifestationer (fenotyper) som skiljer sig åt vad gäller kliniska kännetecken, såsom sjukdomens begynnelseålder, symtomens svårighetsgrad, förekomsten av försämringsskov och associerade sjukdomar «Wenzel SE. Asthma phenotypes: the evolution from c...»2.
- För att bättre förstå astmamekanismerna och prognostisera terapisvaret är indelning av astma i subtyper baserade på inflammationsmekanismen av större betydelse. De viktigaste subtyperna är allergisk eosinofil astma och icke-allergisk eosinofil astma. Neutrofil astma och paucigranulocytär astma är mindre välkända subtyper «Global Initiative for Asthma (GINA). Global Strate...»1, «Lehtimäki L, Karjalainen J. Erikoissairaanhoidon r...»3, «Erjefält JS. Unravelling the complexity of tissue ...»4.
- Eosinofil typ 2-inflammation i slemhinnan är central för både allergisk och icke-allergisk eosinofil astma, men mekanismerna bakom inflammationen är olika «Hammad H, Lambrecht B. The basic immunology of ast...»5.
- Neutrofil astma kännetecknas av en neutrofil inflammation i slemhinnorna utan eosinofil infiltration, vilket torde vara förknippat med långvarig exponering för tobaksrök, luftföroreningar eller mikrober på slemhinneytan «Hammad H, Lambrecht B. The basic immunology of ast...»5. Också långvarig kortikosteroidbehandling kan tänkas orsaka neutrofil inflammation i luftvägarna «Crisford H, Sapey E, Rogers GB ym. Neutrophils in ...»6.
- Vid paucigranulocytär astma saknas granulocytär inflammation i slemhinnorna. Det finns inte mycket data om denna sjukdomsform och informationen om dess verkliga betydelse är motstridig «Erjefält JS. Unravelling the complexity of tissue ...»4.
- En kraftig och långvarig astmainflammation kan orsaka strukturella förändringar i mukosa och submukosa, såsom slemhinneskador, förtjockning av basalmembranet och det glatta muskellagret samt neovaskularisering «Hough KP, Curtiss ML, Blain TJ ym. Airway Remodeli...»7.
- Ojämn och varierande luftvägsförträngning förändrar förhållandet mellan ventilation och blodcirkulation i olika delar av lungorna. Detta kan försämra syresättningen, alltså minska syrehalten i artärblodet «Sarkar M, Niranjan N, Banyal PK. Mechanisms of hyp...»8.
- Eftersom förträngningen i luftrören varierar, är symtomen vid lindrig och begynnande astma ofta intermittenta och lungfunktionen är normal under en stor del av tiden. Vid svår astma kan symtomen och förträngningen i luftrören vara bestående och delvis irreversibla «Global Initiative for Asthma (GINA). Global Strate...»1.
Prevalens
- År 2019 hade 282 158 personer i Finland rätt till specialersättningsgilla astmaläkemedel. Astma var den tredje vanligaste specialersättningsgilla sjukdomen efter blodtryckssjukdom och diabetes. År 2019 beviljades 13 512 nya specialersättningsrättigheter. Siffran har under flera år varit rätt oförändrad eller minskat något.
- År 2019 beviljades 2 818 nya rättigheter till specialersättning för patienter i åldern 0–14 år. Siffran har fortsatt att minska särskilt bland pojkar i åldern 0–4 år och har gått ner till hälften av motsvarande siffra år 2011 (567). År 2019 beviljades 10 694 nya rättigheter till specialersättning för patienter över 15 år. Siffran har varit stabil under de senaste tio åren. Oftast konstateras astma vid vuxen ålder och ju äldre patienten är vid tidpunkten för diagnosen, desto mer sällan är det fråga om allergirelaterad astma «Kankaanranta H, Tuomisto LE, Ilmarinen P. Age-spec...»9, «Pakkasela J, Ilmarinen P, Honkamäki J ym. Age-spec...»10. Flest nya specialersättningsrättigheter beviljades för patienter i åldern 60–64 år «Astman erityiskorvausoikeudet»1.
- I siffrorna ingår specialersättningsrättigheterna som beviljats på grund av svår KOL. År 2011 var andelen av svår KOL 6 % av alla nya specialersättningsrättigheter. Bedömningen av andelen personer med både astma och KOL varierar: både astma och KOL förekommer hos cirka 17–19 % av KOL-patienterna «Soriano JB, Davis KJ, Coleman B ym. The proportion...»11 och hos 15 % av patienterna som sjukhusvårdats på grund av KOL «Kauppi P, Kupiainen H, Lindqvist A ym. Overlap syn...»12. Enligt vissa bedömningar har upp till 55 % av KOL-patienterna också astma «Marsh SE, Travers J, Weatherall M ym. Proportional...»13.
- Åtminstone i Helsingfors har ökningen av astma planat ut och patienterna har färre symtom. År 2016 hade 8,8 % av alla vuxna helsingforsare (i åldern 20–69 år) astmasymtom «Hisinger-Mölkänen H, Pallasaho P, Haahtela T ym. T...»14.
- Antalet patienter med astma och med astmaliknande symtom ökade särskilt i de yngre åldersgrupperna fram till början av 2010-talet. Nu verkar det som om ökningen avstannat. Beroende på åldersgrupp, har 3–6 % av barnen och ungdomarna läkardiagnostiserad astma «Lai CK, Beasley R, Crane J ym. Global variation in...»15, «von Hertzen L, Haahtela T. Disconnection of man an...»16.
- Behovet av sjukhusvård för barn på grund av astma har minskat. Mer information «Lasten astman sairaalahoito»3.
- År 2019 uppgick antalet dödsfall på grund av astma till 63 personer. 58 av de avlidna var över 65 år och 5 var i åldern 15–64 år. Ingen person under 15 år dog av astma år 2019. Under åren 1999–2015 dog endast fyra barn i astma i Finland «Suomen virallinen tilasto (SVT): Kuolemansyyt (ver...»17, «Kivistö JE, Karjalainen J, Kivelä L ym. Very low a...»18.

Astman erityiskorvausoikeudet Suomessa vuonna 2019 .
© Suomalainen Lääkäriseura Duodecim
Riskfaktorer för astma
- För att astma ska uppkomma är en multifaktoriell ärftlig benägenhet viktig. Kartläggning av hela genomet har identifierat nya astmarelaterade gener, men betydelsen av enskilda gener förefaller dock att vara liten «Ferreira MA, Matheson MC, Duffy DL ym. Identificat...»19, «Torgerson DG, Ampleford EJ, Chiu GY ym. Meta-analy...»20, «Moffatt MF, Gut IG, Demenais F ym. A large-scale, ...»21, «Myers RA, Scott NM, Gauderman WJ ym. Genome-wide i...»22, «DeVries A, Vercelli D. Epigenetic Mechanisms in As...»23, «Demenais F, Margaritte-Jeannin P, Barnes KC ym. Mu...»24, «Kotisalmi E, Salmi S, Karjalainen J, Kauppi P. Aik...»25, «Shrine N, Portelli MA, John C ym. Moderate-to-seve...»26, «El-Husseini ZW, Gosens R, Dekker F ym. The genetic...»27.
- Den viktigaste riskfaktorn för astma och atopi är förekomsten av samma sjukdom hos föräldrar och syskon: astma hos en förälder fyrdubblar barnets risk att insjukna i astma «Räsänen M. Familial aggregation and risk factors f...»28, «Skadhauge LR, Christensen K, Kyvik KO ym. Genetic ...»29, «Svanes C, Jarvis D, Chinn S ym. Childhood environm...»30, «Edenharter G, Bergmann RL, Bergmann KE ym. Cord bl...»31, «Bao Y, Chen Z, Liu E ym. Risk Factors in Preschool...»32, «Jones BL, Rosenwasser LJ. Linkage and Genetic Asso...»33, «Borna E, Nwaru BI, Bjerg A ym. Changes in the prev...»34.
- Allergisk snuva 2–4-faldigar risken för astma «Shaaban R, Zureik M, Soussan D ym. Rhinitis and on...»35, «Pallasaho P, Juusela M, Lindqvist A ym. Allergic r...»36, «Tohidinik HR, Mallah N, Takkouche B. History of al...»37.
- Om barnet har en benägenhet att i ung ålder få svår, vinande utandning orsakad av rhinovirus, ökar risken för astma avsevärt (30–80 % har atopisk astma i skolåldern) «Jartti T, Smits HH, Bønnelykke K ym. Bronchiolitis...»38. Sensibilisering mot aeroallergener (oddskvot, odds ratio, OR 45) eller polymorfism i lokus 17q (OR 26) ökar avsevärt risken för astma vid rhinovirusrelaterad vinande utandning hos barn i atopiska familjer «Caliskan M, Bochkov YA, Kreiner-Møller E ym. Rhino...»39, «Rubner FJ, Jackson DJ, Evans MD ym. Early life rhi...»40.
- Moderns rökning under graviditeten «Äidin tupakointi raskauden aikana lisää lapsen astmariskiä.»A och barnets passiva rökning «Passiivinen tupakointi (tupakansavulle altistuminen) kotona lisää astmariskiä lapsilla ja vaikuttaa pitkään keuhkojen toimintaan astmalapsilla.»A höjer barnets astmarisk cirka 1,5-faldigt. Passiv rökning (exponering för tobaksrök) i hemmet ökar risken för astma hos barn och påverkar lungfunktionen långvarigt.
- Rökning under barn- och ungdomsåren ökar risken för astma «Lapsen tai nuoren oma tupakointi lisää astmariskiä.»A.
- Rökning mer än fördubblar «Pallasaho P, Juusela M, Lindqvist A ym. Allergic r...»36 risken för astma (RR, 1,61; 95 % konfidensintervall, 1,07–2,42) «Jayes L, Haslam PL, Gratziou CG ym. SmokeHaz: Syst...»41.
- Se God medicinsk praxis-rekommendationen Tobaks- och nikotinberoende – profylax och behandling «Tobaks- och nikotinberoende – profylax och behandling»2, «Tupakka- ja nikotiiniriippuvuuden ehkäisy ja hoito...»42.
- Vuxna som exponeras för tobaksrök har höjd risk för astma «Passiivinen tupakointi (tupakansavulle altistuminen) lisää astmariskiä aikuisilla.»A.
- Övervikt ökar också risken för att insjukna i astma «Ylipaino ja lihavuus liittyvät lisääntyneeseen astman ilmaantumisen riskiin sekä naisilla että miehillä.»A, «Vork KL, Broadwin RL, Blaisdell RJ. Developing ast...»43, «Jaakkola MS, Piipari R, Jaakkola N ym. Environment...»44, «Simoni M, Baldacci S, Puntoni R ym. Respiratory sy...»45.
- Se God medicinsk praxis-rekommendationen Fetma (barn, unga, vuxna) «Fetma (barn, unga och vuxna)»3, «Lihavuus (lapset, nuoret ja aikuiset). Käypä hoito...»46.
- Personer med astma har oftare refluxsjukdom än den övriga befolkningen, men refluxsjukdomen orsakar uppenbarligen dock inte astma. Läkemedelsbehandlingen av refluxsjukdom påverkar i allmänhet inte heller astmakontrollen «Chan WW, Chiou E, Obstein KL ym. The efficacy of p...»47. Refluxsjukdom kan orsaka hosta «Morice AH, Millqvist E, Bieksiene K ym. ERS guidel...»48 som ofta tolkas som astmarelaterad. Symtomatisk refluxsjukdom behandlas hos astmapatienter enligt samma principer som hos den övriga befolkningen.
- Både epidemiologisk och genetisk forskning stöder sambandet mellan astma, ångestsyndrom och depression «Astma, ahdistuneisuus ja masennus»4. Det förekommer mer depression och ångestsyndrom bland patienter med astma än bland den övriga befolkningen «Choi HG, Kim JH, Park JY ym. Association Between A...»49.
- Epidemiologiska undersökningar har visat att fuktskador inomhus associeras med uppkomst «Mendell MJ, Mirer AG, Cheung K ym. Respiratory and...»50 och försämring av astma «Seuri M, Nevalainen A, Sauni R. Kosteusvaurioraken...»51, men huruvida ett kausalsamband föreligger är osäkert. Det finns omständigheter som tyder på ett kausalsamband mellan fuktskador och astma hos barn «Pekkanen J, Hyvärinen A, Haverinen-Shaughnessy U y...»52, «Tischer C, Chen CM, Heinrich J. Association betwee...»53.
- Enligt populationsundersökningar förklarar exponering i arbetet 16 % av astmafallen som utvecklas i ungdoms- och vuxenåldern «Blanc PD, Annesi-Maesano I, Balmes JR ym. The Occu...»54. Risken för astma är förhöjd bl.a. hos bagare, jordbrukare och jordbruksarbetare, målare, städare, servitörer, metall- och träarbetare samt vårdpersonal «Kogevinas M, Antó JM, Sunyer J ym. Occupational as...»55, «Karjalainen A, Kurppa K, Martikainen R ym. Explora...»56, «Jaakkola JJ, Piipari R, Jaakkola MS. Occupation an...»57, «Kogevinas M, Zock JP, Jarvis D ym. Exposure to sub...»58.
Diagnostik
- Astmadiagnosen grundar sig på påvisande av varierande luftrörsförträngning eller luftrörsförträngning som upphävs med läkemedel som administreras under pågående symtom som tyder på astma. En del patienter känner dock inte igen symtomen. Se tabell «Diagnostik av astma hos personer över 12 år....»1.
| SYMTOM OCH RISKFAKTORER |
|
| FYND |
|
| UNDERSÖKNINGAR Utförs i allmänhet för alla, primärvården är ansvarig |
|
| Görs vid behov inom specialsjukvården |
|
| DIFFERENTIALDIAGNOSTIK |
|
Symtom
- Typiska symtom på astma är inflammationsrelaterad hosta och slemutsöndring samt andnöd och vinande andning på grund av bronkkonstriktion. Vid astma förekommer andningssvårigheterna och den vinande andningen i allmänhet vid utandning.
- Symtomen uppkommer oftast i samband med en respiratorisk virusinfektion, fysisk ansträngning, inandning av kall luft eller exponering för något allergen. Ofta samverkar flera faktorer, t.ex. infektion, fysisk ansträngning och stress.
- Typiskt för astmasymtomen är att de varierar och kommer anfallsvis. Symtomen tenderar att förekomma nattetid och på morgonen.
Fynd
- Varaktigheten och intensiteten av astmasymtomen varierar. En person med lindrig astma
är för det mesta symtomfri och lungfunktionen är normal; detta gäller t.ex. spirometrifyndet.
Den kliniska statusen är då också vanligtvis normal.
- Under pågående symtom hörs vinande från lungorna, ofta vid utandning och ibland även vid inandning (särskilt hos barn). Också rossel kan höras vid slembildning, men stridor hör inte till astma.
- Andningsljuden bör auskulteras också då patienten gör en snabb och kraftig utandning, vilket accentuerar eller framkallar vinandet.
- Om astmaanfallet är svårt och långvarigt, kan vinandet försvinna, andningsljuden avta och de sekundära (accessoriska) andningsmusklerna vara i användning. Detta beror på förträngning i de små luftrören vilket leder till luftretention (luftfälla) i de perifera delarna av lungorna. Tillståndet är livsfarligt.
- Astma är nästan alltid förknippad med någon grad av snuva och ibland med kronisk sinuit och näspolypos. Därför är det skäl att fråga patienten om eventuella symtom på snuva och att undersöka patientens näsa.
Lungfunktionsundersökningar
- Diagnosen fastställs med lungfunktionstester som visar en varierande eller med läkemedelsanvändning reversibel förträngning av luftvägarna som relaterar till en störning i den glatta bronkmuskulaturens funktion.
- Lungfunktionstest som genomförs för att fastställa diagnosen görs då patienten inte använder medicinering som påverkar lungfunktionen «Sovijärvi A, Kainu A, Malmberg P, Lindholm B, Timo...»59. Om patienten har symtom trots medicinering och om ett fynd som tyder på astma konstateras i lungfunktionstesterna, är testresultatet tillförlitligt. Normal lungfunktion under eller utan medicinering utesluter inte astma med säkerhet.
- För att fastställa diagnosen räcker ett av följande sex fynd, om undersökningen gjorts
på ett tillförlitligt sätt och om patientens tillstånd tyder på astma.
- 1. Under två veckors PEF-uppföljning (se tilläggsinformation «Ohje astmapotilaan PEF-kotiseurantaan»5) förekommer åtminstone tre gånger en variation i PEF-värdet på minst 20 % och 60 l/min mellan morgon och kväll, då mätningen gjorts innan patienten tagit bronkdilaterande medicin (dygnsvariation) «Drake S, Wang R, Healy L ym. Diagnosing Asthma wit...»60, «Quanjer PH, Lebowitz MD, Gregg I ym. Peak expirato...»61.
- 2. Under två veckors PEF-uppföljning förekommer åtminstone tre gånger ett bronkdilatationssvar
på minst 15 % och 60 l/min «Quanjer PH, Lebowitz MD, Gregg I ym. Peak expirato...»61.
- Obs! Under PEF-uppföljningen kan man inte kontrollera den tekniska kvaliteten på blåsningarna och därför kan man inte med säkerhet bedöma om ett lågt PEF-värde beror på astma och förträngning av luftrören eller exempelvis på dålig blåsteknik eller funktionell förträngning av struphuvudet. Se video «PEF-seurannan merkitys ja tulkinta (video)»1. Man kan lita på en astmadiagnos som grundar sig på uppföljning av PEF-värdet om symtomen är typiska för astma och om antiinflammatorisk astmamedicineringen ger god respons. Om symtomen inte är typiska eller om läkemedelsresponsen är dålig, ska diagnosen utredas med andra metoder.
- 3. Spirometri visar signifikant svar på administration av bronkdilatator: FEV1 eller FVC förbättras minst med 12 % och 200 ml «Global Initiative for Asthma (GINA). Global Strate...»1, «Pellegrino R, Viegi G, Brusasco V ym. Interpretati...»62, «Sovijärvi A, Kainu A, Malmberg P, Lindholm B, Timo...»59.
- nedsatt FEV1/FVC i spirometri tyder på förträngning av luftrören, se närmare «Sovijärvi A, Kainu A, Malmberg P, Lindholm B, Timo...»59.
- Eftersom referensintervallet är brett, kan spirometriresultaten (t.ex. FEV1) ligga inom referensområdet, men variationer som tyder på astma kan påvisas med bronkdilatationstest.
- Om startvärdet i spirometriundersökningen tyder på förträngning av luftrören, ökar sannolikheten för astma men bekräftar inte diagnosen. Vid behov görs ytterligare undersökningar eller ett behandlingstest.
- 4. Direkta exponeringsprov: vid metakolinexponering konstateras rätt kraftig eller
kraftig hyperreaktivitet.
- Exponering för en inhalerad kumulativ dos av metakolinklorid på 0,6 mg eller mindre orsakar en minskning av FEV1-värdet på minst 20 % (PD20FEV1 ≤ 0,6 mg) «Nieminen MM. Unimodal distribution of bronchial hy...»63, «Juusela M, Poussa T, Kotaniemi J ym. Bronchial hyp...»64.
- För barn under 12 år finns det inte tillräckligt med forskningsresultat för fastställande av ett bestämt diagnostiskt gränsvärde, och metoden rekommenderas därför inte för diagnostik.
- Utebliven hyperreaktivitet (PD20FEV1 för metakolin över 2,6 mg) talar i allmänhet mot astma, men hyperreaktivitet konstateras inte alltid vid begynnande astma «Global Initiative for Asthma (GINA). Global Strate...»1.
- Lindrig hyperreaktivitet förekommer i samband med flera respiratoriska sjukdomar, hos rökare och vid luftvägsinfektioner «Global Initiative for Asthma (GINA). Global Strate...»1, «Juusela M, Pallasaho P, Rönmark E ym. Dose-depende...»65.
- Metakolinexponeringen ska utföras på ett standardiserat sätt «Malmberg P, Karjalainen J, Tikkakoski A, Mäkelä M,...»66.
- 5. Indirekta exponeringsprov: vid belastningstest «Kliinisen rasituskokeen jälkeen mitatun uloshengityksen sekuntikapasiteetin (FEV1) laskua 15 % voidaan pitää merkittävänä muutoksena.»A, vid koldioxidstandardiserad intensiv andning av torr luft (eukapnisk volontär hyperventilation,
EVH) «EVH-provokaation jälkeen mitatun uloshengityksen sekuntikapasiteetin (FEV1) laskua 15 % voi pitää merkittävänä muutoksena.»C eller vid mannitolexponering «Mannitolialtistuksessa mitatun uloshengityksen sekuntikapasiteetin (FEV1) laskua 15 % voi pitää merkittävänä muutoksena.»B konstateras betydande bronkkonstriktion: FEV1 minskar efter provokationen med minst 15 % av utgångsvärdet «Clinical exercise testing with reference to lung d...»67, «Hallstrand TS, Leuppi JD, Joos G ym. ERS technical...»68.
- Om FEV1 sjunker med 10–14 % från utgångsvärdet är resultatet riktgivande för astma.
- Exponeringsproven bör göras med en standardiserad metod. I belastningsprovet ska man sträva efter en tillräcklig ansträngningsnivå som orsakar andfåddhet «Koskela H, Tikkakoski A, Karjalainen J, Mäkelä M, ...»69.
- Hos barn lyckas EVH-testet i allmänhet nöjaktigt från 10 års ålder och gränsvärdet har hög specificitet «Burman J, Elenius V, Lukkarinen H ym. Cut-off valu...»70.
- Hos barn lyckas mannitolexponeringen nöjaktigt från 7 års ålder och gränsvärdet har hög specificitet «Barben J, Kuehni CE, Strippoli MP ym. Mannitol dry...»71.
- 6. I behandlingstestet (medelhög dos av inhalationskortikosteroid med eventuellt tillägg
långverkande bronkdilaterande läkemedel i 8–12 veckor eller, i undantagsfall, prednisolon
20–40 mg/dygn i 5–7 dygn i samband med akut skov) konstateras en tydlig förbättring
av lungfunktionen. I spirometrin ökar FEV1 med minst 15 % och 200 ml, eller det genomsnittliga PEF-värdet ökar med minst 20
% och 60 l/min då värdena 3–5 dagar före behandlingen jämförs med värdena efter behandlingen.
- En symtomatisk astmapatient reagerar i allmänhet på läkemedelsbehandling och skiljer sig från en frisk person, men behandlingstestet särskiljer inte alltid mellan astma och KOL «Broekhuizen BD, Sachs AP, Moons KG ym. Diagnostic ...»72. Se närmare information under Differentialdiagnos «A1»2.
- Om lungfunktionsundersökningar inte är möjliga på grund av patientens bristfälliga funktionsförmåga, bedöms diagnosen och terapisvaret utifrån symtomsvaret.
- Alla lungfunktionsundersökningar är förknippade med ett flertal felkällor, och vid tolkningen av resultaten bör man fästa särskild uppmärksamhet vid undersökningarnas kvalitet «Keuhkojen toimintakokeiden laadun arviointi astmaa tutkittaessa»6.
Utredning av inflammationstyp vid allergi och astma
- Astmadiagnosen grundar sig på symtom och på påvisande av varierande luftvägsobstruktion. Sedan astma har konstaterats utreds dess inflammatoriska subtyp. För detta behövs grundläggande utredningar av allergi, mätning av eosinofiltalet i blodet och i vissa fall utredning av luftvägsinflammation (FeNO-mätning, inflammationsceller i sputum eller slemhinnebiopsi).
- Alla astmapatienter tillfrågas om symtom som tyder på respiratorisk allergi, och allergisk sensibilisering kartläggs genom pricktest eller bestämning av allergenspecifika IgE-antikroppar (dammspecifikation).
- Hos alla astmapatienter mäts eosinofiltalet i blodet i diagnosskedet, vid utredning av eventuella behandlingsproblem och i samband med försämringsskov, gärna före eventuell oral kortikosteroidbehandling (OCS). Ett förhöjt eosinofiltal i blodet (B-Eos > 0,3 x 109 celler/l) belyser den eosinofila inflammationstypen för astma och är en viktig riskfaktor för skov «Denlinger LC, Phillips BR, Ramratnam S ym. Inflamm...»73, «Couillard S, Laugerud A, Jabeen M ym. Derivation o...»74. Vid val av behandling av eventuell svår astma är det till hjälp om det i samband med tidigare skov insamlats information om eosinofilhalten i blodet innan oral kortikosteroidbehandling inletts (se punkt Behandling av astma, nivå 4 «A2»3).
- Inom specialsjukvården rekommenderas även kväveoxidmätning i utandningsluften (FeNO-mätning)
för bedömning av inflammationstyp vid astma, särskilt hos vuxna. Interleukin-13 inducerar
nämligen NO-produktion i bronkslemhinnan, och FeNO-värdet relaterar till eventuell
förekomst av typ 2-inflammation i bronkslemhinnan «Chibana K, Trudeau JB, Mustovich AT ym. IL-13 indu...»75.
- Rökning minskar FeNO-värdet och för rökare finns det inte tillräckliga forskningsdata om användningen av FeNO för bedömning av inflammationstypen eller terapisvaret vid astma «Ahovuo-Saloranta A, Csonka P, Lehtimäki L. Basic c...»76.
- Vid obehandlad astma talar en FeNO-halt under 25 ppb mot eosinofil inflammation, medan ett FeNO-värde över 50 ppb tyder på aktiv eosinofil inflammation «Dweik RA, Boggs PB, Erzurum SC ym. An official ATS...»77 och på ett gott terapisvar på inhalationskortikosteroidbehandling «Lehtimäki L, Csonka P, Mäkinen E ym. Predictive va...»78.
- Under behandling med inhalationskortikosteroid antyder en låg FeNO-halt mindre risk för försämringsskov och då har patienten i allmänhet ingen nytta av en effektivisering av inhalationskortikosteroidbehandlingen, medan en hög FeNO-halt står i samband med en högre risk för försämringsskov och då kan patienten ha nytta av en högre dos av inhalationskortikosteroid «Lehtimäki L, Csonka P, Mäkinen E ym. Predictive va...»78, «Lee LA, Bailes Z, Barnes N ym. Efficacy and safety...»79, «Busse WW, Wenzel SE, Casale TB ym. Baseline FeNO a...»80, «Couillard S, Laugerud A, Jabeen M ym. Derivation o...»74.
- Justering av inhalationskortikosteroiddosen utifrån resultatet av FeNO-mätningen snarare än symtomen eller lungfunktionsmätningarna reducerar dessutom förekomsten av försämringsskov både hos barn och vuxna utan att påverka symtomkontrollen, lungfunktionen eller den genomsnittliga dosen av inhalationskortikosteroid. Forskningsresultaten är dock så heterogena att det optimala gränsvärdet för FeNO är okänt och inte heller vet man vilken eller vilka patienttyper får största nyttan av o.a. tillvägagångssätt «Petsky HL, Kew KM, Turner C ym. Exhaled nitric oxi...»81, «Petsky HL, Kew KM, Chang AB. Exhaled nitric oxide ...»82.
- Om FeNO är över 25 ppb trots pågående behandling hos patienter med svår astma, tyder detta på ett gynnsamt svar på behandling med dupilumab «Castro M, Corren J, Pavord ID ym. Dupilumab Effica...»83 medan FeNO över 19,5 ppb kan tyda på ett gynnsamt svar på behandling med omalizumab «Hanania NA, Wenzel S, Rosén K ym. Exploring the ef...»84. FeNO-värdet har inget samband med svaret på behandlingar med anti-IL5/IL-5R «Pavord ID, Korn S, Howarth P ym. Mepolizumab for s...»85.
- Hos barn bör längdbaserade referensvärden användas vid bedömning av huruvida resultatet är avvikande «Malmberg LP, Petäys T, Haahtela T ym. Exhaled nitr...»86.
- Vid behov kan slemhinneinflammationen bedömas genom analys av inflammationscellerna i sputum eller av slemhinnebiopsi som erhållits vid bronkoskopi.
Bilddiagnostik
- Diagnosen astma görs inte utifrån en lungröntgenbild, men lungröntgen är indicerad för att utesluta andra orsaker till patientens symtom. Långvarig hosta kan förutom astma bero bl.a. på tuberkulos eller lungcancer.
- För differentialdiagnostik och för att utreda de vanliga problemen som förekommer i övre luftvägarna hos astmapatienter, kan nativröntgen eller datortomografi av näsans bihålor vara indicerad.
Diagnostiska undersökningar hos patienter med rikliga symtom
- Vanligtvis genomgår patienten initialt diagnostiska undersökningar och först därefter inleds underhållsbehandlingen med inflammationshämmande astmamedicineringen om detta är påkallat. En patient med symtom behöver en kortverkande beta2-agonist (symtomlindrande läkemedel) redan under undersökningarna.
- Om patienten har besvärliga symtom som förhindrar senareläggning av underhållsmedicineringen
tills undersökningarna slutförts, inleds behandlingen genast med inhalerbara läkemedel.
Initialt kan en kort kur med kortikosteroidtabletter vara indicerad.
- Innan behandlingen inleds, mäts PEF eller FEV1, helst före och efter inhalation av beta2-agonist.
- PEF-uppföljningen inleds samtidigt med behandlingen.
- Om PEF-värdet eller spirometriresultatet inte förbättras under behandlingen, talar detta mot astma men utesluter inte astma med säkerhet.
- I oklara situationer kan de diagnostiska undersökningarna upprepas efter en paus i underhållsbehandlingen på minst fyra veckor. Men om patienten får tydliga symtom redan efter en kortare läkemedelspaus kan undersökningarna upprepas och ett positivt fynd anses då vara tillförlitligt.
Differentialdiagnos
- Bland de viktigaste differentialdiagnostiska sjukdomarna finns kroniskt obstruktiv lungsjukdom (KOL), kronisk bronkit, bihåleinflammation, hjärt- och kärlsjukdomar, funktionell förträngning i struphuvudet, benägenhet för kollaps i de stora luftvägarna (EDAC eller trakeobronkomalaci), sömnapné, hyperventilationssyndrom och paniksyndrom.
- I Finland betraktas KOL som en progressiv, endast delvis reversibel luftvägsförträngning
relaterad till tobaksrökning. Diagnosen KOL ställs om en patient som röker eller som
har rökt uppvisar typiska symtom, har en typisk sjukdomshistoria och uppvisar efter
bronkdilatation en FEV1/FVC-kvot under 0,7 (se God medicinsk praxis-rekommendationen Kroniskt obstruktiv
lungsjukdom «Kroniskt obstruktiv lungsjukdom»4, «Keuhkoahtaumatauti. Käypä hoito -suositus. Suomala...»87).
- För differentialdiagnostik av astma och KOL räcker det inte enbart med lungfunktionsmätningar, utan man måste alltid också beakta patientens rök- och symtomanamnes, associerade sjukdomar och släkthistoria (se God medicinsk praxis-rekommendationen Kroniskt obstruktiv lungsjukdom «Kroniskt obstruktiv lungsjukdom»4), «Keuhkoahtaumatauti. Käypä hoito -suositus. Suomala...»87, «Global Initiative for Asthma (GINA). Global Strate...»1, «Global Initiative for Chronic Obstructive Lung Dis...»88.
- Under initialskedet av KOL förekommer andnöd i allmänhet endast vid ansträngning, symtomvariationen mellan olika dagar är mindre än vid astma och det finns i allmänhet inga anfallsliknande symtom eller symtom vid vila (symtom vid vila förekommer först då KOL-sjukdomen är svår eller vid KOL-exacerbationer). Vid astma är symtomen mer uttalade nattetid och på morgonen.
- Ett bronkdilatationstest särskiljer inte på ett tillförlitligt sätt astma från KOL «Global Initiative for Asthma (GINA). Global Strate...»1, «Global Initiative for Chronic Obstructive Lung Dis...»88, «Fingleton J, Weatherall M, Beasley R. Bronchodilat...»89, eftersom astmapatienterna får ibland ingen bronkdilatationsrespons och å andra sidan får cirka 25–50 % av KOL-patienterna ett signifikant bronkdilatationssvar «Calverley PM, Burge PS, Spencer S ym. Bronchodilat...»90, «Tashkin DP, Celli B, Decramer M ym. Bronchodilator...»91, «Albert P, Agusti A, Edwards L ym. Bronchodilator r...»92.
- Behandlingstestet särskiljer inte heller alltid astma från KOL «Global Initiative for Asthma (GINA). Global Strate...»1, «Global Initiative for Chronic Obstructive Lung Dis...»88.
- Om behandlingstestet normaliserar lungfunktionen är det fråga om astma och inte KOL.
- En astmapatient kan trots behandling och utan att ha utsatts för de typiska faktorer som ligger bakom KOL få permanent bronkobstruktion. Här är det inte fråga om KOL, utan om irreversibel astmarelaterad bronkobstruktion «Zhang L, He L, Gong J ym. Risk Factors Associated ...»93.
- Om patienten har nytta av läkemedlet som användes i behandlingstestet, är det skäl att fortsätta med det, oberoende av diagnos.
- Det är inte alltid möjligt att skilja mellan astma och KOL och patienten kan också ha båda sjukdomarna, vilket bör beaktas i behandlingen (se God medicinsk praxis-rekommendationen Kroniskt obstruktiv lungsjukdom «Kroniskt obstruktiv lungsjukdom»4), «Keuhkoahtaumatauti. Käypä hoito -suositus. Suomala...»87, «Global Initiative for Asthma (GINA). Global Strate...»1, «Global Initiative for Chronic Obstructive Lung Dis...»88.
- Funktionell struphuvudsförträngning (Inducible Laryngeal Obstruction, ILO) är förknippad
med paroxysmal andnöd på grund av förträngning i struphuvudet vid andning «Halvorsen T, Walsted ES, Bucca C ym. Inducible lar...»94.
- Symtomen, vanligtvis vinande andningsljud och känsla av andnöd, förekommer företrädesvis under inandningen, men de kan också förekomma under utandningen. Patienten upplever ofta en känsla av trånghet eller strypning på halsen.
- Typiska utlösande faktorer är fysisk ansträngning, slemhinneirritation (dofter, damm eller os) och, ibland, psykiska faktorer.
- Funktionell struphuvudsförträngning kan förekomma utan astma eller med astma.
- Funktionell struphuvudsförträngning misstänks om symtomen framträder närmast vid inandning
eller om terapisvaret på astmamedicinering är dåligt.
- Obs! Förträngning i struphuvudet sänker PEF-värdet och därför kan funktionell förträngning av struphuvudet orsaka ett felaktigt positivt fynd vid PEF-uppföljning.
- Se patientanvisningen för patienter med funktionell andningsstörning «hoi06030i.pdf»1.
Yrkesastma
Yrkesastma
- Med yrkesastma avses antingen att ny astma utvecklas eller att tidigare lindrig astma aktiveras på grund av sensibilisering för ett ämne som förekommer i arbetet eller engångs- eller upprepad exponering i arbetet för höga koncentrationer av ämnen som irriterar luftvägarna «Blanc PD, Annesi-Maesano I, Balmes JR ym. The Occu...»54, «Kogevinas M, Antó JM, Sunyer J ym. Occupational as...»55, «Karjalainen A, Kurppa K, Martikainen R ym. Explora...»56, «Vandenplas O, Suojalehto H, Cullinan P. Diagnosing...»95. I Finland ersätts också astma i samband med exponering för mikrober som härstammar från fuktskador i arbetet som yrkessjukdom «Jaakkola JJ, Piipari R, Jaakkola MS. Occupation an...»57, se Yrkessjukdomar – Arbetshälsoinstitutet «https://www.ttl.fi/sv/teman/arbetshalsa/yrkessjukdomar»1.
- Försäkringsbolaget beslutar om ersättning för yrkesastma. I Finland ersätts 50–100 fall av astma per år som yrkessjukdom.
- I Finland är incidensen av yrkesastma störst bland jordbrukare och djurskötare, bagare, andra arbetstagare inom livsmedelsbranschen, målare, processoperatörer inom industrin och arbetstagare inom den kemiska branschen «Kogevinas M, Zock JP, Jarvis D ym. Exposure to sub...»58, «Karjalainen A, Kurppa K, Virtanen S ym. Incidence ...»96.
- Patienten remitteras till en poliklinik för lungsjukdomar eller arbetsmedicin om en misstanke vaknat att hen exponerats för astmaframkallande ämnen i arbetet och ifall att symtomen, PEF-uppföljningen på arbetsplatsen eller andra undersökningsresultat tyder på yrkesastma.
- Regelbundna hälsokontroller i arbete där arbetstagare exponeras för astmaprovocerande faktorer kan förbättra prognosen för yrkesastma «Tarlo SM, Liss GM, Yeung KS. Changes in rates and ...»97.
Yrkesastma orsakad av sensibilisering
- Vid misstanke om yrkesastma genomförs de diagnostiska undersökningarna för astma (se punkten Diagnostik «A3»4).
- Uppföljning av PEF-värdet på arbetsplatsen ska genomföras i ett tidigt skede. Se närmare «https://www.ttl.fi/sv/teman/arbetshalsa/yrkessjukdomar/yrkesastma/pef-uppfoljning»2 .
- Utgående från resultatet av uppföljning av PEF-värdet på arbetsplatsen bedöms hur arbetet och exponeringen i arbetet påverkar astman «Ammattiastma»7. Astmadiagnosen ska helst inte göras utifrån uppföljningen av PEF-värdet på arbetsplatsen.
- Diagnosen yrkesastma kan fastställas tillräckligt tillförlitligt utan behov för exponeringsprov då följande fyra kriterier uppfylls 1) Astma har konstaterats. 2) Sjukdomsbilden tyder på yrkesastma. 3) IgE-medierad sensibilisering för arbetsrelaterad exponering är tydligt påvisad. 4) Resultaten av uppföljning av PEF-värdet på arbetsplatsen tyder på yrkesastma.
- I övriga situationer bekräftas diagnosen yrkesastma med ett specifikt exponeringstest för luftvägarna «Vandenplas O, Suojalehto H, Cullinan P. Diagnosing...»95, «Suojalehto H, Malmberg P, Lindström I, Harju T, Ka...»98, «Vandenplas O, Suojalehto H, Aasen TB ym. Specific ...»99.
Andra orsaker till yrkesastma
- Yrkesastma orsakad av irritation (tidigare kallad RADS) orsakas av engångs- eller upprepad exponering för höga koncentrationer av ämnen som irriterar luftvägarna, i allmänhet av frätande eller oxiderande kemikalier. Astmasymtomen debuterar strax efter exponeringen, vanligtvis senast inom några dagar eller veckor «Blanc PD, Annesi-Maesano I, Balmes JR ym. The Occu...»54, «Kogevinas M, Antó JM, Sunyer J ym. Occupational as...»55, «Karjalainen A, Kurppa K, Martikainen R ym. Explora...»56, «Brooks SM, Weiss MA, Bernstein IL. Reactive airway...»100.
Astma som förvärras i arbetsmiljön
- Astma som förvärras i arbetsmiljön betyder astma som försvåras på grund av förhållandena på arbetsplatsen sedan yrkesastma har konstaterats vara osannolik. Astma som förvärras i arbetsmiljön ersätts inte som yrkessjukdom.
- Var femte yrkesverksam person med astma upplever en försämring av sina symtom i arbetsmiljön «Henneberger PK, Redlich CA, Callahan DB ym. An off...»101, «Purokivi M, Sauni R, Hannu T, Harju T, Jaakkola M,...»102, «Saarinen K, Karjalainen A, Martikainen R ym. Preva...»103.
- Försämring av astmasymtom har associerats med följande agenser: olika damm, ångor, os, städkemikalier, fukt- och mögelskador i byggnaden, sensibiliserande agenser som orsakar astma, kalla förhållanden, fysiskt tungt arbete och psykisk stress «Le Moual N, Carsin AE, Siroux V ym. Occupational e...»104, «Kim JL, Henneberger PK, Lohman S ym. Impact of occ...»105.
- Mer information «Ammattiastma»7.
Astma hos äldre personer över 65 år
- Astma är en vanlig sjukdom hos äldre personer «Sherman CB. Late-onset asthma: making the diagnosi...»106 och dess incidens avviker inte från incidensen i andra åldersgrupper «Bauer BA, Reed CE, Yunginger JW ym. Incidence and ...»107.
- Astma hos äldre personer är ofta icke-allergisk «Honkamäki J, Hisinger-Mölkänen H, Ilmarinen P ym. ...»108, «Pakkasela J, Ilmarinen P, Honkamäki J ym. Age-spec...»10.
- Förekomsten av astma bland äldre ökar då befolkningen åldras och den förväntade livslängden ökar.
- Astma hos äldre personer torde vara underdiagnostiserad och underbehandlad och ny astma förekommer även hos äldre «Ikääntyneiden astma lienee alidiagnosoitu ja -hoidettu, ja uutta astmaa ilmaantuu ikääntyneillä.»B. Andra samtidiga sjukdomar, såsom hjärtsvikt och KOL, försvårar diagnostiken av astma, och äldre personer upplever inte förträngning i luftrören på samma sätt som yngre «Ekici M, Apan A, Ekici A ym. Perception of broncho...»109, «Connolly MJ, Crowley JJ, Charan NB ym. Reduced sub...»110, «Allen SC, Khattab A. The airflow resistance sensin...»111. Försämrad kognition försvårar identifieringen av symtom «Monisairas potilas. Käypä hoito -suositus. Suomala...»112.
- I den diagnostiska utredningen följs inte alltid rekommendationerna «Bauer BA, Reed CE, Yunginger JW ym. Incidence and ...»107, trots att 90 % av befolkningen över 65 år kan utföra framgångsrikt exempelvis spirometri «Enright PL, McClelland RL, Newman AB ym. Underdiag...»113 och bronkdilatationstest «Lehmann S, Vollset SE, Nygaard HA ym. Factors dete...»114. PEF-uppföljningen kan uppvisa dämpad dygnsvariation hos äldre personer på grund av stelhet i bröstkorgen eller muskelsvaghet. Bristen på PEF-variation utesluter inte astma.
- Trots att atopisk allergi har mindre betydelse för astma hos äldre än hos yngre personer, är sensibilisering framför allt mot inomhusallergener «Huss K, Naumann PL, Mason PJ ym. Asthma severity, ...»118 vanligare hos äldre personer med astma än hos personer utan astma «Burney PG, Britton JR, Chinn S ym. Descriptive epi...»115, «Braman SS, Kaemmerlen JT, Davis SM. Asthma in the ...»116, «Litonjua AA, Sparrow D, Weiss ST ym. Sensitization...»117, och allergiutredningar ingår också i den diagnostiska utredningen för äldre. Det saknas tydlig kunskap om hur sensibilisering och exponering påverkar astmans svårighetsgrad hos äldre «Skloot GS, Busse PJ, Braman SS ym. An Official Ame...»126.
- Behandling med inhalationskortikosteroider minskar såväl behovet för sjukhusvård som dödligheten hos äldre personer med astma «Sin DD, Tu JV. Inhaled corticosteroid therapy redu...»119, men dålig behandlingsföljsamhet och låg läkemedelsanvändning ökar användningen av hälso- och sjukvårdstjänster «Goeman DP, Douglass JA. Optimal management of asth...»120. Dessutom behöver äldre personer oftare sjukhusvård än yngre «Harju T, Keistinen T, Tuuponen T ym. Hospital admi...»121 och dödligheten är högre «Tsai CL, Lee WY, Hanania NA ym. Age-related differ...»122.
- Neutrofil inflammation är vanligare hos äldre personer med astma än hos yngre «Busse PJ, Birmingham JM, Calatroni A ym. Effect of...»123 och reagerar sämre på kortikosteroidbehandling «Dunn RM, Lehman E, Chinchilli VM ym. Impact of Age...»124. Åren 2015–2018 dog i genomsnitt 79 personer årligen i astma i Finland, varav cirka 93 % var över 65 år «Tilastokeskus. www.stat.fi. Viitattu 1.2.2020...»125.
- Åldersrelaterade fysiologiska och immunologiska förändringar påverkar hur astma yttrar sig, och hos äldre personer är inflammationen i regel något annat än eosinofil typ 2-inflammation, vilket försvagar responsen på inhalationskortikosteroider. Utöver valet av läkemedel kräver patientens inhalationsteknik och behandlingsföljsamhet särskild uppmärksamhet «Skloot GS, Busse PJ, Braman SS ym. An Official Ame...»126, «Dunn RM, Busse PJ, Wechsler ME. Asthma in the elde...»127.
Behandling av astma
Syfte för behandlingen av astma
- Syftet med behandlingen av astma är att på individuell nivå förebygga nedsatt funktionsförmåga, arbetsoförmåga och dödsfall på grund av astma.
- Målet för alla astmapatienter är symtomfrihet, normal lungfunktion och förebyggande av skov. Patienten ska endast använda de läkemedel som behandlingen av sjukdomen förutsätter.
- Centralt för behandlingen är att
- inleda behandling av ny astma med regelbunden astmamedicinering
- öka eller minska behandlingen enligt sjukdomskontrollen: målet är alltid god astmakontroll
- behandla försämringsskov utan dröjsmål och förebygga dem.
Astmakontroll
- Astmabehandlingen baseras på kontinuerlig bedömning av astmakontrollen. Astmakontrollen omfattar den aktuella symtomkontrollen och riskfaktorerna som är kopplade till framtida astmaproblem (tabell «Bedömning av astmakontrollen under pågående behandling omfattar kartläggning av symtomen och riskfaktorerna som associeras med sämre prognos....»2).
- Astmasymtomkontrollen bör följas upp med hjälp av en validerad symtomenkät, t.ex. Astmatestet.
- Riskfaktorerna för eventuella astmaproblem kartläggs bl.a. genom att utreda tidigare försämringsskov och kontrollera läkemedelsanvändningen.
- Under uppföljningsbesöken ligger fokus på att behandla faktorer som försämrar astmakontrollen och på att förebygga försämringsskov genom att hantera relevanta riskfaktorer. Astmamedicineringen ändras vid behov, om astman inte är under god kontroll.
- Lungfunktionen hos alla patienter följs upp med spirometri minst med 2–5 års intervall. Lungfunktionen följs upp med tätare intervaller, särskilt vid dålig astmakontroll eller när patienten har riskfaktorer för försämringsskov. Uppföljningen av barn sker i allmänhet årligen.
- Om en ökning av medicineringen inte förbättrar astmakontrollen återgår man till föregående dosering. Onödig polyfarmaci undviks.
- Om astmakontrollen varit god under en längre tid (t.ex. 6–12 månader), prövas en minskning av medicineringen. Se punkten Lättare läkemedelsbehandling «A4»5.
- Vid behandling av alla astmapatienter strävar man efter god astmakontroll, men om det gäller att effektivisera och fortsätta medicineringen, är det alltid viktigt att avväga för- och nackdelarna. Hos en del patienter kan god astmakontroll inte uppnås, och då får man nöja sig med att patienten klarar sin vardag.
| BEDÖMNING AV ASTMASYMTOMKONTROLLEN (under de föregående 4 veckorna) | |||
|---|---|---|---|
| ICS = inhalationskortikosteroid OCS = oral kortikosteroid |
|||
| God symtomkontroll | Måttlig symtomkontroll | Dålig symtomkontroll | |
| Astmasymtom dagtid | ≤ 2 gånger i veckan, helst inte alls | Målet för bra kontroll har uppnåtts åtminstone på en punkt | Målet för bra kontroll har inte uppnåtts på tre eller flera punkter |
| Astmasymtom nattetid | Inte alls | ||
| Behov av symtomlindrande läkemedel | ≤ 2 gånger i veckan, helst inte alls | ||
| Begränsade vardagssysslor (t.ex. arbete, studier, hobbyer) | Inte alls | ||
| Riskfaktorer som associeras med astmaproblem | |||
Riskfaktorer för försämringsskov:
|
|||
Riskfaktorer för permanent obstruktion:
|
|||
Riskfaktorer för läkemedelsbiverkningar:
|
|||
| Omarbetad från källa «Global Initiative for Asthma (GINA). Global Strate...»1 | |||
Systematisk utredning av astma vid dåligt terapisvar eller dålig kontroll
- Om den påbörjade astmamedicineringen inte ger ett gott behandlingssvar eller om astmakontrollen
är fortgående dålig, utförs en systematisk astmautredning som omfattar följande:
- Är astmadiagnosen tillförlitlig?
- Tydde symtomen ursprungligen på astma? Har patienten en tillförlitlig diagnos som grundar sig på lungfunktionsmätningar? Observera att en astmadiagnos som grundar sig på PEF-uppföljning inte är tillförlitlig om patienten har atypiska symtom och/eller dåligt terapisvar.
- Är de nuvarande symtomen med säkerhet orsakade av astma?
- Är symtomen förenliga med luftrörsförträngning på grund av sammandragning av glatt bronkmuskulatur, eller kan symtomen bero på funktionella andningsstörningar, funktionell förträngning i struphuvudet, hosta på grund av slemhinnekänslighet, infektionssymtom eller exempelvis hjärtsjukdom?
- Har patienten accepterat att ta sin underhållsmedicin enligt ordination (kontrollera läkemedelsinköpen), kan patienten använda sin inhalator rätt (kontrollera tekniken) och använder patienten tillräckligt med astmamedicin (se behandlingsnivåerna nedan)?
- Har faktorerna som förvärrar astman och associerade sjukdomar beaktats och behandlats?
- Är astmadiagnosen tillförlitlig?
Undvikande av försämringsfaktorer (triggers) och hyposensibilisering
- Astmapatienterna ska sluta röka och undvika tobaksrök. Personer med icke-allergisk astma behöver inte undvika inandningsbara allergener.
- Allergiska patienter ska fästa uppmärksamhet vid inomhusmiljön. Om exempelvis exponering för djurdamm upphör, kan sjukdomen lindras, men evidensen som talar för på detta är knapp «Shirai T, Matsui T, Suzuki K ym. Effect of pet rem...»128, «Leas BF, D’Anci KE, Apter AJ, Bryant-Stephens T, S...»129.
- Exponering för fukt- och mögelskador i inomhusmiljön ökar luftvägssymtomen hos personer med astma. Inverkan av bostadsrenoveringar på läkning eller lindring av astmasjukdomen har endast undersökts i begränsad omfattning, men reparation av fuktskador kan lindra symtomen «Sauni R, Verbeek JH, Uitti J ym. Remediating build...»130. Att upptäcka och åtgärda fuktskador utan dröjsmål är dock en väsentlig del av symtompreventionen.
- Mängden dammkvalster i finländska hem är i allmänhet liten, men ibland kan dammkvalster utgöra ett betydande allergen. Om man misstänker kontinuerlig exponering och att exponeringsfaktorn inverkar på astmabalansen, kan sublingual hyposensibilisering övervägas. Dammkvalsterhyposensibilisering kan förbättra astmabalansen «Agache I, Laculiceanu A, Cojanu C ym. Advances in ...»131. Allmänt taget är hyposensibilisering inte den primära behandlingen av astma, men används för behandling av pollenallergier, och ibland djurallergier, om patienten förutom astma också har allergisk rhinokonjunktivit. Se God medicinsk praxis-rekommendationen Hyposensibilisering «Hyposensibilisering»5, «Siedätyshoito. Käypä hoito -suositus. Suomalaisen ...»132.
- Patienter som är överkänsliga mot icke-steroida antiinflammatoriska läkemedel (NSAID) ska undvika dem, men de flesta astmapatienterna kan använda dem normalt.
- Föroreningar i utomhusluften, t.ex. kvävedioxid, svaveldioxid och ozon, ökar risken för astmaanfall och förvärrar luftvägssymtomen «Global Initiative for Asthma (GINA). Global Strate...»1, «Shin SW, Bae DJ, Park CS ym. Effects of air pollut...»133, «Liu Y, Pan J, Zhang H ym. Short-Term Exposure to A...»134. Små partiklar i omgivningsluften har associerats med ökad risk för astma, men deras betydelse för astmasymtomen är däremot oklar «Ward DJ, Ayres JG. Particulate air pollution and p...»135, «Cai Y, Zijlema WL, Doiron D ym. Ambient air pollut...»136. Undersökningar av luftföroreningar har i allmänhet gjorts i länder där omgivningsluften är mer förorenad än i Finland.
- Behandling av refluxsjukdom med protonpumpshämmare påverkar i allmänhet inte astmans behandlingsbalans «Chan WW, Chiou E, Obstein KL ym. The efficacy of p...»47. Symtomgivande refluxsjukdom hos astmatiker behandlas på samma sätt som hos andra.
- Vid konstaterad yrkesastma bör arbetstagaren omplaceras till arbetsuppgifter där exponeringen för det utlösande ämnet helt upphör «Henneberger PK, Patel JR, de Groene GJ ym. Workpla...»137. I vissa fall kan exponeringen reduceras väsentligt; exempelvis jordbrukare tar i allmänhet i bruk motoriserat andningsskydd i arbete som medför exponering.
Läkemedelsfri behandling
- Personer med astma uppmanas att vaccinera sig mot säsongsinfluensa och Covid-19 «Global Initiative for Asthma (GINA). Global Strate...»1.
- Rökstopp och undvikande av passiv exponering för tobaksrök förbättrar astmakontrollen «Guilbert TW, Morgan WJ, Zeiger RS ym. Long-term in...»225.
- Regelbunden motion rekommenderas på grund av hälsofördelarna: aerobisk träning kan lindra astmasymtomen en aning och förbättra lungfunktionen, medan inflammationen inte påverkas «Hansen ESH, Pitzner-Fabricius A, Toennesen LL ym. ...»140.
- Fysisk träning förbättrar den kardiorespiratoriska prestationsförmågan och tycks förbättra livskvaliteten och astmakontrollen, men påverkar inte lungfunktionen «Fyysinen harjoittelu parantaa kardiorespiratorista suorituskykyä ja ilmeisesti lisää terveyteen liittyvää elämänlaatua ja astman hallintaa, mutta ei vaikuta keuhkojen toimintaan.»B. Astmatiker som ägnar sig åt intensiv uthållighetsträning (skidning, simning, uthållighetslöpning) kan få ökade astmasymtom, men symtomen förblir vanligtvis lindriga «Karjalainen A, Kurppa K, Martikainen R ym. Work is...»141.
- Hos obesa personer kan en viktminskning på 5–10 % förbättra astmakontrollen och livskvaliteten «Scott HA, Gibson PG, Garg ML ym. Dietary restricti...»142.
- Andningsövningar kan komplettera behandlingen av astma och ha en gynnsam inverkan på subjektiva symtom och livskvalitet, men andningsövningar minskar inte förekomsten av försämringsskov och förbättrar inte heller lungfunktionen «Santino TA, Chaves GS, Freitas DA ym. Breathing ex...»143.
Läkemedelsbehandling av astma hos vuxna och barn över 12 år
- För att lindra symtomen ska alla astmapatienter ha vid behov tillgång till ett bronkdilaterande symtomlindrande läkemedel som vidgar luftrören snabbt. Det gäller oftast en snabbverkande (salbutamol, terbutalin) eller snabb- och långverkande (formoterol) beta2-agonist «Behandling av astma hos vuxna och ungdomar på minst 12 år»2 eller en kombination av inhalerbar kortikosteroid och formoterol. Kortverkande antikolinergika kan också användas som symtomlindrande läkemedel vid astma, antingen ensamt eller tillsammans med en kortverkande beta2-agonist.
- Om behovet av symtomlindrande läkemedel mot upprepade astmasymtom blir regelbundet, är detta ett tecken på dålig astmakontroll. I sådana fall ska astmabehandlingen utvärderas på nytt. Då en minskning eller seponering av symtomlindrande astmamedicin lyckas, är detta är en viktig indikator på framgångsrik och effektiv behandling.
- Beroende på sjukdomens svårighetsgrad, kan olika astmamediciner användas ensamt eller i kombination för underhållsbehandling av astmasjukdomen «Behandling av astma hos vuxna och ungdomar på minst 12 år»2. De rekommenderade doserna för inhalationskortikosteroider presenteras i tabell «Riktgivande doser av inhalationskortikosteroider från pulverinhalatorer och drivgasaerosoler till personer över 12 år. ...»3.
| * De använda doserna av samma läkemedelsmolekyl kan skilja sig avsevärt mellan olika
inhalatorer. ** Trimbow-dosen anges som den dos som utgår från apparatens munstycke (ex-actuator-dosen 87 μg), och därför avviker gränsvärdena från motsvarande dos för Innovair (där dosen anges som den dos som utgår från apparatens behållare, ex-valve-dosen 100 μg). *** För Budesonid anges dosen från inhalatorer som innehåller ett verksamt ämne (Budesonid, Pulmicort) som dosen från inhalatorns behållare (ex-valve-dos 100, 200 och 400 μg) och för kombinationspreparat (Bufomix, Symbicort) som dosen från inhalatorns munstycke (ex-actuator-dos 80, 160 och 320 μg), och därför avviker de angivna gränsvärdena från varandra. *** För mometasonfuroat beror läkemedelsdosen som når lungorna i hög grad på inhalatortyp och på hjälpämnena som ingår i preparatet, och därför avviker de riktgivande doserna mellan de olika preparaten mycket. |
|||
| Tabellen visar inte exakta skillnader i behandlingseffekten eller dosmotsvarigheterna mellan preparaten. De flesta av inhalationskortikosteroidernas fördelar uppnås redan vid låg dos, men en del patienter behöver en medelhög dos. Endast få patienter behöver en hög dos, och med tanke på eventuella biverkningar bör en hög dos i allmänhet användas endast om det trots en medelhög dos och tilläggsläkemedel förekommer skov och aktiv eosinofil inflammation, där symtomen är förknippade med allergi eller B-Eos > 0,3 x 109 celler/l eller FeNO > 25 ppb. I tabellen används läkemedlens handelsnamn, eftersom det finns betydande skillnader i de använda doserna mellan olika preparat med samma aktiva substans, vilket beror på inhalatortekniken och principen för dosangivelse (dos som uppmätts i enheten eller dos som lämnar enheten). Läkemedelsförteckningen har sammanställts utifrån försäljningstillstånden som gällde 4.1.2022, med undantag för preparat med specialtillstånd. Tabellen anger både inhalatorer enbart med kortikosteroid och kombinationsinhalatorer med kortikosteroid och långverkande bronkdilatator. Gruppering enligt kortikosteroid. | |||
| Läkemedelsmolekyl och inhalator* | Vanlig behandlingsdos (μg/dygn) | Hög dos som behövs sällan (μg/dygn) | |
|---|---|---|---|
| Låg dos | Medelhög dos | ||
| Beklometason | |||
| Traditionell inhalator (Beclomet EH®) |
200–500 | > 500–1 000 | > 1 000 |
| Finfördelad aerosol (Aerobec®, Innovair®) |
100–200 | > 200–400 | > 400 |
| Finfördelad aerosol (Trimbow®**) |
– | 348 (87 µg, 2 x 2) | 696 (174 µg, 2 x 2) |
| Budesonid*** | |||
| Budesonid EH®, Pulmicort® |
200–400 | > 400–800 | > 800 |
| Bufomix EH®, Symbicort® |
160–320 | > 320–640 | > 640 |
| Flutikasonfuroat | |||
| Relvar® | – | 92 | 184 |
| Flutikasonpropionat | |||
| Flixotide®, Flutiform®, Salflumix EH®, Salmeson®, Salmex®, Seretide® |
100–250 | > 250–500 | > 500 |
| Mometasonfuroat**** | |||
| Asmanex® | 200 | > 200–400 | > 400 |
| Atectura® | 62,5 | 127,5 | 260 |
| Enerzair® | – | – | 136 |
| Ciklesonid | |||
| Alvesco® | 80–160 | > 160–320 | > 320 |
Nivå 1: Sporadisk användning av bronkdilaterande läkemedel räcker till för att hålla astman under kontroll (se bild «Behandling av astma hos vuxna och ungdomar på minst 12 år»2).
- Denna nivå betyder inte att behandlingen av ny, symtomgivande astma skulle påbörjas
från denna nivå. Behandlingen av astma inleds på nivå 2 eller 3. Symtomlindrande
medicinering som används vid behov som enda läkemedel lämpar sig endast för patienter
med normal lungfunktion och sporadiska symtom dagtid högst 2 gånger per månad och
som inte har astmatiska försämringsskov. Om symtom förekommer flera gånger i månaden
eller om de ökar periodvis (t.ex. i samband med infektioner eller under pollensäsongen),
påbörjas regelbunden underhållsmedicinering för viss tid eller kontinuerligt. Det
symtomlindrande läkemedlet som tas vid behov kan utgöras av en kortverkande beta2-agonist, en kombination av kortverkande beta2-agonist och antikolinergikum eller ett symtomlindrande, inflammationsdämpande läkemedel,
alltså en kombination av inhalationskortikosteroid och formoterol. Om patientens biverkningströskel
för beta2-agonister är låg, kan ett kortverkande antikolinergikum vara lämpligt symtomlindrande
läkemedel.
- Hos astmapatienter orsakar fysiska aktiviteter ofta hosta, vinande och andningssvårigheter, vilket innebär att sjukdomen inte är under god kontroll. Insättning eller effektivisering av regelbunden underhållsmedicinering minskar symtomen vid ansträngning. Det finns ingen separat "ansträngningsastma", utan symtom som framträder vid ansträngning tyder helt enkelt på att sjukdomen är aktiv.
- Långverkande beta2-agonister ska inte användas som enda läkemedel för behandling av astma. Om de används som monoterapi, ökar risken för att astman försvåras och för astmadöd «Cates CJ, Cates MJ, Lasserson TJ. Regular treatmen...»144, «Cates CJ, Cates MJ. Regular treatment with salmete...»145. Samtidig användning av långverkande beta2-agonist och inhalationskortikosteroid har inte konstaterats öka risken för dödsfall «Stempel DA, Raphiou IH, Kral KM ym. Serious Asthma...»146.
- Den internationella vårdrekommendationen för astma rekommenderar en kombination av
inhalationskortikosteroid och formoterol att tas av astmapatienter vid behov om symtomen
är sporadiska och om medicineringen varit på nivå 1 «Global Initiative for Asthma (GINA). Global Strate...»1.
- Denna behandling har inte undersökts hos patienter på nivå 1 med sporadiska symtom, utan rekommendationen har extrapolerats från studier som gjorts med astmapatienter på regelbunden behandling. Grunden till rekommendationen ligger i följande säkerhetssynpunkt «Global Initiative for Asthma (GINA). Global Strate...»1: om en astmapatient, som endast använder symtomlindrande läkemedel och som har sporadiska symtom, inte uppsöker vård när symtomen ökar och om en regelbunden underhållsmedicinering då inte inleds, löper patienten stor risk för försämringsskov om hen använder endast kortverkande bronkdilatorer för symtomlindring och inte en kombination av inhalationskortikosteroid och formoterol för symtomlindring.
Nivå 2: Regelbunden medicinering behövs för kontroll av astma.
- För symtomatiska patienter inleds behandlingen i regel med medicinering på nivå 2, ibland på nivå 3.
- Dosen av inhalationskortikosteroid är vanligen liten eller högst medelhög. De största fördelarna uppnås redan med en liten dos och risken för biverkningar ökar när dosen ökar «Beasley R, Harper J, Bird G ym. Inhaled Corticoste...»147. Riktgivande doser och dosmotsvarigheter presenteras i tabell «Riktgivande doser av inhalationskortikosteroider från pulverinhalatorer och drivgasaerosoler till personer över 12 år. ...»3.
- Det finns ingen betydande skillnad i behandlingseffekt om behandlingen inleds med en mindre eller större dos av inhalationskortikosteroid «Powell H, Gibson PG. High dose versus low dose inh...»148, «Global Initiative for Asthma (GINA). Global Strate...»1.
- Under cirka 3–12 månader eftersträvas den lägsta möjliga dosen av inhalationskortikosteroid som upprätthåller astmakontrollen.
- Om inga tecken på terapisvar ses inom en månad, utförs den systematiska astmautredningen ovan. Vid behov övergår man till medicinering på nivå 3.
- Leukotrienblockerare (montelukast) är ett andrahandsalternativ då behandlingen av lindrig astma inleds «Global Initiative for Asthma (GINA). Global Strate...»1, «Expert Panel Working Group of the National Heart, ...»149, «Ducharme FM, Hicks GC. Anti-leukotriene agents com...»150, men hos vuxna är effekten av montelukast inte alltid tillräcklig. I allmänhet är en medelhög dos av inhalationskortikosteroid effektivare än en leukotrienblockerare «Ducharme FM, Hicks GC. Anti-leukotriene agents com...»150.
- Symtomlindrande läkemedel används vid behov. Om behovet är litet (högst 2 dagar i veckan), tyder detta på adekvat behandlingen, medan ett ökat behov tyder på dålig astmakontroll.
- Trots att den internationella vårdrekommendationen på nivå 2 rekommenderar primärt behandling med en kombination av inhalationskortikosteroid och formoterol vid behov och inte regelbunden inhalationskortikosteroidbehandling i låg dos «Global Initiative for Asthma (GINA). Global Strate...»1, rekommenderar vi inte detta som förstahandsalternativ i finsk praxis. Orsaken är att det trots allt finns förhållandevis få studier som belyser denna fråga och både symtomkontrollen och lungfunktionen föreföll bättre i gruppen som tog regelbunden inhalationskortikosteroid «O'Byrne PM, FitzGerald JM, Bateman ED ym. Inhaled ...»151, «Bateman ED, Reddel HK, O'Byrne PM ym. As-Needed Bu...»152.
Nivå 3: Tilläggsbehandling utöver antiinflammatoriska astmaläkemedel behövs för kontroll av astma.
- Enligt rekommendationen inleds behandlingen av en patient med ny astma i regel med
medicinering på nivå 2, men om astmasymtomen är uttalade, om hen har besvärlig obstruktion
eller om terapisvaret på inhalationskortikosteroider ser ut att bli svagt (lågt FeNO,
rökning, betydande övervikt) kan behandlingen inledas från nivå 3 «Global Initiative for Asthma (GINA). Global Strate...»1, «Ni Chroinin M, Greenstone I, Lasserson TJ ym. Addi...»153.
- Vi behandlingsstart ger kombinationen ICS+LABA snabbare symtomlindring och snabbare förbättring i lungfunktionen än enbart inhalationskortikosteroidbehandling «Ni Chroinin M, Greenstone I, Lasserson TJ ym. Addi...»153.
- Rökning «Polosa R, Thomson NC. Smoking and asthma: dangerou...»154, övervikt «Pradeepan S, Garrison G, Dixon AE. Obesity in asth...»155 och lågt FeNO «Lehtimäki L, Csonka P, Mäkinen E ym. Predictive va...»78 förknippas med sämre respons på inhalationskortikosteroider.
- Om patienten använder medicinering på adekvat sätt på nivå 2 men ändå uppvisar symtom,
kompletteras medicineringen (utöver den lilla eller medelhöga dosen av inhalationskortikosteroid)
med ett av följande läkemedel:
- långverkande beta2-agonist
- långverkande antikolinergikum
- leukotrienblockerare.
- Användningen av kompletterande astmamedicin inleds helst med ett läkemedel åt gången, och sedan fortsätter eller avslutas behandlingen beroende på hur patienten svarar på läkemedlet. Läkemedel kan också kombineras.
- Det effektivaste tilläggsläkemedlet är lämplig långverkande beta2-agonist som tillsammans med inhalationskortikosteroid i regel administreras med samma
inhalator (kombinationspreparat). Kombinationen minskar bl.a. förekomsten av försämringsskov
som kräver oral kortikosteroidbehandling, symtom och behovet av symtomlindrande läkemedel.
Kombinationen förbättrar också resultaten av lungfunktionstesterna i högre grad än
samma dos «Ducharme FM, Ni Chroinin M, Greenstone I ym. Addit...»156 eller minst dubbel dos av inhalerad kortikosteroid «Ducharme FM, Ni Chroinin M, Greenstone I ym. Addit...»156.
- Ett kombinationspreparat som innehåller budesonid eller beklometason och formoterol (6 μg) kan användas regelbundet morgon och kväll eller som symtomlindrande läkemedel i stället för kortverkande symtomlindrande läkemedel. Behandlingsmodellen med en enda inhalator har visat sig mer effektiv i att minska antalet försämringsskov som kräver oral kortikosteroidbehandling jämfört med en kombination av långverkande beta2-agonist och kortikosteroid som tas regelbundet plus kortverkande beta2-agonist som tas vid behov. Däremot minskar den aktuella behandlingsmodellen generellt inte de dagliga symtomen mer effektivt än den traditionella behandlingsmodellen «Lehtimäki L, Csonka P, Mäkinen E ym. Predictive va...»78, «Kew KM, Karner C, Mindus SM ym. Combination formot...»157, «Rogliani P, Ritondo BL, Ora J ym. SMART and as-nee...»158. Också i denna behandlingsmodell är läkemedelsdoserna som patienten tar för symtomlindring ett mått på behovet att utvärdera huruvida den regelbundna basmedicineringen (morgon- och kvällsdoser) räcker till eller inte.
- Långverkande antikolinergika som regelbunden tilläggsmedicinering har undersökts för
behandling av vuxenastma antingen utöver inhalationskortikosteroid eller utöver en
kombination av inhalationskortikosteroid plus långverkande beta2-agonist. Biverkningarna har varit ringa och framför allt har lungfunktionen förbättrats.
Försämringsskoven kan minska i antal och symtomkontrollen kan bli bättre. Det finns
mest forskningsevidens för tiotropium, men hos vuxna har man också undersökt glykopyrronium
och aklidinium.
- Trots användningen av inhalationskortikosteroid hos vuxenpatienter med symtom förbättrar tillägg av ett långverkande antikolinergikum lungfunktionen och minskar antalet skov, men någon tydlig effekt på symtomen ses inte «Anderson DE, Kew KM, Boyter AC. Long-acting muscar...»159. Det är oklart om tillägg av ett långverkande antikolinergikum är effektivare i en sådan situation än en ökning av dosen inhalationskortikosteroid «Evans DJ, Kew KM, Anderson DE ym. Long-acting musc...»160. Det förefaller dock som om ett långverkande antikolinergikum skulle vara ett lika bra tilläggsläkemedel som en långverkande beta2-agonist «Kew KM, Evans DJ, Allison DE ym. Long-acting musca...»161, men den övergripande forskningsevidensen är starkare för långverkande beta2-agonister.
- Tillägg av ett långverkande antikolinergikum, utöver en inhalationskortikosteroid och en långverkande beta2-agonist, hos symtomatiska vuxenpatienter med astma förbättrar lungfunktionen, men resultaten är motstridiga när gäller inverkan på försämringsskoven och symtomkontrollen «Kew KM, Dahri K. Long-acting muscarinic antagonist...»162, «Lee LA, Bailes Z, Barnes N ym. Efficacy and safety...»79, «Virchow JC, Kuna P, Paggiaro P ym. Single inhaler ...»163, «Kerstjens HAM, Maspero J, Chapman KR ym. Once-dail...»164. Tillägg av ett långverkande antikolinergikum, utöver inhalationskortikosteroid och långverkande beta2-agonist, ger sannolikt störst effekt hos patienter som trots tidigare behandling har kvarstående obstruktion och reversibel luftvägsobstruktion «Singh D, Virchow JC, Canonica GW ym. Extrafine tri...»165, «Singh D, Virchow JC, Canonica GW ym. Determinants ...»166.
- Som tilläggsläkemedel kan man också använda leukotrienblockerare som tas oralt dagligen.
- Kombinationen av långverkande inhalationsbeta2-agonist och inhalationskortikosteroid minskar dock effektivare astmasymtomen, behovet av symtomlindrande läkemedel och förekomsten av försämringsskov än kombinationen inhalationskortikosteroid plus leukotrienblockerare «Ducharme FM, Lasserson TJ, Cates CJ. Addition to i...»167.
- Behandlingen av astma kan effektiviseras genom ökning av inhalationskortikosteroiddosen,
men effekten är i allmänhet liten om dosen redan är medelhög «Beasley R, Harper J, Bird G ym. Inhaled Corticoste...»147, «Kankaanranta H, Lahdensuo A, Moilanen E ym. Add-on...»168, «Adams N, Bestall J, Jones PW. Budesonide at differ...»169, «Adams N, Bestall J, Jones P. Beclomethasone at dif...»170, «Adams NP, Bestall JC, Jones P ym. Fluticasone at d...»171, «Bousquet J, Ben-Joseph R, Messonnier M ym. A meta-...»172. Effekten syns i första hand som minskad incidens av försämringsskov, men inte nödvändigtvis
i den dagliga symtomgivningen «Lee LA, Bailes Z, Barnes N ym. Efficacy and safety...»79, «Adams N, Bestall J, Jones PW. Budesonide at differ...»169.
- En övergång till en hög dos av inhalationskortikosteroid bör ske endast om patienten trots kombinationsbehandling med en medelhög inhalationskortikosteroiddos fortfarande upplever försämringsskov och aktiv eosinofil inflammation (FeNO över 25 ppb och/eller B-Eos över 0,3 x 109 celler/l) «Lee LA, Bailes Z, Barnes N ym. Efficacy and safety...»79.
- Långvarig användning av höga doser av inhalationskortikosteroid ökar risken för både lokala och systemiska biverkningar «Powell H, Gibson PG. High dose versus low dose inh...»148, «Lipworth BJ. Systemic adverse effects of inhaled c...»173, «Powell H, Gibson PG. Inhaled corticosteroid doses ...»174.
- Hos multisymtomatiska patienter kan inhalationskortikosteroid kombineras med astmaläkemedel som har olika verkningsmekanismer.
Nivå 4: Specialbehandling vid svår astma.
- Om astman inte kan kontrolleras med medicinering på nivå 3, är en systematisk utredning indicerad. Vid behov remitteras patienten till specialsjukvården.
- I följande fall är det fråga om svår astma som kräver läkemedelsbehandling på nivå
4:
- en specialist som är insatt i diagnostik och behandling av svår astma har gjort en systematisk utredning för svårbehandlad astma
- trots medicinering på nivå 3 har patienten dålig symtomkontroll och/eller upprepade försämringsskov (≥ 2 skov per år som kräver oral kortikosteroidbehandling eller ≥ 1 svåra skov per år som kräver sjukhusvård) «Global Initiative for Asthma (GINA). Global Strate...»1
- I samband med svår astma ska inflammationstypen för astma alltid fastställas, eftersom
den påverkar valet av eventuella specialbehandlingar «Global Initiative for Asthma (GINA). Global Strate...»1, «Lehtimäki L, Karjalainen J. Erikoissairaanhoidon r...»3.
- Allergisk eosinofil astma kan konstateras om patienten har IgE-medierad sensibilisering och exponering för dessa allergener orsakar astmasymtom.
- Icke-allergisk eosinofil astma kan konstateras om kriterierna för allergisk astma
inte uppfylls, men patienten har fynd som tyder på eosinofil slemhinneinflammation
- B-Eos över 0,3 x 109 celler/l, eller
- FeNO över 25 ppb under behandling med inhalationskortikosteroid (eller över 50 ppb utan behandling med inhalationskortikosteroid), eller
- eosinofilkoncentrationen i sputumprov är minst 2 %, eller
- eosinofil inflammation konstateras i biopsi från luftrörsslemhinnan.
- Det finns inga allmänt godkända kriterier för neutrofil astma, men karakteristiskt för den är ökat neutrofiltal i sputumprov eller neutrofili i biopsi från luftrörsslemhinnan.
- Paucigranulocytär astma kan konstateras om astmadiagnosen är tillförlitlig och kriterierna för ovannämnda andra inflammationstyper inte uppfylls.
- Orala kortikosteroider är effektiva vid svår allergisk och icke-allergisk eosinofil astma, men upprepade kurer eller regelbunden användning bör undvikas på grund av läkemedelsbiverkningar «Global Initiative for Asthma (GINA). Global Strate...»1.
- Följande biologiska läkemedel används för behandling av svår astma «Global Initiative for Asthma (GINA). Global Strate...»1, «Agache I, Beltran J, Akdis C ym. Efficacy and safe...»175:
- IgE-hämmaren omalizumab som kan insättas för behandling av svår allergisk astma
- minskar förekomsten av skov och kan förbättra livskvaliteten, symtomen och lungfunktionen
- IL-5-hämmaren mepolizumab och reslizumab samt IL-5-receptorblockeraren benralizumab
som kan insättas för behandling av svår eosinofil astma
- minskar förekomsten av skov och behovet av oral kortikosteroid och kan förbättra livskvaliteten, symtomen och lungfunktionen
- IL-4/13-receptorblockeraren dupilumab som kan påbörjas för behandling av astma vid
svår typ 2-inflammation
- minskar skov och behovet av oral kortikosteroid och kan förbättra livskvaliteten, symtomen och lungfunktionen.
- IgE-hämmaren omalizumab som kan insättas för behandling av svår allergisk astma
- Kriterierna för begränsad rätt till ersättning för biologiska läkemedel ( «https://www.kela.fi/»3) kan också anses utgöra en indikation för insättning av dessa läkemedel. Den terapeutiska nyttan av biologiska läkemedel har också påvisats i studier med patienter som haft lindrigare tillstånd än vad som ersättningskriterierna anger, men rekommendationen baseras på en uppskattning av kostnadseffektivitet med aktuella priser.
- Regelbunden användning av 500 mg azitromycin tre dagar i veckan utöver övrig behandling
förefaller att minska förekomsten av astmaskov «Global Initiative for Asthma (GINA). Global Strate...»1, «Hiles SA, McDonald VM, Guilhermino M ym. Does main...»176.
- Terapisvaret verkar inte ha något samband med den astmatiska inflammationstypen «Hiles SA, McDonald VM, Guilhermino M ym. Does main...»176, «Gibson PG, Yang IA, Upham JW ym. Effect of azithro...»177, men terapisvaret kan vara bättre om sputumprovet innehåller rikligt med Haemophilus-bakterier «Taylor SL, Ivey KL, Gibson PG ym. Airway abundance...»178.
- Om azitromycin 500 mg ger biverkningar, kan en lägre dos på 250 mg tre dagar i veckan prövas «Global Initiative for Asthma (GINA). Global Strate...»1.
- Innan azitromycinbehandlingen påbörjas, rekommenderas sputumprov för att identifiera bakterier som elimineras av en kort antibiotikakur och för att utesluta atypisk mykobakterie. Dessutom rekommenderas EKG före och under behandlingen för att kontrollera QT-tiden «Global Initiative for Asthma (GINA). Global Strate...»1.
- I bronkiell termoplastik leds radiofrekvensenergi till bronkväggen under bronkoskopi
vid tre olika behandlingstillfällen. Bronkiell termoplastik kan användas för att behandla
en del patienter med svår astma. Behandlingen minskar förekomsten av skov, men den
har uppenbarligen ingen betydande effekt på lungfunktion eller symtomkontroll «Global Initiative for Asthma (GINA). Global Strate...»1, «Torrego A, Solà I, Munoz AM ym. Bronchial thermopl...»179.
- Den subtyp av astma som är bäst lämpad för behandling med bronkiell termoplastik har inte identifierats, men i praktiken kan kriteriet för denna behandling anses vara upprepade försämringsskov och funktionsstörningar i den glatta bronkmuskulaturen trots läkemedelsbehandling. I undersökningar har patienternas FEV1-värde varit över 60 % av referensvärdet.
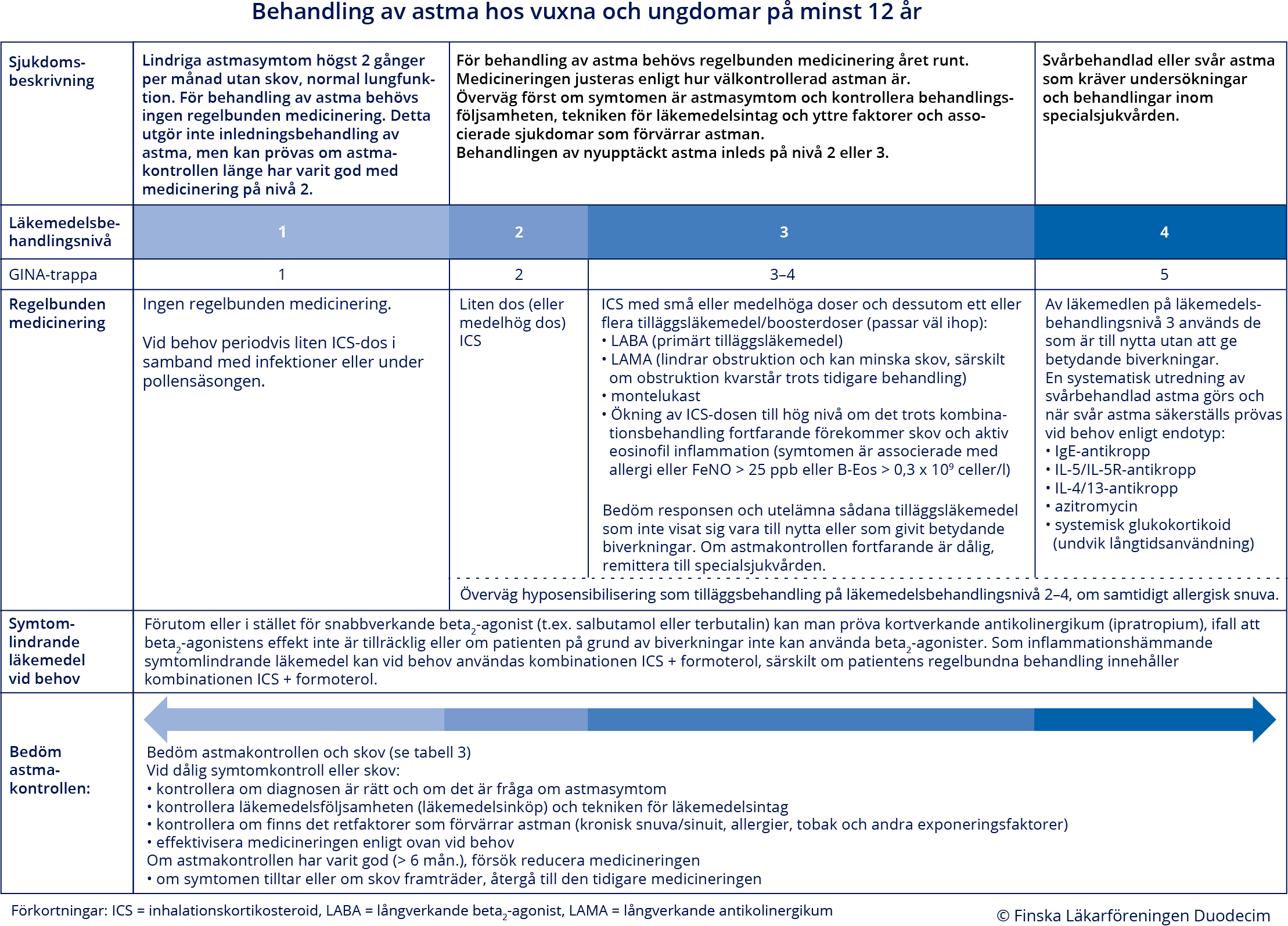
Behandling av astma hos vuxna och ungdomar på minst 12 år. Öppna schemats PDF-version via denna länk «hoi06030m_sv.pdf»2
© Finska Läkarföreningen Duodecim
Nedtrappning av medicineringen
- Om astmakontrollen har varit god under en längre tid (t.ex. 6–12 månader), prövas nedtrappning av medicineringen. Det är inte ändamålsenligt att reducera medicineringen före den besvärligaste årstiden (t.ex. strax före pollensäsongen för personer med allergi eller under vintern för personer som får symtom i kallt väder).
- Medicineringen reduceras enligt bild «Behandling av astma hos vuxna och ungdomar på minst 12 år»2 genom att övergå till en lägre behandlingsnivå. Det finns ingen exakt information om i vilken ordning läkemedlen bör trappas ner i olika kombinationer. Ordningen för nedtrappningen kan variera, eftersom läkemedelseffekten varierar mellan olika patienter. Responsen på läkemedelsförändringarna bör bedömas.
- Om patienten använder en medelhög eller hög dos av inhalationskortikosteroid och av en långverkande beta2-agonist, är det vanligtvis bäst att börja minskningen av medicineringen med kortikosteroiddosen «Global Initiative for Asthma (GINA). Global Strate...»1, «Rogers L, Sugar EA, Blake K ym. Step-Down Therapy ...»180.
- Om patienten använder en liten dos av inhalationskortikosteroid och ett tilläggsläkemedel, är det bra att seponera tilläggsläkemedlen ett i taget. Det sista läkemedlet i regelbunden användning ska bli inhalationskortikosteroiden.
- Om endast inhalationskortikosteroid används som inflammationshämmande läkemedel, reduceras dosen. Om dosen redan är liten, kan man övergå från dosering två gånger per dag till dosering en gång per dag (på kvällen) eller försöka seponera den regelbundna medicineringen. Man kan också pröva en strategi med periodisk behandling: medicinering används i perioder på 2–4 veckor efter symtomdebut, t.ex. i samband med en luftvägsinfektion eller under pollensäsongen. Det finns bevis på att strategin fungerar hos barn i skolåldern «Turpeinen M, Pelkonen AS, Selroos O ym. Continuous...»181, «Chong J, Haran C, Chauhan BF ym. Intermittent inha...»182. Risken är att patienten eller vårdnadshavaren inte inleder behandlingen i tid och att sjukdomskontrollen lider. Efter att den regelbundna kortikosteroidbehandlingen avslutats återkommer astmasymtomen ganska snabbt hos cirka hälften av patienterna «Rogers L, Reibman J. Stepping down asthma treatmen...»183. Endast en liten del av astman hos vuxenpatienterna går i remission så att regelbunden inflammationshämmande medicinering kan avslutas «Tuomisto LE, Ilmarinen P, Niemelä O ym. A 12-year ...»184, «Honkamäki J, Piirilä P, Hisinger-Mölkänen H ym. As...»185, «Tuomisto LE, Ilmarinen P, Kankaanranta H. Prognosi...»186.
- Om en minskning av medicineringen leder till en ökning av symtomen, återupptas den tidigare medicineringen och vid behov behandlas skov dessutom med en oral kortikosteroidkur.
- Enkelhet i långvarig medicinering bör eftersträvas. Enkel medicinering förbättrar patientens behandlingsföljsamhet vad gäller den nödvändiga medicineringen.
Val av inhalator
- För att minimera systemiska biverkningar av kortikosteroid och beta2-agonister eftersträvas alltid medicinering med inhalator.
- Pulverinhalatorn (och soft mist-inhalatorn) lämnar ett betydligt mindre koldioxidavtryck än drivgasaerosolen, och därför bör astmaläkemedlets primära form vara pulverinhalator (eller soft mist-inhalator) om det inte finns någon terapeutisk orsak att använda någon annan apparat för läkemedelsadministrationen. Största delen av barnen i skolåldern och äldre kan trots lungsjukdomen använda pulverinhalatorn. Om användningen av pulverinhalator (eller soft mist-inhalator) inte lyckas, används drivgasaerosol «Woodcock A, Beeh KM, Sagara H ym. The environmenta...»187 och inhalationsspacer (som också kallas inhalationskammare eller förlängningskammare) samt vid behov mask och hjälp av en assisterande person «Malmberg LP, Pelkonen AS, Vartiainen V ym. Patient...»188, «Haughney J, Lee AJ, McKnight E ym. Peak Inspirator...»189. Se videon «Tilajatkeiden valinta ja oikea käyttö (video)»8.
- För varje patient väljs en lämplig inhalator. För att behandlingen ska lyckas, är det viktigt att patienten använder apparaten på rätt sätt och att detta säkerställs i samband med uppföljningsbesöken. En betydande del av astmapatienterna använder inte inhalatorn rätt «Crompton GK, Barnes PJ, Broeders M ym. The need to...»190, «Sanchis J, Gich I, Pedersen S ym. Systematic Revie...»191.
- Användningen av pulverinhalator kräver ingen koordination mellan apparatens avfyrning och inandning av patienten, men en tillräcklig inandningshastighet krävs nog (t.ex. 30 eller 60 l/min beroende på apparaten).
- Användningen av drivgasaerosol kräver visserligen ingen hög inandningshastighet, men patienten måste kunna avfyra apparaten i början av inandningen.
- Användningen av inhalationsspacer med drivgasaerosoler minskar behovet av koordinering och antalet större läkemedelsdroppar som blir kvar i munnen och svalget «Laube BL, Janssens HM, de Jongh FH ym. What the pu...»192.
- Drivgasaerosoler i suspensionsform bör doseras endast via inhalationsspacer för att minimera mängden läkemedel som blir kvar i munnen och svalget.
- Finfördelade drivgasaerosoler i lösningsform kan också administreras utan behållare, om patientens koordination räcker till för att hen ska kunna avfyra apparaten i början av inandningen «Singh D, Collarini S, Poli G ym. Effect of AeroCha...»193, «Engelstätter R, Szlávik M, Gerber C ym. Once-daily...»194, «Drollmann A, Nave R, Steinijans VW ym. Equivalent ...»195.
- Inhalerbara läkemedel till barn under 5 år ska ges som drivgasaerosol och med inhalationsspacer. Mer information «Alle 5-vuotiaiden lasten inhaloitavat astmalääkkeet»9.
- Se information om särdragen hos inhalationsspacerna «Inhaloitavien astmalääkkeiden tilajatkeet»10.
- Från 5–6 års ålder kan man använda pulverinhalator om barnet behärskar den nödvändiga andningstekniken och har tillräcklig inandningskraft och tillräckligt lång inandning (flöde 60 l/min eller snabb inandning i 1–2 sekunder) «National Heart Lung and Blood Institute. Expert Pa...»196. Läkaren eller sjukskötaren ska säkerställa intagstekniken för läkemedel.
- Barn över 5 år kan använda pulverinhalator eller drivgasaerosol (och vid behov inhalationsspacer) enligt apparatens egenskaper, egna preferenser och inlärningsförmåga.
- Kombinationen inhalationsaerosol och inhalationsspacer prioriteras för akut behandling i stället för nebulisator för både barn och vuxna. Prioriteten avgörs av hur enkel och kostnadseffektiv doseringen är, under förutsättning att effekten är lika god «Inhalaatioaerosolin ja tilajatkeen yhdistelmä on yhtä tehokas mutta halvempi ja helppokäyttöisempi kuin nebulisaattori.»A.
Biverkningar av astmaläkemedel
- Munnen bör alltid sköljas efter inhalation av läkemedel, eftersom användningen av inhalerbara astmaläkemedel associerats med negativa effekter på tänderna och munslemhinnan, bl.a. kandidos, tanderosion, karies och tandköttssjukdomar «Alavaikko S, Jaakkola MS, Tjäderhane L ym. Asthma ...»197. Se mer information «Astmalääkkeiden haittavaikutuksia»11.
- Risken för systemiska biverkningar är liten, om vuxna på långvarig behandling inhalerar per dygn högst 800 μg beklometason eller motsvarande läkemedel och barn högst 400 μg beklometason eller motsvarande läkemedel «British Guideline on the Management of Asthma 2011...»198. Mer information «Astmalääkkeiden haittavaikutuksia»11, «Riktgivande doser av inhalationskortikosteroider från pulverinhalatorer och drivgasaerosoler till personer över 12 år. ...»3, «Referensdoser för inhalationskortikosteroider för barn 6–11 år: pulverinhalatorer och drivgasaerosoler. ...»6.
- Biverkningar av kortvariga orala kortikosteroidkurer (mineraliseringsstörningar i skelettet och binjureinsufficiens) börjar framträda hos barn och vuxna som använder mera än tre kurer under ett år «Dolan LM, Kesarwala HH, Holroyde JC ym. Short-term...»199, «van Staa TP, Cooper C, Leufkens HG ym. Children an...»200, «Ducharme FM, Chabot G, Polychronakos C ym. Safety ...»201, «Price DB, Trudo F, Voorham J ym. Adverse outcomes ...»202, «Sullivan PW, Ghushchyan VH, Skoner DP ym. Complica...»203.
- En fall-kontrollstudie med vuxna patienter visade att orala kortikosteroidkurer är särskilt kraftigt associerade med ökad risk för osteoporos/osteoporotisk fraktur (hasardkvot, hazard ratio, HR 3,1), lunginflammation (HR 2,7), kardiovaskulär sjukdom/störning i hjärnans blodcirkulation (HR 1,5) eller gråstarr (HR 1,5). Biverkningarna ökade när den kumulativa dosen ökade och detta gällde särskilt då den kumulativa dosen låg mellan 1,0 och 2,5 g «Price DB, Trudo F, Voorham J ym. Adverse outcomes ...»202.
- De vanliga biverkningarna av beta2-agonister, såsom rastlöshet, hjärtklappning och darrningar, är kortvariga och utgör inte något betydande kliniskt problem «Leung JS, Johnson DW, Sperou AJ ym. A systematic r...»204. Se mer information «Astmalääkkeiden haittavaikutuksia»11.
- Långverkande beta2-agonister ska inte användas som enda läkemedel för behandling av astma, då dessa läkemedel utan intag av samtidig inhalerbar kortikosteroid kan öka risken för försvårad astma och astmadöd «Salpeter SR, Wall AJ, Buckley NS. Long-acting beta...»205, «Cates CJ, Lasserson TJ. Regular treatment with for...»206. Omfattande uppföljningsstudier hos barn och vuxna har visat att långverkande beta2-agonister i kombination med en inhalationskortikosteroid är trygg behandling «Stempel DA, Szefler SJ, Pedersen S ym. Safety of A...»207, «Busse WW, Bateman ED, Caplan AL ym. Combined Analy...»208.
- Leukotrienreceptorantagonisterna tolereras väl och har i allmänhet inte mer biverkningar än placebo «Leung JS, Johnson DW, Sperou AJ ym. A systematic r...»204. Deras samband med sömnstörningar framträder sällan «Leung JS, Johnson DW, Sperou AJ ym. A systematic r...»204, «Cereza G, Garcia Doladé N, Laporte JR. Nightmares ...»209, övertygande evidens på psykiatriska biverkningar saknas «Schumock GT, Lee TA, Joo MJ ym. Association betwee...»210, «Sansing-Foster V, Haug N, Mosholder A ym. Risk of ...»211 och det finns inga preciserade forskningsdata om ett samband med Churg-Strauss syndrom «Scadding GW, Scadding GK. Recent advances in antil...»212.
- De vanligaste biverkningarna av antikolinergika är muntorrhet, synstörningar och urineringssvårigheter. Hos barn har dessa biverkningar bedömts som lindriga och ovanliga «Dusser D, Ducharme FM. Safety of tiotropium in pat...»213. Inhalationsantikolinergika passerar inte blod-hjärnbarriären och behöver därför inte seponeras hos patienter med minnesstörningar.
- Biverkningarna av biologiska läkemedel som används vid behandling av astma är i allmänhet lindriga «Agache I, Beltran J, Akdis C ym. Efficacy and safe...»175, «Farne HA, Wilson A, Powell C ym. Anti-IL5 therapie...»214. Se mer information «Astmalääkkeiden haittavaikutuksia»11.
Läkemedel som ofta är olämpliga för astmapatienter
- Antiinflammatoriska läkemedel, såsom acetylsalicylsyra och ibuprofen, kan försvåra astmasymtomen eller kan t.o.m. ge livshotande anfall hos cirka 5 % av astmatikerna (intolerans mot icke-steroida antiinflammatoriska läkemedel), men hos barn är det mycket sällsynt. Största delen av astmatikerna kan använda icke-steroida antiinflammatoriska läkemedel som vanligt.
- Icke-selektiva betablockerare, även ögondroppar, kan förvärra astman. Astmapatienter med god terapeutisk balans tål vanligen beta1-selektiva betablockerare.
- Kolinerga ögondroppar orsakar sällan problem.
- Kodein, morfin och pankuron frigör histamin och orsakar ibland förträngningar i luftrören.
Försämringsskov av astma
- Ett försämringsskov (exacerbation) är ett tillstånd där patientens astmarelaterade symtom ökar vanligen betydligt under cirka 1–3 veckor och en tillfällig effektivisering av behandlingen 'r indicerad. I samband med kraftiga exacerbationssymtom behövs akut bedömning.
- Försämringsskoven orsakas oftast av en extern faktor, såsom virusinfektion, allergenexponering, luftföroreningar eller damm. Orsaken kan också vara försummad läkemedelsbehandling mot astma, men hos en del patienter uppkommer skoven spontant «Global Initiative for Asthma (GINA). Global Strate...»1.
- Astma skyddar inte patienten mot andra sjukdomar som orsakar respiratoriska symtom, och vid bedömning av situationen måste andra eventuella orsaker till symtomen givetvis beaktas.
- Läkaren ger patienten individuella anvisningar för behandling av lindriga skov hemma.
- Det viktigaste är att patienten tar tillräckligt med symtomlindrande läkemedel, dock
så att hjärtsjuka och multisjuka patienter beaktar särskilt risken för biverkningar
vid höga doser:
- salbutamol 200–400 μg 1–6 gånger per dygn (dosering 5–6 gånger kräver SIC!-anteckning på receptet)
- terbutalin 500–1000 μg 1–6 gånger per dygn eller
- formoterolmonoterapi eller i kombinationspreparat högst 72 μg per dygn.
- Rutinmässig fördubbling eller fyrfaldigande av den regelbundna inhalationskortikosteroiddosen i samband med luftvägsinfektion rekommenderas inte. En sådan dosökning minskar nämligen inte förekomsten av skov eller behovet av oral kortikosteroid hos patienter med lindrig eller medelsvår astma «Säännöllisen inhaloitavan kortikosteroidiannoksen rutiinimainen nosto oireiden lisääntyessä ei vähennä pahenemisvaiheita tai suun kautta otettavan kortikosteroidihoidon tarvetta lievää tai keskivaikeaa astmaa sairastavilla potilailla.»A, «Oborne J, Mortimer K, Hubbard RB ym. Quadrupling t...»215, «McKeever T, Mortimer K, Wilson A ym. Quadrupling I...»216. Se videon «Hengitettävän kortikosteroidin annoksen säätely flunssien aikana (video)»2.
- Om symtomen försvåras eller blir långvariga ska läkare uppsökas för bedömning.
- Alla astmapatienter ska inte rutinmässigt få recept på orala kortikosteroidkurer i
händelse av skov.
- Om försämringsskov förekommer sällan, kan patienten inte nödvändigtvis bedöma sitt tillstånd rätt och är inte van vid behandling av skov. Det är säkrare för patienten att uppsöka läkare, om tillägg av ett symtomlindrande läkemedel inte ger tillräcklig respons.
- Om försämringsskov förekommer ofta, behöver patienten i vilket fall som helst regelbunden vårdbedömning och eventuellt remiss till specialistläkare.
- Om patienten har ofta återkommande försämringsskov, om basmedicineringen är optimerad, om möjligheterna till specialbehandlingar vid svår astma har bedömts och om patienten kan behandla medelsvåra exacerbationer hemma, kan recept på en oral kortikosteroidkur utfärdas i händelse av skov, t.ex. prednisolon 40 mg i 5–7 dagar.
- Det viktigaste är att patienten tar tillräckligt med symtomlindrande läkemedel, dock
så att hjärtsjuka och multisjuka patienter beaktar särskilt risken för biverkningar
vid höga doser:
- Den kliniska undersökningen och den jourmässiga behandlingen av patienter med försämringsskov presenteras i bakgrundsmaterialet «Astman pahenemisvaiheet»12 samt i diagrammen: 6-åringar och äldre «Behandling av astmaskov hos barn från 6 års ålder»3 och astmapatienter under 6 år «Alle 6-vuotiaan lapsen astmakohtauksen hoito »4.
- Läkaren bedömer om en oral kortikosteroid behövs för behandlingen av skov. Den rekommenderade kuren är 40 mg prednisolon i 5–7 dygn. Om möjligt bör eosinofiltalet i blodprov fastställas innan kuren inleds. Om kuren inte ger någon klar nytta, rekommenderas ingen ny kur för fortsatt behandling. Upprepade kurer ökar risken för glukokortikosteroidbiverkningar.
- Ingalunda alla astmapatienter upplever skov, medan en del patienter har upprepade skov. Patienter med upprepade försämringsskov (> 2/år) ska bedömas inom specialsjukvården med tanke bl.a. på specialbehandlingar och kan individuella anvisningar för egenvården.
Behandling av astmaskov hos barn från 6 års ålder. Öppna schemats PDF-version via denna länk «hoi06030n_sv.pdf»4
© Finska Läkarföreningen Duodecim

Alle 6-vuotiaan lapsen astmakohtauksen hoito.
Avaa kaavion PDF-versio tästä linkistä «hoi06030j.pdf»5
© Suomalainen Lääkäriseura Duodecim
Egenvård av astma
- Patientens vårdplan antecknas i patientjournalen.
- Egenvårdshelheten omfattar planerad läkemedelsbehandling, rökfrihet, viktkontroll och tillräcklig motion.
- Patienten ska förstå hurudan sjukdom astma är, huvudprinciperna för behandlingen och hur behandlingsföljsamheten ska befästas. Dessutom måste patienten behärska rätt inhalationsteknik för inhalationsläkemedel.
- Patienten (vårdnadshavarna när det gäller barn) ser till att behandlingen verkställs. Läkaren, sjukskötarna och också apotekspersonalen handleder och stöder patientens egenvård.
- Patienten måste lära sig att identifiera astmasymtom och kunna behandla dem med ett läkemedel avsett för behandling av symtomen.
- Astmasymtom utlöses individuellt av olika retfaktorer. Patienten ska lära sig identifiera de retfaktorer som hen själv reagerar för (t.ex. pollen, kyla, icke-steroida antiinflammatoriska läkemedel osv.) och veta hur hen ska göra i fråga om dem.
- Om det rutinmässiga rådet att vid behov fördubbla den antiinflammatoriska astmamedicinen
utelämnats från patientens vårdanvisningar, betyder detta inte att medicineringen
inte kan intensifieras på ett på förhand planlagt sätt, baserat på patientens tidigare
sjukdomshistoria i särskilt betydelsefulla situationer:
- Ett exempel är en pollenallergisk patient som annars har god astmakontroll med låg inhalationskortikosteroiddos men som får astmasymtom under pollensäsongen. Patienten kan instrueras exempelvis att öka dosen av den antiinflammatoriska astmamedicinen eller att övergå till kombinationspreparat under pollensäsongen.
- För ett barn som tydligt uppvisar symtom vid rhinovirusepidemier på hösten kan man tänka sig en större dos under början av hösten. En patient som inleder sin militärtjänstgöring kunde ta effektiverad medicinering under de 2 första månaderna av tjänstgöringen då risken för skov är förhöjd.
- En patient som mår väl på somrarna kan klara sig på en mycket liten underhållsdos under största delen av året, men under tider av vinterkyla kan det vara nödvändigt att effektivisera medicineringen för att undvika skov.
- Se videon «Hengitettävän kortikosteroidin annoksen säätely flunssien aikana (video)»2.
- Hos en del patienter förekommer t.o.m. svåra symtom som relaterar till andra mekanismer än astma. Om sådana symtom förekommer måste patienten lära sig att skilja dem från astmasymtom. Hosta och laryngealt betingad andnöd kan förekomma t.ex. i anslutning till dofter eller lukter eller på grund av ansträngning eller refluxsjukdom. Att behandla alla symtom i luftvägarna med astmaläkemedel leder lätt till övermedicinering.
- En stor del av astmapatienterna har lindrig eller medelsvår astma, där rutinmässig uppföljning av PEF varken påverkar vårdbesluten i praktiken eller är nödvändig. Hos enskilda patienter kan uppföljning av PEF-värdet dock användas vid behov bl.a. för att bedöma responsen av ändringar i medicineringen och i sådana fall kan det vara förnuftigt med PEF-mätningar hemma. Om astman är välkontrollerad, ses ingen signifikant dygnsvariation eller bronkdilatationssvar i PEF. Man bör dock komma ihåg att PEF-värdena kan sjunka också av andra orsaker än astma (t.ex. funktionell struphuvudsförträngning). Se videon «PEF-seurannan merkitys ja tulkinta (video)»1.
Astma hos barn
Diagnostik
- Oberoende av åldern grundar sig astmadiagnosen hos barn på symtomen och, i mån av möjlighet, på lungfunktionstest som visar reversibel förträngning i luftrören eller en ökad bronkiell hyperreaktivitet. Tecken på bronkiell inflammation stöder diagnosen «Gaillard EA, Kuehni CE, Turner S ym. European Resp...»217.
- Under den diagnostiska utredningen är det viktigt att överväga hur stor risken är att patienten får ett nytt försämringsskov. Risken ökar om någondera föräldern har astma, om barnet har atopiskt eksem, om hen är sensibiliserad mot aeroallergener och om symtomen är rikliga. Hos småbarn har man konstaterat att benägenheten för vinande andning i samband med rhinovirusinfektion är en betydande och tidig riskfaktor för astma «Jartti T, Smits HH, Bønnelykke K ym. Bronchiolitis...»38.
- Problematiken kring diagnostik och behandling av utandningssvårigheter hos barn under 2 år behandlas i God medicinsk praxis-rekommendationen Nedre luftvägsinfektioner (hos barn) «Nedre luftvägsinfektioner (hos barn)»6, «Alahengitystieinfektiot (lapset). Käypä hoito -suo...»218 och i en färsk översiktsartikel «Elenius V, Dunder T, Ruotsalainen M, Schultz R, Mä...»219.
Symtom
- Ju mindre barnet är, desto vanligare är det med utandningssvårigheter, vinande andning och hosta till följd av slemhinnesvullnaden som följer på inflammation och slemutsöndring.
- En luftvägsinfektion orsakad av virus är den viktigaste utlösaren av symtom.
- Hos barn ger astma uppenbara symtom också vid ansträngning. Ett litet barn hostar under vilda lekar eller t.o.m. när barnet gråter och skrattar.
- Hos större barn kan också exponering för allergener, såsom björkpollen eller djur, försvåra astman eller orsaka ett anfall. På grund av långvarig slemhinneinflammation i luftvägarna kan också andra retfaktorer, såsom infektioner, ansträngning, kall luft och luftföroreningar, utlösa astmasymtom.
Fynd
- När barnet mår väl, framkommer det sällan fynd som skulle tala för astma under en
klinisk undersökning. Under en förkylning kan man däremot höra hostan, se andningssvårigheten
och identifiera avvikelser i lungauskultationen.
- Hos en patient med symtom kan man ofta höra vinande ljud från båda lungorna vid utandning och ibland även vid inandning. Andningsljuden bör auskulteras också vid snabb utandning. Ofta hörs också rossel.
- Under ett lindrigt astmaanfall hos barn blir andningen ytligare och snabbare. I slutet av utandningen kan vinande andning och rossel höras. Då andnöden är svår, är barnet blekt och i värsta fall kan läpparna bli cyanotiska (blåna). Ju svårare andnöden är, desto längre varar utandningen i förhållande till inandningen. Vinande hörs ofta både vid utandning och inandning. Interkostalrummen blir synliga och barnet använder diafragmat kraftigt och andas tungt.
- Vid livshotande astmaanfall kan vinandet försvinna, andningsljuden avta och patienten använda sina accessoriska andningsmuskler.
- Astma är ofta förknippad med allergisk snuva, så näsan bör undersökas med anterior rhinoskopi.
- Atopiskt eksem kan förekomma och i så fall dokumenteras, eftersom personer med atopiskt eksem löper ökad risk för astma.
Lungfunktionsundersökningar
- Hos barn över 3 år är det skäl att försöka mäta lungfunktionen. Oscillometri i kombination med bronkdilatationsprov (salbutamol 0,4 mg «Gaillard EA, Kuehni CE, Turner S ym. European Resp...»217) eller utomhuslöptest förbättrar precisionen för astmadiagnostiken hos små barn «Oskillometria yhdistettynä bronkodilataatio- tai ulkojuoksukokeeseen parantaa pienten lasten astmadiagnostiikan osuvuutta.»A.
- Om resistansen som uppmätts med oscillometri (Rrs5) minskar med 40 % eller mera i bronkdilatationsprovet och/eller om resistansen ökar med 40 % eller mera t.ex. i löptestet, är förändringen betydande «Oskillometrialla mitatun resistanssin (Rrs5) laskua vähintään noin 40 % bronkodilataatiokokeessa ja nousua vähintään noin 40 % keuhkoputkien provokaatiossa (esimerkiksi juoksukokeen yhteydessä) voidaan pitää merkittävänä muutoksena.»A, «King GG, Bates J, Berger KI ym. Technical standard...»220.
- I båda proven är en förändring på 35–39 % riktgivande.
- Oscillometri är känslig för fel. Trots att mätningen inte kräver stor samarbetsförmåga av barnet, förutsätter den förtrogenhet och erfarenhet av den som utför undersökningen. Genom att bekanta sig med de praktiska aspekterna nedan blir det lättare att tolka mätvärdena och att förstå det tekniska utförandet. Mer information «Oskillometrian käytännön suoritus ja tulkinta lapsilla astmaa tutkittaessa»13.
- För barn i skolåldern finns det endast begränsat med forskningsdata om referensvärdena och lämpligheten av oscillometri för diagnostik och gemensamt godkända diagnostiska kriterier saknas. För att få konsekventa resultat ska astmadiagnosen hos barn i skolåldern i regel grunda sig endast på spirometri och hos barn över 12 år på PEF-uppföljning. Dessa mätningar lyckas i allmänhet tillfredsställande «Ohje astmapotilaan PEF-kotiseurantaan»5. Om spirometriundersökningarna i undantagsfall inte lyckas, t.ex. på grund av barnets utvecklingsmässiga funktionsnedsättning, används oscillometrimätningar som stöd för astmadiagnosen.
- Spirometri kan utprovas hos barn över 5 år, men undersökningen lyckas i allmänhet tillförlitligt först då barnet nått skolåldern «Beydon N, Davis SD, Lombardi E ym. An official Ame...»221.
- Tillförlitligheten av PEF-uppföljning är inte lika hög hos barn som hos vuxna och dess användning i diagnostiken kan rekommenderas först från 12 års ålder. Se videon «PEF-seurannan merkitys ja tulkinta (video)»1.
- Spirometri kombineras med bronkdilatationstest (salbutamol 0,4 mg «Gaillard EA, Kuehni CE, Turner S ym. European Resp...»217), där en förbättring av FEV1 eller FVC med minst 12 % och 200 ml är signifikant «Sovijärvi A, Kainu A, Malmberg P, Lindholm B, Timo...»59.
- Hos barn är belastningsprovet ofta det känsligaste diagnostikverktyget, och responsen mäts antingen oscillometriskt eller spirometriskt. Vid testning för belastningsastma är reaktionen signifikant om FEV1 efter ansträngning minskar med 15 % eller mer från utgångsvärdet «Clinical exercise testing with reference to lung d...»67, «Hallstrand TS, Leuppi JD, Joos G ym. ERS technical...»68, «Kliinisen rasituskokeen jälkeen mitatun uloshengityksen sekuntikapasiteetin (FEV1) laskua 15 % voidaan pitää merkittävänä muutoksena.»A. Hos barn med tydliga astmasymtom kan en minskning på 10–14 % anses vara riktgivande och utifrån detta kan behandlingsförsök med inhalationskortikosteroid övervägas. Om belastningsprov inte kan utföras hos ett barn med symtom, eller om resultatet av provet inte är diagnostiskt, kan andra indirekta metoder som mäter bronkiell hyperreaktivitet användas, t.ex. eukapnisk volontär hyperventilationstest (från 10 års ålder) «EVH-provokaation jälkeen mitatun uloshengityksen sekuntikapasiteetin (FEV1) laskua 15 % voi pitää merkittävänä muutoksena.»C och exponering för mannitol (från 7 års ålder) «Mannitolialtistuksessa mitatun uloshengityksen sekuntikapasiteetin (FEV1) laskua 15 % voi pitää merkittävänä muutoksena.»B. Dessa testningar genomförs vid enheter som är förtrogna med mätningar inom specialsjukvården. En minskning av FEV1 med 15 % till följd av exponering kan anses vara en betydande reaktion och en reaktion som tyder på astma, Hos ett barn med symtom kan en mindre förändring (på 10–14 %) anses vara riktgivande och ett behandlingstest med inhalationskortikosteroid kan övervägas «Koskela H, Tikkakoski A, Karjalainen J, Mäkelä M, ...»69.
- Kväveoxidhalten i utandningsluften avspeglar graden av eosinofil inflammation i luftvägarna. För barn i lek- och skolåldern finns inhemska längdkorrigerade referensvärden. Värdena är större ju längre barnet är «Malmberg LP, Petäys T, Haahtela T ym. Exhaled nitr...»86. Ett klart förhöjt kväveoxidvärde i utandningsluften hos en patient med symtom tyder visserligen på astma, men diagnosen astma kan inte ställas enbart på basis av en förhöjd kväveoxidhalt «Malmberg LP, Pelkonen AS, Haahtela T ym. Exhaled n...»222.
- Atopi hos barn kan vara förknippad med förhöjda kväveoxidvärden även om barnet inte har astma. Höjda kväveoxidvärden tyder dock på subklinisk eosinofil inflammation i de nedre luftvägarna «Yao TC, Ou LS, Lee WI ym. Exhaled nitric oxide dis...»223. Vid allergisk (atopisk) astma hos barn är kväveoxidhalten i utandningsluften klart förhöjd, och vid icke-allergisk astma kan den också vara normal «Malmberg LP, Pelkonen AS, Mattila PS ym. Exhaled n...»224. En pågående luftvägsinfektion under mätningen höjer kväveoxidvärdena.
- Hos barn förekommer ofta lindrig hyperreaktivitet i luftrören. Hos personer över 12
år stöder en måttligt kraftig eller kraftig hyperreaktivitet efter exponering för
metakolin diagnosen astma.
- När en kumulativ metakolindos på 0,6 mg eller mindre vid exponeringstest sänker FEV1 med minst 20 %, kan fyndet anses diagnostiskt för astma «Nieminen MM. Unimodal distribution of bronchial hy...»63, «Malmberg P, Karjalainen J, Tikkakoski A, Mäkelä M,...»66.
- Hos barn under 12 år finns det inte tillräckligt med forskningsrön om det diagnostiska gränsvärdet och metoden rekommenderas inte för diagnostik. Om dock ingen hyperreaktivitet (PD20FEV1>2,6 mg) föreligger, är astma osannolik.
Laboratoriefynd
- Hos småbarn är återkommande vinande andning ett tecken på begynnande astma och ofta förknippat med en atopisk diates (tabell «Kriterier för bedömning av astmarisken hos småbarn med återkommande vinande andning ....»4). Därför fastställs sensibiliseringen mot aero- och matallergener hos barn under 3 år antingen genom pricktester eller genom bestämning av specifika IgE i serum. Screeningtest kan användas vid IgE-bestämningar, såsom damm eller matallergener.
- Hos barn i lek- och skolåldern ska man vid misstanke om astma alltid bestämma IgE-svaret för typiska luftvägsallergener antingen med serumprov och dammspecifikation eller med pricktest.
- Ett förhöjt eosinofiltal i blodprov vittnar om att risken för astma är förhöjd (tabell «Kriterier för bedömning av astmarisken hos småbarn med återkommande vinande andning ....»4). Det är bra att bestämma eosinofiltalet både vid misstanke om sjukdom och senare under pågående behandling, eftersom det hjälper till att fastställa sjukdomens inflammatoriska subtyp. Innan astmadiagnosen ställs, är det skäl att överväga att ta en lungröntgenbild särskilt av små barn och sådana patienter som har en oklar sjukdomsbild eller läkemedelsrespons (tabell «Differentialdiagnostik av astmaliknande symtom hos barn....»5).
- Särskilt hos spädbarn fäster man särskild uppmärksamhet vid differentialdiagnostiken och utfärdar vid behov remiss till specialsjukvården (tabell «Differentialdiagnostik av astmaliknande symtom hos barn....»5).
| Om minst ett huvudkriterium eller två bikriterier uppfylls tyder detta på astma hos småbarn med återkommande vinande andning. | |
|---|---|
| Huvudkriterier | Bikriterier |
| 1. av läkare konstaterad astma hos förälder | 1. IgE-medierad sensibilisering mot mat |
| 2. av läkare konstaterat atopiskt eksem | 2. vinande andning också då barnet inte har förkylning |
| 3. sensibilisering mot luftvägsallergener | 3. eosinofiler i blodet > 4 % eller > 0,3 x 109/l |
| SMÅBARN |
| Hosta efter infektion och överirritation i luftvägarna: virusinfektioner (RSV), kikhosta och mykoplasma |
| Gastroesofageal reflux (GER): aspiration |
| Medfödda strukturavvikelser: trakeomalaci, trakeoesofageal fistel och anomalier i de stora blodkärlen ("vascular ring", truncus brachiocephalicus-syndrom) |
| Interstitiella lungsjukdomar, såsom neuroendokrin hyperplasi i barndomen (Neuroendocrine Cell Hyperplasia of Infancy = NEHI) |
| Faktorer som förtränger luftvägarna: stor farynxtonsill, främmande kropp, tumör och förstorade lymfknutor |
| Cystisk fibros, funktionsstörning i flimmerhåren (PCD) |
| Kronisk inflammation: bronkopulmonell dysplasi (BPD) |
| Hjärtrelaterade orsaker |
| BARN I SKOLÅLDERN |
| Infektion och överirritation i luftvägarna efter infektion: virusinfektioner, kikhosta och mykoplasma |
| Funktionella andningsstörningar (dysfunctional breathing, inducible laryngeal obstruction, vocal cord dysfunction, dvs. dysfunktionell andning, inducerbar larynxobstruktion, stämbandsdysfunktion) |
| Hyperventilationssyndrom |
Diagnosen av astma hos barn
- Småbarn med återkommande vinande andning och förträngning i luftvägarna utgör en heterogen patientgrupp och astmafenotypen varierar. För en stor del av icke-atopiska barn är det fråga om en övergående egenskap som beror t.ex. på att luftrörens diameter är liten eller att immunförsvaret mot virus är bristfälligt «Makrinioti H, Custovic A, Hasegawa K ym. The role ...»226. Faktorer som påverkar luftrörens diameter är mindre välkända, men moderns rökning under graviditeten ökar barnets risk för luftvägsobstruktion «Tager IB, Hanrahan JP, Tosteson TD ym. Lung functi...»227, vilket kunde bl.a. bero på förtjockning av bronkväggarna «Elliot J, Vullermin P, Robinson P. Maternal cigare...»228, «Bossley CJ, Fleming L, Gupta A ym. Pediatric sever...»229, «de Blic J, Tillie-Leblond I, Emond S ym. High-reso...»230, «O'Reilly R, Ullmann N, Irving S ym. Increased airw...»231, «Jartti T, Gern JE. Role of viral infections in the...»232.
- Hos småbarn kan försök med astmaläkemedel inledas på kliniska grunder. Regelbunden antiinflammatorisk behandling inleds om barnet under ett år haft minst tre episoder av vinande andning som konstaterats av läkare och har dessutom de riskfaktorer för astma som nämns i tabell «Kriterier för bedömning av astmarisken hos småbarn med återkommande vinande andning ....»4. Om det inte finns några riskfaktorer och om symtomen är lindriga, följs situationen upp.
- Barn med påvisad eosinofili eller tydlig atopisk diates verkar får mest nytta av inhalationskortikosteroider «Fitzpatrick AM, Bacharier LB, Guilbert TW ym. Phen...»233.
- Om symtomen är frekventa (minst 2 anfall under 6 veckor) eller svåra (upprepade sjukhusperioder), är en längre prövning av läkemedelsbehandling indicerad oavsett barnets atopistatus «0–5-vuotiaan lapsen astman hoito»5 .
- Om barnet har kontinuerliga symtom redan efter den första episoden med vinande andning och drar nytta av bronkdilaterade läkemedel och behöver bronkdilaterande läkemedel oftare än två dagar i veckan i över en månads tid, övervägs inledning av regelbunden antiinflammatorisk behandling.
- Astmadiagnosen görs senast om behovet av antiinflammatorisk medicinering varar i längre tid än sex månader. Samtidigt ska journalhandlingarna innehålla en anteckning om det är fråga om allergisk astma, dvs. IgE-medierad sensibilisering (J45.0) eller icke-allergisk astma (J45.1), eftersom risken för svåra anfall och kronisk sjukdom är klart större i det förstnämnda fallet. Diagnosen blir ospecificerad astma (J45.9), om sensibiliseringsstatus inte är känd. Vid akuta astmaanfall används dessutom diagnosen J46.
- Hos barn från 3 års ålder försöker man påvisa avvikelser i lungfunktionen med hjälp av oscillometri eller spirometri innan regelbunden behandling påbörjas.
- Se nivåstrukturering av läkemedelsbehandling av astma hos barn under 6 år «0–5-vuotiaan lapsen astman hoito»5 .

0–5-vuotiaan lapsen astman hoito.
Avaa kaavion PDF-versio tästä linkistä «hoi06030k.pdf»6
© Suomalainen Lääkäriseura Duodecim
Behandling av astma hos barn
- Astmasymtomen behandlas med ett bronkdilaterande läkemedel som tas vid behov (snabbverkande (salbutamol, terbutalin) eller snabb- och långverkande (formoterol) beta2-agonist), men regelbunden användning av enbart öppnande läkemedel rekommenderas inte.
- Långvarig astma i barndomen är nära kopplad till atopi och ärftlig belastning, och därför används ett kliniskt riskindex för nivåstrukturering av den regelbundna medicineringen av astma hos småbarn (tabell «Kriterier för bedömning av astmarisken hos småbarn med återkommande vinande andning ....»4) «Castro-Rodríguez JA, Holberg CJ, Wright AL ym. A c...»234. För barn som har ett positivt riskindex eller har kraftiga symtom inleds med låg tröskel ett tremånaders behandlingstest med regelbunden inhalationskortikosteroid och behandlingen fortsätter också längre för dessa patienter. (Obs.: vid behov reduceras förekomsten av allergener i omgivningen, om det finns starka indicier på det allergen som orsakar symtomen).
- En stor del av icke-allergiska barn blir av med astmasymtomen före skolåldern «Martinez FD. Heterogeneity of the association betw...»235.
- Syftet med behandlingen är att få symtomen under kontroll och att förhindra skov. Det naturliga förloppet av astma hos barn kan inte påverkas genom tidig inledning av behandling med inhalationskortikosteroid «Lasten astman luonnolliseen kulkuun ei voida vaikuttaa varhaisella inhaloidun kortikosteroidin aloituksella.»A.
- Det primära antiinflammatoriska läkemedlet hos barn i alla åldrar är en inhalationskortikosteroid «Global Initiative for Asthma (GINA). Global Strate...»1, «Salpeter SR, Ormiston TM, Salpeter EE. Meta-analys...»236, «Simons FE. A comparison of beclomethasone, salmete...»237, «Smith AD, Taylor DR. Is exhaled nitric oxide measu...»238, «Smith AD, Cowan JO, Filsell S ym. Diagnosing asthm...»239, «Sorkness CA, Lemanske RF Jr, Mauger DT ym. Long-te...»240, «Szefler SJ, Phillips BR, Martinez FD ym. Character...»241, «National Heart Lung and Blood Institute. Expert Pa...»242. De rekommenderade doserna för barn presenteras i tabell «Referensdoser för inhalationskortikosteroider för barn 6–11 år: pulverinhalatorer och drivgasaerosoler. ...»6.
- Kriterier för att inleda ett tremånaders behandlingstest för hos barn under 3 år som inte har använt regelbunden medicinering och som dragit nytta av bronkdilaterande läkemedel är följande «Global Initiative for Asthma (GINA). Global Strate...»1, «Expert Panel Working Group of the National Heart, ...»149: barnet har haft tre anfall av utandningssvårighet (som har pågått längre än ett dygn och som påverkat sömnen) under det föregående året och har ett positivt riskindex (tabell «Kriterier för bedömning av astmarisken hos småbarn med återkommande vinande andning ....»4).
- Följande kriterier indicerar behandling med inhalationskortikosteroid oavsett astmarisken:
- Symtomen är kontinuerliga, dvs. barnet har behövt bronkdilaterande läkemedel oftare än två gånger i veckan i över fyra veckor.
- Barnet har haft två orala kortikosteroidkurer med mindre än sex månaders intervall.
- Frekventa försämringsskov (oftare än med sex veckors intervall) då behovet av bronkdilaterande läkemedel uppgått till 4 gånger per dygn.
- En rutinmässig ökning av dosen av regelbunden inhalationskortikosteroid t.ex. i samband med förkylningar och symtomökning minskar varken förekomsten av försämringsskov eller behovet av oral kortikosteroid hos patienter med lindrig eller medelsvår astma «Säännöllisen inhaloitavan kortikosteroidiannoksen rutiinimainen nosto oireiden lisääntyessä ei vähennä pahenemisvaiheita tai suun kautta otettavan kortikosteroidihoidon tarvetta lievää tai keskivaikeaa astmaa sairastavilla potilailla.»A. Basmedicineringen ska effektiviseras endast om man misstänker att den inhalerade dosen av kortikosteroid är alltför låg vid kontinuerlig behandling.
- Kombinationen inhalationskortikosteroid och långverkande beta2-agonist kan användas för behandling av barn mellan 4 och 11 år (nivå 3) om den terapeutiska balansen inte uppnås med inhalationskortikosteroid enbart. Hos en stor del av barnen är detta det effektivaste alternativet, då det gäller att minska astmaskov och förbättra lungfunktionen «Lemanske RF Jr, Mauger DT, Sorkness CA ym. Step-up...»243, «Chauhan BF, Chartrand C, Ni Chroinin M ym. Additio...»244. De individuella variationerna i läkemedelsresponsen varierar dock kraftigt och därför är det viktigt att följa upp terapisvaret.
- Kombinationen inhalationskortikosteroid med långverkande beta2-agonist för barn i åldern 4–11 år är trygg «Stempel DA, Szefler SJ, Pedersen S ym. Safety of A...»207. Evidensen för flexibel kombinationsbehandling (budesonid-formoterol) i denna åldersgrupp är tills vidare knapp. I den amerikanska vårdrekommendationen ges dock möjlighet att tillämpa denna vårdstrategi också hos 6–11-åringar «Global Initiative for Asthma (GINA). Global Strate...»1, «Bisgaard H, Le Roux P, Bjåmer D ym. Budesonide/for...»245, «O'Byrne PM, Bisgaard H, Godard PP ym. Budesonide/f...»246, «Expert Panel Working Group of the National Heart, ...»149.
- Behandlingen kan också inledas med en kombination av inhalationskortikosteroid och långverkande beta2-agonist, om barnet har t.ex. kraftiga symtom under pollensäsongen eller svår obstruktion. Montelukast kan vara till nytta för barn som har lindrig astma och vars symtom förvärras på grund av allergisk snuva «Krishnamoorthy M, Mohd Noor N, Mat Lazim N ym. Eff...»247, «Chauhan BF, Jeyaraman MM, Singh Mann A ym. Additio...»248.
- Om barnets symtom förutsätter medicinering på nivå 3 ska en barnallergolog eller barnläkare som är insatt i astmabehandling konsulteras.
- Tiotropium kan ordineras av barnallergolog eller barnläkare som är insatt i behandlingen av astma hos barn i åldern 6 år och äldre utöver inhalerbar kortikosteroid och långverkande beta2-agonist, om astman inte kontrolleras av inhalationskortikosteroid, montelukast och långverkande bronkdilatator. Tillsättning av tiotropium till behandling med inhalationskortikosteroid eller till kombinationsbehandling med inhalationskortikosteroid, långverkande bronkdilaterande läkemedel och montelukast för symtomatisk astma förbättrar barnets lungfunktion och lindrar symtomen och reducerar förekomsten av astmaskov «Szefler SJ, Murphy K, Harper T 3rd ym. A phase III...»249, «Vogelberg C, Moroni-Zentgraf P, Leonaviciute-Klima...»250, «Vogelberg C, Engel M, Laki I ym. Tiotropium add-on...»251, «Szefler SJ, Vogelberg C, Bernstein JA ym. Tiotropi...»252.
- Om barnet, trots maximal medicinering på nivå 3, under det senaste året haft minst två försämringsskov eller ett skov som krävt sjukhusvård, bör behandling med biologiska läkemedel övervägas. Detta ska ske vid en specialiserad enhet inom sjukvården med kompetens inom området. Innan sådan behandling inleds ska faktorer som bristande följsamhet och andra behandlingsrelaterade orsaker ha uteslutits, och hänsyn tas till eventuell samsjuklighet (komorbiditet) «Morris TS, Autry EB, Kuhn RJ. The Role of Biologic...»253, «Scotney E, Burchett S, Goddard T ym. Pediatric pro...»254.
- Användning av biologiska läkemedel vid behandling av svår astma hos barn förutsätter
en noggrann genomgång av diagnosen samt identifiering av astmans fenotyp:
- Det finns mest erfarenhet och forskningsrön kring användningen av omalizumab för behandling av barn över 6 år med svår astma. Forskning visar att omalizumab minskar förekomsten av försämringsskov t.o.m. i samband med virusinfektioner hos barn med allergisk astma. Användningen begränsas av en strikt indikation som förutsätter sensibilisering mot ett allergen som förekommer året runt samt en total IgE-halt under 1500 U/l.
- Mepolizumab (anti-IL5-antikropp) är indicerat för behandling av personer över 6 år med svår astma. Ersättning beviljas endast för personer över 12 år som har haft minst fyra försämringsskov under föregående år och vars eosinofiltal i blodet är ≥ 3 0,3 x 109/l, eller som har haft minst två försämringsskov under föregående år trots regelbunden användning av oral kortikosteroid. Beträffande småbarn, har endast en farmakodynamisk studie med mepolizumab publicerats och enligt den är läkemedlet även under långvarig uppföljning (52 veckor) säkert och vältolererat.
- Dupilumab är ett antikroppspreparat som binder till interleukin-4 och interleukin-13 receptorn och som är indicerat för behandling av patienter äldre än 6 år med svår astma kopplad till typ 2-inflammation, vilket identifieras genom förhöjda nivåer av eosinofiler i blodet och/eller förhöjda halter av kväveoxid (FeNO) i utandningsluften. Indikationen svår astma förutsätter användning en medelhög dos av inhalationskortikosteroid hos 6–11-åringar, medan för barn över 12 år är kravet hög dos. Ersättning beviljas endast personer över 12 år. Förutom att effektivt minska förekomsten av försämringsskov, förbättrar dupilumab även lungfunktionen i måttlig grad hos barn med svår astma med typ 2-inflammationsprofil «Bacharier LB, Maspero JF, Katelaris CH ym. Dupilum...»255.
- Nivåstruktureringen av läkemedelsbehandlingen av astma hos barn presenteras i bilderna «0–5-vuotiaan lapsen astman hoito»5 och «6–11-vuotiaan lapsen astman hoito »6 . I vården av barn över 12 år följs vårdlinjerna för vuxna «Behandling av astma hos vuxna och ungdomar på minst 12 år»2 .
- Hos en del patienter kan man uppnå bättre symtomkontroll om man följer upp det bästa personliga PEF-värdet «National Heart, Lung, and Blood Institute. Nationa...»256, «Jartti T, Vanto T. Astmapotilaan on tärkeää tietää...»257.
- Kväveoxidvärdet (FeNO) i utandningsluften har, på grund av stor variation i uppföljningen av terapisvaret, endast ett svagt prognostiskt värde för bedömning av behandlingsbalansen hos barn med lindrig eller medelsvår astma «McCormack MC, Aloe C, Curtin-Brosnan J ym. Guideli...»258, «Fielding S, Pijnenburg M, de Jongste JC ym. Change...»259. FeNO-styrd läkemedelsbehandling av astma ger bättre astmakontroll, men leder samtidigt till ökad användning av inhalationskortikosteroider «Wang X, Tan X, Li Q. Effectiveness of fractional e...»260.
- Huvudansvaret för diagnostik och behandling av astma hos barn under skolåldern ligger hos specialsjukvården. Regelbunden behandling av astma hos småbarn ska inledas endast av specialistläkare som är insatt i astma hos barn.
- Uppföljningen ordnas så att barnet med 6–12 månaders intervall (eller oftare om situationen och sjukdomens svårighetsgrad så kräver) besöker en specialist som är insatt i behandling av astma hos barn.
- Diagnostiken för barn under 12 år bör ordnas enligt den regionala nivåstruktureringen av vården vid en specialistläkarledd mottagning inom primärvården eller specialsjukvården.
- Konsultation med barnallergolog övervägs i specialsituationer:
- det är svårt att uppnå symtomfrihet hos barnet
- familjen behöver särskild handledning för att genomföra behandlingen
- läkemedelsbehandling på nivå 3 (nivåstrukturerad vård «0–5-vuotiaan lapsen astman hoito»5 , «6–11-vuotiaan lapsen astman hoito »6 )
- småbarnet har behövt regelbunden medicinering i mer än tre månader
- Sedan läkemedelsbehandling av astma inletts. finns det sällan skäl att avsluta den efter en kortare period än ett år. Det är dock viktigt att seponera onödiga läkemedel. Regelbunden astmamedicinering kan frångås när barnet eller den unga varit symtomfri i 6–12 månader, om lungfunktionen är normal och om vid behovsmedicinering införs. Då det gäller periodisk behandling används astmamedicinering vanligtvis i perioder på 1–4 veckor sedan symtomen debuterat, t.ex. under pollensäsongen. Det kliniska tillståndet och lungfunktionen kontrolleras under en läkemedelsfri period.
| * Doserna av en och samma läkemedelssubstans kan skilja sig avsevärt beroende på vilken
inhalator som används. ** För Budesonid anges dosen i inhalatorer som innehåller endast ett verksamt ämne (Budesonid, Pulmicort) som dosen från inhalatorns behållare (ex-valve-dos 100, 200 och 400 μg) och för kombinationspreparat (Bufomix, Symbicort) som dosen från inhalatorns munstycke (ex-actuator-dos 80, 160 och 320 μg), och därför skiljer sig de angivna gränsvärdena från varandra. |
||
| För vissa preparat gäller åldersindikationen från åldern 4 år eller 5 år och doserna nedan kan tillämpas i dessa fall. Doserna är approximativa och ger inte en exakt jämförelse av behandlingseffekten eller dosekvivalens mellan preparaten. Vid kontinuerlig användning hos barn bör säkerhetsgränsen beaktas. Den definierar den dosnivå som, om den överskrids, kan leda till hämning av längdtillväxt hos vissa barn eller till binjurebarkssuppression. I praktiken motsvarar detta den övre gränsen för en medelhög dos. Endast ett fåtal barn är i behov av behandling med hög dos. Dosnivåer i mikrogram för höga doser har inte tydligt definierats, då sådan behandling bör förbehållas specialister inom den specialiserade vården med särskild kompetens i pediatrisk astmabehandling. Mängden läkemedel i mikrogram för höga doser har inte fastställts, då ordinering av höga doser till barn bör begränsas till specialister inom specialsjukvården med erfarenhet i behandling av astma hos barn. | ||
| Läkemedelssubstans och inhalator* | Normal behandlingsdos (μg/dygn) | |
| Låg dos | Medelhög dos | |
| Beklometason | ||
| Traditionell inhalator (Beclomet®) | 100–200 | > 200–400 |
| Finfördelad aerosol (Aerobec®) | 50–100 | > 100–200 |
| Budesonid** | ||
| Budesonid®, Pulmicort® | 100–200 | > 200–400 |
| Bufomix®, Symbicort® | 80–160 | > 160–320 |
| Flutikasonpropionat (Flixotide®, Flutiform®, Salmex®, Seretide®) | 50–125 | > 125–250 |

6–11-vuotiaan lapsen astman hoito.
Avaa kaavion PDF-versio tästä linkistä «hoi06030l.pdf»7
© Suomalainen Lääkäriseura Duodecim
Nivåstrukturerad vård och uppföljning inom primärvården
Vuxna och personer över 12 år
- Primärvården har huvudansvaret för diagnostiken, behandlingen och uppföljningen av astma hos vuxna och för utlåtanden om läkemedelsersättning (B-utlåtande). Vårdansvaret för barn och ungdomar i åldern 12–18 år kan fördelas mellan den lokala pediatriska specialsjukvårdsenheten och primärvården t.ex. genom lokala vårdkedjor.
- Av grundundersökningarna ansvarar primärvården för PEF-uppföljning, spirometri, lungröntgenbild, allergiutredningar och bestämning av eosinofiltalet i blodet.
- Indikationer för konsultation inom specialsjukvården:
- Diagnosen kan inte bekräftas.
- Symtomen svarar inte på läkemedelsbehandlingen på förväntat sätt, trots att man beaktat omständigheterna som försämrar astmakontrollen (patienten använder inte läkemedlen eller kan inte inhalationstekniken, obehandlad allergisk snuva, fortsatt rökning, fortsatt exponeringen för allergener).
- Man misstänker yrkesastma eller arbetsförmågan måste bedömas på lång sikt.
- Bedömning av behovet för hyposensibilisering.
- Patienten är gravid och har dålig astmakontroll.
- Astman kan inte kontrolleras tillräckligt väl med medicinering på nivå 3.
- Patienten behöver upprepade orala kortikosteroidkurer (t.ex. mer än 2 eller 3 kurer under ett år).
- Astmapatienter med regelbunden medicinering bör gå på kontroll årligen.
- Om astmakontrollen är god, kan kontrollbesöken ske hos sjukskötare eller läkare enligt den lokala arbetsfördelningen. Läkarbedömning utförs dock minst med 3–5 års intervall.
- Uppföljningsbesökets (kontrollbesökets) innehåll:
- Fastställande av astmakontrollen:
- Patienten tillfrågas om sina astmasymtom med hjälp av en strukturerad enkät, t.ex. Astmatestet eller motsvarande.
- Patienten tillfrågas om försämringsskov, orala kortikosteroidkurer och eventuella akutbesök.
- Tecknen på dålig prognos kartläggs (se tabell «Bedömning av astmakontrollen under pågående behandling omfattar kartläggning av symtomen och riskfaktorerna som associeras med sämre prognos....»2).
- För undersökning av lungfunktionen uppföljs PEF-värdena gärna under en hel vecka: morgon och kväll gör patienten ett bronkdilatationstest med en snabbverkande beta2-agonist (t.ex. salbutamol). En annan möjlighet är att patienten genomgår spirometri och i samband med spirometrin administreras lämplig bronkdilatator. Spirometri bör vanligen utföras med 3–5 års intervall, men om patienten har problem med astmabehandlingen, görs spirometri årligen.
- Inhalationstekniken kontrolleras.
- Mängden läkemedel som patienten använt kontrolleras genom att fråga eller vid behov med patientens tillstånd genom anteckningarna i de elektroniska databaserna.
- Ersättningsstatus för läkemedlen kontrolleras.
- Anvisningarna för egenvård kontrolleras och en för patienten god PEF-nivå fastställs.
- Rökningsstatus utreds och vid behov erbjuds avvänjningsbehandling.
- Om astmakontrollen är otillfredsställande, bedöms orsakerna (se ovan). Försämringsfaktorerna åtgärdas och medicineringen effektiviseras vid behov. Det är bra att minnas att det ingalunda alltid är lätt att ställa rätt diagnos. Diagnosen kan eventuellt fastställas först under uppföljning. Diagnosen kan ha varit fel från början.
- Om astmakontrollen varit god i minst sex månader, kan en minskning av medicineringen övervägas, om detta inte prövats redan tidigare.
- Fastställande av astmakontrollen:
Barn i skolåldern (7–11 år)
- Inom primärvården kan man åtminstone under mellankontrollerna följa upp de barn i skolåldern som har god astmakontroll. I övrigt sker diagnostiken och vården huvudsakligen inom specialsjukvården.
- I samband med undersökningarna inom skolhälsovården är det också bra att bedöma astmastatusen, men uppföljningen av kroniska sjukdomar hör strängt taget inte till skolhälsovården. Astmakontrollerna för barn i skolåldern genomförs på samma sätt som för vuxna men oftare, vanligtvis med ½–2 års intervall, beroende på astmabalansen. Spirometri görs vanligtvis med 1–2 års intervall. Tillväxtkurvan kontrolleras.
Barn under skolåldern (0–6 år)
- Diagnostik och behandling av astma hos barn under skolåldern hör i huvudsak till specialsjukvården. Se remitteringskriterierna i Social- och hälsovårdsministeriets publikation Enhetliga grunder för icke-brådskande vård. «http://urn.fi/URN:ISBN:978-952-00-3520-4»4, «Yhtenäiset kiireettömän hoidon perusteet 2019. Sos...»261.
Behandling av astma under graviditet och amning
- Under graviditet kan astman förvärras, men i allmänhet förblir den oförändrad eller lindras.
- Den viktigaste informationen är att om modern har dålig astmabalans under graviditeten, utgör detta en större risk för fostret än om hon använder astmaläkemedel «Global Initiative for Asthma (GINA). Global Strate...»1, «NAEPP 2004: Management of asthma during pregnancy....»262, «Bonham CA, Patterson KC, Strek ME. Asthma Outcomes...»263, «Pfaller B, José Yepes-Nuñez J, Agache I ym. Biolog...»264. Astma behandlas på samma sätt under graviditet som före graviditet och medicineringen justeras enligt sjukdomskontrollen. Det finns internationella rekommendationer för läkemedelsbehandling under graviditet och amning «Global Initiative for Asthma (GINA). Global Strate...»1, «British Thoracic Society, Scottish Intercollegiate...»265. Tills vidare finns det endast lite publicerade data om säkerheten av biologiska läkemedel som används under graviditet, förutom för omalizumab, Astma associeras med risk för prematuritet och för att barnet är litet för gestationsålder (small for gestational age, SGA) «Rejnö G, Lundholm C, Larsson K ym. Adverse Pregnan...»266, «Kemppainen M, Lahesmaa-Korpinen AM, Kauppi P ym. M...»267.
- Dålig terapeutisk balans vid astma och svår astma ökar risken för graviditetsproblem «Global Initiative for Asthma (GINA). Global Strate...»1, «Rejnö G, Lundholm C, Larsson K ym. Adverse Pregnan...»266, «Robijn AL, Brew BK, Jensen ME ym. Effect of matern...»268.
- Upprepade astmaskov ökar risken för både elektivt och akut kejsarsnitt samt för att barnet är litet för gestationsåldern «Robijn AL, Brew BK, Jensen ME ym. Effect of matern...»268. Under graviditet och amning är det tryggt att använda inhalationskortikosteroider, inhalerbara beta2-agonister och sannolikt också inhalerbara antikolinergika. Montelukast anses i allmänhet vara tryggt, åtminstone efter första graviditetstrimestern. Eventuella astmaskov kan orsaka hypoxemi hos fostret, och därför ska astmaskoven behandlas effektivt, vid behov bl.a. med oral kortikosteroidkur «Global Initiative for Asthma (GINA). Global Strate...»1, «Sanchis J, Gich I, Pedersen S ym. Systematic Revie...»191.
- Allergisk snuva behandlas med andra generationens antihistaminer (mest dokumentation finns för loratadin och cetirizin) och näskortikosteroid «NAEPP 2004: Management of asthma during pregnancy....»262. Om dekongestiva läkemedel behövs, används nässprayer medan orala preparat undviks «NAEPP 2004: Management of asthma during pregnancy....»262, «British Thoracic Society, Scottish Intercollegiate...»265.
- Om astman inte kan balanseras under graviditeten, remitteras patienten till specialsjukvården.
Yrkesval
- Personer med astma och allergiska sjukdomar behandlas inte som någon enhetlig grupp i yrkesvägledningen. Principen är att undvika absoluta begränsningar.
- Vid yrkesvalet beaktas individuella hälsofaktorer, men studieriktningen och yrkesvalet avgörs i första hand av personens motivation för branschen som hen valt.
- Då olika alternativ gås igenom, är det väsentligt att beakta hurdana symtomen är, deras svårighetsgrad och utveckling, särskilda individuella allergier samt behovet av medicinering och annan vård.
- Vid bedömning av en astmapatients lämplighet för ett visst yrke är det viktigt att beakta omfattningen av exponeringen i relation till arbetsuppgifterna, möjligheterna till skydd samt personens inlärningsförmåga och förutsättningar att följa skyddsanvisningarna.
- Lindrig astma i god balans med måttlig medicinering är sällan något hinder för yrkesutövning. Symtomatisk astma i skolåldern möjliggör inte studier inom räddnings- eller sjöfartsbranschen som förutsätter rökdykarbehörighet «Uusitalo A, Lindström I, Karjalainen J, Kauppi P...»269. Personer med astma och allergisk rinit lämpar sig dåligt för arbeten med betydande exponering för luftvägsirriterande damm eller specifika allergener. «https://www.ttl.fi/teemat/tyoterveys/toissa-terveena-ammatinvalinta-allergia-ihottuma-ja-astma»5
- Riskyrken är sådana där det förekommer exponering för mjöldamm (bagerier) eller djurdamm (boskaps- och djurskötselarbeten), textilarbeten och frisörarbeten.
- Om den unga står inför flera yrkesalternativ, bör man tillsammans med hen överväga vilken bransch som vore mest lämplig med tanke på hens sjukdomar.
- Tungt fysiskt arbete eller långvarig exponering för kyla eller damm är oftast olämpligt för personer med svår astma «Pelkonen A, Aalto-Korte K. Astma, allergiat ja amm...»270, «Terho E. Allergiaoireiden ottaminen huomioon ammat...»271.
- Mer information: «https://www.ttl.fi/teemat/tyoterveys/toissa-terveena-ammatinvalinta-allergia-ihottuma-ja-astma»5
Militärtjänst
- Varje år avbryter cirka 100–150 beväringar eller kvinnor som fullgör frivillig militärtjänst sin militärtjänst på grund av astma (cirka 3–4 % av alla avbrott på grund av hälsoskäl). Dessutom görs cirka 200 astmarelaterade ändringar i tjänstgöringsduglighetsklassen «Sotilaslääketieteen keskus, Puolustusvoimat. http...»272. Vid uppbåden har 5,2 % av beväringarna diagnosen astma «Reijula J, Latvala J, Mäkelä M ym. Long-term trend...»273.
- Under militärtjänsten försvåras astman av upprepade luftvägsinfektioner, fysisk ansträngning, damm, dålig inomhusluft och irriterande faktorer i utomhusluften (köld, pollen). Astma som tidigare varit symtomfri (t.ex. i barndomen) kan ge symtom under militärtjänstgöring och lindrig astma kan försvåras. Det är dock vanligare att astman förblir oförändrad eller lindras under tjänstgöringstiden «Lindström I, Koponen P, Luukkonen R ym. Military s...»274.
- Astma utgör ingen grund för befrielse från militärtjänst om symtomen är under kontroll och medicineringen är adekvat. Situationen bedöms innan tjänstgöringen inleds och ofta finns det skäl att påbörja användning av inhalationskortikosteroid för att förebygga förvärrad astma, åtminstone under de första, mest ansträngande militärtjänstgöringsmånaderna. Astma utesluter vissa specialuppdrag, såsom fallskärmsjägare, specialgränsjägare och tjänstgöring inom Finlands internationella beredskapstrupper. I princip är astma inget hinder för en militär karriär.
- Av tjänsteduglighetsklasserna är det besvärligaste alternativet för en ung person tillfällig befrielse från tjänstgöring (klass E). I allmänhet lyckas det nämligen att vid behov effektivisera behandlingen av astma och att uppnå en god terapeutisk balans under tiden mellan uppbådet och tjänstgöringens början. Om astman är svår och den terapeutiska balansen trots försök är otillräcklig, är det rimligt att bli befriad från tjänstgöring «Pääesikunta. Terveystarkastusohje 2012;330:7. http...»275.
Astma och idrott
- Astma som bryter ut i barndomen begränsar vanligen inte idrott. Hos idrottare förekommer astma i samma utsträckning som hos den övriga befolkningen. Vissa idrottsgrenar är på tävlingsnivå förknippade med en ökad risk för astma under idrottskarriären.
- En betydande tilläggsrisk associeras med sådana idrottsgrenar där en hög minutventilation behövs och där idrottaren kan exponeras för respiratoriska retämnen. Sådana grenar är t.ex. terrängskidning, skidskytte, simning, cykling, löpning, orientering och triathlon.
- Andningssymtom är mycket vanliga, särskilt hos idrottare inom ovan nämnda uthållighetsgrenar. Alla symtom beror dock ingalunda på astma. Diagnosen astma hos idrottare grundar sig på samma kriterier som hos andra patienter. Eftersom symtomen oftast är kopplade till ansträngning, är maximalt belastningsprov och andra provokationstest, särskilt det eukapniska volontära hyperventilationstestet, värdefulla för utredning av symtomen.
- Idrottarnas astmabalans är i allmänhet god. Om symtom återstår trots adekvat behandling, aktualiseras frågan om behovet av noggrann differentialdiagnostik.
- Trots att alla selektiva och icke-selektiva beta2-agonister är förbjudna inom idrotten, är det tillåtet att använda inhalerbara astmaläkemedel om följande maximidoser inte överskrids: salbutamol högst 1600 μg per 24 timmar, fördelat på doser så att ingen enskild dos överstiger 600 μg under en period om 8 timmar, oavsett från vilken dos man räknar; formoterol högst 54 μg per 24 timmar (levererad dos); salmeterol högst 200 μg per 24 timmar; vilanterol högst 25 μg per 24 timmar. Den aktuella listan kan kontrolleras på WADA:s webbplats «https://www.wada-ama.org/en»6.
- I Finland är det enkelt att kontrollera om läkemedel med försäljningstillstånd är tillåtna inom idrotten genom att besöka den webbplats som upprätthålls av Finlands centrum för etik inom idrotten FCEI r.f: KAMU-läkemedelssökning «https://kamu.suek.fi/sv/»7.
Arbetsgrupp tillsatt av Finska Läkarföreningen Duodecim, Finlands Lungläkarförening r.f., Barnläkarföreningen i Finland r.f., Barnläkarföreningen för allergologi i Finland r.f. och Finska föreningen för klinisk fysiologi r.f.
För mer information om arbetsgruppsmedlemmar samt anmälan om intressekonflikter, se «Astma»1 (på finska)
Översättare: Lingsoft Language Services Oy
Granskning av översättningen: Robert Paul
Litteratur
Astma. God medicinsk praxis-rekommendation. Arbetsgrupp tillsatt av Finska Läkarföreningen Duodecim, Finlands Lungläkarförening r.f., Barnläkarföreningen i Finland r.f., Barnläkarföreningen för allergologi i Finland r.f. och Finska föreningen för klinisk fysiologi r.f.. Helsingfors: Finska Läkarföreningen Duodecim, 2025 (hänvisning dd.mm.åååå). Tillgänglig på internet: www.kaypahoito.fi
Närmare anvisningar: «https://www.kaypahoito.fi/sv/god-medicinsk-praxis/nyttjanderattigheter/citering»8
Ansvarsbegränsning
God medicinsk praxis- och Avstå klokt-rekommendationerna är sammandrag gjorda av experter gällande diagnostik och behandling av bestämda sjukdomar. Rekommendationerna fungerar som stöd när läkare eller andra yrkesutbildade personer inom hälso- och sjukvården ska fatta behandlingsbeslut. De ersätter inte läkarens eller annan hälsovårdspersonals egen bedömning av vilken diagnostik, behandling och rehabilitering som är bäst för den enskilda patienten då behandlingsbeslut fattas.
Litteratur
- Global Initiative for Asthma (GINA). Global Strategy for Asthma Management and Prevention. Updated 2021. https://ginasthma.org/wp-content/uploads/2021/05/GINA-Main-Report-2021-V2-WMS.pdf
- Wenzel SE. Asthma phenotypes: the evolution from clinical to molecular approaches. Nat Med 2012;18:716-25 «PMID: 22561835»PubMed
- Lehtimäki L, Karjalainen J. Erikoissairaanhoidon rooli astman diagnostiikassa ja hoidossa. Duodecim 2019;135:1779-86
- Erjefält JS. Unravelling the complexity of tissue inflammation in uncontrolled and severe asthma. Curr Opin Pulm Med 2019;25:79-86 «PMID: 30422896»PubMed
- Hammad H, Lambrecht B. The basic immunology of asthma. Cell 2021;184:1469-85, PMID: 33711259
- Crisford H, Sapey E, Rogers GB ym. Neutrophils in asthma: the good, the bad and the bacteria. Thorax 2021;: «PMID: 33632765»PubMed
- Hough KP, Curtiss ML, Blain TJ ym. Airway Remodeling in Asthma. Front Med (Lausanne) 2020;7:191 «PMID: 32509793»PubMed
- Sarkar M, Niranjan N, Banyal PK. Mechanisms of hypoxemia. Lung India 2017;34:47-60 «PMID: 28144061»PubMed
- Kankaanranta H, Tuomisto LE, Ilmarinen P. Age-specific incidence of new asthma diagnoses in Finland. J Allergy Clin Immunol Pract 2017;5:189-191.e3 «PMID: 27765463»PubMed
- Pakkasela J, Ilmarinen P, Honkamäki J ym. Age-specific incidence of allergic and non-allergic asthma. BMC Pulm Med 2020;20:9 «PMID: 31924190»PubMed
- Soriano JB, Davis KJ, Coleman B ym. The proportional Venn diagram of obstructive lung disease: two approximations from the United States and the United Kingdom. Chest 2003;124:474-81 «PMID: 12907531»PubMed
- Kauppi P, Kupiainen H, Lindqvist A ym. Overlap syndrome of asthma and COPD predicts low quality of life. J Asthma 2011;48:279-85 «PMID: 21323613»PubMed
- Marsh SE, Travers J, Weatherall M ym. Proportional classifications of COPD phenotypes. Thorax 2008;63:761-7 «PMID: 18728201»PubMed
- Hisinger-Mölkänen H, Pallasaho P, Haahtela T ym. The increase of asthma prevalence has levelled off and symptoms decreased in adults during 20 years from 1996 to 2016 in Helsinki, Finland. Respir Med 2019;155:121-126 «PMID: 31344661»PubMed
- Lai CK, Beasley R, Crane J ym. Global variation in the prevalence and severity of asthma symptoms: phase three of the International Study of Asthma and Allergies in Childhood (ISAAC). Thorax 2009;64:476-83 «PMID: 19237391»PubMed
- von Hertzen L, Haahtela T. Disconnection of man and the soil: reason for the asthma and atopy epidemic? J Allergy Clin Immunol 2006;117:334-44 «PMID: 16461134»PubMed
- Suomen virallinen tilasto (SVT): Kuolemansyyt (verkkojulkaisu). ISSN 1799-5051. 2019, Liitetaulukko 1a. Kuolleet peruskuolemansyyn ja iän mukaan 2019, molemmat sukupuolet . Helsinki: Tilastokeskus (viitattu: 15.1.2021). http://www.stat.fi/til/ksyyt/2019/ksyyt_2019_2020-12-14_tau_001_fi.html
- Kivistö JE, Karjalainen J, Kivelä L ym. Very low asthma death incidence among Finnish children from 1999 to 2015. Pediatr Pulmonol 2018;53:1009-1013 «PMID: 29717545»PubMed
- Ferreira MA, Matheson MC, Duffy DL ym. Identification of IL6R and chromosome 11q13.5 as risk loci for asthma. Lancet 2011;378:1006-14 «PMID: 21907864»PubMed
- Torgerson DG, Ampleford EJ, Chiu GY ym. Meta-analysis of genome-wide association studies of asthma in ethnically diverse North American populations. Nat Genet 2011;43:887-92 «PMID: 21804549»PubMed
- Moffatt MF, Gut IG, Demenais F ym. A large-scale, consortium-based genomewide association study of asthma. N Engl J Med 2010;363:1211-1221 «PMID: 20860503»PubMed
- Myers RA, Scott NM, Gauderman WJ ym. Genome-wide interaction studies reveal sex-specific asthma risk alleles. Hum Mol Genet 2014;23:5251-9 «PMID: 24824216»PubMed
- DeVries A, Vercelli D. Epigenetic Mechanisms in Asthma. Ann Am Thorac Soc 2016;13 Suppl 1:S48-50 «PMID: 27027952»PubMed
- Demenais F, Margaritte-Jeannin P, Barnes KC ym. Multiancestry association study identifies new asthma risk loci that colocalize with immune-cell enhancer marks. Nat Genet 2018;50:42-53 «PMID: 29273806»PubMed
- Kotisalmi E, Salmi S, Karjalainen J, Kauppi P. Aikuistyypin astman riskitekijät. (Risk factors for adult onset asthma) (review) Duodecim 2019; 135: 1759-66.
- Shrine N, Portelli MA, John C ym. Moderate-to-severe asthma in individuals of European ancestry: a genome-wide association study. Lancet Respir Med 2019;7:20-34 «PMID: 30552067»PubMed
- El-Husseini ZW, Gosens R, Dekker F ym. The genetics of asthma and the promise of genomics-guided drug target discovery. Lancet Respir Med 2020;8:1045-1056 «PMID: 32910899»PubMed
- Räsänen M. Familial aggregation and risk factors for asthma and hay fever among Finnish adolescent twins - a twin family study. Väitöskirja. Helsinki 2000
- Skadhauge LR, Christensen K, Kyvik KO ym. Genetic and environmental influence on asthma: a population-based study of 11,688 Danish twin pairs. Eur Respir J 1999;13:8-14 «PMID: 10836316»PubMed
- Svanes C, Jarvis D, Chinn S ym. Childhood environment and adult atopy: results from the European Community Respiratory Health Survey. J Allergy Clin Immunol 1999;103:415-20 «PMID: 10069874»PubMed
- Edenharter G, Bergmann RL, Bergmann KE ym. Cord blood-IgE as risk factor and predictor for atopic diseases. Clin Exp Allergy 1998;28:671-8 «PMID: 9677130»PubMed
- Bao Y, Chen Z, Liu E ym. Risk Factors in Preschool Children for Predicting Asthma During the Preschool Age and the Early School Age: a Systematic Review and Meta-Analysis. Curr Allergy Asthma Rep 2017;17:85 «PMID: 29151195»PubMed
- Jones BL, Rosenwasser LJ. Linkage and Genetic Association in Severe Asthma. Immunol Allergy Clin North Am 2016;36:439-47 «PMID: 27401617»PubMed
- Borna E, Nwaru BI, Bjerg A ym. Changes in the prevalence of asthma and respiratory symptoms in western Sweden between 2008 and 2016. Allergy 2019;74:1703-1715 «PMID: 31021427»PubMed
- Shaaban R, Zureik M, Soussan D ym. Rhinitis and onset of asthma: a longitudinal population-based study. Lancet 2008;372:1049-57 «PMID: 18805333»PubMed
- Pallasaho P, Juusela M, Lindqvist A ym. Allergic rhinoconjunctivitis doubles the risk for incident asthma--results from a population study in Helsinki, Finland. Respir Med 2011;105:1449-56 «PMID: 21600752»PubMed
- Tohidinik HR, Mallah N, Takkouche B. History of allergic rhinitis and risk of asthma; a systematic review and meta-analysis. World Allergy Organ J 2019;12:100069 «PMID: 31660100»PubMed
- Jartti T, Smits HH, Bønnelykke K ym. Bronchiolitis needs a revisit: Distinguishing between virus entities and their treatments. Allergy 2019;74:40-52 «PMID: 30276826»PubMed
- Caliskan M, Bochkov YA, Kreiner-Møller E ym. Rhinovirus wheezing illness and genetic risk of childhood-onset asthma. N Engl J Med 2013;368:1398-407 «PMID: 23534543»PubMed
- Rubner FJ, Jackson DJ, Evans MD ym. Early life rhinovirus wheezing, allergic sensitization, and asthma risk at adolescence. J Allergy Clin Immunol 2017;139:501-507 «PMID: 27312820»PubMed
- Jayes L, Haslam PL, Gratziou CG ym. SmokeHaz: Systematic Reviews and Meta-analyses of the Effects of Smoking on Respiratory Health. Chest 2016;150:164-79 «PMID: 27102185»PubMed
- Tupakka- ja nikotiiniriippuvuuden ehkäisy ja hoito. Käypä hoito -suositus. Suomalaisen Lääkäriseuran Duodecimin ja Suomen Yleislääketieteen yhdistyksen asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim, 2018 (viitattu 13.10.2021). Saatavilla internetissä: www.kaypahoito.fi
- Vork KL, Broadwin RL, Blaisdell RJ. Developing asthma in childhood from exposure to secondhand tobacco smoke: insights from a meta-regression. Environ Health Perspect 2007;115:1394-400 «PMID: 17938726»PubMed
- Jaakkola MS, Piipari R, Jaakkola N ym. Environmental tobacco smoke and adult-onset asthma: a population-based incident case-control study. Am J Public Health 2003;93:2055-60 «PMID: 14652334»PubMed
- Simoni M, Baldacci S, Puntoni R ym. Respiratory symptoms/diseases and environmental tobacco smoke (ETS) in never smoker Italian women. Respir Med 2007;101:531-8 «PMID: 16893638»PubMed
- Lihavuus (lapset, nuoret ja aikuiset). Käypä hoito -suositus. Suomalaisen Lääkäriseuran Duodecimin, Suomen Lihavuustutkijat ry:n ja Suomen Lastenlääkäriyhdistys ry:n asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim, 2020 (viitattu 13.10.2021). Saatavilla internetissä: www.kaypahoito.fi
- Chan WW, Chiou E, Obstein KL ym. The efficacy of proton pump inhibitors for the treatment of asthma in adults: a meta-analysis. Arch Intern Med 2011;171:620-9 «PMID: 21482834»PubMed
- Morice AH, Millqvist E, Bieksiene K ym. ERS guidelines on the diagnosis and treatment of chronic cough in adults and children. Eur Respir J 2020;55: «PMID: 31515408»PubMed
- Choi HG, Kim JH, Park JY ym. Association Between Asthma and Depression: A National Cohort Study. J Allergy Clin Immunol Pract 2019;7:1239-1245.e1 «PMID: 30423450»PubMed
- Mendell MJ, Mirer AG, Cheung K ym. Respiratory and allergic health effects of dampness, mold, and dampness-related agents: a review of the epidemiologic evidence. Environ Health Perspect 2011;119:748-56 «PMID: 21269928»PubMed
- Seuri M, Nevalainen A, Sauni R. Kosteusvauriorakennusten mikrobikasvuun liittyvät hengitystieoireet ja -sairaudet. Suom Lääkär 2007;62:783-7
- Pekkanen J, Hyvärinen A, Haverinen-Shaughnessy U ym. Moisture damage and childhood asthma: a population-based incident case-control study. Eur Respir J 2007;29:509-15 «PMID: 17107993»PubMed
- Tischer C, Chen CM, Heinrich J. Association between domestic mould and mould components, and asthma and allergy in children: a systematic review. Eur Respir J 2011;38:812-24 «PMID: 21540311»PubMed
- Blanc PD, Annesi-Maesano I, Balmes JR ym. The Occupational Burden of Nonmalignant Respiratory Diseases. An Official American Thoracic Society and European Respiratory Society Statement. Am J Respir Crit Care Med 2019;199:1312-1334 «PMID: 31149852»PubMed
- Kogevinas M, Antó JM, Sunyer J ym. Occupational asthma in Europe and other industrialised areas: a population-based study. European Community Respiratory Health Survey Study Group. Lancet 1999;353:1750-4 «PMID: 10347988»PubMed
- Karjalainen A, Kurppa K, Martikainen R ym. Exploration of asthma risk by occupation--extended analysis of an incidence study of the Finnish population. Scand J Work Environ Health 2002;28:49-57 «PMID: 11871852»PubMed
- Jaakkola JJ, Piipari R, Jaakkola MS. Occupation and asthma: a population-based incident case-control study. Am J Epidemiol 2003;158:981-7 «PMID: 14607806»PubMed
- Kogevinas M, Zock JP, Jarvis D ym. Exposure to substances in the workplace and new-onset asthma: an international prospective population-based study (ECRHS-II). Lancet 2007;370:336-41 «PMID: 17662882»PubMed
- Sovijärvi A, Kainu A, Malmberg P, Lindholm B, Timonen K, Piirilä P. Spirometria- ja PEF-mittausten suoritus ja tulkinta. 15. painos. Moodi 2021
- Drake S, Wang R, Healy L ym. Diagnosing Asthma with and without Aerosol-Generating Procedures. J Allergy Clin Immunol Pract 2021;9:4243-4251.e7 «PMID: 34303020»PubMed
- Quanjer PH, Lebowitz MD, Gregg I ym. Peak expiratory flow: conclusions and recommendations of a Working Party of the European Respiratory Society. Eur Respir J Suppl 1997;24:2S-8S «PMID: 9098701»PubMed
- Pellegrino R, Viegi G, Brusasco V ym. Interpretative strategies for lung function tests. Eur Respir J 2005;26:948-68 «PMID: 16264058»PubMed
- Nieminen MM. Unimodal distribution of bronchial hyperresponsiveness to methacholine in asthmatic patients. Chest 1992;102:1537-43 «PMID: 1424879»PubMed
- Juusela M, Poussa T, Kotaniemi J ym. Bronchial hyperresponsiveness in a population of north Finland with no previous diagnosis of asthma or chronic bronchitis assessed with histamine and methacholine tests. Int J Circumpolar Health 2008;67:308-17 «PMID: 19024801»PubMed
- Juusela M, Pallasaho P, Rönmark E ym. Dose-dependent association of smoking and bronchial hyperresponsiveness. Eur Respir J 2013;42:1503-12 «PMID: 23722612»PubMed
- Malmberg P, Karjalainen J, Tikkakoski A, Mäkelä M, Koskela H. Keuhkoputkien supistumisherkkyyden mittaus metakoliinialtistuksella. Suomen Kliinisen Fysiologian yhdistyksen ja Suomen Keuhkolääkäriyhdistyksen ja Suomen Lastenlääkäreiden Allergologiayhdistyksen suositus. Suom Lääkäril 2018; 23:1511-1513
- Clinical exercise testing with reference to lung diseases: indications, standardization and interpretation strategies. ERS Task Force on Standardization of Clinical Exercise Testing. European Respiratory Society. Eur Respir J 1997;10:2662-89 «PMID: 9426113»PubMed
- Hallstrand TS, Leuppi JD, Joos G ym. ERS technical standard on bronchial challenge testing: pathophysiology and methodology of indirect airway challenge testing. Eur Respir J 2018;52: «PMID: 30361249»PubMed
- Koskela H, Tikkakoski A, Karjalainen J, Mäkelä M, Malmberg P. Epäsuorat altistuskokeet astman diagnosoinnissa. Duodecim 2019;135:1787-94
- Burman J, Elenius V, Lukkarinen H ym. Cut-off values to evaluate exercise-induced asthma in eucapnic voluntary hyperventilation test for children. Clin Physiol Funct Imaging 2020;40:343-350 «PMID: 32491255»PubMed
- Barben J, Kuehni CE, Strippoli MP ym. Mannitol dry powder challenge in comparison with exercise testing in children. Pediatr Pulmonol 2011;46:842-8 «PMID: 21465681»PubMed
- Broekhuizen BD, Sachs AP, Moons KG ym. Diagnostic value of oral prednisolone test for chronic obstructive pulmonary disorders. Ann Fam Med 2011;9:104-9 «PMID: 21403135»PubMed
- Denlinger LC, Phillips BR, Ramratnam S ym. Inflammatory and Comorbid Features of Patients with Severe Asthma and Frequent Exacerbations. Am J Respir Crit Care Med 2017;195:302-313 «PMID: 27556234»PubMed
- Couillard S, Laugerud A, Jabeen M ym. Derivation of a prototype asthma attack risk scale centred on blood eosinophils and exhaled nitric oxide. Thorax 2022;77:199-202 «PMID: 34362839»PubMed
- Chibana K, Trudeau JB, Mustovich AT ym. IL-13 induced increases in nitrite levels are primarily driven by increases in inducible nitric oxide synthase as compared with effects on arginases in human primary bronchial epithelial cells. Clin Exp Allergy 2008;38:936-46 «PMID: 18384429»PubMed
- Ahovuo-Saloranta A, Csonka P, Lehtimäki L. Basic characteristics and clinical value of FeNO in smoking asthmatics-a systematic review. J Breath Res 2019;13:034003 «PMID: 30861509»PubMed
- Dweik RA, Boggs PB, Erzurum SC ym. An official ATS clinical practice guideline: interpretation of exhaled nitric oxide levels (FENO) for clinical applications. Am J Respir Crit Care Med 2011;184:602-15 «PMID: 21885636»PubMed
- Lehtimäki L, Csonka P, Mäkinen E ym. Predictive value of exhaled nitric oxide in the management of asthma: a systematic review. Eur Respir J 2016;48:706-14 «PMID: 27492830»PubMed
- Lee LA, Bailes Z, Barnes N ym. Efficacy and safety of once-daily single-inhaler triple therapy (FF/UMEC/VI) versus FF/VI in patients with inadequately controlled asthma (CAPTAIN): a double-blind, randomised, phase 3A trial. Lancet Respir Med 2021;9:69-84 «PMID: 32918892»PubMed
- Busse WW, Wenzel SE, Casale TB ym. Baseline FeNO as a prognostic biomarker for subsequent severe asthma exacerbations in patients with uncontrolled, moderate-to-severe asthma receiving placebo in the LIBERTY ASTHMA QUEST study: a post-hoc analysis. Lancet Respir Med 2021;9:1165-1173 «PMID: 34181876»PubMed
- Petsky HL, Kew KM, Turner C ym. Exhaled nitric oxide levels to guide treatment for adults with asthma. Cochrane Database Syst Rev 2016;9:CD011440 «PMID: 27580628»PubMed
- Petsky HL, Kew KM, Chang AB. Exhaled nitric oxide levels to guide treatment for children with asthma. Cochrane Database Syst Rev 2016;11:CD011439 «PMID: 27825189»PubMed
- Castro M, Corren J, Pavord ID ym. Dupilumab Efficacy and Safety in Moderate-to-Severe Uncontrolled Asthma. N Engl J Med 2018;378:2486-2496 «PMID: 29782217»PubMed
- Hanania NA, Wenzel S, Rosén K ym. Exploring the effects of omalizumab in allergic asthma: an analysis of biomarkers in the EXTRA study. Am J Respir Crit Care Med 2013;187:804-11 «PMID: 23471469»PubMed
- Pavord ID, Korn S, Howarth P ym. Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double-blind, placebo-controlled trial. Lancet 2012;380:651-9 «PMID: 22901886»PubMed
- Malmberg LP, Petäys T, Haahtela T ym. Exhaled nitric oxide in healthy nonatopic school-age children: determinants and height-adjusted reference values. Pediatr Pulmonol 2006;41:635-42 «PMID: 16703576»PubMed
- Keuhkoahtaumatauti. Käypä hoito -suositus. Suomalaisen Lääkäriseuran Duodecimin ja Suomen Keuhkolääkäriyhdistys ry:n asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim, 2020 (viitattu 13.10.2021). Saatavilla internetissä: www.kaypahoito.fi
- Global Initiative for Chronic Obstructive Lung Disease. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease. 2021 Report. https://goldcopd.org/wp-content/uploads/2020/11/GOLD-REPORT-2021-v1.1-25Nov20_WMV.pdf
- Fingleton J, Weatherall M, Beasley R. Bronchodilator responsiveness: interpret with caution. Thorax 2012;67:667-8 «PMID: 22693176»PubMed
- Calverley PM, Burge PS, Spencer S ym. Bronchodilator reversibility testing in chronic obstructive pulmonary disease. Thorax 2003;58:659-64 «PMID: 12885978»PubMed
- Tashkin DP, Celli B, Decramer M ym. Bronchodilator responsiveness in patients with COPD. Eur Respir J 2008;31:742-50 «PMID: 18256071»PubMed
- Albert P, Agusti A, Edwards L ym. Bronchodilator responsiveness as a phenotypic characteristic of established chronic obstructive pulmonary disease. Thorax 2012;67:701-8 «PMID: 22696176»PubMed
- Zhang L, He L, Gong J ym. Risk Factors Associated with Irreversible Airway Obstruction in Asthma: A Systematic Review and Meta-Analysis. Biomed Res Int 2016;2016:9868704 «PMID: 27119087»PubMed
- Halvorsen T, Walsted ES, Bucca C ym. Inducible laryngeal obstruction: an official joint European Respiratory Society and European Laryngological Society statement. Eur Respir J 2017;50: «PMID: 28889105»PubMed
- Vandenplas O, Suojalehto H, Cullinan P. Diagnosing occupational asthma. Clin Exp Allergy 2017;47:6-18 «PMID: 27883240»PubMed
- Karjalainen A, Kurppa K, Virtanen S ym. Incidence of occupational asthma by occupation and industry in Finland. Am J Ind Med 2000;37:451-8 «PMID: 10723039»PubMed
- Tarlo SM, Liss GM, Yeung KS. Changes in rates and severity of compensation claims for asthma due to diisocyanates: a possible effect of medical surveillance measures. Occup Environ Med 2002;59:58-62 «PMID: 11836470»PubMed
- Suojalehto H, Malmberg P, Lindström I, Harju T, Kauppi P, Kilpeläinen M, et al. Ammattikeuhkosairauksien asiantuntijaryhmän (AKAR) suositus. Hengitysteiden spesifiset altistuskokeet ammattiastman osoittamisessa. Duodecim 2011;127:2205-14
- Vandenplas O, Suojalehto H, Aasen TB ym. Specific inhalation challenge in the diagnosis of occupational asthma: consensus statement. Eur Respir J 2014;43:1573-87 «PMID: 24603815»PubMed
- Brooks SM, Weiss MA, Bernstein IL. Reactive airways dysfunction syndrome (RADS). Persistent asthma syndrome after high level irritant exposures. Chest 1985;88:376-84 «PMID: 4028848»PubMed
- Henneberger PK, Redlich CA, Callahan DB ym. An official american thoracic society statement: work-exacerbated asthma. Am J Respir Crit Care Med 2011;184:368-78 «PMID: 21804122»PubMed
- Purokivi M, Sauni R, Hannu T, Harju T, Jaakkola M, Karjalainen J, et al. Tyon pahentama astma. Duodecim 2014;130:1691-8
- Saarinen K, Karjalainen A, Martikainen R ym. Prevalence of work-aggravated symptoms in clinically established asthma. Eur Respir J 2003;22:305-9 «PMID: 12952265»PubMed
- Le Moual N, Carsin AE, Siroux V ym. Occupational exposures and uncontrolled adult-onset asthma in the European Community Respiratory Health Survey II. Eur Respir J 2014;43:374-86 «PMID: 23949964»PubMed
- Kim JL, Henneberger PK, Lohman S ym. Impact of occupational exposures on exacerbation of asthma: a population-based asthma cohort study. BMC Pulm Med 2016;16:148 «PMID: 27842581»PubMed
- Sherman CB. Late-onset asthma: making the diagnosis, choosing drug therapy. Geriatrics 1995;50:24-6, 29-30, 33 «PMID: 7498799»PubMed
- Bauer BA, Reed CE, Yunginger JW ym. Incidence and outcomes of asthma in the elderly. A population-based study in Rochester, Minnesota. Chest 1997;111:303-10 «PMID: 9041973»PubMed
- Honkamäki J, Hisinger-Mölkänen H, Ilmarinen P ym. Age- and gender-specific incidence of new asthma diagnosis from childhood to late adulthood. Respir Med 2019;154:56-62 «PMID: 31212122»PubMed
- Ekici M, Apan A, Ekici A ym. Perception of bronchoconstriction in elderly asthmatics. J Asthma 2001;38:691-6 «PMID: 11758898»PubMed
- Connolly MJ, Crowley JJ, Charan NB ym. Reduced subjective awareness of bronchoconstriction provoked by methacholine in elderly asthmatic and normal subjects as measured on a simple awareness scale. Thorax 1992;47:410-3 «PMID: 1496497»PubMed
- Allen SC, Khattab A. The airflow resistance sensing threshold during tidal breathing rises in old age in patients with asthma. Age Ageing 2012;41:557-60 «PMID: 22427506»PubMed
- Monisairas potilas. Käypä hoito -suositus. Suomalaisen Lääkäriseuran Duodecimin ja Suomen yleislääketieteen yhdistyksen asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim, 2021 (viitattu 23.12.2021). Saatavilla internetissä: www.kaypahoito.fi
- Enright PL, McClelland RL, Newman AB ym. Underdiagnosis and undertreatment of asthma in the elderly. Cardiovascular Health Study Research Group. Chest 1999;116:603-13 «PMID: 10492260»PubMed
- Lehmann S, Vollset SE, Nygaard HA ym. Factors determining performance of bronchodilator reversibility tests in middle-aged and elderly. Respir Med 2004;98:1071-9 «PMID: 15526807»PubMed
- Burney PG, Britton JR, Chinn S ym. Descriptive epidemiology of bronchial reactivity in an adult population: results from a community study. Thorax 1987;42:38-44 «PMID: 3497466»PubMed
- Braman SS, Kaemmerlen JT, Davis SM. Asthma in the elderly. A comparison between patients with recently acquired and long-standing disease. Am Rev Respir Dis 1991;143:336-40 «PMID: 1990949»PubMed
- Litonjua AA, Sparrow D, Weiss ST ym. Sensitization to cat allergen is associated with asthma in older men and predicts new-onset airway hyperresponsiveness. The Normative Aging Study. Am J Respir Crit Care Med 1997;156:23-7 «PMID: 9230721»PubMed
- Huss K, Naumann PL, Mason PJ ym. Asthma severity, atopic status, allergen exposure and quality of life in elderly persons. Ann Allergy Asthma Immunol 2001;86:524-30 «PMID: 11379803»PubMed
- Sin DD, Tu JV. Inhaled corticosteroid therapy reduces the risk of rehospitalization and all-cause mortality in elderly asthmatics. Eur Respir J 2001;17:380-5 «PMID: 11405515»PubMed
- Goeman DP, Douglass JA. Optimal management of asthma in elderly patients: strategies to improve adherence to recommended interventions. Drugs Aging 2007;24:381-94 «PMID: 17503895»PubMed
- Harju T, Keistinen T, Tuuponen T ym. Hospital admissions of asthmatics by age and sex. Allergy 1996;51:693-6 «PMID: 8904996»PubMed
- Tsai CL, Lee WY, Hanania NA ym. Age-related differences in clinical outcomes for acute asthma in the United States, 2006-2008. J Allergy Clin Immunol 2012;129:1252-1258.e1 «PMID: 22385630»PubMed
- Busse PJ, Birmingham JM, Calatroni A ym. Effect of aging on sputum inflammation and asthma control. J Allergy Clin Immunol 2017;139:1808-1818.e6 «PMID: 27725186»PubMed
- Dunn RM, Lehman E, Chinchilli VM ym. Impact of Age and Sex on Response to Asthma Therapy. Am J Respir Crit Care Med 2015;192:551-8 «PMID: 26068329»PubMed
- Tilastokeskus. www.stat.fi. Viitattu 1.2.2020
- Skloot GS, Busse PJ, Braman SS ym. An Official American Thoracic Society Workshop Report: Evaluation and Management of Asthma in the Elderly. Ann Am Thorac Soc 2016;13:2064-2077 «PMID: 27831798»PubMed
- Dunn RM, Busse PJ, Wechsler ME. Asthma in the elderly and late-onset adult asthma. Allergy 2018;73:284-294 «PMID: 28722758»PubMed
- Shirai T, Matsui T, Suzuki K ym. Effect of pet removal on pet allergic asthma. Chest 2005;127:1565-71 «PMID: 15888829»PubMed
- Leas BF, D’Anci KE, Apter AJ, Bryant-Stephens T, Schoelles K, Umscheid CA. Effectiveness of Indoor Allergen Reduction in Management of Asthma. Rockville (MD): Agency for Healthcare Research and Quality (US); February 2018
- Sauni R, Verbeek JH, Uitti J ym. Remediating buildings damaged by dampness and mould for preventing or reducing respiratory tract symptoms, infections and asthma. Cochrane Database Syst Rev 2015;:CD007897 «PMID: 25715323»PubMed
- Agache I, Laculiceanu A, Cojanu C ym. Advances in allergen immunotherapy for asthma. Curr Opin Allergy Clin Immunol 2020;20:602-608 «PMID: 32769712»PubMed
- Siedätyshoito. Käypä hoito -suositus. Suomalaisen Lääkäriseuran Duodecimin, Suomen Allergologi- ja Immunologiyhdistys ry:n ja Suomen Lastenlääkäreiden Allergologiayhdistys ry:n asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim, 2019 (viitattu 13.10.2021). Saatavilla internetissä: www.kaypahoito.fi
- Shin SW, Bae DJ, Park CS ym. Effects of air pollution on moderate and severe asthma exacerbations. J Asthma 2020;57:875-885 «PMID: 31122089»PubMed
- Liu Y, Pan J, Zhang H ym. Short-Term Exposure to Ambient Air Pollution and Asthma Mortality. Am J Respir Crit Care Med 2019;200:24-32 «PMID: 30871339»PubMed
- Ward DJ, Ayres JG. Particulate air pollution and panel studies in children: a systematic review. Occup Environ Med 2004;61:e13 «PMID: 15031404»PubMed
- Cai Y, Zijlema WL, Doiron D ym. Ambient air pollution, traffic noise and adult asthma prevalence: a BioSHaRE approach. Eur Respir J 2017;49: «PMID: 27824608»PubMed
- Henneberger PK, Patel JR, de Groene GJ ym. Workplace interventions for treatment of occupational asthma. Cochrane Database Syst Rev 2019;10:CD006308 «PMID: 31593318»PubMed
- Chaudhuri R, Livingston E, McMahon AD ym. Effects of smoking cessation on lung function and airway inflammation in smokers with asthma. Am J Respir Crit Care Med 2006;174:127-33 «PMID: 16645173»PubMed
- Rayens MK, Burkhart PV, Zhang M ym. Reduction in asthma-related emergency department visits after implementation of a smoke-free law. J Allergy Clin Immunol 2008;122:537-41.e3 «PMID: 18692884»PubMed
- Hansen ESH, Pitzner-Fabricius A, Toennesen LL ym. Effect of aerobic exercise training on asthma in adults: a systematic review and meta-analysis. Eur Respir J 2020;56: «PMID: 32350100»PubMed
- Karjalainen A, Kurppa K, Martikainen R ym. Work is related to a substantial portion of adult-onset asthma incidence in the Finnish population. Am J Respir Crit Care Med 2001;164:565-8 «PMID: 11520716»PubMed
- Scott HA, Gibson PG, Garg ML ym. Dietary restriction and exercise improve airway inflammation and clinical outcomes in overweight and obese asthma: a randomized trial. Clin Exp Allergy 2013;43:36-49 «PMID: 23278879»PubMed
- Santino TA, Chaves GS, Freitas DA ym. Breathing exercises for adults with asthma. Cochrane Database Syst Rev 2020;3:CD001277 «PMID: 32212422»PubMed
- Cates CJ, Cates MJ, Lasserson TJ. Regular treatment with formoterol for chronic asthma: serious adverse events. Cochrane Database Syst Rev 2008;:CD006923 «PMID: 18843738»PubMed
- Cates CJ, Cates MJ. Regular treatment with salmeterol for chronic asthma: serious adverse events. Cochrane Database Syst Rev 2008;:CD006363 «PMID: 18646149»PubMed
- Stempel DA, Raphiou IH, Kral KM ym. Serious Asthma Events with Fluticasone plus Salmeterol versus Fluticasone Alone. N Engl J Med 2016;374:1822-30 «PMID: 26949137»PubMed
- Beasley R, Harper J, Bird G ym. Inhaled Corticosteroid Therapy in Adult Asthma. Time for a New Therapeutic Dose Terminology. Am J Respir Crit Care Med 2019;199:1471-1477 «PMID: 30645143»PubMed
- Powell H, Gibson PG. High dose versus low dose inhaled corticosteroid as initial starting dose for asthma in adults and children. Cochrane Database Syst Rev 2004;:CD004109 «PMID: 15106238»PubMed
- Expert Panel Working Group of the National Heart, Lung, and Blood Institute (NHLBI) administered and coordinated National Asthma Education and Prevention Program Coordinating Committee (NAEPPCC)., Cloutier MM, Baptist AP ym. 2020 Focused Updates to the Asthma Management Guidelines: A Report from the National Asthma Education and Prevention Program Coordinating Committee Expert Panel Working Group. J Allergy Clin Immunol 2020;146:1217-1270 «PMID: 33280709»PubMed
- Ducharme FM, Hicks GC. Anti-leukotriene agents compared to inhaled corticosteroids in the management of recurrent and/or chronic asthma in adults and children. Cochrane Database Syst Rev 2002;:CD002314 «PMID: 12137655»PubMed
- O'Byrne PM, FitzGerald JM, Bateman ED ym. Inhaled Combined Budesonide-Formoterol as Needed in Mild Asthma. N Engl J Med 2018;378:1865-1876 «PMID: 29768149»PubMed
- Bateman ED, Reddel HK, O'Byrne PM ym. As-Needed Budesonide-Formoterol versus Maintenance Budesonide in Mild Asthma. N Engl J Med 2018;378:1877-1887 «PMID: 29768147»PubMed
- Ni Chroinin M, Greenstone I, Lasserson TJ ym. Addition of inhaled long-acting beta2-agonists to inhaled steroids as first line therapy for persistent asthma in steroid-naive adults and children. Cochrane Database Syst Rev 2009;:CD005307 «PMID: 19821344»PubMed
- Polosa R, Thomson NC. Smoking and asthma: dangerous liaisons. Eur Respir J 2013;41:716-26 «PMID: 22903959»PubMed
- Pradeepan S, Garrison G, Dixon AE. Obesity in asthma: approaches to treatment. Curr Allergy Asthma Rep 2013;13:434-42 «PMID: 23619597»PubMed
- Ducharme FM, Ni Chroinin M, Greenstone I ym. Addition of long-acting beta2-agonists to inhaled steroids versus higher dose inhaled steroids in adults and children with persistent asthma. Cochrane Database Syst Rev 2010;:CD005533 «PMID: 20393943»PubMed
- Kew KM, Karner C, Mindus SM ym. Combination formoterol and budesonide as maintenance and reliever therapy versus combination inhaler maintenance for chronic asthma in adults and children. Cochrane Database Syst Rev 2013;:CD009019 «PMID: 24343671»PubMed
- Rogliani P, Ritondo BL, Ora J ym. SMART and as-needed therapies in mild-to-severe asthma: a network meta-analysis. Eur Respir J 2020;56: «PMID: 32430423»PubMed
- Anderson DE, Kew KM, Boyter AC. Long-acting muscarinic antagonists (LAMA) added to inhaled corticosteroids (ICS) versus the same dose of ICS alone for adults with asthma. Cochrane Database Syst Rev 2015;:CD011397 «PMID: 26301488»PubMed
- Evans DJ, Kew KM, Anderson DE ym. Long-acting muscarinic antagonists (LAMA) added to inhaled corticosteroids (ICS) versus higher dose ICS for adults with asthma. Cochrane Database Syst Rev 2015;:CD011437 «PMID: 26196545»PubMed
- Kew KM, Evans DJ, Allison DE ym. Long-acting muscarinic antagonists (LAMA) added to inhaled corticosteroids (ICS) versus addition of long-acting beta2-agonists (LABA) for adults with asthma. Cochrane Database Syst Rev 2015;:CD011438 «PMID: 26031392»PubMed
- Kew KM, Dahri K. Long-acting muscarinic antagonists (LAMA) added to combination long-acting beta2-agonists and inhaled corticosteroids (LABA/ICS) versus LABA/ICS for adults with asthma. Cochrane Database Syst Rev 2016;:CD011721 «PMID: 26798035»PubMed
- Virchow JC, Kuna P, Paggiaro P ym. Single inhaler extrafine triple therapy in uncontrolled asthma (TRIMARAN and TRIGGER): two double-blind, parallel-group, randomised, controlled phase 3 trials. Lancet 2019;394:1737-1749 «PMID: 31582314»PubMed
- Kerstjens HAM, Maspero J, Chapman KR ym. Once-daily, single-inhaler mometasone-indacaterol-glycopyrronium versus mometasone-indacaterol or twice-daily fluticasone-salmeterol in patients with inadequately controlled asthma (IRIDIUM): a randomised, double-blind, controlled phase 3 study. Lancet Respir Med 2020;8:1000-1012 «PMID: 32653074»PubMed
- Singh D, Virchow JC, Canonica GW ym. Extrafine triple therapy in patients with asthma and persistent airflow limitation. Eur Respir J 2020;56: «PMID: 32430414»PubMed
- Singh D, Virchow JC, Canonica GW ym. Determinants of response to inhaled extrafine triple therapy in asthma: analyses of TRIMARAN and TRIGGER. Respir Res 2020;21:285 «PMID: 33121501»PubMed
- Ducharme FM, Lasserson TJ, Cates CJ. Addition to inhaled corticosteroids of long-acting beta2-agonists versus anti-leukotrienes for chronic asthma. Cochrane Database Syst Rev 2011;:CD003137 «PMID: 21563136»PubMed
- Kankaanranta H, Lahdensuo A, Moilanen E ym. Add-on therapy options in asthma not adequately controlled by inhaled corticosteroids: a comprehensive review. Respir Res 2004;5:17 «PMID: 15509300»PubMed
- Adams N, Bestall J, Jones PW. Budesonide at different doses for chronic asthma. Cochrane Database Syst Rev 2001;:CD003271 «PMID: 11687182»PubMed
- Adams N, Bestall J, Jones P. Beclomethasone at different doses for chronic asthma (review). Cochrane Database Syst Rev 2001;:CD002879 «PMID: 11279769»PubMed
- Adams NP, Bestall JC, Jones P ym. Fluticasone at different doses for chronic asthma in adults and children. Cochrane Database Syst Rev 2008;:CD003534 «PMID: 18843646»PubMed
- Bousquet J, Ben-Joseph R, Messonnier M ym. A meta-analysis of the dose-response relationship of inhaled corticosteroids in adolescents and adults with mild to moderate persistent asthma. Clin Ther 2002;24:1-20 «PMID: 11833824»PubMed
- Lipworth BJ. Systemic adverse effects of inhaled corticosteroid therapy: A systematic review and meta-analysis. Arch Intern Med 1999;159:941-55 «PMID: 10326936»PubMed
- Powell H, Gibson PG. Inhaled corticosteroid doses in asthma: an evidence-based approach. Med J Aust 2003;178:223-5 «PMID: 12603186»PubMed
- Agache I, Beltran J, Akdis C ym. Efficacy and safety of treatment with biologicals (benralizumab, dupilumab, mepolizumab, omalizumab and reslizumab) for severe eosinophilic asthma. A systematic review for the EAACI Guidelines - recommendations on the use of biologicals in severe asthma. Allergy 2020;75:1023-1042 «PMID: 32034960»PubMed
- Hiles SA, McDonald VM, Guilhermino M ym. Does maintenance azithromycin reduce asthma exacerbations? An individual participant data meta-analysis. Eur Respir J 2019;54: «PMID: 31515407»PubMed
- Gibson PG, Yang IA, Upham JW ym. Effect of azithromycin on asthma exacerbations and quality of life in adults with persistent uncontrolled asthma (AMAZES): a randomised, double-blind, placebo-controlled trial. Lancet 2017;390:659-668 «PMID: 28687413»PubMed
- Taylor SL, Ivey KL, Gibson PG ym. Airway abundance of Haemophilus influenzae predicts response to azithromycin in adults with persistent uncontrolled asthma. Eur Respir J 2020;56: «PMID: 32366495»PubMed
- Torrego A, Solà I, Munoz AM ym. Bronchial thermoplasty for moderate or severe persistent asthma in adults. Cochrane Database Syst Rev 2014;:CD009910 «PMID: 24585221»PubMed
- Rogers L, Sugar EA, Blake K ym. Step-Down Therapy for Asthma Well Controlled on Inhaled Corticosteroid and Long-Acting Beta-Agonist: A Randomized Clinical Trial. J Allergy Clin Immunol Pract 2018;6:633-643.e1 «PMID: 28974349»PubMed
- Turpeinen M, Pelkonen AS, Selroos O ym. Continuous versus intermittent inhaled corticosteroid (budesonide) for mild persistent asthma in children--not too much, not too little. Thorax 2012;67:100-2 «PMID: 22038795»PubMed
- Chong J, Haran C, Chauhan BF ym. Intermittent inhaled corticosteroid therapy versus placebo for persistent asthma in children and adults. Cochrane Database Syst Rev 2015;:CD011032 «PMID: 26197430»PubMed
- Rogers L, Reibman J. Stepping down asthma treatment: how and when. Curr Opin Pulm Med 2012;18:70-5 «PMID: 22081088»PubMed
- Tuomisto LE, Ilmarinen P, Niemelä O ym. A 12-year prognosis of adult-onset asthma: Seinäjoki Adult Asthma Study. Respir Med 2016;117:223-9 «PMID: 27492535»PubMed
- Honkamäki J, Piirilä P, Hisinger-Mölkänen H ym. Asthma Remission by Age at Diagnosis and Gender in a Population-Based Study. J Allergy Clin Immunol Pract 2021;9:1950-1959.e4 «PMID: 33338683»PubMed
- Tuomisto LE, Ilmarinen P, Kankaanranta H. Prognosis of new-onset asthma diagnosed at adult age. Respir Med 2015;109:944-54 «PMID: 26052036»PubMed
- Woodcock A, Beeh KM, Sagara H ym. The environmental impact of inhaled therapy: making informed treatment choices. Eur Respir J 2021;: «PMID: 34916263»PubMed
- Malmberg LP, Pelkonen AS, Vartiainen V ym. Patients with asthma or chronic obstructive pulmonary disease (COPD) can generate sufficient inspiratory flows via Easyhaler® dry powder inhaler: a pooled analysis of two randomized controlled trials. J Thorac Dis 2021;13:621-631 «PMID: 33717535»PubMed
- Haughney J, Lee AJ, McKnight E ym. Peak Inspiratory Flow Measured at Different Inhaler Resistances in Patients with Asthma. J Allergy Clin Immunol Pract 2021;9:890-896 «PMID: 33011302»PubMed
- Crompton GK, Barnes PJ, Broeders M ym. The need to improve inhalation technique in Europe: a report from the Aerosol Drug Management Improvement Team. Respir Med 2006;100:1479-94 «PMID: 16495040»PubMed
- Sanchis J, Gich I, Pedersen S ym. Systematic Review of Errors in Inhaler Use: Has Patient Technique Improved Over Time? Chest 2016;150:394-406 «PMID: 27060726»PubMed
- Laube BL, Janssens HM, de Jongh FH ym. What the pulmonary specialist should know about the new inhalation therapies. Eur Respir J 2011;37:1308-31 «PMID: 21310878»PubMed
- Singh D, Collarini S, Poli G ym. Effect of AeroChamber Plus™ on the lung and systemic bioavailability of beclometasone dipropionate/formoterol pMDI. Br J Clin Pharmacol 2011;72:932-9 «PMID: 21615456»PubMed
- Engelstätter R, Szlávik M, Gerber C ym. Once-daily ciclesonide via metered-dose inhaler: Similar efficacy and safety with or without a spacer. Respir Med 2009;103:1643-50 «PMID: 19596188»PubMed
- Drollmann A, Nave R, Steinijans VW ym. Equivalent pharmacokinetics of the active metabolite of ciclesonide with and without use of the AeroChamber Plus spacer for inhalation. Clin Pharmacokinet 2006;45:729-36 «PMID: 16802853»PubMed
- National Heart Lung and Blood Institute. Expert Panel Report 3 (EPR3) 2007: Guidelines for the Diagnosis and Management of Asthma. http://www.nhlbi.nih.gov/health-pro/guidelines/current/asthma-guidelines
- Alavaikko S, Jaakkola MS, Tjäderhane L ym. Asthma and caries: a systematic review and meta-analysis. Am J Epidemiol 2011;174:631-41 «PMID: 21828369»PubMed
- British Guideline on the Management of Asthma 2011. British guideline for asthma.pdf (http://globalasthmanetwork.org/management/guides/bosnia_and_herzegovina/British%20guideline%20for%20asthma.pdf)
- Dolan LM, Kesarwala HH, Holroyde JC ym. Short-term, high-dose, systemic steroids in children with asthma: the effect on the hypothalamic-pituitary-adrenal axis. J Allergy Clin Immunol 1987;80:81-7 «PMID: 3598031»PubMed
- van Staa TP, Cooper C, Leufkens HG ym. Children and the risk of fractures caused by oral corticosteroids. J Bone Miner Res 2003;18:913-8 «PMID: 12733732»PubMed
- Ducharme FM, Chabot G, Polychronakos C ym. Safety profile of frequent short courses of oral glucocorticoids in acute pediatric asthma: impact on bone metabolism, bone density, and adrenal function. Pediatrics 2003;111:376-83 «PMID: 12563067»PubMed
- Price DB, Trudo F, Voorham J ym. Adverse outcomes from initiation of systemic corticosteroids for asthma: long-term observational study. J Asthma Allergy 2018;11:193-204 «PMID: 30214247»PubMed
- Sullivan PW, Ghushchyan VH, Skoner DP ym. Complications and Health Care Resource Utilization Associated with Systemic Corticosteroids in Children and Adolescents with Persistent Asthma. J Allergy Clin Immunol Pract 2021;9:1541-1551.e9 «PMID: 33290914»PubMed
- Leung JS, Johnson DW, Sperou AJ ym. A systematic review of adverse drug events associated with administration of common asthma medications in children. PLoS One 2017;12:e0182738 «PMID: 28793336»PubMed
- Salpeter SR, Wall AJ, Buckley NS. Long-acting beta-agonists with and without inhaled corticosteroids and catastrophic asthma events. Am J Med 2010;123:322-8.e2 «PMID: 20176343»PubMed
- Cates CJ, Lasserson TJ. Regular treatment with formoterol versus regular treatment with salmeterol for chronic asthma: serious adverse events. Cochrane Database Syst Rev 2012;:CD007695 «PMID: 22419326»PubMed
- Stempel DA, Szefler SJ, Pedersen S ym. Safety of Adding Salmeterol to Fluticasone Propionate in Children with Asthma. N Engl J Med 2016;375:840-9 «PMID: 27579634»PubMed
- Busse WW, Bateman ED, Caplan AL ym. Combined Analysis of Asthma Safety Trials of Long-Acting ß2-Agonists. N Engl J Med 2018;378:2497-2505 «PMID: 29949492»PubMed
- Cereza G, Garcia Doladé N, Laporte JR. Nightmares induced by montelukast in children and adults. Eur Respir J 2012;40:1574-5 «PMID: 23204025»PubMed
- Schumock GT, Lee TA, Joo MJ ym. Association between leukotriene-modifying agents and suicide: what is the evidence? Drug Saf 2011;34:533-44 «PMID: 21663330»PubMed
- Sansing-Foster V, Haug N, Mosholder A ym. Risk of Psychiatric Adverse Events Among Montelukast Users. J Allergy Clin Immunol Pract 2021;9:385-393.e12 «PMID: 32795564»PubMed
- Scadding GW, Scadding GK. Recent advances in antileukotriene therapy. Curr Opin Allergy Clin Immunol 2010;10:370-6 «PMID: 20585242»PubMed
- Dusser D, Ducharme FM. Safety of tiotropium in patients with asthma. Ther Adv Respir Dis 2019;13:1753466618824010 «PMID: 30795731»PubMed
- Farne HA, Wilson A, Powell C ym. Anti-IL5 therapies for asthma. Cochrane Database Syst Rev 2017;9:CD010834 «PMID: 28933516»PubMed
- Oborne J, Mortimer K, Hubbard RB ym. Quadrupling the dose of inhaled corticosteroid to prevent asthma exacerbations: a randomized, double-blind, placebo-controlled, parallel-group clinical trial. Am J Respir Crit Care Med 2009;180:598-602 «PMID: 19590019»PubMed
- McKeever T, Mortimer K, Wilson A ym. Quadrupling Inhaled Glucocorticoid Dose to Abort Asthma Exacerbations. N Engl J Med 2018;378:902-910 «PMID: 29504499»PubMed
- Gaillard EA, Kuehni CE, Turner S ym. European Respiratory Society clinical practice guidelines for the diagnosis of asthma in children aged 5-16 years. Eur Respir J 2021;58: «PMID: 33863747»PubMed
- Alahengitystieinfektiot (lapset). Käypä hoito -suositus. Suomalaisen Lääkäriseuran Duodecimin, Suomen Lastenlääkäriyhdistyksen ja Suomen Yleislääketieteen Yhdistys ry:n asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim, 2015 (viitattu 21.2.2022). Saatavilla internetissä: www.kaypahoito.fi
- Elenius V, Dunder T, Ruotsalainen M, Schultz R, Mäkelä M, Jartti T. Flunssaisen vauvan uloshengitys vinkuu – mistä taudista on kyse? Suom lääkäril 2020;47:2525-29
- King GG, Bates J, Berger KI ym. Technical standards for respiratory oscillometry. Eur Respir J 2020;55: «PMID: 31772002»PubMed
- Beydon N, Davis SD, Lombardi E ym. An official American Thoracic Society/European Respiratory Society statement: pulmonary function testing in preschool children. Am J Respir Crit Care Med 2007;175:1304-45 «PMID: 17545458»PubMed
- Malmberg LP, Pelkonen AS, Haahtela T ym. Exhaled nitric oxide rather than lung function distinguishes preschool children with probable asthma. Thorax 2003;58:494-9 «PMID: 12775859»PubMed
- Yao TC, Ou LS, Lee WI ym. Exhaled nitric oxide discriminates children with and without allergic sensitization in a population-based study. Clin Exp Allergy 2011;41:556-64 «PMID: 21338427»PubMed
- Malmberg LP, Pelkonen AS, Mattila PS ym. Exhaled nitric oxide and exercise-induced bronchoconstriction in young wheezy children - interactions with atopy. Pediatr Allergy Immunol 2009;20:673-8 «PMID: 19496956»PubMed
- Guilbert TW, Morgan WJ, Zeiger RS ym. Long-term inhaled corticosteroids in preschool children at high risk for asthma. N Engl J Med 2006;354:1985-97 «PMID: 16687711»PubMed
- Makrinioti H, Custovic A, Hasegawa K ym. The role of interferons in preschool wheeze. Lancet Respir Med 2021;9:9-11 «PMID: 33412119»PubMed
- Tager IB, Hanrahan JP, Tosteson TD ym. Lung function, pre- and post-natal smoke exposure, and wheezing in the first year of life. Am Rev Respir Dis 1993;147:811-7 «PMID: 8466114»PubMed
- Elliot J, Vullermin P, Robinson P. Maternal cigarette smoking is associated with increased inner airway wall thickness in children who die from sudden infant death syndrome. Am J Respir Crit Care Med 1998;158:802-6 «PMID: 9731008»PubMed
- Bossley CJ, Fleming L, Gupta A ym. Pediatric severe asthma is characterized by eosinophilia and remodeling without T(H)2 cytokines. J Allergy Clin Immunol 2012;129:974-82.e13 «PMID: 22385633»PubMed
- de Blic J, Tillie-Leblond I, Emond S ym. High-resolution computed tomography scan and airway remodeling in children with severe asthma. J Allergy Clin Immunol 2005;116:750-4 «PMID: 16210046»PubMed
- O'Reilly R, Ullmann N, Irving S ym. Increased airway smooth muscle in preschool wheezers who have asthma at school age. J Allergy Clin Immunol 2013;131:1024-32, 1032.e1-16 «PMID: 23069488»PubMed
- Jartti T, Gern JE. Role of viral infections in the development and exacerbation of asthma in children. J Allergy Clin Immunol 2017;140:895-906 «PMID: 28987219»PubMed
- Fitzpatrick AM, Bacharier LB, Guilbert TW ym. Phenotypes of Recurrent Wheezing in Preschool Children: Identification by Latent Class Analysis and Utility in Prediction of Future Exacerbation. J Allergy Clin Immunol Pract 2019;7:915-924.e7 «PMID: 30267890»PubMed
- Castro-Rodríguez JA, Holberg CJ, Wright AL ym. A clinical index to define risk of asthma in young children with recurrent wheezing. Am J Respir Crit Care Med 2000;162:1403-6 «PMID: 11029352»PubMed
- Martinez FD. Heterogeneity of the association between lower respiratory illness in infancy and subsequent asthma. Proc Am Thorac Soc 2005;2:157-61 «PMID: 16113485»PubMed
- Salpeter SR, Ormiston TM, Salpeter EE. Meta-analysis: respiratory tolerance to regular beta2-agonist use in patients with asthma. Ann Intern Med 2004;140:802-13 «PMID: 15148067»PubMed
- Simons FE. A comparison of beclomethasone, salmeterol, and placebo in children with asthma. Canadian Beclomethasone Dipropionate-Salmeterol Xinafoate Study Group. N Engl J Med 1997;337:1659-65 «PMID: 9385125»PubMed
- Smith AD, Taylor DR. Is exhaled nitric oxide measurement a useful clinical test in asthma? Curr Opin Allergy Clin Immunol 2005;5:49-56 «PMID: 15643344»PubMed
- Smith AD, Cowan JO, Filsell S ym. Diagnosing asthma: comparisons between exhaled nitric oxide measurements and conventional tests. Am J Respir Crit Care Med 2004;169:473-8 «PMID: 14644933»PubMed
- Sorkness CA, Lemanske RF Jr, Mauger DT ym. Long-term comparison of 3 controller regimens for mild-moderate persistent childhood asthma: the Pediatric Asthma Controller Trial. J Allergy Clin Immunol 2007;119:64-72 «PMID: 17140647»PubMed
- Szefler SJ, Phillips BR, Martinez FD ym. Characterization of within-subject responses to fluticasone and montelukast in childhood asthma. J Allergy Clin Immunol 2005;115:233-42 «PMID: 15696076»PubMed
- National Heart Lung and Blood Institute. Expert Panel Report 3 (EPR3): Guidelines for the Diagnosis and Management of Asthma. http://www.nhlbi.nih.gov/health-pro/guidelines/current/asthma-guidelines
- Lemanske RF Jr, Mauger DT, Sorkness CA ym. Step-up therapy for children with uncontrolled asthma receiving inhaled corticosteroids. N Engl J Med 2010;362:975-85 «PMID: 20197425»PubMed
- Chauhan BF, Chartrand C, Ni Chroinin M ym. Addition of long-acting beta2-agonists to inhaled corticosteroids for chronic asthma in children. Cochrane Database Syst Rev 2015;:CD007949 «PMID: 26594816»PubMed
- Bisgaard H, Le Roux P, Bjåmer D ym. Budesonide/formoterol maintenance plus reliever therapy: a new strategy in pediatric asthma. Chest 2006;130:1733-43 «PMID: 17166990»PubMed
- O'Byrne PM, Bisgaard H, Godard PP ym. Budesonide/formoterol combination therapy as both maintenance and reliever medication in asthma. Am J Respir Crit Care Med 2005;171:129-36 «PMID: 15502112»PubMed
- Krishnamoorthy M, Mohd Noor N, Mat Lazim N ym. Efficacy of Montelukast in Allergic Rhinitis Treatment: A Systematic Review and Meta-Analysis. Drugs 2020;80:1831-1851 «PMID: 32915441»PubMed
- Chauhan BF, Jeyaraman MM, Singh Mann A ym. Addition of anti-leukotriene agents to inhaled corticosteroids for adults and adolescents with persistent asthma. Cochrane Database Syst Rev 2017;3:CD010347 «PMID: 28301050»PubMed
- Szefler SJ, Murphy K, Harper T 3rd ym. A phase III randomized controlled trial of tiotropium add-on therapy in children with severe symptomatic asthma. J Allergy Clin Immunol 2017;140:1277-1287 «PMID: 28189771»PubMed
- Vogelberg C, Moroni-Zentgraf P, Leonaviciute-Klimantaviciene M ym. A randomised dose-ranging study of tiotropium Respimat® in children with symptomatic asthma despite inhaled corticosteroids. Respir Res 2015;16:20 «PMID: 25851298»PubMed
- Vogelberg C, Engel M, Laki I ym. Tiotropium add-on therapy improves lung function in children with symptomatic moderate asthma. J Allergy Clin Immunol Pract 2018;6:2160-2162.e9 «PMID: 29751157»PubMed
- Szefler SJ, Vogelberg C, Bernstein JA ym. Tiotropium Is Efficacious in 6- to 17-Year-Olds with Asthma, Independent of T2 Phenotype. J Allergy Clin Immunol Pract 2019;7:2286-2295.e4 «PMID: 30922990»PubMed
- Morris TS, Autry EB, Kuhn RJ. The Role of Biologics in the Management of Asthma in the Pediatric Patient. J Pediatr Pharmacol Ther 2021;26:427-436 «PMID: 34239393»PubMed
- Scotney E, Burchett S, Goddard T ym. Pediatric problematic severe asthma: Recent advances in management. Pediatr Allergy Immunol 2021;32:1405-1415 «PMID: 34002877»PubMed
- Bacharier LB, Maspero JF, Katelaris CH ym. Dupilumab in Children with Uncontrolled Moderate-to-Severe Asthma. N Engl J Med 2021;385:2230-2240 «PMID: 34879449»PubMed
- National Heart, Lung, and Blood Institute. National Asthma Education and Prevention Program. Expert Panel Report 3: Guidelines for the Diagnosis and Management of Asthma. Full Report 2007. https://www.nhlbi.nih.gov/sites/default/files/media/docs/EPR-3_Asthma_Full_Report_2007.pdf
- Jartti T, Vanto T. Astmapotilaan on tärkeää tietää oma paras PEF-arvonsa. Suom Lääkär 2010;15:1331-3
- McCormack MC, Aloe C, Curtin-Brosnan J ym. Guideline-recommended fractional exhaled nitric oxide is a poor predictor of health-care use among inner-city children and adolescents receiving usual asthma care. Chest 2013;144:923-929 «PMID: 23764806»PubMed
- Fielding S, Pijnenburg M, de Jongste JC ym. Change in FEV1 and Feno Measurements as Predictors of Future Asthma Outcomes in Children. Chest 2019;155:331-341 «PMID: 30359613»PubMed
- Wang X, Tan X, Li Q. Effectiveness of fractional exhaled nitric oxide for asthma management in children: A systematic review and meta-analysis. Pediatr Pulmonol 2020;55:1936-1945 «PMID: 32525611»PubMed
- Yhtenäiset kiireettömän hoidon perusteet 2019. Sosiaali- ja terveysministeriön julkaisuja 2019:2. http://urn.fi/URN:ISBN:978-952-00-3520-4
- NAEPP 2004: Management of asthma during pregnancy. http://www.nhlbi.nih.gov/health/prof/lung/asthma/astpreg/astpreg_full.pdf
- Bonham CA, Patterson KC, Strek ME. Asthma Outcomes and Management During Pregnancy. Chest 2018;153:515-527 «PMID: 28867295»PubMed
- Pfaller B, José Yepes-Nuñez J, Agache I ym. Biologicals in atopic disease in pregnancy: An EAACI position paper. Allergy 2021;76:71-89 «PMID: 32189356»PubMed
- British Thoracic Society, Scottish Intercollegiate Guidelines Network. British guideline on the management of asthma. BTS/SIGN, 2019. https://www.guidelines.co.uk/respiratory/bts/sign-asthma-in-pregnancy-guideline/455418.article
- Rejnö G, Lundholm C, Larsson K ym. Adverse Pregnancy Outcomes in Asthmatic Women: A Population-Based Family Design Study. J Allergy Clin Immunol Pract 2018;6:916-922.e6 «PMID: 28988783»PubMed
- Kemppainen M, Lahesmaa-Korpinen AM, Kauppi P ym. Maternal asthma is associated with increased risk of perinatal mortality. PLoS One 2018;13:e0197593 «PMID: 29775476»PubMed
- Robijn AL, Brew BK, Jensen ME ym. Effect of maternal asthma exacerbations on perinatal outcomes: a population-based study. ERJ Open Res 2020;6: «PMID: 33447617»PubMed
- Uusitalo A, Lindström I, Karjalainen J, Kauppi P, Koskela H, Suojalehto H. Pelastustyöntekijän astma. Duodecim 2019;135:1795-801
- Pelkonen A, Aalto-Korte K. Astma, allergiat ja ammatinvalinta. Kirjassa: Kaila M ym. (toim). Lasten allergiset sairaudet. Helsinki: Suomen Lastenlääkäriyhdistys, Allergiajaosto 2008;244-5
- Terho E. Allergiaoireiden ottaminen huomioon ammatinvalinnassa ja niiden aiheuttamat työrajoitteet. Kirjassa Haahtela T ym. (toim). Allergia. Duodecim 2007;410-1
- Sotilaslääketieteen keskus, Puolustusvoimat. https://puolustusvoimat.fi/web/logistiikkalaitos/sotilaslaaketieteen-keskus
- Reijula J, Latvala J, Mäkelä M ym. Long-term trends of asthma, allergic rhinitis and atopic eczema in young Finnish men: a retrospective analysis, 1926-2017. Eur Respir J 2020;56: «PMID: 32764114»PubMed
- Lindström I, Koponen P, Luukkonen R ym. Military service-aggravated asthma improves at two-year follow-up. Respir Med 2009;103:1926-35 «PMID: 19541470»PubMed
- Pääesikunta. Terveystarkastusohje 2012;330:7. https://puolustusvoimat.fi/documents/1948673/2015558/Terveystarkastusohje/95c74723-da6f-47f8-b1cf-964fc3affb73/Terveystarkastusohje.pdf
- Akinbami LJ, Fryar CD. Current Asthma Prevalence by Weight Status Among Adults: United States, 2001-2014. NCHS Data Brief 2016;:1-8
- Anderson SD, Brannan J, Spring J ym. A new method for bronchial-provocation testing in asthmatic subjects using a dry powder of mannitol. Am J Respir Crit Care Med 1997;156:758-65 «PMID: 9309990»PubMed
- Annesi-Maesano I, Oryszczyn MP, Raherison C ym. Increased prevalence of asthma and allied diseases among active adolescent tobacco smokers after controlling for passive smoking exposure. A cause for concern? Clin Exp Allergy 2004;34:1017-23 «PMID: 15248844»PubMed
- Arif AA, Rohrer JE, Delclos GL. A population-based study of asthma, quality of life, and occupation among elderly Hispanic and non-Hispanic whites: a cross-sectional investigation. BMC Public Health 2005;5:97 «PMID: 16176583»PubMed
- Backer V, Ulrik CS. Bronchial responsiveness to exercise in a random sample of 494 children and adolescents from Copenhagen. Clin Exp Allergy 1992;22:741-7
- Bellia V, Battaglia S, Catalano F ym. Aging and disability affect misdiagnosis of COPD in elderly asthmatics: the SARA study. Chest 2003;123:1066-72 «PMID: 12684295»PubMed
- Beuther DA, Sutherland ER. Overweight, obesity, and incident asthma: a meta-analysis of prospective epidemiologic studies. Am J Respir Crit Care Med 2007;175:661-6 «PMID: 17234901»PubMed
- Bisgaard H, Hermansen MN, Loland L ym. Intermittent inhaled corticosteroids in infants with episodic wheezing. N Engl J Med 2006;354:1998-2005
- Carson KV, Chandratilleke MG, Picot J ym. Physical training for asthma. Cochrane Database Syst Rev 2013;:CD001116 «PMID: 24085631»PubMed
- Castro-Rodriguez JA, Rodrigo GJ. beta-agonists through metered-dose inhaler with valved holding chamber versus nebulizer for acute exacerbation of wheezing or asthma in children under 5 years of age: a systematic review with meta-analysis. J Pediatr 2004;145:172-7 «PMID: 15289762»PubMed
- Cates CJ, Welsh EJ, Rowe BH. Holding chambers (spacers) versus nebulisers for beta-agonist treatment of acute asthma. Cochrane Database Syst Rev 2013;:CD000052 «PMID: 24037768»PubMed
- Childhood Asthma Management Program Research Group., Szefler S, Weiss S ym. Long-term effects of budesonide or nedocromil in children with asthma. N Engl J Med 2000;343:1054-63 «PMID: 11027739»PubMed
- Coogan PF, Castro-Webb N, Yu J ym. Active and passive smoking and the incidence of asthma in the Black Women's Health Study. Am J Respir Crit Care Med 2015;191:168-76 «PMID: 25387276»PubMed
- Covar RA, Spahn JD, Murphy JR ym. Progression of asthma measured by lung function in the childhood asthma management program. Am J Respir Crit Care Med 2004;170:234-41 «PMID: 15028558»PubMed
- Custovic A, Arifhodzic N, Robinson A ym. Exercise testing revisited. The response to exercise in normal and atopic children. Chest 1994;105:1127-32 «PMID: 8162737»PubMed
- de Aguiar KB, Anzolin M, Zhang L. Global prevalence of exercise-induced bronchoconstriction in childhood: A meta-analysis. Pediatr Pulmonol 2018;53:412-425
- Devulapalli CS, Lødrup Carlsen KC, Håland G ym. No evidence that early use of inhaled corticosteroids reduces current asthma at 10 years of age. Respir Med 2007;101:1625-32 «PMID: 17513101»PubMed
- Eichenberger PA, Diener SN, Kofmehl R ym. Effects of exercise training on airway hyperreactivity in asthma: a systematic review and meta-analysis. Sports Med 2013;43:1157-70 «PMID: 23846823»PubMed
- Eliasson AH, Phillips YY, Rajagopal KR ym. Sensitivity and specificity of bronchial provocation testing. An evaluation of four techniques in exercise-induced bronchospasm. Chest 1992;102:347-55 «PMID: 1643912»PubMed
- Francisco CO, Bhatawadekar SA, Babineau J ym. Effects of physical exercise training on nocturnal symptoms in asthma: Systematic review. PLoS One 2018;13:e0204953 «PMID: 30346958»PubMed
- Genuneit J, Weinmayr G, Radon K ym. Smoking and the incidence of asthma during adolescence: results of a large cohort study in Germany. Thorax 2006;61:572-8
- Gilliland FD, Li YF, Peters JM. Effects of maternal smoking during pregnancy and environmental tobacco smoke on asthma and wheezing in children. Am J Respir Crit Care Med 2001;163:429-36 «PMID: 11179118»PubMed
- Godfrey S, Springer C, Bar-Yishay E ym. Cut-off points defining normal and asthmatic bronchial reactivity to exercise and inhalation challenges in children and young adults. Eur Respir J 1999;14:659-68 «PMID: 10543290»PubMed
- Godfrey S, Springer C, Noviski N ym. Exercise but not methacholine differentiates asthma from chronic lung disease in children. Thorax 1991;46:488-92 «PMID: 1877036»PubMed
- Haby MM, Anderson SD, Peat JK ym. An exercise challenge protocol for epidemiological studies of asthma in children: comparison with histamine challenge. Eur Respir J 1994;7:43-9 «PMID: 8143831»PubMed
- Haby MM, Peat JK, Mellis CM ym. An exercise challenge for epidemiological studies of childhood asthma: validity and repeatability. Eur Respir J 1995;8:729-36 «PMID: 7656943»PubMed
- He Z, Wu H, Zhang S ym. The association between secondhand smoke and childhood asthma: A systematic review and meta-analysis. Pediatr Pulmonol 2020;55:2518-2531 «PMID: 32667747»PubMed
- Hellinckx J, De Boeck K, Bande-Knops J ym. Bronchodilator response in 3-6.5 years old healthy and stable asthmatic children. Eur Respir J 1998;12:438-43 «PMID: 9727798»PubMed
- Hofhuis W, van der Wiel EC, Nieuwhof EM ym. Efficacy of fluticasone propionate on lung function and symptoms in wheezy infants. Am J Respir Crit Care Med 2005;171:328-33 «PMID: 15531753»PubMed
- Holst GJ, Pedersen CB, Thygesen M ym. Air pollution and family related determinants of asthma onset and persistent wheezing in children: nationwide case-control study. BMJ 2020;370:m2791 «PMID: 32816747»PubMed
- Huovinen E, Kaprio J, Koskenvuo M. Factors associated to lifestyle and risk of adult onset asthma. Respir Med 2003;97:273-80 «PMID: 12645835»PubMed
- Hurwitz KM, Argyros GJ, Roach JM ym. Interpretation of eucapnic voluntary hyperventilation in the diagnosis of asthma. Chest 1995;108:1240-5 «PMID: 7587423»PubMed
- Jaakkola JJ, Gissler M. Maternal smoking in pregnancy, fetal development, and childhood asthma. Am J Public Health 2004;94:136-40 «PMID: 14713711»PubMed
- Jaakkola JJK, Aalto SAM, Hernberg S ym. Regular exercise improves asthma control in adults: A randomized controlled trial. Sci Rep 2019;9:12088
- Jackson DJ, Bacharier LB, Mauger DT ym. Quintupling Inhaled Glucocorticoids to Prevent Childhood Asthma Exacerbations. N Engl J Med 2018;378:891-901
- Kalliola S, Pelkonen AS, Malmberg LP ym. Maternal smoking affects lung function and airway inflammation in young children with multiple-trigger wheeze. J Allergy Clin Immunol 2013;131:730-5 «PMID: 23380219»PubMed
- Kattan M, Keens TG, Mellis CM ym. The response to exercise in normal and asthmatic children. J Pediatr 1978;92:718-21 «PMID: 641618»PubMed
- Kernen P, Steveling-Klein EH, Saccilotto RT ym. The sensitivity and specificity of the mannitol bronchial challenge test to identify asthma in different populations: a systematic review. Swiss Med Wkly 2019;149:w20100 «PMID: 31476241»PubMed
- Kew KM, Quinn M, Quon BS ym. Increased versus stable doses of inhaled corticosteroids for exacerbations of chronic asthma in adults and children. Cochrane Database Syst Rev 2016;:CD007524 «PMID: 27272563»PubMed
- Kilpeläinen M, Terho EO, Helenius H ym. Body mass index and physical activity in relation to asthma and atopic diseases in young adults. Respir Med 2006;100:1518-25
- Lajunen K, Kalliola S, Kotaniemi-Syrjänen A ym. Environmental Tobacco Smoke Affects Lung Function of Preschoolers with Asthma Even after a Decade. Am J Respir Crit Care Med 2019;199:534-536 «PMID: 30562040»PubMed
- Lannerö E, Wickman M, Pershagen G ym. Maternal smoking during pregnancy increases the risk of recurrent wheezing during the first years of life (BAMSE). Respir Res 2006;7:3
- Larsson L. Incidence of asthma in Swedish teenagers: relation to sex and smoking habits. Thorax 1995;50:260-4 «PMID: 7660339»PubMed
- Larsson ML, Loit HM, Meren M ym. Passive smoking and respiratory symptoms in the FinEsS Study. Eur Respir J 2003;21:672-6 «PMID: 12762355»PubMed
- Lee J, Song JU. Diagnostic comparison of methacholine and mannitol bronchial challenge tests for identifying bronchial hyperresponsiveness in asthma: a systematic review and meta-analysis. J Asthma 2021;58:883-891 «PMID: 32138564»PubMed
- Lundholm C, Gunnerbeck A, D'Onofrio BM ym. Smoking and snuff use in pregnancy and the risk of asthma and wheeze in pre-schoolchildren-A population-based register study. Clin Exp Allergy 2020;50:597-608 «PMID: 32149429»PubMed
- Malmberg LP, Mäkelä MJ, Mattila PS ym. Exercise-induced changes in respiratory impedance in young wheezy children and nonatopic controls. Pediatr Pulmonol 2008;43:538-44 «PMID: 18433041»PubMed
- Malmberg LP, Pelkonen A, Poussa T ym. Determinants of respiratory system input impedance and bronchodilator response in healthy Finnish preschool children. Clin Physiol Funct Imaging 2002;22:64-71 «PMID: 12003103»PubMed
- Marotta A, Klinnert MD, Price MR ym. Impulse oscillometry provides an effective measure of lung dysfunction in 4-year-old children at risk for persistent asthma. J Allergy Clin Immunol 2003;112:317-22 «PMID: 12897737»PubMed
- Martinez FD, Chinchilli VM, Morgan WJ ym. Use of beclomethasone dipropionate as rescue treatment for children with mild persistent asthma (TREXA): a randomised, double-blind, placebo-controlled trial. Lancet 2011;377:650-7 «PMID: 21324520»PubMed
- Murray CS, Woodcock A, Langley SJ ym. Secondary prevention of asthma by the use of Inhaled Fluticasone propionate in Wheezy INfants (IFWIN): double-blind, randomised, controlled study. Lancet 2006;368:754-62 «PMID: 16935686»PubMed
- Nielsen KG, Bisgaard H. Discriminative capacity of bronchodilator response measured with three different lung function techniques in asthmatic and healthy children aged 2 to 5 years. Am J Respir Crit Care Med 2001;164:554-9 «PMID: 11520714»PubMed
- Nielsen KG, Bisgaard H. Lung function response to cold air challenge in asthmatic and healthy children of 2-5 years of age. Am J Respir Crit Care Med 2000;161:1805-9 «PMID: 10852748»PubMed
- Pakhale S, Luks V, Burkett A ym. Effect of physical training on airway inflammation in bronchial asthma: a systematic review. BMC Pulm Med 2013;13:38 «PMID: 23758826»PubMed
- Payares-Salamanca L, Contreras-Arrieta S, Florez-García V ym. Metered-dose inhalers versus nebulization for the delivery of albuterol for acute exacerbations of wheezing or asthma in children: A systematic review with meta-analysis. Pediatr Pulmonol 2020;55:3268-3278 «PMID: 32940961»PubMed
- Peters U, Dixon AE, Forno E. Obesity and asthma. J Allergy Clin Immunol 2018;141:1169-1179 «PMID: 29627041»PubMed
- Price OJ, Ansley L, Levai IK ym. Eucapnic Voluntary Hyperpnea Testing in Asymptomatic Athletes. Am J Respir Crit Care Med 2016;193:1178-80 «PMID: 27174482»PubMed
- Radon K, Büsching K, Heinrich J ym. Passive smoking exposure: a risk factor for chronic bronchitis and asthma in adults? Chest 2002;122:1086-90 «PMID: 12226059»PubMed
- Rodriguez-Martinez CE, Sossa-Briceño MP, Castro-Rodriguez JA. Metered-dose inhalers vs nebulization for the delivery of albuterol in pediatric asthma exacerbations: A cost-effectiveness analysis in a middle-income country. Pediatr Pulmonol 2020;55:866-873 «PMID: 31951679»PubMed
- Song TW, Kim KW, Kim ES ym. Utility of impulse oscillometry in young children with asthma. Pediatr Allergy Immunol 2008;19:763-8 «PMID: 18331417»PubMed
- Thamrin C, Gangell CL, Udomittipong K ym. Assessment of bronchodilator responsiveness in preschool children using forced oscillations. Thorax 2007;62:814-9 «PMID: 17412777»PubMed
- Uddenfeldt M, Janson C, Lampa E ym. High BMI is related to higher incidence of asthma, while a fish and fruit diet is related to a lower- Results from a long-term follow-up study of three age groups in Sweden. Respir Med 2010;104:972-80 «PMID: 20171076»PubMed
- Vork KL, Broadwin RL, Blaisdell RJ. Developing asthma in childhood from exposure to secondhand tobacco smoke: insights from a meta-regression. Environ Health Perspect 2007;115:1394-400 «PMID: 17938726»PubMed

