Cellförändringar i livmoderhalsen, slidan och yttre könsorganen
Hur kan man hänvisa till God medicinsk praxis-rekommendationen? «K1»1
Den här svenskspråkiga God medicinsk praxis-rekommendationen har översatts från den finska God medicinsk praxis-rekommendationen (Käypä hoito -suositus Kohdunkaulan, emättimen ja ulkosynnytinten solumuutokset «Kohdunkaulan, emättimen ja ulkosynnytinten solumuutokset»1). Om det finns skillnader i texterna gäller den uppdaterade finskspråkiga versionen.
Huvudsakligen finns evidenssammandragen och bakgrundsmaterialen samt internetlänkarna på finska.
Centrala rekommendationer
- Prevalensen av livmoderhalscancer är störst bland kvinnor i fertil ålder.
- Det riksomfattande screeningprogrammet för livmoderhalscancer riktas med 5 års mellanrum kommunvis till kvinnor i åldern (25)30–65 år.
- Det finns två alternativ till primärt screeningtest i screeningprogrammet, antingen ett high-risk HPV-test (hrHPV, humant papillomvirus) eller ett papaprov.
- I Finland utförs mycket spontanscreening utanför programmet, särskilt för kvinnor under 25 år, vars screening inte är effektivt. Screeningliknande papaprov eller hrHPV-test borde inte alls tas av kvinnor under 20 år.
- Deltagande i den organiserade screeningen bör uppmuntras på grund av dess bättre kostnadseffektivitet. Även papaprov och hrHPV-tester och fortsatta undersökningar utanför programmet bör registreras på samma sätt som vid organiserad screening.
- Dessutom strävar man efter att förebygga livmoderhalscancer genom det nationella HPV-vaccinationsprogrammet, som inleddes 2013 för flickor och utvidgades från hösten 2020 till att omfatta även pojkar. Screening av vaccinerade är också behövligt.
- Diagnosen och behandlingen av cellförändringar i livmoderhalsen grundar sig på cytologi (exfoliativa cellprov), kolposkopi (endoskopi av livmoderhalsen med förstorande optik) och histopatologisk undersökning av vävnadsprov som tagits i samband med kolposkopin.
- Histologiska LSIL-förändringar och lindrigare förändringar följs upp i allmänhet utan behandling, eftersom största delen av dem läker av sig själva, särskilt hos unga kvinnor.
- Histologiska HSIL- och starkare förändringar behandlas vanligtvis (kirurgisk borttagning av förändringsområdet).
- Behandlingen utförs i kolposkopistyrning.
- Risken för cancer har ökat tydligt i samband med förändringarna, även efter behandlingen.
Tabeller
- Tabell 1. Termer och förkortningar som används i rekommendationen «Termer och förkortningar som används i rekommendationen....»1
- Tabell 2. Den gamla WHO 2003-klassificeringen och den nya WHO 2014-klassificeringen av histologiska förändringar i skiv- och cylinderepitelcellerna i livmoderhalsen, slidan och de yttre könsorganen. Den nya klassificeringen innehåller uppgifter om vilka förändringar som ska anmälas till Finlands Cancerregister. «Tidigare WHO:s klassifikationer från 2003, 2014 och 2020 av histologiska förändringar i skiv- och cylinderepitelcellerna i livmoderhalsen, slidan och de yttre könsorganen samt arbetsgruppens rekommendation om ICD-10-koder. I den senaste klassificeringen finns uppgifter om vilka förändringar som ska anmälas till Finlands Cancerregister....»2
- Tabell 3. Motsvarighet mellan histologiska och cytologiska klassificeringar av skivepitel i livmoderhalsen och HPV-kategori «Motsvarighet mellan histologiska och cytologiska klassificeringar av HPV-beroende skivepitel i livmoderhalsen och HPV-kategori...»3
- Tabell 4. Indikationer för papaprov inom öppenvården «Indikationer för papaprov inom öppenvården...»4
- Tabell 5. Indikationer för hrHPV-test inom öppenvården «Indikationer för hrHPV-test inom öppenvården...»5
- Tabell 6. Bethesda-systemet 2014 «Bethesda-systemet 2014 2...»6
- Tabell 7. Indikationer för kolposkopi samt brådskandegrad «Indikationer för kolposkopi och brådskandegrad...»7
- Tabell 8. Åtgärdsrekommendationer vid konstaterande av papafynd utan tydlig dysplasi «Åtgärdsrekommendationer vid konstaterande av papafynd utan tydlig dysplasi...»8
- Tabell 9. Klassificering av kolposkopifynd enligt kolposkopiindexet Swede score «Klassificering av kolposkopifynd enligt kolposkopiindexet Swede score...»9
Figurer
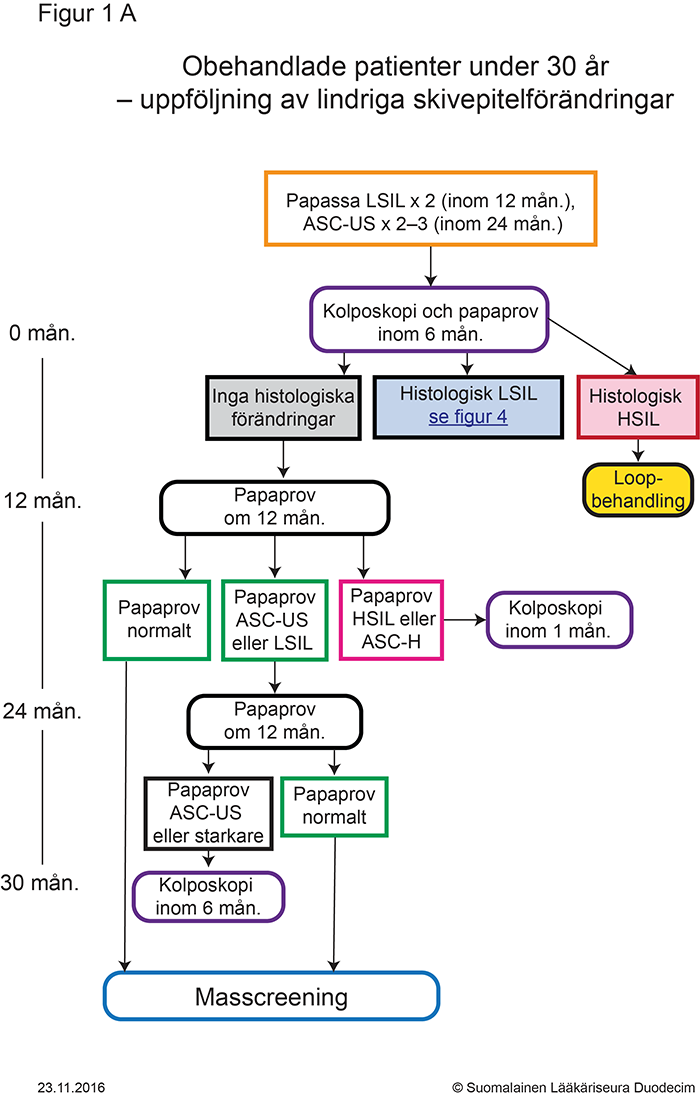
- Figur 1A. Obehandlade patienter under 30 år – uppföljning av lindriga skivepitelförändringar «gvr00069a.pdf»1, «Obehandlade patienter under 30 år – uppföljning av lindriga skivepitelförändringar»1
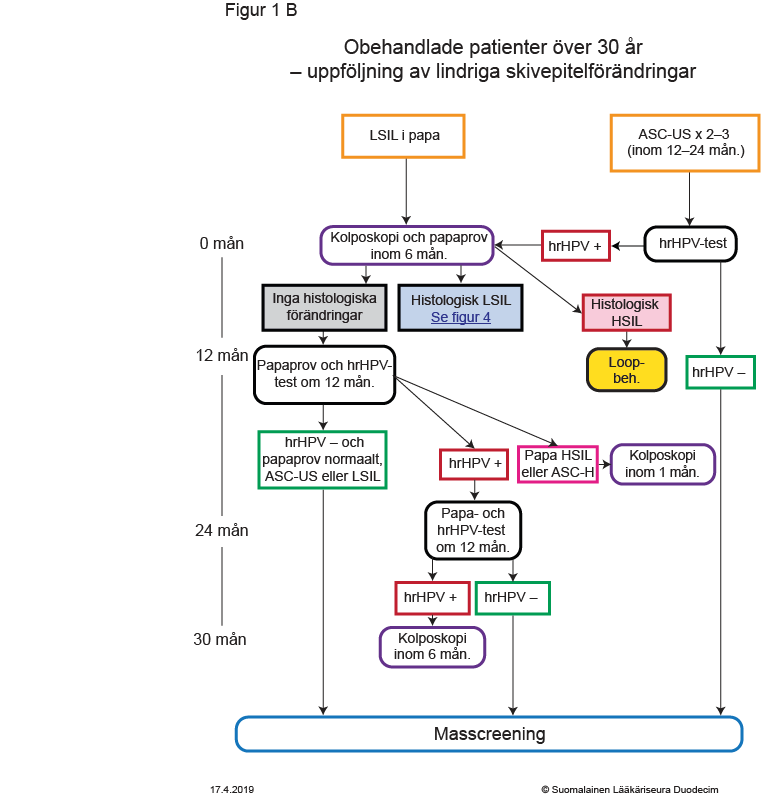
- Figur 1B. Obehandlade patienter över 30 år – uppföljning av lindriga skivepitelförändringar «gvr00069b.pdf»2, «Obehandlade patienter över 30 år - uppföljning av lindriga skivepitelförändringar»2
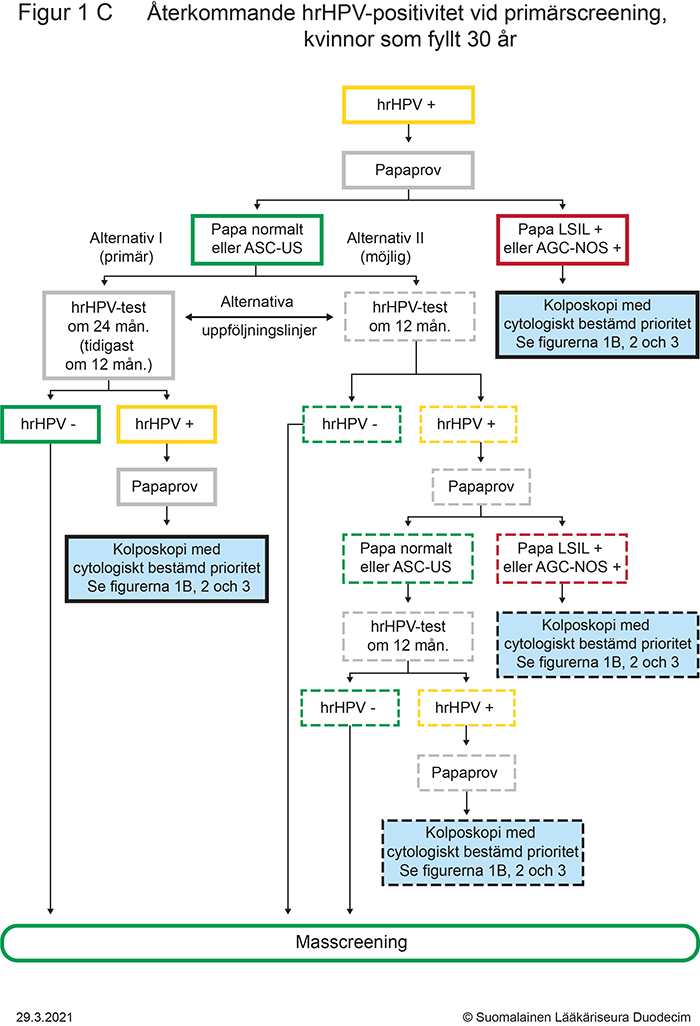
- Figur 1C. Återkommande hrHPV-positivitet vid primärscreening, kvinnor som fyllt 30 år «gvr00069c.pdf»3, «Återkommande hrHPV-positivitet vid primärscreening, kvinnor som fyllt 30 år»3
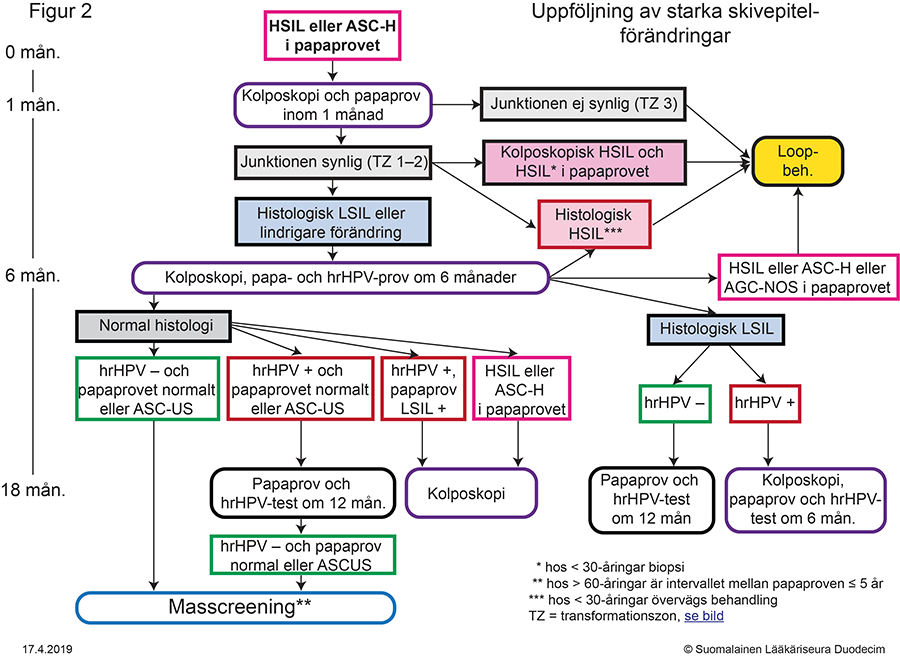
- Figur 2. Uppföljning av starka skivepitelförändringar «gvr00069d.pdf»4, «Uppföljning av starka skivepitel-förändringar»4
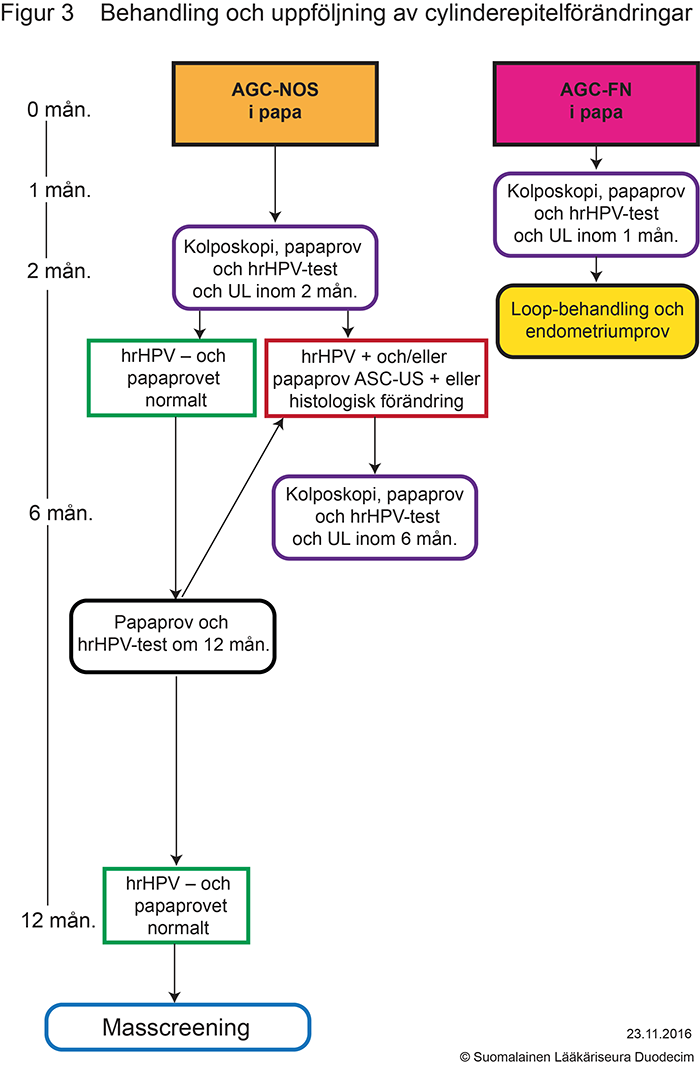
- Figur 3. Behandling och uppföljning av cylinderepitelförändringar «gvr00069e.pdf»5, «Behandling och uppföljning av cylinderepitelförändringar»5
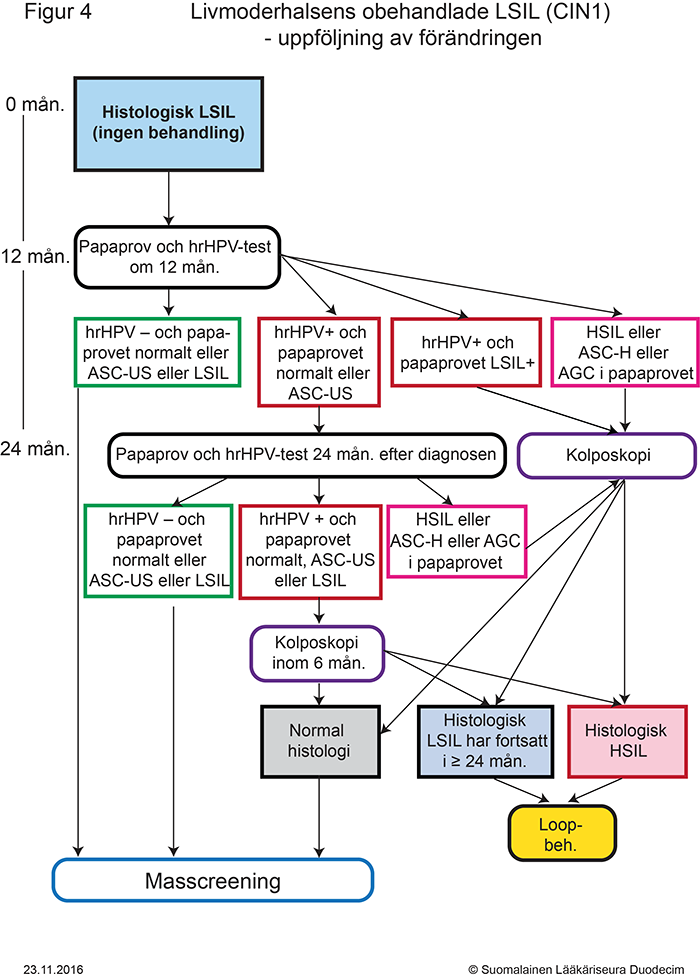
- Figur 4. Uppföljning av obehandlad LSIL (CIN 1)-förändring i livmoderhalsen «gvr00069f.pdf»6, «Livmoderhalsens obehandlade LSIL (CIN1) - uppföljning av förändringen»6
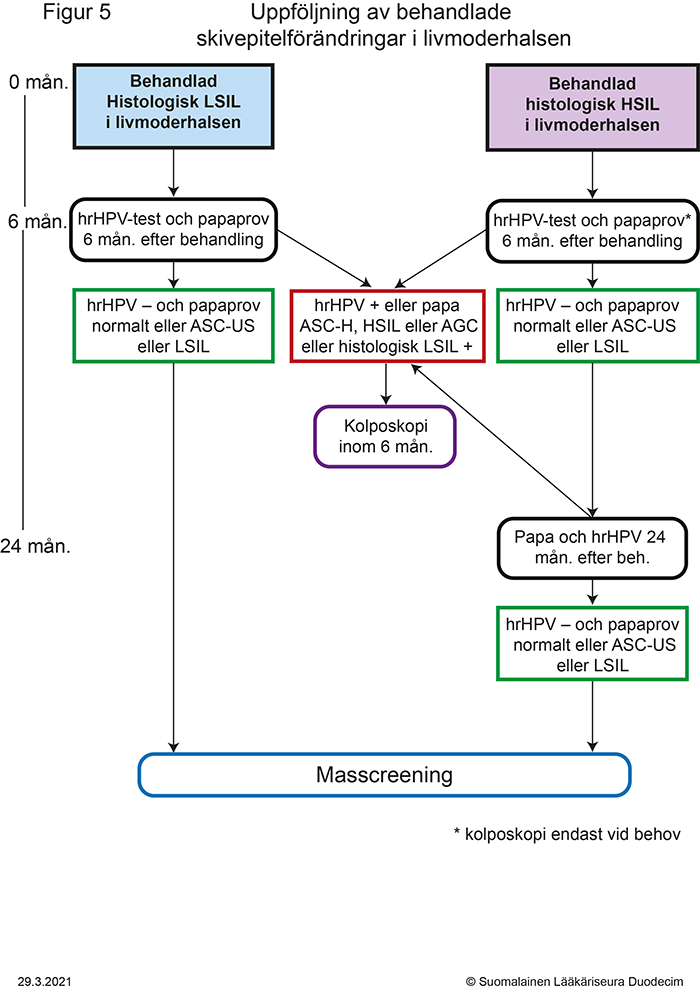
- Figur 5. Uppföljning av behandlade skivepitelförändringar i livmoderhalsen «gvr00069g.pdf»7, «Uppföljning av behandlade skivepitelförändringar i livmoderhalsen»7
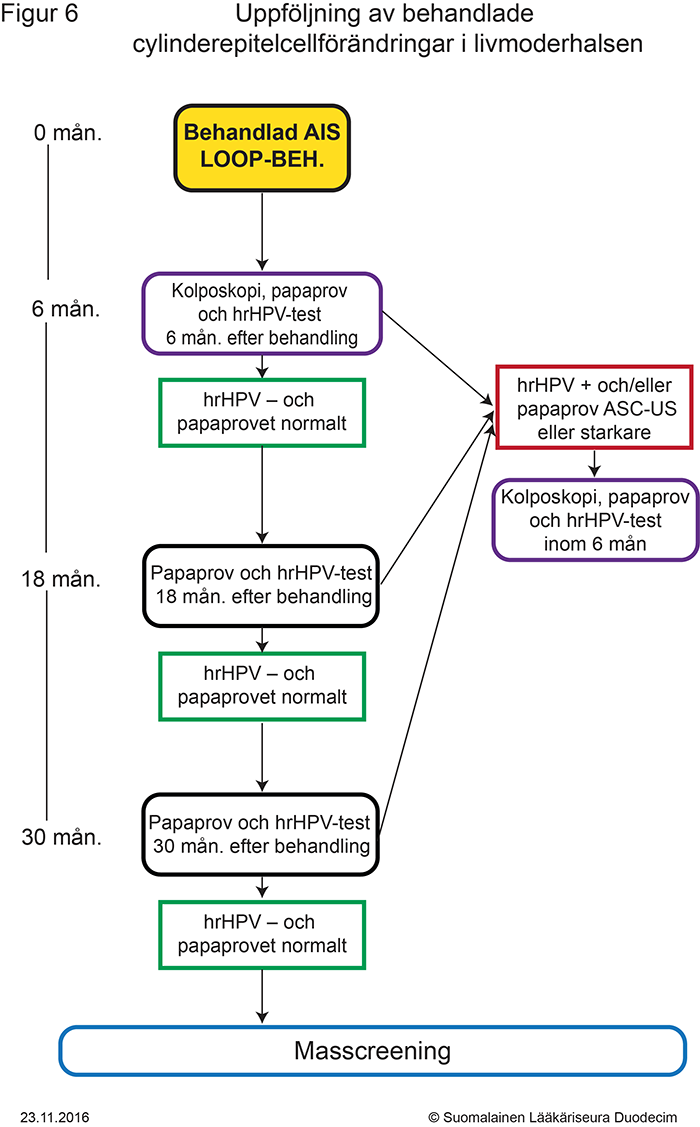
- Figur 6. Uppföljning av behandlade cylinderepitelförändringar i livmoderhalsen «gvr00069h.pdf»8, «Uppföljning av behandlade cylinderepitelcellförändringar i livmoderhalsen»8
- Figur 7. Uppföljning och behandling av cellförändringar under graviditeten och efter förlossningen «gvr00069i.pdf»9, «Uppföljning och behandling av cellförändringar under graviditeten och efter förlossningen»9
- Figur 8. Behandling och uppföljning av vävnadsförändringar i slidan «gvr00069j.pdf»10, «Vård och uppföljning av vävnadsförändringar i slidan»10
- Figur 9. Uppföljning av behandlade HSIL- och dVIN-förändringar i de yttre könsorganen «gvr00069k.pdf»11, «Uppföljning av behandlade HSIL- och dVIN-förändringar i yttre könsorganen»11
| Term eller förkortning | Förklaring |
|---|---|
| Papaprov | gynekologiskt exfoliativt cellprov |
| Papatest, dvs. papaprov | cytologens bedömning av gynekologiskt exfoliativt cellprov |
| Cytologi: | |
| ASC-H | atypiska skivepitelceller, HSIL kan inte uteslutas (atypical squamous cells, cannot exclude HSIL) |
| ASC-US | atypiska skivepitelceller, betydelsen oklar (atypical squamous cells of undetermined significance) |
| AGC-FN | atypiska cylinderceller, neoplasi sannolik (atypical glandular cells, favor neoplasia) |
| AGC-NOS | i övrigt icke specificerade atypiska körtelceller (atypical glandular cells not otherwise specified) |
| HSIL | svår skivepitelförändring (high-grade squamous intraepithelial lesion) |
| LSIL | lindrig skivepitelförändring (low-grade squamous intraepithelial lesion) |
| LSIL+ eller HSIL+ |
LSIL+ inkluderar LSIL- och svårare förändringar (LSIL, HSIL, AIS) HSIL+ inkluderar HSIL- och svårare förändringar (HSIL, AIS) |
| Histologi: | |
| AIS | carcinoma in situ i livmoderhalsen (adenocarcinoma in situ) |
| CIN | atypi av epitel i livmoderhalsen (cervical intraepithepatial neoplasia) CIN 1 = lindrig mognadsstörning (dysplasia levis) CIN 2 = måttlig mognadsstörning (dysplasia moderata) CIN 3 = svår mognadsstörning (dysplasia gravis, carcinoma in situ) |
| HSIL | svår skivepitelförändring (high-grade squamous intraepithelial lesion) |
| LSIL | lindrig skivepitelförändring (low-grade squamous intraepithelial lesion) |
| VAIN | atypi av epitel i slidan (vaginal intraepithepatial neoplasia) VAIN 1 = lindrig mognadsstörning (dysplasia levis) VAIN 2 = måttlig mognadsstörning (dysplasia moderata) VAIN 3 = svår mognadsstörning (dysplasia gravis, carcinoma in situ) |
| VIN | atypi av epitel i yttre könsorganen (vulvar intraepithepatial neoplasia) VIN 1 = lindrig mognadsstörning (dysplasia levis) VIN 2 = måttlig mognadsstörning (dysplasia moderata) VIN 3 = svår mognadsstörning (dysplasia gravis, carcinoma in situ) |
| dVIN | Differentiated type vulvar intraepithelial neoplasia (dVIN) |
| gAIS | Adenocarcinoma in situ, gastric-type |
| LEGH | Lobular endocervical glandular hyperplasia |
| SMILE | Stratified mucin-producing intraepithelial lesion |
| Övriga förkortningar med anknytning till cytologi och histologi: | |
| HPV | Humant papillomvirus (Human papilloma virus) |
| IFCPC | International Federation of Cervical Pathology and Colposcopy |
| EFC | European Federation for Colposcopy |
| RCI | Reids kolposkopiindex |
| TBS | The Bethesda System |
| Loop-behandling: | |
| LEEP | loop electrosurgical excision procedure |
| LLETZ | large loop excision of the transformation zone |
- För mer information se även webbkursen "Osaatko ehkäistä kohdunkaulan syöpää?" i Duodecims Oppiportti «https://www.oppiportti.fi/op/dvk00098»1 (avgiftsbelagd, kräver åtkomsträtt).
Utskrivbar PDF «gvr00069a.pdf»1
Utskrivbar PDF «gvr00069b.pdf»2
Utskrivbar PDF «gvr00069c.pdf»3
Utskrivbar PDF «gvr00069d.pdf»4
Utskrivbar PDF «gvr00069e.pdf»5
Utskrivbar PDF «gvr00069f.pdf»6
Utskrivbar PDF «gvr00069g.pdf»7
Utskrivbar PDF «gvr00069h.pdf»8
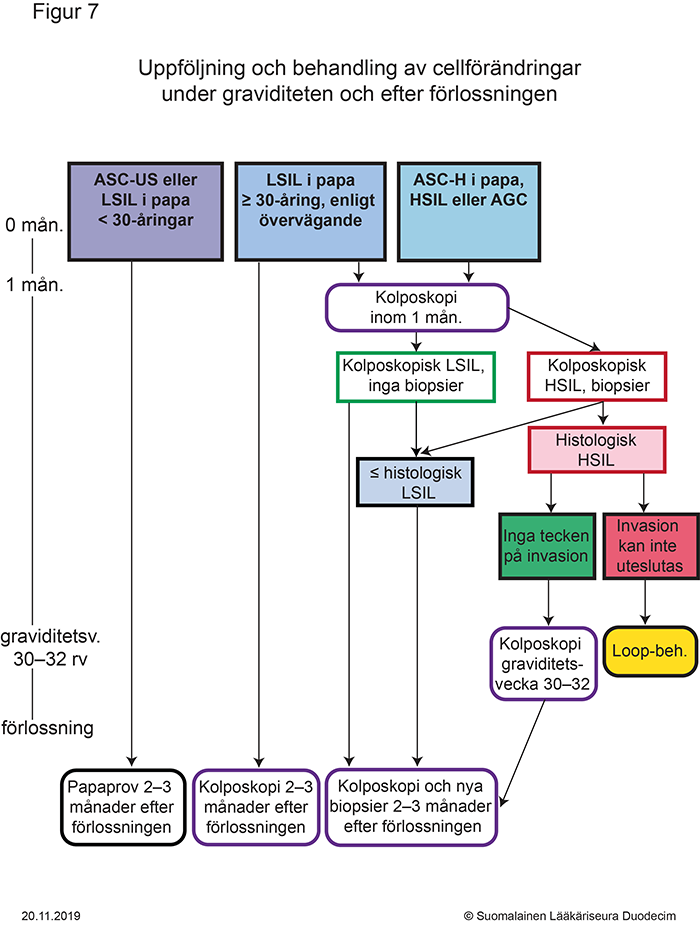
Utskrivbar PDF «gvr00069i.pdf»9
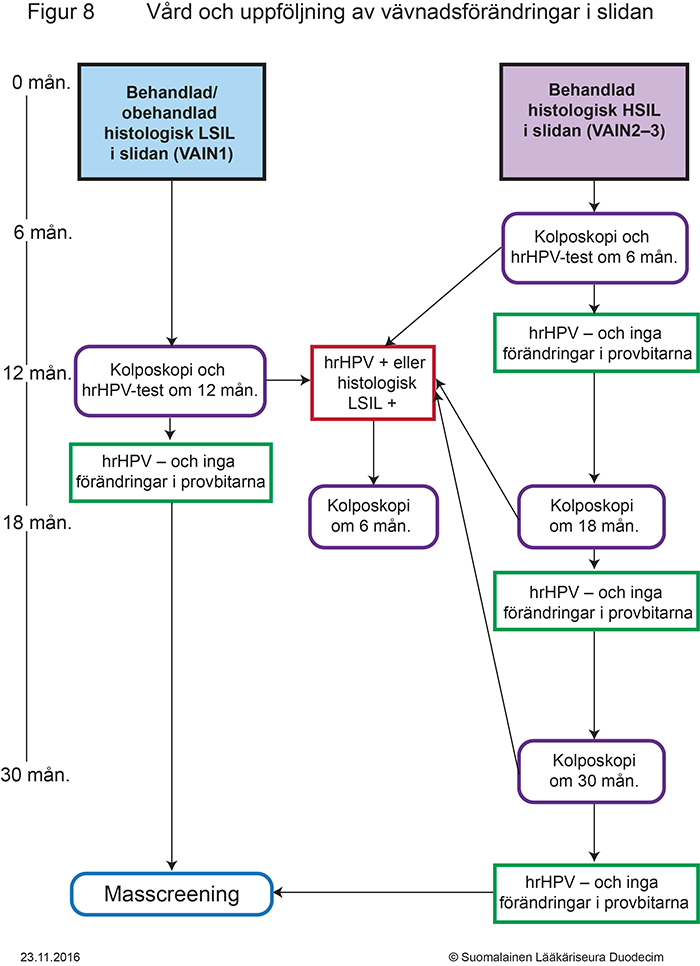
Utskrivbar PDF «gvr00069j.pdf»10
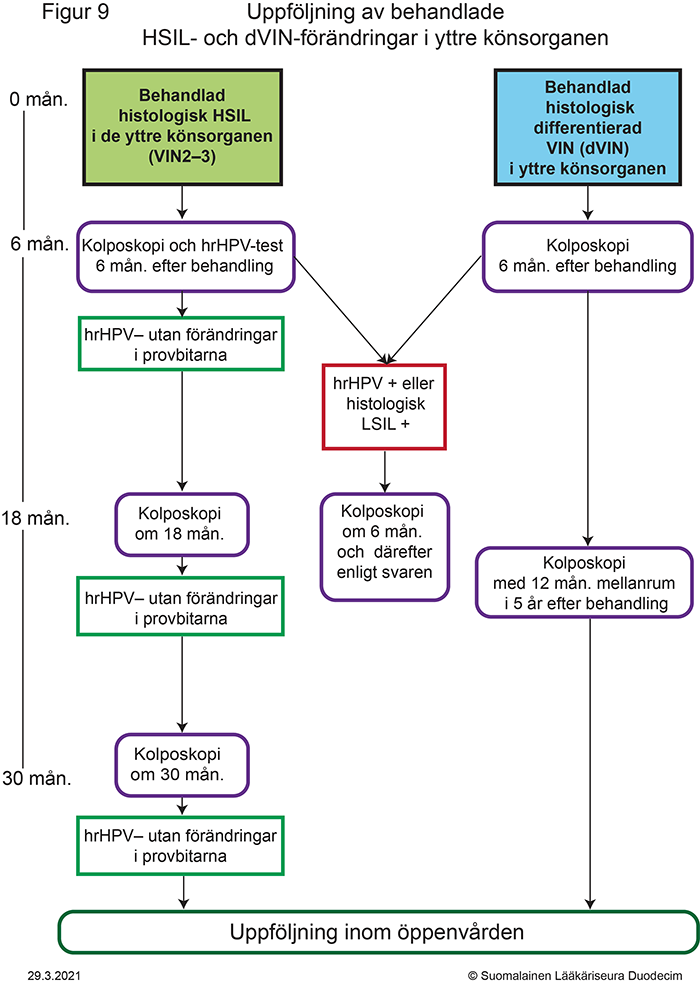
Utskrivbar PDF «gvr00069k.pdf»11
Målsättningar
- Syftet med rekommendationen är att i Finland förenhetliga diagnostiken, behandlingen och uppföljningen av cell- och vävnadsförändringar i livmoderhalsen, slidan och de yttre könsorganen samt att trygga verksamhetens höga kvalitet.
Målgrupper
- Rekommendationen är avsedd för primärvården och specialsjukvården.
- Målgruppen är i synnerhet de personer som ansvarar för screeningen samt läkare som diagnostiserar, behandlar och följer upp nämnda cell- och vävnadsförändringar.
Avgränsning
- Rekommendationen har avgränsats till att gälla cellförändringar av olika grad i livmoderhalsen och i könsorganen ytter om den.
Klassificering och anmälan till Cancerregistret
Klassificering
- Klassificering och utveckling av histologiska förändringar i skiv- och cylinderepitelcellerna i livmoderhalsen, slidan och de yttre könsorganen presenteras i tabell «Tidigare WHO:s klassifikationer från 2003, 2014 och 2020 av histologiska förändringar i skiv- och cylinderepitelcellerna i livmoderhalsen, slidan och de yttre könsorganen samt arbetsgruppens rekommendation om ICD-10-koder. I den senaste klassificeringen finns uppgifter om vilka förändringar som ska anmälas till Finlands Cancerregister....»2.
- Motsvarighet mellan histologiska och cytologiska klassificeringar av skivepitel i livmoderhalsen och HPV-kategori presenteras i tabell «Motsvarighet mellan histologiska och cytologiska klassificeringar av HPV-beroende skivepitel i livmoderhalsen och HPV-kategori...»3
- Se mer information om klassificering av förändringar i skivepitelcellerna «Levyepiteelisolumuutosten luokittelu»2.
| WHO 2003 | WHO 2014 | WHO 2020 | ICD-10 (rekommendation) |
|
|---|---|---|---|---|
| Livmoderhalsen, skivepitel | ||||
| CIN 1 | LSIL | LSIL | N87.0 | |
| CIN 2 | HSIL | HSIL* | N87.2 | |
| CIN 3 | HSIL | HSIL* | N87.2 | |
| Livmoderhalsen, cylinderepitel | ||||
| Glandular dysplasia | AIS | Med HPV-bakgrund: AIS (usual type)* SMILE* |
D06.0 | |
| AIS | AIS | Oberoende av HPV: AIS, gastrisk typ (gAIS) * Atypical LEGH * |
D06.0 | |
| Slidan | ||||
| VAIN 1 | LSIL | LSIL | N89.0 | |
| VAIN 2 | HSIL | HSIL* | N89.2 | |
| VAIN 3 | HSIL | HSIL* | N89.2 | |
| Yttre könsorganen | ||||
| VIN 1 | LSIL | LSIL | N90.0 | |
| VIN 2 | HSIL | HSIL* | N90.2 | |
| VIN 3 | HSIL | HSIL* | N90.2 | |
| Differentiated-VIN (dVIN) | dVIN | dVIN* | D07.1 | |
| * Ska anmälas till Cancerregistret (se Cancerregistret «https://syoparekisteri.fi/tiedonkeruu/ilmoituspalvelu»2) | ||||
| Histologi (WHO 2014/2020) | Histologi (WHO 2003) | Cytologi (Bethesda 2014) | HPV-kategori | |
|---|---|---|---|---|
| LSIL | CIN 1 | LSIL (ASC-US) | Låg och hög risk | |
| HSIL | CIN 2 | HSIL (ASC-H) | Hög risk | |
| HSIL | CIN 3 | HSIL (ASC-H) | Hög risk | |
| AIS | AIS | AGC-FN (AGC-NOS) | Hög risk | |
HPV = humant papillomvirus (Human papilloma virus) AGC-FN = (atypical glandular cells, favour neoplasia) ASC-US = (atypical squamous cells of undetermined significance) ASC-H = (atypical squamous cells, high-grade cannot be ruled out) LSIL = (low grade squamous intraepithelial lesion) HSIL = (high grade squamous intraepithelial lesion) AGC-NOS = (atypical glandular cells, not otherwise specified) |
||||
Anmälan av cancerfall och förstadier till cancer till Cancerregistret
- Till Finlands Cancerregister «https://syoparekisteri.fi/tiedonkeruu/ilmoituspalvelu/»3 ska anmälas cancerfall och förstadier till cancer, helst elektroniskt (se tabell
«Tidigare WHO:s klassifikationer från 2003, 2014 och 2020 av histologiska förändringar
i skiv- och cylinderepitelcellerna i livmoderhalsen, slidan och de yttre könsorganen
samt arbetsgruppens rekommendation om ICD-10-koder. I den senaste klassificeringen
finns uppgifter om vilka förändringar som ska anmälas till Finlands Cancerregister....»2).
- I Finland anmäls årligen cirka 2 000 fall av förstadieförändringar i livmoderhalsen (histologiskt HSIL eller in situ-karcinom) till Cancerregistret, varav cirka 100 AIS-förändringar per år «https://syoparekisteri.fi/tilastot/tautitilastot/»4, «Suomen Syöpärekisteri, tietokantaversio 2.9, tarka...»1, «Suomen Syöpärekisteri, https://tilastot.syoparekis...»2. Den livslånga risken för förstadium till livmoderhalscancer är ca 5 %, dvs. cirka fem av hundra kvinnor konstateras ha förstadium till livmoderhalscancer under sitt liv.
- Åren 2016–2019 registrerades 76 % förstadier till livmoderhalscancer hos 30-åringar eller äldre och på motsvarande sätt ca 7 % hos kvinnor under 25 år «https://syoparekisteri.fi/tilastot/tautitilastot/»4.
- Cirka 70–80 fall av förstadier till cancer i slidan (histologisk HSIL) anmäls årligen till Cancerregistret. Cirka 115 fall av förstadier till cancer i de yttre könsorganen anmäls årligen «Suomen Syöpärekisteri, https://tilastot.syoparekis...»2. Av dessa är cirka 10 % dVIN-förändringar, resten i praktiken HSIL-förändringar «Suomen Syöpärekisteri, tietokantaversio 2.9, tarka...»1.
- Det kan fortfarande finnas brister i anmälningarna.
Epidemiologi
Livmoderhalscancer
- Livmoderhalscancer är den fjärde vanligaste cancerformen bland kvinnor i hela världen.
År 2018 insjuknade uppskattningsvis 570 000 kvinnor i livmoderhalscancer och 311 000
avled «Parkin DM, Whelan SL, Ferlay J, Teppo L, Thomas DB...»3, «World Health Organisation (WHO) Mortality Databank...»4, «Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torr...»5, «Ferlay J, Ervik M, Lam F, Colombet M, Mery L, Piñe...»6. Se WHO:s webbplats «https://gco.iarc.fr/today/online-analysis-table»5 och «https://gco.iarc.fr/today/data/factsheets/cancers/23-Cervix-uteri-fact-sheet.pdf»6.
- Endast cirka 12 % av fallen konstaterades i länder med en hög inkomstnivå «Ferlay J, Ervik M, Lam F, Colombet M, Mery L, Piñe...»6.
- Enligt Cancerregistret i Finland
- År 2018 konstaterades 171 nya fall av livmoderhalscancer och 57 kvinnor dog i sjukdomen «Suomen Syöpärekisteri, https://tilastot.syoparekis...»2, «https://syoparekisteri.fi/tilastot/tautitilastot/»4, «https://nordcan.iarc.fr/en»7. Enligt Cancerregistret konstateras 100–110 fall av skivepitelkarcinom per år, ca 50–60 fall av adenokarcinom och ca 10 fall av andra eller ospecificerade karcinom «Suomen Syöpärekisteri, tietokantaversio 2.9, tarka...»1. Ungefär fem av tusen kvinnor insjuknar i något skede av sitt liv i livmoderhalscancer «https://syoparekisteri.fi/tilastot/tautitilastot/»4, «https://nordcan.iarc.fr/en»7.
- numera förhindras med hjälp av screening mer än 80 % av cancerfall och dödsfall «Anttila A, Pukkala E, Söderman B ym. Effect of org...»7, «International Agency for Research on Cancer. Cervi...»8 (se punkten Screening).
- incidensen av livmoderhalscancer har ökat från och med slutet av 1990-talet bland kvinnor under 40 år och ligger nu på samma nivå som före screeningen «https://syoparekisteri.fi/tilastot/tautitilastot/»4, «https://nordcan.iarc.fr/en»7, «Anttila A. Kohdunkaulansyövän seulonnan kohdistami...»9, «Nieminen P, Hakama M, Tarkkanen J ym. Effect of ty...»10, «Engholm G, Ferlay J, Christensen N, Kejs AMT, Joha...»11, «Engholm G, Ferlay J, Christensen N ym. NORDCAN--a ...»12.
- Den relativa femårsöverlevnadskvoten för patienter med livmoderhalscancer är ca 71 % «Quinn MA, Benedet JL, Odicino F ym. Carcinoma of t...»13, «https://syoparekisteri.fi/tilastot/tautitilastot/»4.
Cancer i slidan och yttre könsorganen
- År 2018 konstaterades 25 fall av cancer i slidan och 120 fall av cancer i de yttre könsorganen i Finland «Suomen Syöpärekisteri, https://tilastot.syoparekis...»2. I dessa sjukdomar dog 16 respektive 38 kvinnor. Se Finlands Cancerregister «https://syoparekisteri.fi/tilastot/tautitilastot/»4, «Suomen Syöpärekisteri, https://tilastot.syoparekis...»2.
- I Cancerregistret är ca 64 % av cancerfall i slidan skivepitelkarcinom, 16 % adenokarcinom och 10 % melanom «Suomen Syöpärekisteri, tietokantaversio 2.9, tarka...»1.
- I Cancerregistret är cirka 84 % av cancer i de yttre könsorganen skivepitelkarcinom, 10 % adenokarcinom (i praktiken Pagets sjukdom) och 4 % melanom «Suomen Syöpärekisteri, tietokantaversio 2.9, tarka...»1.
Riskfaktorer och naturligt förlopp för livmoderhalscancer och dess förstadier
Riskfaktorer
- HPV-infektion är en central men inte ensam en tillräcklig etiologisk faktor för livmoderhalscancer «zur Hausen H. Papillomaviruses causing cancer: eva...»14.
- 170 HPV-typer har beskrivits «de Villiers EM. Cross-roads in the classification ...»15.
- Cirka 40 av dem kan orsaka infektion i genitalområdet.
- HPV-typerna kan grupperas enligt hur stark deras koppling till skivepitelkarcinom och dess förstadier är.
- Typer av hög risk (onkogen eller high risk HPV, hr-HPV) är 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 och 59 «IARC Working group on the Evaluation of Carsinogen...»16.
- hrHPV-infektion är inte samma sak som förstadium till livmoderhalscancer.
- Uppkomsten av förstadier till cancer förutsätter en långvarig HPV-infektion med hög risk.
- Se punkten HPV-infektionens naturliga förlopp.
- Läs mer om HPV «Lisätietoa kohdunkaulasyövän ja sen esiasteiden riskitekijöistä»3.
- Övriga inflammatoriska, kemiska, hormonella, immunologiska och genetiska faktorer
påverkar en utdragen HPV-infektion och utvecklingen av förstadier till cancer samt
risken för cancer. Sådana är bland annat
- rökning «Tupakointi on ilmeisesti kohdunkaulasyövän itsenäinen riskitekijä.»B
- andra gynekologiska infektioner, särskilt klamydia «Anttila T, Saikku P, Koskela P ym. Serotypes of Ch...»17, «Smith JS, Bosetti C, Muñoz N ym. Chlamydia trachom...»18
- tidig ålder för inledande av samlag «Deacon JM, Evans CD, Yule R ym. Sexual behaviour a...»19, «Burger MP, Hollema H, Gouw AS ym. Cigarette smokin...»20, «Plummer M, Herrero R, Franceschi S ym. Smoking and...»21
- flera sexpartner «Deacon JM, Evans CD, Yule R ym. Sexual behaviour a...»19, «Burger MP, Hollema H, Gouw AS ym. Cigarette smokin...»20, «Plummer M, Herrero R, Franceschi S ym. Smoking and...»21
- sexpartnernas riskfyllda sexuella beteende «Franceschi S, Castellsagué X, Dal Maso L ym. Preva...»22, «Castellsagué X, Ghaffari A, Daniel RW ym. Prevalen...»23, «Castellsagué X, Bosch FX, Muñoz N ym. Male circumc...»24, «Winer RL, Lee SK, Hughes JP ym. Genital human papi...»25, «Thomas DB, Ray RM, Pardthaisong T ym. Prostitution...»26
- immunsuppression eller HIV-infektion «Birkeland SA, Storm HH, Lamm LU ym. Cancer risk af...»27, «Frisch M, Biggar RJ, Goedert JJ. Human papillomavi...»28.
- Det finns motstridiga uppgifter om risken som orsakas av långvarig användning av kombinerade
p-piller.
- I alla dessa studier utgörs problemet av standardiseringen enligt ålder, när menstruationen har börjat, sexuell aktivitet, antalet sexpartner, övriga infektioner, rökning, HPV-infektioner och typen av dessa. Evidensen är alltså osäker åt båda hållen «Moreno V, Bosch FX, Muñoz N ym. Effect of oral con...»29, «Marks M, Gravitt PE, Gupta SB ym. Combined oral co...»30, «Nielsen A, Kjaer SK, Munk C ym. Persistence of hig...»31, «Molano M, Van den Brule A, Plummer M ym. Determina...»32, «Moscicki AB, Ma Y, Farhat S ym. Redetection of cer...»33.
HPV-infektionens naturliga förlopp
- Största delen av HPV-infektionerna läker av sig själva.
- HPV-infektionens genomsnittliga varaktighet hos kvinnor i åldern 13–23 år är 8 månader. Upp till 90 % av infektionerna läker inom 2 år «HPV-infektion keskimääräinen kesto 13–23-vuotiailla naisilla on kahdeksan kuukautta ja jopa 90 % infektioista paranee kahdessa vuodessa.»B.
- I en finländsk studie läktes infektionen hos cirka 50 % av 25-åriga kvinnor inom 6 år «Louvanto K, Syrjänen KJ, Rintala MA ym. Genotype-s...»34.
- HPV-smitta med hög risk varar vanligen längre än HPV-smitta med låg risk «Korkean riskin HPV-tartunta kestää yleensä kauemmin kuin matalan riskin HPV-tartunta.»B.
- Av de förändringar i HPV (ASC-US och LSIL) som konstaterats i cellprovet läker i genomsnitt 85–91 % under 36–54 månaders uppföljning utan behandling «Irtosolunäytteessä todetuista HPV:een viittaavista muutoksista (ASC-US – LSIL) paranee keskimäärin 85-91 % keskimäärin 36-54 kuukauden seurannassa.»A.
- En biopsi från förändringen kan minska progressionen och öka den spontana läkningen «Nasiell K, Nasiell M, Vaclavinková V. Behavior of ...»35.
- En långvarig HPV-infektion ökar risken för förstadieförändringar.
- En HPV-infektion, särskilt HPV med hög risk, som varat i mer än 6 månader, ökar risken för histologisk HSIL-förändring «Yli 6 kuukautta kestänyt erityisesti korkean riskin HPV-tulehdus lisää riskiä saada histologinen HSIL.»A.
- Tiden från konstaterande av HPV-infektion till utveckling av in situ karcinom är i allmänhet minst 7 år, oftast längre «Ylitalo N, Josefsson A, Melbye M ym. A prospective...»36.
Naturligt förlopp av förstadier till livmoderhalscancer
- Histologisk LSIL (tidigare CIN 1/HPV)
- Patienten läker ofta av sig själv utan behandling under några års uppföljning och endast cirka 10 % av fallen framskrider till HSIL-förändring «Histologiset LSIL-muutokset (CIN 1) paranevat usein itsestään ilman hoitoa muutaman vuoden seurannan aikana. Vain noin kymmenen prosenttia progessoituu HSIL-muutoksiksi.»A, «Holowaty P, Miller AB, Rohan T ym. Natural history...»37, «Cox JT, Schiffman M, Solomon D ym. Prospective fol...»38, «Guido R, Schiffman M, Solomon D ym. Postcolposcopy...»39.
- Risken för att utveckla en malignitet ökar med åldern «van Oortmarssen GJ, Habbema JD. Epidemiological ev...»40.
- Histologisk HSIL (tidigare CIN 2 och 3)
- Hos kvinnor i åldern 30–60 år skulle 16–39 % av obehandlade histologiska HSIL-förändringar utvecklas till cancer inom 5–12 år «van Oortmarssen GJ, Habbema JD. Epidemiological ev...»40, «Hakama M, Räsänen-Virtanen U. Effect of a mass scr...»41. Av förstadierna hos 35–åringar och äldre skulle upp till 60 % utvecklas till cancer under livstiden «van Oortmarssen GJ, Habbema JD. Epidemiological ev...»40.
- Spontan läkning kan ske hos cirka en tredjedel «Vahvoissa esiastemuutoksissa (HSIL /aiemmin CIN 3, dysplasia gravis, Ca in situ) syöpäriskiksi on arvioitu olevan ainakin 12 %.»B.
- Cancerrisken vid starka förstadieförändringar har bedömts vara minst 12 % «Vahvoissa esiastemuutoksissa (HSIL /aiemmin CIN 3, dysplasia gravis, Ca in situ) syöpäriskiksi on arvioitu olevan ainakin 12 %.»B.
- Hos yngre kvinnor är den spontana läkningsbenägenheten större. Hos dem läker 20–71 % av HSIL-förändringarna vid uppföljning inom 3–12 månader «Nuoremmilla naisilla spontaani paranemistaipumus on suurempi ja heillä 3 kuukauden – vuoden aikana HSIL -muutoksista paranee seurannassa 20-71%.»B.
- Cirka 60 % av återfall konstateras under de första två åren efter behandlingen «Noin 60 %, persistenssistä tai rekurrenssistä, todetaan ensimmäisen 2 vuoden aikana hoidon jälkeen.»B.
- Förändringar i cylinderceller och adenokarcinom in situ (AIS):
- Största delen av AIS-förändringarna har HPV-bakgrund. Till dessa hör AIS (usual type) och SMILE (stratified mucin-producing intraepithelial lesion).
- En liten del av cylindercellförändringarna på neoplastisk in situ-nivå är oberoende av HPV, främst den gastriska typen av AIS (gAIS) och den atypiska lobulära endocervikala körtelhyperplasin (Atypical LEGH).
- Man känner inte exakt till förändringarnas naturliga förlopp «Krivak TC, Rose GS, McBroom JW ym. Cervical adenoc...»42.
Screening
- Målet med screeningen av livmoderhalscancer är att minska sjukdomsfallen och de dödsfall som sjukdomen orsakar «https://syoparekisteri.fi/seulonta/»8.
- I Finland riktas screeningprogrammet för förebyggande av livmoderhalscancer till kvinnor
i åldern 30–65 år med 5 års mellanrum (Statsrådets förordning om screening 2011 och Statsrådets förordning
om ändring av 2 § i statsrådets förordning om screening 2021), «https://syoparekisteri.fi/seulonta/»8, «https://www.finlex.fi/fi/laki/alkup/2011/20110339»9, «https://www.finlex.fi/fi/laki/alkup/2018/20180908»10, «https://finlex.fi/fi/laki/alkup/2021/20210752»11.
- I vissa kommuner utförs screening även av kvinnor i åldern 25.
- Genom organiserad befolkningsbaserad sedvanlig screening kan man förebygga över 80 % av livmoderhalscancerfall samt dödsfall orsakade av dessa «Organisoidulla väestöpohjaisella perinteisellä seulonnalla voidaan ehkäistä yli 80 % kohdunkaulansyövistä ja niiden aiheuttamista kuolemista.»A.
- Screeningen inleddes i Finland på 1960-talet.
- Incidensen av livmoderhalscancer har ökat från och med slutet av 1990-talet bland kvinnor under 40 år och ligger nu på samma nivå som före screeningen «Anttila A. Kohdunkaulansyövän seulonnan kohdistami...»9, «Nieminen P, Hakama M, Tarkkanen J ym. Effect of ty...»10, «Engholm G, Ferlay J, Christensen N, Kejs AMT, Joha...»11, «Engholm G, Ferlay J, Christensen N ym. NORDCAN--a ...»12. Dödligheten i livmoderhalscancer har dock inte ökat «Makkonen P, Heinävaara S, Sarkeala T ym. Impact of...»43.
- Enligt EU:s screeningrekommendation bör screeningen inledas vid 25–30 års ålder och
fortsättas till minst 60 års ålder med 3–5 års screeningintervall «Arbyn M, Anttila A, Jordan J ym. European guidelin...»44.
- Screening av personer under 25 år minskar inte förekomsten av livmoderhalscancer «Alle 25-vuotiaiden seulonnalla ei näyttäisi olevan syöpäriskiä pienentävää vaikutusta.»B, «Arbyn M, Anttila A, Jordan J ym. European guidelin...»44.
- Att inleda screening på riksnivå för 25-åringar enligt den nedre gränsen för THL:s och EU:s rekommendationer «Arbyn M, Anttila A, Jordan J ym. European guidelin...»44, «THL. Terveyden ja hyvinvoinnin laitoksen asettaman...»45 kan minska den överdrivna spontanscreeningen av unga kvinnor i Finland.
- Screening för kvinnor i åldern 25–29 år minskar dock inte förekomsten av eller dödligheten i livmoderhalscancer «Alle 30-vuotiaiden naisten seulonta ei näyttäisi vähentävän kohdunkaulasyövän ilmaantuvuutta tai kuolleisuutta tautiin.»B.
- Screening för 65–åringar minskar förekomsten av livmoderhalscancer. Även dödligheten
i livmoderhalscancer minskar under 5 års uppföljning «65-vuotiaiden kohdunkaulan irtosolunäytteen seulonta ilmeisesti liittyy ei-seulottuja pienempään kohdunkaulansyövän ilmaantuvuuteen ja kuolleisuuteen siihen.»B, «Melnikow J, Henderson JT, Burda BU ym. Screening f...»46, «Pankakoski M, Anttila A, Sarkeala T ym. Effectiven...»47, «US Preventive Services Task Force., Curry SJ, Kris...»48.
- Arbetsgruppen rekommenderar att screeningen utvidgas nationellt till kvinnor i åldern 65 år.
- Screeningprovet tas på samma sätt som ett diagnostiskt prov. Cellprovstagning beskrivs
i punkten Tagning av cellprov.
- I screeningprogrammet kan man använda papaprov eller hos kvinnor som är 30 år eller
äldre primärtest av hrHPV-typer.
- hrHPV-screeningen minskar incidensen av cancer minst lika mycket som den cytologiska screeningen «Korkean riskin HPV-määrityksellä on parempi herkkyys (eli testi tunnistaa solumuutokset herkemmin), mutta jonkin verran huonompi tarkkuus (eli jonkin verran enemmän vääriä positiivisia) kuin perinteisellä Papa-seulonnalla. HPV-seulonta vähentää kohdunkaulasyövän ilmaantuvuutta vähintään yhtä paljon kuin sytologinen seulonta.»A.
- En hrHPV-screening kan öka överdiagnostiken av lindrigare HSIL-förändringar (tidigare CIN 2) särskilt hos kvinnor under 35 år och ännu mer hos kvinnor under 30 år «HPV-seulonta voi lisätä lievempien HSIL-muutosten (entinen CIN 2) ylidiagnostiikkaa varsinkin alle 35-vuotiailla naisilla, ja vielä enemmänalle 30-vuotiailla alle 30-vuotiailla.»A.
- Genom hrHPV-hemprovtagning kan man öka andelen kvinnor som deltar i screeningen av livmoderhalscancer bland de kvinnor som inte deltar på basis av kallelsebrev «Kotinäytteenoton avulla saadaan nostatettua kohdunkaulansyövän seulonnan osallistuvuusosuutta niiden naisten joukossa, jotka eivät osallistu kutsukirjeiden perusteella.»A.
- Se mer information om hrHPV-testet vid screening «Lisätietoa uusista näytteenottotekniikoista»4.
- Den som deltagit i screeningen får svaret hem per brev «Lisätietoa kohdunkaulan syövän seulonnan organisoinnin, suunnittelun, arvioinnin ja seulontakutsun osalta»5, «Lisätietoa kohdunkaulansyövän seulonnan käytännön järjestelyistä»6, «https://syoparekisteri.fi/seulonta/syopaseulontojen-jarjestaminen/»12.
- I screeningprogrammet kan man använda papaprov eller hos kvinnor som är 30 år eller
äldre primärtest av hrHPV-typer.
- Graviditet, amning eller hysterektomi är inga hinder för att delta i screeningprovet
(se punkterna Tagning av cellprov och Graviditet).
- Efter en hysterektomi kan cellförändringar fortfarande uppträda i slidan och de yttre
könsorganen samt i livmodertappen om den inte tagits bort under operationen.
- Om en stark cellförändring har behandlats innan hysterektomin är screeningen viktig på grund av den ökade risken för cancer i slidan och i de yttre könsorganen «Kalliala I, Anttila A, Pukkala E ym. Risk of cervi...»49, «Jakobsson M, Pukkala E, Paavonen J ym. Cancer inci...»50.
- Efter en hysterektomi kan cellförändringar fortfarande uppträda i slidan och de yttre
könsorganen samt i livmodertappen om den inte tagits bort under operationen.
- Även personer som fått HPV-vaccin bör delta i screeningarna, eftersom vaccinerna endast förhindrar en del av HPV-infektioner. Se punkten Förebyggande av livmoderhalscancer: HPV-vaccin.
- En väsentlig del av screeningen är fortsatta undersökningar av screeningsfynden och
behandling av de förstadier som hittats.
- Med behandling av förstadier kan 95–99 % av livmoderhalscancerfall förhindras «Kalliala I, Anttila A, Pukkala E ym. Risk of cervi...»49.
- Till fortsatta undersökningar (kolposkopi) hänvisas ca en av hundra kvinnor i en screening som baserar sig på papaprov. Cellförändringar som kräver uppföljning konstateras i genomsnitt hos ca 5 % och variationen är 2–12 % per screeninglaboratorium och -område, «https://syoparekisteri.fi/tilastot/seulontatilastot»13, «Anttila A. Kohdunkaulansyövän seulonnan kohdistami...»9, «Nieminen P, Hakama M, Tarkkanen J ym. Effect of ty...»10, «Anttila A, Näveri T, Sarkeala T. Kohdunkaulan syöv...»51.
- Årligen behandlas cirka 2 000 förstadier till livmoderhalscancer «THL. Terveyden ja hyvinvoinnin laitoksen asettaman...»45, «Suomen Syöpärekisteri, https://tilastot.syoparekis...»2, «Suomen Syöpärekisteri, https://tilastot.syoparekis...»52, varav i screeningprogrammet ca 800, dvs. 5 kvinnor per 1 000 screeningar. Dessutom konstateras enbart i screeningprogrammet ca 700 histologiska LSIL-förändringar per år och rikligt med fall även utanför screeningprogrammet. Det finns ett fall av cancer per cirka 10 000 screeningar. Se Finlands Cancerregister «https://syoparekisteri.fi/tilastot/seulontatilastot»13.
- Den som genomför cancerscreeningen skickar uppgifterna om de som kallas till screening, genomförda screeningundersökningar och resultaten av dem till Finlands Cancerregister. Mer information «Lisätietoa seulontojen rekisteröinnistä»7.
- Mer information om effektiviteten av screening genom cellprov finns i tilläggsmaterialet «Lisätietoa irtosolukokeella tehtävän seulonnan vaikuttavuudesta»8.
Papaprov som tagits utanför screeningprogrammet
- I Finland tas cirka två tredjedelar av alla papaprov utanför screeningprogrammet «Monto K, Nieminen P. Gynekologisten irtosolunäytte...»53, «Salo H, Nieminen P, Kilpi T ym. Divergent coverage...»54.
- I tabell «Indikationer för papaprov inom öppenvården...»4 redogörs för indikationerna för papaprov inom öppenvården.
- Spontan screening kan minska förekomsten av och dödligheten i livmoderhalscancer, men dock i mindre grad än vid organiserad screening «Spontaaniseulonta saattaa vähentää kohdunkaulasyövän ilmaantuvuutta ja kuolleisuutta kuitenkin organisoitua seulontaa vähemmän.»C.
- En del av förstadierna hittas fortfarande på grund av det spontana papaprovet för kvinnor som är yngre än screeningprogrammets målålder. I denna ålder läker förstadierna vanligtvis av sig själva «THL. Terveyden ja hyvinvoinnin laitoksen asettaman...»45, «Salo H, Nieminen P, Kilpi T ym. Divergent coverage...»54.
- Testning av kvinnor under 25 år har också orsakat olägenheter och kostnader «THL. Terveyden ja hyvinvoinnin laitoksen asettaman...»45, «Salo H, Nieminen P, Kilpi T, Auranen K, Leino T, V...»55, «Salo H, Nieminen P, Kilpi T ym. Divergent coverage...»56.Se även Avstå klokt-rekommendationen «Nuorten naisten Papa-näytteet»9: Undvik att ta ett oriktat papaprov från symtomfria unga kvinnor (under 25 år), eftersom cellförändringar i livmoderhalsen i den åldern oftast läker av sig själva.
- Spontantestning görs också av kvinnor över 65 år som passerat målåldern för screening «Thomas DB, Ray RM, Pardthaisong T ym. Prostitution...»26.
Testning av symtomfria 25–29-åringar, om kvinnan inte har deltagit i en masscreening,
och testningen enligt läkarens bedömning anses behövlig
|
Testning av symtomfria kvinnor ≥ 30 år fram till 65 års ålder, om kvinnan inte har
deltagit i masscreeningen och det gått 5 år eller mer från det senaste screeningtestet
|
Diagnostiskt papaprov (för en kvinna över 20 år med symtom) när det finns en klinisk
indikation, såsom
|
När behövs testning utanför programmet?
- Om en kvinna i screeningåldern inte har genomgått testning inom screeningprogrammet under de senaste 5 åren eller inte vill delta i programmet, behövs testning utanför programmet. Testningsintervallet är detsamma som i programmet. Vid testningen kan hrHPV-test användas för kvinnor i åldern ≥ 30 år, om kvalitetssäkringen av testningen och åtgärderna därefter har genomförts i enlighet med screeningprogrammet. Om hrHPV-testet är positivt och resultatet av papaprovet är normalt eller ASCUS, tas ett nytt hrHPV-test om 13–24 månader. Om papaprovet visar på LSIL eller en starkare förändring hänvisas patienten till kolposkopi.
- För personer som passerat screeningsåldern är det skäl att göra ett hrHPV-test eller ett papaprov med högst 5 års mellanrum, om en förstadieförändring har behandlats under screeninghistorien «Arbyn M, Anttila A, Jordan J ym. European guidelin...»44, «Meijer CJ, Berkhof J, Castle PE ym. Guidelines for...»57.
- Arbetsgruppen rekommenderar att det sista screeningprovet tas inom primärvården vid 65 års ålder om kvinnans hemkommun inte kallar 65-åringar till screening.
- I screeningsyfte som förebygger risken för livmoderhalscancer finns det inget behov av papaprov före 25 års ålder.
Användning av hrHPV-testet utanför screeningprogrammet
- Se mer information i tabell «Indikationer för hrHPV-test inom öppenvården...»5. Indikationer för hrHPV-test inom öppenvården.
Testning av symtomfria kvinnor ≥ 30 år fram till 65 års ålder, om kvinnan inte har
deltagit i masscreeningen och det gått ≥ 5 år från det senaste screeningtestet
|
Upprepad ASC-US i papaprovet hos en kvinna ≥ 30 år:
|
Registrering av prover av screeningkaraktär
- Arbetsgruppen rekommenderar att de tagna proverna och de kolposkopier, diagnoser och behandlingar som de medfört registreras på samma sätt som masscreeningproverna för att bedöma deras effektivitet. Se bilaga «Lisätietoa seulontojen rekisteröinnistä»7.
Förebyggande av livmoderhalscancer: HPV-vaccin
- Tre HPV-vaccin som förebygger infektioner finns tillgängliga «Muñoz N, Manalastas R Jr, Pitisuttithum P ym. Safe...»58, «Paavonen J, Naud P, Salmerón J ym. Efficacy of hum...»59, «GlaxoSmithKline Vaccine HPV-007 Study Group., Roma...»60, «Muñoz N, Kjaer SK, Sigurdsson K ym. Impact of huma...»61, «European Medicines Agency. Cervarix. Procedural st...»62, «European Medicines Agency. Gardasil. Procedural st...»63, «Joura EA, Giuliano AR, Iversen OE ym. A 9-valent H...»64.
- Vaccinet förhindrar 93–100 % av de starka förstadieförändringar (histologisk HSIL), med de HPV-typerna som ingår i vaccinet, hos unga kvinnor som inte tidigare haft HPV-infektion «Sekä nelivalenttinen että kaksivalenttinen rokote antavat 93–100% ja ainakin 3–4 vuotta kestävän suojan kohdunkaulasyövän vahvoja esiasteita (HSIL) vastaan rokotettaessa teini-ikäisiä tyttöjä ja nuoria naisia, jotka eivät ole infektoituneet rokotusajankohtaan mennessä onkogeenisillä papilloomaviruksilla. Molempien rokotteiden teho on 30–44%, jos mukana on infektoituneita tutkittavia.»A, «Muñoz N, Manalastas R Jr, Pitisuttithum P ym. Safe...»58, «GlaxoSmithKline Vaccine HPV-007 Study Group., Roma...»60, «Rowhani-Rahbar A, Mao C, Hughes JP ym. Longer term...»66.
- Vaccinernas effekt på motsvarande starka förstadieförändringar (histologisk HSIL) är 30–44 %, då de vaccinerade även omfattar HPV-infekterade kvinnor «Sekä nelivalenttinen että kaksivalenttinen rokote antavat 93–100% ja ainakin 3–4 vuotta kestävän suojan kohdunkaulasyövän vahvoja esiasteita (HSIL) vastaan rokotettaessa teini-ikäisiä tyttöjä ja nuoria naisia, jotka eivät ole infektoituneet rokotusajankohtaan mennessä onkogeenisillä papilloomaviruksilla. Molempien rokotteiden teho on 30–44%, jos mukana on infektoituneita tutkittavia.»A, «Muñoz N, Manalastas R Jr, Pitisuttithum P ym. Safe...»58, «GlaxoSmithKline Vaccine HPV-007 Study Group., Roma...»60, «European Medicines Agency. Gardasil. Procedural st...»63, «Kjaer SK, Sigurdsson K, Iversen OE ym. A pooled an...»65.
- HPV-vaccin (både bi- och fyrvalenta) hindrar enligt studier som utförts i Finland och Sverige även livmoderhalscancer «Luostarinen T, Apter D, Dillner J ym. Vaccination ...»67, «Lei J, Ploner A, Elfström KM ym. HPV Vaccination a...»68.
- Vaccin har också en förebyggande effekt mot anogenitala HPV-infektioner och förstadieförändringar hos unga kvinnor och män «GlaxoSmithKline Vaccine HPV-007 Study Group., Roma...»60, «Harper DM, Franco EL, Wheeler CM ym. Sustained eff...»69, «Harper DM, Franco EL, Wheeler C ym. Efficacy of a ...»70, «Koutsky LA, Ault KA, Wheeler CM ym. A controlled t...»71, «Garland SM, Hernandez-Avila M, Wheeler CM ym. Quad...»72, «Ault KA, Future II Study Group. Effect of prophyla...»73, «FUTURE II Study Group. Quadrivalent vaccine agains...»74, «Palefsky J ym. HPV Vaccine against Anal HPV Infec...»75, «Giuliano AR, Palefsky JM, Goldstone S ym. Efficacy...»76.
- Bivalent vaccin har konstaterats ha effekt på prevalensen av HPV-infektioner i orofarynx «Lehtinen M, Apter D, Eriksson T ym. Effectiveness ...»77.
- Den bästa effekten har i allmänhet uppnåtts med ett skolbaserat vaccinationsprogram
och en tillräcklig vaccinationstäckning «HPV-rokotteen ottaminen kansalliseen rokoteohjelmaan vähentää tehokkaasti HPV:n aiheuttamia kohdunsuun vaikea-asteisia muutoksia sekä kondyloomia.»A.
- Kors- och flockskydd har också konstaterats enligt vaccinationstäckningen «Gertig DM, Brotherton JM, Budd AC ym. Impact of a ...»78, «Baldur-Felskov B, Dehlendorff C, Munk C ym. Early ...»79, «Pollock KG, Kavanagh K, Potts A ym. Reduction of l...»80, «Drolet M, Bénard É, Boily MC ym. Population-level ...»81, «Lehtinen M, Dillner J. Clinical trials of human pa...»82.
- Vaccinerna har konstaterats vara säkra «Muñoz N, Manalastas R Jr, Pitisuttithum P ym. Safe...»58, «GlaxoSmithKline Vaccine HPV-007 Study Group., Roma...»60, «WHO. Global Advisory Committee on Vaccine Safety, ...»83, «Arnheim-Dahlström L, Pasternak B, Svanström H ym. ...»84, «Scheller NM, Svanström H, Pasternak B ym. Quadriva...»85, «http://www.who.int/vaccine_safety/committee/GACVS_HPV_statement_17Dec2015.pdf»14, «Beibei L ym. Efficacy and Safety of Prophylactic V...»86, «Skufca J, Ollgren J, Artama M ym. The association ...»87.
- Hösten 2013 inleddes ett HPV-vaccinationsprogram i Finland som hösten 2020 utvidgades
till att omfatta även pojkar. Målbefolkningen är 10–12-åringar, flickor och pojkar
i årskurs 5–6.
- Vaccinationsprogrammets täckning har tillsvidare inte uppnått målnivån (över 80 %), utan den har per kommun och region stannat kring 60–70 %.
- Se vaccinationsregistret «https://www.thl.fi/roko/rokotusrekisteri/atlas/atlas.html?show=hpvraportit2015»15
- Läs mer om HPV-vaccin «Lisätietoa HPV-rokotteista»10.
- Vaccination av pojkar är också till nytta både på grund av flockskyddet och på grund av pojkarnas personliga nytta (t.ex. förebyggande av anal-, penis- och tonsillcancer) (THL-rapport 28/2011, THL-rapport 2019).
- Länkningsundersökningar är viktiga bland annat med tanke på en tillförlitlig studie av eventuella biverkningar av vaccin «Arnheim-Dahlström L, Pasternak B, Svanström H ym. ...»84, «Anttila A, Arbyn M, De Vuyst H, Dillner J, Dillner...»88.
Vaccin och screening
- Den nuvarande målåldern och definitionen av screeningintervall är tillsvidare valida även för vaccinerade, även om HPV-vaccinet ingår i vaccinationsprogrammet.
- Innan de vaccinerade ålderskohorterna uppnår screeningålder är det viktigt att utveckla och förnya screeningprogrammet «Herweijer E, Leval A, Ploner A ym. Association of ...»89, «Pollock KG, Kavanagh K, Potts A ym. Reduction of l...»90, «Kavanagh K, Pollock KG, Potts A ym. Introduction a...»91, «Lehtinen M, Nieminen P, Paavonen J. Pitäisikö Papa...»92.
Diagnostik, livmoderhalsen
- Diagnostiken av cell- och vävnadsförändringar i livmoderhalsen grundar sig på cytologi
(papaprov) eller HPV-test samt kompletterande kolposkopi och histologiska prover.
- Enbart på basis av ett cytologiskt fynd eller HPV-test är det inte möjligt att tillförlitligt fastställa karaktären och svårighetsgraden hos den underliggande förändringen. Se Histologisk klassificering av epitelförändringar «Lisätietoa epiteelimuutosten histologisesta luokituksesta»11.
- Om informationen som fåtts genom olika metoder (cytologi, kolposkopi, histopatologi) är motstridig, ska patienten följas upp eller diagnostiska åtgärder upprepas.
- Diagnostiken för slidan och de yttre könsorganen presenteras i punkterna Förstadieförändringar i slidan och Förstadieförändringar i de yttre könsorganen.
Gynekologisk cellprovtagning (papaprov)
Indikationer för cellprovtagning
- Om screening, se även «Irtosolukokeen osuvuus»12.
- Ett diagnostiskt papaprov ska tas när det finns en klinisk indikation, såsom
- upprepade blödningar vid samlag, mellanblödningar eller ihållande vitflytning, eftersom de kan vara symtom på livmoderhalscancer «Naisilla, joilla esiintyy yhdynnän jälkeistä veristä vuotoa, lienee kohonnut kohdunkaulansyövän ja CIN-riski.»C
- makroskopiska kondylom eller andra förändringar i livmodertappen
- långvariga besvär i slidan och de yttre könsorganen.
- individuella riskfaktorer beaktas (se punkten Risfaktorer).
- Testning av könssjukdomar och annan gynekologisk infektionsdiagnostik bör beaktas (se God medicinsk praxis-rekommendationen Seksitaudit «Seksitaudit»2 (på finska); Könssjukdomar, sexuellt överförda infektioner «Könssjukdomar, sexuellt överförda infektioner»3 (på svenska)) «Anttila T, Saikku P, Koskela P ym. Serotypes of Ch...»17, «Smith JS, Bosetti C, Muñoz N ym. Chlamydia trachom...»18.
- Det är inte befogat att ta papaprov av kvinnor under 20 år, eftersom HPV-infektionen hos symtomfria kvinnor i åldern 13–23 år varar i genomsnitt i 8 månader och till och med 90 % av infektionerna läker inom 2 år «HPV-infektion keskimääräinen kesto 13–23-vuotiailla naisilla on kahdeksan kuukautta ja jopa 90 % infektioista paranee kahdessa vuodessa.»B.
- Vid uppföljning av papaförändringar och efter behandling av förstadieförändringar är intervallet mellan proverna kortare än vid screening. Se separata anvisningar i punkten Åtgärder vid cell- och vävnadsförändringar i livmoderhalsen.
Cellprovtagning
- Praktiska aspekter på papaprovtagning «Papakokeen ottoon liittyviä käytännön näkökohtia»13.
- Screenings- eller uppföljningsprov tas helst inte i samband med menstruation eller
kliniskt konstaterad kolpit eller cervicit.
- Dessa symtom utgör dock inget hinder för provtagning om provet inte tillförlitligt
fås under de följande dagarna.
- Menstruationsblodet eller vitflytningen torkas bort före provtagningen.
- Graviditet, amning (eller hysterektomi) är inga hinder för provtagning.
- Det är också säkert att göra ett borstprov från livmoderhalskanalen oberoende av graviditetens längd.
- Dessa symtom utgör dock inget hinder för provtagning om provet inte tillförlitligt
fås under de följande dagarna.
Förhandsgranskning av och svar på cellprov
- I Finland används Bethesda 2014-klassificeringen «Nayar R, Wilbur, D. (Eds.) The Bethesda System for...»93, «Bethesda-systemet 2014 2...»6 i alla cytologiska rapporter om gynekologiska cellprov.
- Se mer information om förhandsgranskning av cellprovet «Irtosolunäytteen esitarkastus»14.
- Se mer information om cellprovssvar och Bethesda 2014-klassificeringen «Lisätietoa gynekologisen irtosolunäytteen vastaamisesta ja Bethesda –luokituksesta»15.
| Klassificering | Svar | Bild |
|---|---|---|
| Typ av prov | Utstrykspreparat, vätskepapa | |
| Provets representativitet | Tillräcklig | |
| Tillräcklig, cylinderceller saknas | ||
| Tolkning osäker (orsak) | ||
| Kan inte tolkas (orsak) | ||
| Allmän klassificering | Ingen epitelcellsatypi | |
| Epitelcellsatypi | ||
| Annan förändring, se utlåtande | ||
| Mikrober som avviker från det normala | Bakteriell vaginos, clue-celler | |
| Blandflora | ||
| Svamp | ||
| Actinomyces | ||
| Trichomonas vaginalis | ||
| Herpes | ||
| Reaktiva förändringar | Inflammation | «Tulehduksen aiheuttamia solumuutoksia irtosolunäytteessä»12 |
| Regeneration | «Regeneraatio irtosolunäytteessä»13 | |
| Bestrålningsförändring | ||
| Förändring orsakad av spiral | ||
| Andra icke-neoplastiska förändringar | Endometriala celler hos personer över 50 år | |
| Cylinderceller efter hysterektomi | ||
| Atrofi | ||
| Cytolys | ||
| Skivepitelatypi | ASC-US | «ASC-US irtosolunäytteessä»14 |
| ASC-H (HSIL-förändring kan inte uteslutas) | «ASC-H irtosolunäytteessä»15 | |
| LSIL (lindrig epitelskada)1 | «LSIL irtosolunäytteessä»16 | |
| HSIL (stark epitelskada) | «HSIL irtosolunäytteessä»17 | |
| Skivepitelkarcinom | «Levyepiteelikarsinooma irtosolunäytteessä»18 | |
| Cylinderepitel | AGC-NOS i endocervixcellerna, betydelsen oklar | «Lievä endocervixin lieriöatypia (AGC-NOS) irtosolunäytteessä»19 |
| AGC-FN i endocervixcellerna, misstanke om neoplasi | «Vahva endocervixin Endocervix (AGC-FN) irtosolunäytteessä»20 | |
| I endometriumceller, betydelsen oklar | ||
| I endometriumceller, misstanke om neoplasi | ||
| Ursprung kan inte fastställas, betydelsen oklar | ||
| Ursprung kan inte fastställas, misstanke om neoplasi | ||
| Adenokarcinom in situ | ||
| Adenokarcinom | ||
| Hormonpåverkan | Mognadsindex | |
| Motsvarar ålder och anamnes | ||
| Motsvarar inte ålder och anamnes (orsak) | ||
| Kan inte tolkas (orsak) | ||
| 1Ibland kan provet utöver det obestridliga LSIL-fyndet innehålla ett knapphändigt fynd
som tyder på en starkare förändring än så men som inte är diagnostisk med avseende
på HSIL. I en sådan situation kan fyndet rapporteras LSIL och ASC-H. 2Tabellen är en delvis anpassad version av de fall som rapporteras i Finland enligt gängse praxis. |
||

Tulehduksen aiheuttamia solumuutoksia irtosolunäytteessä
© Pekka Nieminen

Regeneraatio irtosolunäytteessä
© Pekka Nieminen

ASC-US irtosolunäytteessä
© Pekka Nieminen

ASC-H irtosolunäytteessä
© Pekka Nieminen

LSIL irtosolunäytteessä
© Pekka Nieminen

HSIL irtosolunäytteessä
© Pekka Nieminen

Levyepiteelikarsinooma irtosolunäytteessä
© Pekka Nieminen

Lievä endocervixin lieriöatypia (AGC-NOS) irtosolunäytteessä
© Pekka Nieminen

© Pekka Nieminen
Tolkning av svar på cellprov och därav följande åtgärder
- Cytologin är normal:
- Anges med diagnosen "Ingen epitelcellsatypi" eller NILM (negative for intraepithelial lesion or malignancy).
- Normal mjölksyrabakterieflora anges inte separat.
- Cellatypierna (både skiv- och cylindercellsatypierna) är alltid indikation för fortsatta
utredningar.
- Åtgärder orsakade av lindriga skivepitelförändringar (ASC-US, LSIL) presenteras för personer under 30 år i figur 1A «gvr00069a.pdf»1 och för personer som fyllt 30 år i figur 1B «gvr00069b.pdf»2 samt i tabell «Indikationer för kolposkopi och brådskandegrad...»7.
- Åtgärder orsakade av starka skivepitelförändringar (ASC-H, HSIL, cancer) presenteras i figur 2 «gvr00069d.pdf»4 och tabell «Indikationer för kolposkopi och brådskandegrad...»7.
- Åtgärder som orsakas av förändringar i cylindercellförändringar (AGC-NOS och AGC-FN) presenteras i tabell «Indikationer för kolposkopi och brådskandegrad...»7 och i figur 3 «gvr00069e.pdf»5.
- Se tilläggsinformation om åtgärder som orsakas av både skivepitelförändringar «Irtosolunäytevastauksen tulkinta ja sen aiheuttamat toimenpiteet levyepiteelisoluatypioissa»16, «Levyepiteeliatypiat indikaationa kolposkopiaan»17, «ASC-US-löydöksen jatkotutkimuksena voidaan käyttää toistettua sytologista tutkimusta tai korkean riskin papilloomavirusinfektion osoitusta HC II -menetelmällä, joista jälkimmäinen on sensitiivisempi. Suomalaiseen käytäntöön soveltuva vaihtoehto vähintään 35-vuotiailla naisilla on toistuvan ASC-US-löydöksen varmistus HC II -menetelmällä ennen kolposkopiaan lähettämistä.»A och cylindercellförändringar «Irtosolunäytevastauksen tulkinta ja sen aiheuttamat toimenpiteet lieriösoluatypioissa»18, «hrHPV-testi antaa lisähyötyä sytologiselle AGC-löydökselle.»B.
- Åtgärder orsakade av andra fynd som konstaterats i svaret på cellprovet (inte epitelcellsatypi) presenteras i tabell «Åtgärdsrekommendationer vid konstaterande av papafynd utan tydlig dysplasi...»8.
- I allmänhet kräver regenerationsfynd inga fortsatta åtgärder. Den starka regenerationen som syns i cellprovet kan dock likna adenokarcinom i livmoderhalsen. Därför kan cytologen ibland rekommendera uppföljningsprov eller kolposkopi i samband med regeneration «Nieminen P. Miten Papalausuntoa tulee lukea? Duode...»94.
| Indikation för kolposkopi | Brådskandegrad | |
|---|---|---|
| Makroskopisk misstanke om cancer | Genast (1–7 dygn) | |
| Cellförändringar: | Karcinom | Genast (1–7 dygn) |
| HSIL | Inom en månad | |
| LSIL1 | Enligt cytologens rekommendation1 | |
| ASC-H | Inom en månad | |
| Återkommande ASC-US (2–3 gånger under 12–24 månader) Återkommande ASC-US och hrHPV-positivitet hos kvinnor som fyllt 30 år |
Inom 6 månader | |
| Cylinderatypi i endocervix, misstanke om neoplasi (AGC-FN) eller AIS | Inom en månad | |
| Cylinderatypi i endocervix, betydelsen oklar (AGC-NOS) | Inom 2 månader eller enligt cytologens rekommendation2 | |
| Cylinderatypi i endometriumcellerna (om endometriumprovet och ultraljudsundersökningen inte klargör situationen) | Inom en månad | |
| Regeneration och cytologen rekommenderar kolposkopi | Enligt prövning | |
| Upprepad inflammatorisk förändring trots behandling (12 månader) | Enligt prövning | |
| Oklara blödningsbesvär: | Upprepade blödningar efter samlag | Enligt prövning |
| Menopausal blödning (först ultraljudsundersökning och endometriumprov) | Enligt prövning | |
| Återkommande hrHPV-positivitet under mer än 12 månader | Inom 6 månader | |
| Outredd blödning | Enligt prövning | |
| Långvariga besvär i slidan och de yttre könsorganen: | Kondylom | Enligt prövning |
| Deskvamativ vaginit (DIV = deskvamativ inflammatorisk vaginit) | Enligt prövning | |
| Sårig vulvovaginit | Enligt prövning | |
| Tumörer | Enligt prövning | |
| Sårighet | Enligt prövning | |
| 1Personer som fyllt 30 år hänvisas till kolposkopi som ska utföras senast efter 6 månader.
Personer under 30 år hänvisas för kolposkopi enligt cytologens rekommendation eller
om fyndet i uppföljningsprovet om 6–12 månader är ASC-US eller starkare. 2Enligt cytologens rekommendation eller om uppföljningsprovet inte är normalt efter 4–6 månader |
||
| Fynd | Åtgärd |
|---|---|
| Tillräcklig, cylinderceller saknas | Nytt prov efter övervägande |
| Osäker tolkning av provet | Nytt prov efter övervägande |
| Provet kan inte undersökas | Nytt prov |
| Förändringar utan epitelatypi: | |
| Infektion | Vid behov mikrobspecifik behandling och uppföljning enligt kliniskt behov eller enligt cytologens rekommendation |
| Regeneration | Vid behov uppföljningsprov eller kolposkopi enligt cytologens rekommendation |
| Atrofisk vaginit | Lokal östrogenbehandling rekommenderas, uppföljningsprov enligt cytologens rekommendation |
| Förändring orsakad av bestrålning | Uppföljningsprov efter 4–12 månader; kolposkopi om förändringen är stark eller återkommande; enligt cytologens rekommendation |
Cellprovets precision
- På grund av cellprovets karaktär är dess känslighet och noggrannhet inte idealiska.
- Undersökningens känslighet att identifiera förstadier till cancer är 30–90 % «Yksittäisen papakokeen sensitiivisyys ja spesifisyys lienee tyydyttävä.»B.
- Vid HSIL-förändringar är känsligheten och noggrannheten dock ca 90 % «HSIL-muutoksissa irtosolunäytteen sensitiivisyys ja spesifisyys on 90 % luokkaa.»B.
- Det cytologiska fyndet är inte nödvändigtvis diagnostiskt med avseende på den histologiska förändringen «Kinney WK, Manos MM, Hurley LB ym. Where's the hig...»95.
- Antalet fortsatta undersökningar beror i hög grad på nivån på de cytologiska undersökningarna, alltså bör särskild uppmärksamhet fästas vid kvalitetskontrollen.
- Laboratoriernas kvalitetscertifieringar kan vara till hjälp för detta.
Kolposkopi
- Med kolposkopi avses undersökning av livmoderhalsen, slidan och de yttre könsorganen
med en förstorande optisk apparat. Se tilläggsmaterial «Kolposkopian toteutuksesta»19. Kolposkopisten ska vara ändamålsenligt utbildad och gärna certifierad (se bilagan
«Suomen Kolposkopiayhdistyksen (SKY) myöntämä kolposkopiasertifikaatti (SKYKS)»20 om Finska Kolposkopiföreningens utbildningsprogram och certifikat).
- Kolposkopins känslighet för diagnostik av skivepitelatypier är 96 % och noggrannheten 48 % «Kolposkopian sensitiivisyys levyepiteeliatypioiden diagnostiikassa on 96 % ja spesifisyys on 48 %.»B.
- Kolposkopins noggrannhet förbättras när förändringens svårighetsgrad ökar «Mikäli tyydytään pelkkään kolposkopiaan ilman koepaloja, saattaa jopa 56 % mikroinvasiivisista ja 30 % invasiivisista muutoksista jäädä toteamatta.»B, «Lievien levyepiteelimuutosten vuoksi tehty normaali kolposkopialöydös on melko luotettava dysplasian poissulkemiseksi»B, «Persistoivissa HSIL-muutoksissa löytyy usein CIN 2 tai CIN 3, vaikka kolposkopia olisi normaali.»B.
- Resultatet av cellprovet ska vara känt före kolposkopin.
- Om resultatet av cellprovet är känt, förbättras kolposkopins noggrannhet då förändringens svårighetsgrad ökar «Jos irtosolukokeen tulos on tiedossa, kolposkopian tarkkuus paranee muutoksen vaikeusasteen lisääntyessä.»C.
- När resultatet av cellprovet och kolposkopin kombineras förbättras diagnostiken för histologiska HSIL- och svårare förändringar «Yhdistämällä irtosolukokeen ja kolposkopian löydökset keskivaikean tai vaikean dysplasian diagnostiikka parantuu.»B.
- I samband med kolposkopin tas vanligen vävnadsprov.
- Provtagningen behandlas i tilläggsmaterialet «Näytteen laatu»21.
- Vid en omfattande förändring rekommenderas att man tar flera vävnadsprov från områden som kolposkopiskt verkar allvarligast.
- Vid misstanke om en histologisk HSIL-förändring eller cylindercellförändring och förändringen sträcker sig till den inre delen av livmoderhalskanalen (transformationszon typ 3 (TZ 3)), rekommenderas i stället för biopsier provtagning med elektrisk slinga (select and treat) «Baldauf JJ, Dreyfus M, Ritter J ym. An analysis of...»96.
- I fall där man endast nöjt sig med kolposkopi utan provtagning har enligt studier upp till hälften av mikroinvasiva och en tredjedel av invasiva förändringar förblivit okonstaterade «Mikäli tyydytään pelkkään kolposkopiaan ilman koepaloja, saattaa jopa 56 % mikroinvasiivisista ja 30 % invasiivisista muutoksista jäädä toteamatta.»B.
- Om vävnadsprov inte tas ska orsaken alltid anges.
- Man ska komma ihåg möjligheten till en invasiv sjukdom och alltid ta ett biopsi- eller
konisationsprov med elektrisk slinga, om
- en histologisk förändring på HSIL-nivå eller svårare misstänks utgående från kolposkopin
- kolposkopifyndet verkar lindrigt men i cellprovet konstateras HSIL eller en svårare förändring
- förändringen är endocervikal. För mer information se «Kohdunkaulakanavan muutokset kolposkopiassa»22.
- Om patienten är postmenopausal eller om man i övrigt konstaterar slemhinneatrofi, lönar det sig att använda lokalt östrogen åtminstone 2 veckor före kolposkopin (arbetsgruppens åsikt). Lokalbehandling kan minska förekomsten av TZ 3 och stenosering efter ingreppet
- Internationella rekommendationer ger anvisningar för HIV-provtagning vid diagnos av minst en HSIL/CIN 2-förändring «HIV Indicator Conditions. http://hiveurope.eu/Fina...»97, «HIV-testing-guidelines-2020.pdf (bhiva.org) ...»98. Behandlingsresultaten av en förstadieförändring var också sämre och risken för återfall större för patienter med en icke-diagnostiserad HIV-infektion «Carlander C, Wagner P, van Beirs A ym. Suppressive...»99.
- HIV-testningen anses vara kostnadseffektiv om antalet icke-diagnostiserade HIV-positiva personer i befolkningen överstiger 0,1 % «HIV Indicator Conditions. http://hiveurope.eu/Fina...»97. Det torde alltså löna sig att ta testet i samband med kolposkopin åtminstone hos de kvinnor med invandrarbakgrund som kommer från länder där HIV-infektionen är vanlig «Carlander C, Marrone G, Brännström J ym. Assessing...»100.
Indikationer för kolposkopi
- Cylinder- och skivepitelcellförändringar i livmoderhalsen som indikationer för kolposkopi presenteras i tabell «Indikationer för kolposkopi och brådskandegrad...»7 och figurerna 1A «gvr00069a.pdf»1, 1B «gvr00069b.pdf»2, 2 «gvr00069d.pdf»4 och 3 «gvr00069e.pdf»5.
- Övriga indikationer för kolposkopi är
- återkommande hrHPV-positivitet vid primärscreening (kvinnor minst 30 år), beskrivs närmare i figur 1C «gvr00069c.pdf»3
- makroskopiska kondylom i livmodertappen
- makroskopisk misstanke om tumör oberoende av ålder
- upprepade blödningar efter samlag, mellanblödningar eller ihållande vitflytning, eftersom
de kan vara symtom på livmoderhalscancer «Naisilla, joilla esiintyy yhdynnän jälkeistä veristä vuotoa, lienee kohonnut kohdunkaulansyövän ja CIN-riski.»C
- Då görs enligt övervägande även en gynekologisk klinisk undersökning och ultraljudsundersökning. Även ett exfoliativt cellprov från livmoderhalsen samt ett prov på livmoderns slemhinna tas.
- återkommande inflammatorisk förändring som konstaterats i cellprovet trots behandling
eller upprepad stark regeneration
- Då utförs en kolposkopi efter övervägande enligt cytologens rekommendation «Irtosolunäytteessä todettuun toistuvaan tulehdusmuutokseen saattaa liittyä kohonnut kohdunkaulansyövän riski.»C.
- långvariga besvär i slidan och de yttre könsorganen.
- Läs mer «Lisätietoa Kolposkopian laatuvaatimuksista ja löydösten luokittelusta»23, «Levy- ja lieriöepiteelimuutokset irtosolunäytteessä kolposkopian aiheina»24, «ASC-US-löydöksen jatkotutkimuksena voidaan käyttää toistettua sytologista tutkimusta tai korkean riskin papilloomavirusinfektion osoitusta HC II -menetelmällä, joista jälkimmäinen on sensitiivisempi. Suomalaiseen käytäntöön soveltuva vaihtoehto vähintään 35-vuotiailla naisilla on toistuvan ASC-US-löydöksen varmistus HC II -menetelmällä ennen kolposkopiaan lähettämistä.»A, «Levyepiteeliatypiat indikaationa kolposkopiaan»17, «Histologiset LSIL-muutokset (CIN 1) paranevat usein itsestään ilman hoitoa muutaman vuoden seurannan aikana. Vain noin kymmenen prosenttia progessoituu HSIL-muutoksiksi.»A, «Rutiinimaisesta endoserviksi-näytteenotosta ei ilmeisesti ole hyötyä.»B, «Lieriöepiteelimuutokset kolposkopian aiheena»25, «Kohdunkaulansyövän riski on kohonnut hoidetun esiasteen jälkeen.»A.
Brådskandegrad av kolposkopi
- Se även tabell «Indikationer för kolposkopi och brådskandegrad...»7.
- Misstanke om cancer: genast
- Korrelationen mellan misstänkt invasion utgående från ett cellprov och histologiskt
konstaterad invasiv cancer är stor (positivt prognosvärde tydligt över 50 %) «Johnson SJ, Wadehra V. How predictive is a cervica...»101.
- HSIL:
- kolposkopi inom en månad från remitteringen. Se punkten Naturligt förlopp av förstadier till cancer samt tilläggsinformation «Levyepiteeliatypiat indikaationa kolposkopiaan»17.
- ASC-H:
- kolposkopi inom en månad från remitteringen
- LSIL:
- kolposkopi senast 6 månader från remitteringen. Se indikationer, «LSIL tai toistuva ASC-US irtosolunäytteessä (6–12 kuukauden välein otetuissa näytteissä) voi viitata vaikea-asteisemman muutoksen kehittymiseen.»A.
- upprepad ASC-US. Se indikationer.
- kolposkopi inom 6 månader från remitteringen «LSIL tai toistuva ASC-US irtosolunäytteessä (6–12 kuukauden välein otetuissa näytteissä) voi viitata vaikea-asteisemman muutoksen kehittymiseen.»A
- AGC-FN, misstanke om neoplasi i cylinderepitelceller:
- AGC-NOS, cylindercellsatypi av oklar betydelse
- återkommande hrHPV-positivitet inom 24 månader (dock tidigast 12 månader), även om
resultatet av papaprovet är normalt eller ASC-US.
- kolposkopi inom 6 månader från remitteringen.
- HSIL:
- Korrelationen mellan misstänkt invasion utgående från ett cellprov och histologiskt
konstaterad invasiv cancer är stor (positivt prognosvärde tydligt över 50 %) «Johnson SJ, Wadehra V. How predictive is a cervica...»101.
Genomförande av kolposkopi
- I patientjournalen ska antecknas
- orsak till remitteringen
- graden av cytologisk förändring
- beskrivning av kolposkopifynden enligt IFCPC:s (International Federation of Cervical Pathology and Colposcopy) klassificering genom att använda till exempel Swede score «Klassificering av kolposkopifynd enligt kolposkopiindexet Swede score...»9
- kolposkopisk diagnos, även i PAD-remissen
- gärna en (digital) bild av lesionen.
- Vid kolposkopi inriktas kontrollen framför allt på noggrann undersökning av transformationszonen (transformation zone, TZ) och junktionen av portio, men även andra delar av livmoderhalsen, livmoderhalskanalen, slidan och de yttre könsorganen kontrolleras.
- Transformationszonen delas in i tre typer enligt (IFCPC) klassificeringen; bild «Transformaatiovyöhykkeet»21
- typ I, TZ 1. Förändringsområdet (stort eller litet) är helt ektocervikalt. Hela junktionen är synlig.
- typ II, TZ 2. Förändringen ligger delvis i livmoderhalskanalen, men junktionen fås helt synlig. Ibland ingår även en stor eller en liten ektocervikal andel.
- typ III, TZ 3. Förändringen ligger delvis eller helt i livmoderhalskanalen, och junktionen fås inte helt synlig. Ibland ingår även en stor eller en liten ektocervikal andel
- En rutinmässig endocervixprovtagning (skrapning) har uppenbarligen ingen nytta «Rutiinimaisesta endoserviksi-näytteenotosta ei ilmeisesti ole hyötyä.»B.
- Läs mer om kolposkopi och dess kvalitetskrav «Lisätietoa kolposkopian luonteesta»26.
| Tolkning: 8 poäng eller mer tyder på HSIL (tid. CIN 2 eller svårare förändring) (känslighet 38 %, noggrannhet 95 %, positivt prognosvärde 83 % och negativt prognosvärde 70 %) «Bowring J, Strander B, Young M ym. The Swede score...»102, «Strander B, Ellström-Andersson A, Franzén S ym. Th...»103. |
|||
| 0 poäng | 1 poäng | 2 poäng | |
| Lesionens kanter | Otydliga eller fjuniga kanter, satelliter | Skarp men oregelbunden form, kantiga, skrovliga kanter, "kartliknande" | Skarpa, jämna eller avflagnande kanter. Lesionens inre kant |
| Färg | Transparent, lindrig ljushet | Genomsnittlig, mjölkaktig ljushet | Stark, grumlig, ljus, gråaktig, gulaktig |
| Blodkärl | Svag, regelbunden kärlsättning samt punktat eller mosaikism | Ingen kärlsättning | Grovt punktat eller mosaikism, oregelbundenhet |
| Förändringens storlek | < 5 mm | 5–15 mm eller 2 fjärdedelar | > 15 mm, 3 eller 4 fjärdedelar eller avgränsas endocervikalt |
| Jodfärgning | Brun | Fläckat eller svagt gul | Tydligt gul |

Transformaatiovyöhykkeet.
Lähde: Bentley J ym. Colposcopic Management of Abnormal Cervical Cytology and Histology. J Obstet Gynaecol Can 2012;34:1188-1202. Kuva julkaistaan hoitosuosituksessa Elsevier-kustantajan luvalla.
Histopatologisk undersökning
- Den histologiska undersökningen av de biopsiprover som tagits vid kolposkopin beskriver i allmänhet det verkliga tillståndet i livmodermunnen bättre än det cytologiska fyndet, men en diagnos som gjorts utgående från operationsproven (konus, livmoder) kan till och med i mer än en tredjedel av fallen avvika från kolposkopiprovdiagnosen «Heatley MK, Bury JP. The correlation between the g...»104.
- I den cytologiska och histologiska diagnostiken är undersökningsresultatet «Sytologisen ja histopatologisen tutkimuksen toistettavuus on yleisesti kohtuullisen hyvä, mutta lieväasteisissa muutoksissa heikko.»B.
- Kolposkopiproverna ska tas från det område där förändringen verkar starkast (se Klassificering av kolposkopifynd tabell «Klassificering av kolposkopifynd enligt kolposkopiindexet Swede score...»9). Se även tilläggsmaterialet «Lisätietoa epiteelimuutosten histologisesta luokituksesta»11 och «p16-immunohistokemiallisen tutkimuksen aihe ja tulkinta»27.
- En tillförlitlig histopatologisk undersökning kräver tillräckligt stora (över 3 mm)
prover.
- Även stroma eller stödvävnad ska ingå. Se även tilläggsmaterialet «Lisätietoa histopatologisesta tutkimuksesta kolposkopian yhteydessä»28.
- I PAD-utlåtandet ska uppges (särskilt när det gäller prov taget med elektrisk slinga)
- preparatets mått
- ifall preparatet innehåller junktion eller transformationszon
- störning i skivepitelmognaden eller övriga förändringar
- grad av mognadsstörning
- resektionsmarginaler eller om förändringen sträcker sig till resektionsytan
- det maximala djupet av en eventuell invasion och diametern på en invasiv komponent.
- cylindercellförändringar och i samband med dem även
- höjden på endocervikalt slemhinnesegment i preparatet (avstånd från junktion till kranial resektionsyta)
- om preparatet sträcker sig i djupled till kryptornas (körtlarnas) botten
- typ av cylinderförändring (ospecifik atypi, AIS, gastriskt AIS)
- resektionsmarginaler eller om förändringen sträcker sig till resektionsytan.
Åtgärder vid cell- och vävnadsförändringar i livmoderhalsen
- Vårdbeslutet ska fattas utifrån det sammanlagda resultatet av cytologi, kolposkopi
och histologi.
- Sjukdomens goda benägenhet att läka av sig själv ska beaktas, vilket innebär att vårdlinjen ofta kan vara konservativ.
- Behandlingen utförs alltid i kolposkopistyrning
- Vården av unga kvinnor kräver särskilt övervägande.
- I allmänhet ska den histologiska diagnosen vara klar före behandlingen (med undantag
av omedelbar behandling (select and treat)) och behandlingen görs alltid i kolposkopistyrning.
Omedelbar behandling kan i synnerhet hos kvinnor som inte fött orsaka fler onödiga
åtgärder än den behandling som genomförs efter biopsiresultaten «Välitön sähkösilmukkahoito (select and treat), on suositeltava hoitomuoto potilaille, joilla papakokeessa on todettu sytologinen HSIL-löydös ja kolposkopiassakolposkopisti toteaa high grade dysplasiaan sopivan muutoksen.»C.
- Omedelbar behandling (select and treat) kan göras om
- det i papaprovet konstateras en kraftig cellförändring (HSIL) och ett kolposkopiskt fynd motsvarar en stark förändring (HSIL)
- patienten har ett TZ 3- (junktionen syns inte i sin helhet) och HSIL- eller ASC-H-fynd.
- Omedelbar behandling görs om det finns en AGC-FN-förändring i papaprovet.
- Omedelbar behandling (select and treat) kan göras om
- Syftet med behandlingen är att avlägsna transformationszonen och förändringsområdet
i sin helhet.
- Det borttagna området lämnas in för histologisk bedömning (se punkten Histopatologisk undersökning), «Sähkösilmukkakonisaatio on suositeltavin eksisiotoimenpide dysplasia-muutosten hoidossa, sillä se mahdollistaa hyvän histologisen tutkimuksen.»A.
- Behandling som förstör vävnader (laservaporisation, kryobehandling) används endast om det finns särskilda skäl för det (se punkten Val av behandlingsmetod).
- Patienten måste ha histologisk HSIL-diagnos i biopsin eller i konus i > 85 % av behandlingarna. Se kvalitetskriterierna «Lisätietoa histopatologisesta tutkimuksesta kolposkopian yhteydessä»28.
- Kanterna på borttagen konus ska vara fria från den histologiska HSIL-förändringen till mer än 80 %. Se kvalitetskriterierna «Lisätietoa histopatologisesta tutkimuksesta kolposkopian yhteydessä»28.
- Behandlingen görs vanligen under lokalbedövning på polikliniken. Operationssal eller anestesi behövs endast i undantagsfall.
Indikationer för behandling och åtgärder
- Indikationer för behandling presenteras i figurerna 2 «gvr00069d.pdf»4, 3 «gvr00069e.pdf»5 och 4 «gvr00069f.pdf»6.
Skivepitelförändringar
- Histologisk LSIL-förändring, (tidigare CIN 1, innehåller förändringar, condyloma planum eller atypia condylomatosa),
figur 4 «gvr00069f.pdf»6.
- Förändringen behandlas i allmänhet inte, eftersom sannolikheten för spontan läkning är cirka 90 % (se punkten HPV-infektionens naturliga förlopp). Lindriga förstadier läker vanligtvis väl särskilt hos unga kvinnor (se punkten HPV-infektionens naturliga förlopp) «Irtosolunäytteessä todetuista HPV:een viittaavista muutoksista (ASC-US – LSIL) paranee keskimäärin 85-91 % keskimäärin 36-54 kuukauden seurannassa.»A, «Histologiset LSIL-muutokset (CIN 1) paranevat usein itsestään ilman hoitoa muutaman vuoden seurannan aikana. Vain noin kymmenen prosenttia progessoituu HSIL-muutoksiksi.»A, «HPV-infektion keskimääräinen kesto 13–23-vuotiailla naisilla on kahdeksan kuukautta ja jopa 90 % infektioista paranee kahdessa vuodessa.»B.
- Förändringen kan behandlas om histologisk LSIL persisterar i mer än 24 månader.
- Se uppföljningen i figur 4 «gvr00069f.pdf»6.
- Om cellprovet före den histologiska LSIL-förändringen var HSIL eller ASC-H, görs efter 6 månader en ny kolposkopi och ett hrHPV-test och papaprov. Se figur 2 «gvr00069d.pdf»4.
- Om kolposkopin är otillfredsställande, TZ3 (junktionen är inte synlig), ska histologiska LSIL behandlas med konisation med elektrisk slinga för att utesluta en starkare förändring.
- Se även Avstå klokt-rekommendationen «Kohdunkaulan lievien solumuutosten (LSIL / CIN1) hoito»29: Undvik behandling av LSIL-förändringar i livmoderhalsen (CIN1), eftersom dessa infektionsförändringar ofta läker av sig själva utan behandling under några års uppföljning.
- Histologisk HSIL-förändring:
- Behandling är motiverad eftersom spontan läkning är mer sällsynt och sannolikheten för progression är större. Se punkten Naturligt förlopp av förstadier till cancer «Nuoremmilla naisilla spontaani paranemistaipumus on suurempi ja heillä 3 kuukauden – vuoden aikana HSIL -muutoksista paranee seurannassa 20-71%.»B, «Vahvoissa esiastemuutoksissa (HSIL /aiemmin CIN 3, dysplasia gravis, Ca in situ) syöpäriskiksi on arvioitu olevan ainakin 12 %.»B.
- Om kolposkopi är otillfredsställande (junktionen är inte synlig, TZ 3) är excision den enda godtagbara behandlingsmetoden, helst loop-behandling (select and treat).
- Återfall av histologisk HSIL-förändring (CIN 2–3) behandlas med excision, helst med loop-behandling.
- Histologisk HSIL hos unga kvinnor under 31 år, som kontrollerat motsvarar den tidigare CIN 2-förändringen och sträcker sig till högst två av fyra segment, kan lämnas obehandlad. Dessa patienter ska följas upp noggrant med 6 månaders mellanrum i högst 2 års tid. I denna patientgrupp har CIN 2-förändringarna en 60 procents sannolikhet för regression «Tainio K, Athanasiou A, Tikkinen KAO ym. Clinical ...»105.
- Den behandlade histologiska HSIL-förändringen fortsätter till konuspreparatets kanter.
- Patienten följs upp i allmänhet med hrHPV-test och papaprov i stället för omedelbar ny behandling «HPV-positiivisuus hoidon jälkeen ennustaa ilmeisesti hoidon epäonnistumista paremmin kuin konuksen reunoihin ulottuva esiastemuutos.»B. Se punkten Uppföljning.
- Risken för residual eller återfall har ökat (i ektocervikala 5 %, i endocervikala
12 %), eller dysplasin sträcker sig till alla marginaler (22 %) «HPV-positiivisuus hoidon jälkeen ennustaa ilmeisesti hoidon epäonnistumista paremmin kuin konuksen reunoihin ulottuva esiastemuutos.»B.
- hrHPV-testet är känsligare för att visa återfall än papaprovet «hrHPV-testin käyttö hoidon jälkeisessä seurannassa lisää herkkyyttä todeta residuaali tai uusiutunut esiastemuutos pelkkään sytologiaan verrattuna»A. Det finns inga bevis på kolposkopins betydelse i uppföljningen och den är inte nödvändig om hrHPV-testet är negativt efter behandlingen.
- Om patienten inte längre har några önskemål om graviditet och den histologiska HSIL-förändringen
sträcker sig till den endocervikala operationsytan eller alla operationsytor, kan
man överväga en ny behandling med elektrisk slinga «HPV-positiivisuus hoidon jälkeen ennustaa ilmeisesti hoidon epäonnistumista paremmin kuin konuksen reunoihin ulottuva esiastemuutos.»B.
- Om patienten inte längre har några önskemål om graviditet, HPV-testet är upprepat positivt och TZ 3 kan en ny behandling med elektrisk slinga övervägas «HPV-positiivisuus hoidon jälkeen ennustaa ilmeisesti hoidon epäonnistumista paremmin kuin konuksen reunoihin ulottuva esiastemuutos.»B.
- Om patienten är över 50 år och den histologiska HSIL-förändringen sträcker sig ända till områdets kant i upprepade prov tagna med elektrisk slinga, övervägs hysterektomi «Dysplasian uusiutumisriski kasvaa iän noustessa.»B.
Cylindercellförändringar
- I cellprovet finns AGC-NOS, cylindercellsatypi med oklar betydelse i livmoderhalskanalen «Lievä endocervixin lieriöatypia (AGC-NOS) irtosolunäytteessä»19 och inga fynd konstateras i kolposkopin, hrHPV-testet och provbitarna.
- hrHPV-test och papaprov efter 12 månader rekommenderas. Om båda är negativa kan patienten övergå till masscreening «Massad LS, Einstein MH, Huh WK ym. 2012 updated co...»106.
- Om AIS konstateras i kolposkopin behandlas det med elektrisk slinga. Med tanke på konusens storlek bör man sträva efter ett djup på över 15 mm för att mer sannolikt nå förändringsområdet i sin helhet. Figur 3 «gvr00069e.pdf»5. Om patienten inte har önskemål på graviditet är den rekommenderade behandlingen därefter hysterektomi.
- I cellprovet konstateras AGC-FN, cylindercellsatypi i livmoderhalskanalen, på basis av vilken man misstänker neoplasi,
men i kolposkopin konstateras inget specifikt fynd.
- Behandlingen är diagnostisk behandling med elektronisk slinga «Jos kohdunsuun irtosolunäytteessä todetaan endoserviksin lieriöepiteelimuutokset ja epäily neoplasiasta, suositellaan diagnostisena toimenpiteenä sähkösilmukkahoitoa, vaikkei kolposkopiassa todetakaan diagnostisia muutoksia.»C, figur 3 «gvr00069e.pdf»5.
- Adenokarcinom in situ (AIS) behandlas alltid «Adenokarsinooma in situ (AIS) hoidetaan aina.»A, «Adenokarsinooma in situ (AIS) -diagnoosi varmistetaan konisaatiolla.»B, «Jos fertiliteetti halutaan säilyttää, voidaan adenokarsinooma in situ (AIS) hoitaa konisaatiolla, kunhan konisaatin marginaalit ja endoservikaalinen näyte ovat tautivapaat.»A, «AIS:n ensisijainen hoito on kohdun poisto, ellei fertiliteettiä haluta säilyttää.»B. Om patienten inte har önskemål på graviditet är den rekommenderade behandlingen
hysterektomi efter diagnostisk behandling med loop-konisation.
- Om beslut fattas om fertilitetssparande behandling får AIS-förändringen inte nå konus operationsytor (positiva marginaler). I denna situation ska behandlingen med elektrisk slinga upprepas så att operationsytorna är fria från sjukdomen «Salani R, Puri I, Bristow RE. Adenocarcinoma in si...»107, «Baalbergen A, Helmerhorst TJ. Adenocarcinoma in si...»108, «Teoh D, Musa F, Salani R ym. Diagnosis and Managem...»109.
- Det rekommenderas att vårdlinjen för AIS-förändringar som är oberoende av HPV beslutas på ett multiprofessionellt vårdmöte.
Alternativa och kontraindikativa behandlingsmetoder
- Omedelbar behandling, det vill säga s.k. "Se och behandla" (see and treat)-metoden vid kolposkopi, ska inte användas rutinmässigt, eftersom den leder till för många onödiga behandlingar «”See and treat” ei ole hyväksyttävä hoitomenetelmä rutiinikäytössä, jos potilaalla on papakokeessa sytologinen LSIL-löydös, koska siitä seuraa liikaa turhia hoitoja.»A, «Lisätietoa välittömästä hoidosta (select and treat)»30.
- Behandling som förstör vävnader (laservaporisation, kryobehandling) används endast om det finns särskilda skäl för det. Se tilläggsmaterial «Lisätietoa välittömästä hoidosta (select and treat)»30.
- Podofyllin och podofyllintoxin ska inte användas vid behandling av slidan och livmoderhalsen.
- Hysterektomi ska inte användas som primär behandling (med undantag av AIS), om det inte också finns andra orsaker till detta «AIS:n ensisijainen hoito on kohdun poisto, ellei fertiliteettiä haluta säilyttää.»B, «Hysterektomiaa ei suositella ensisijaisena CIN:n hoitona.»B.
Behandling av återkommande förändringar i epitelcellerna efter behandling
- Vårdbehovet avgörs av förändringens svårighetsgrad. Se punkten Behandlingsindikationer.
- Vid behandling av återkommande HSIL-sjukdom är excision den enda godtagbara metoden, helst behandling med elektrisk slinga «Anderson MC. Invasive carcinoma of the cervix foll...»110.
Behandlingskomplikationer
- Smärta under ingreppet:
- Under ingrepp i livmodermunnen upplever 2–18 % av patienterna kraftig smärta «Martin-Hirsch PP, Paraskevaidis E, Bryant A ym. Su...»111, «Berget A, Andreasson B, Bock JE ym. Outpatient tre...»112, «Townsend DE, Richart RM. Cryotherapy and carbon di...»113, «Gunasekera PC, Phipps JH, Lewis BV. Large loop exc...»114, «Oyesanya OA, Amerasinghe CN, Manning EA. Outpatien...»115.
- Blödning under ingreppet:
- Alla åtgärdstekniker är förknippade med blödning som stör ingreppet hos 2–12 % av patienterna «Martin-Hirsch PP, Paraskevaidis E, Bryant A ym. Su...»111, «Berget A, Andreasson B, Bock JE ym. Outpatient tre...»112, «Bostofte E, Berget A, Falck Larsen J ym. Conizatio...»116, «Kristensen GB, Jensen LK, Hølund B. A randomized t...»117, «Partington CK, Turner MJ, Soutter WP ym. Laser vap...»118.
- Blödningen i samband med ingreppet kan minskas med god åtgärdsteknik och med vasokonstriktor
som kombinerats till bedövningsmedlet.
- Vasopressin minskar blödningen under ingreppet «Martin-Hirsch PL, Kitchener H. Interventions for p...»119.
- Det finns inte tillräckligt med evidens för att tranexamsyra skulle ha effekt på primärblödningen «Martin-Hirsch PL, Kitchener H. Interventions for p...»119.
- Blödning efter ingreppet:
- Förlängd blödning efter behandling av livmodermunnen förekommer hos mindre än 1–15 % av patienterna. De olika ingreppen skiljer sig sannolikt inte från varandra i fråga om blödningsrisken «Martin-Hirsch PP, Paraskevaidis E, Bryant A ym. Su...»111, «Santesso N, Mustafa RA, Wiercioch W ym. Systematic...»120.
- Vitflytning efter ingreppet:
- Bäckeninflammation (pelvic inflammatory disease, PID) är en sällsynt komplikation i samband med ingreppet «Santesso N, Mustafa RA, Wiercioch W ym. Systematic...»120, «Ferenczy A. Comparison of cryo- and carbon dioxide...»121.
- Förträngning av livmoderhalsen har påträffats hos 2–37 % «Hoidon komplikaatiot ja kohdunkaulan ahtautuminen»31.
Behandlingens inverkan på den reproduktiva hälsan
- Behandlingarna påverkar inte fertiliteten «Kohdunkaulan hoidot eivät vähennä hedelmällisyyttä.»C.
- Inverkan på senare graviditeter:
- Behandlingarna kan öka risken för prematur förlossning «LEEP-hoito voi ilmeisesti lisätä ennenaikaisen synnytyksen riskiä.»B. Den behandlade vävnadsbitens volym och djup påverkar risken för prematuritet «Ennenaikaisuuden riski lisääntyy poistetun kudospalan suuruuden lisääntyessä.»C.
Prognos vid cell- och vävnadsförändringar i livmoderhalsen
Risk för utveckling av förstadium eller cancer efter behandling
- Risken för att insjukna i livmoderhalscancer är 2–5 gånger större jämfört med befolkningens genomsnittliga incidens «Kalliala I, Athanasiou A, Veroniki AA ym. Incidenc...»122, «Kohdunkaulansyövän riski on kohonnut hoidetun esiasteen jälkeen.»A.
- Cirka 60 % av persistenta fall och återfall konstateras inom de första 24 månaderna efter behandlingen «Noin 60 %, persistenssistä tai rekurrenssistä, todetaan ensimmäisen 2 vuoden aikana hoidon jälkeen.»B.
- Risken ökar med åldern «Dysplasian uusiutumisriski kasvaa iän noustessa.»B.
- hrHPV-testet är det känsligaste testet för att visa återfall efter behandling «hrHPV-testin käyttö hoidon jälkeisessä seurannassa lisää herkkyyttä todeta residuaali tai uusiutunut esiastemuutos pelkkään sytologiaan verrattuna»A, «Saman HPV-genotyypin persistointi ennen ja jälkeen hoidon lisää dysplasian residivointiriskiä.»B.
- Återfall är något sannolikare i behandlade cylinderatypier än vid kraftiga skivepitelförändringar. Dessutom kan cylindercellförändringar återkomma även efter en mycket lång tid «Cuschieri K, Bhatia R, Cruickshank M ym. HPV testi...»123, «Costa S, Venturoli S, Negri G ym. Factors predicti...»124.
- Oavsett förstadium är risken avsevärt större ännu 20 år efter behandlingen «Kohdunkaulansyövän riski on kohonnut hoidetun esiasteen jälkeen.»A
- Det finns inte tillräckligt med information om HPV 16/18-genotypning i uppföljningen
av behandlingen.
- Risken för återfall hos HPV 16-positiva kvinnor är 66 % under 5 års uppföljning
- Även för hr-HPV-positiva men HPV 16-negativa kvinnor är risken för återfall 29 % «Kocken M, Helmerhorst TJ, Berkhof J ym. Risk of re...»125.
- Risken för vaginal karcinom och vulvakarcinom har också ökat hos kvinnor som behandlats för förstadieförändring «Kalliala I, Athanasiou A, Veroniki AA ym. Incidenc...»122, «Kohdunkaulansyövän riski on kohonnut hoidetun esiasteen jälkeen.»A, «Noin 60 %, persistenssistä tai rekurrenssistä, todetaan ensimmäisen 2 vuoden aikana hoidon jälkeen.»B.
Uppföljning, livmoderhalsen
Uppföljning efter behandling med elektrisk slinga
- Alla behandlade patienter ska följas upp med hrHPV-test och papaprov på grund av risken för återfall av cellförändringar.
- Hur länge uppföljningen pågår och hur den genomförs beror på hur svår den behandlade
förändringen är.
- Uppföljningen efter behandlade histologiska LSIL- och HSIL-förändringar presenteras i figur 5 «gvr00069g.pdf»7.
- Uppföljningen efter behandlad AIS-förändring presenteras i figur 6 «gvr00069h.pdf»8.
- En kolposkopi ger sannolikt inget mervärde för uppföljningen efter behandlingen i förhållande till hrHVP-testet och papaprovet och rekommenderas inte vid rutinmässig uppföljning efter behandling «Heinonen A, Jakobsson M, Kiviharju M ym. Role of C...»126.
- Om förändringen fortsätter till kanten av den avlägsnade vävnadsbiten förknippas detta med en ökad risk för återfall av HSIL-förändringen, men hrHPV-positivitet är känsligare än marginalpositivitet för identifiering av fall där patienten löper återfallsrisk «Arbyn M, Redman CWE, Verdoodt F ym. Incomplete exc...»127.
- Det finns inte tillräckligt med information om HPV 16/18-genotypning i uppföljningen
av behandlingen.
- Recidivrisken hos HPV 16-positiva kvinnor är 66 % under 5 års uppföljning.
- Även för hr-HPV-positiva men HPV 16-negativa kvinnor är risken för återfall 29 % «Kocken M, Helmerhorst TJ, Berkhof J ym. Risk of re...»125.
- I fortsättningen får intervallet mellan papaproverna eller hrHPV-testerna inte överstiga 5 år och uppföljningen bör fortsätta i minst 20 år även om den fortsätter efter 65 års ålder «Strander B, Andersson-Ellström A, Milsom I ym. Lon...»128.
- Uppföljningsenheten bestäms enligt de regionala anvisningarna, men arbetsgruppen rekommenderar att det första uppföljningsbesöket görs vid den enhet som ansvarat för vården «Lisätietoa loop-hoidon jälkeisestä seurannasta»32.
- Efter en hysterektomi görs uppföljningen enligt samma anvisningar.
Uppföljning efter diagnostisk kolposkopi (ingen behandling med elektrisk slinga)
- Uppföljningen efter en diagnostisk kolposkopi presenteras i figurerna:
- efter lindriga skivepitelförändringar (se figur 1A «gvr00069a.pdf»1, figur 1B «gvr00069b.pdf»2)
- efter starka skivepitelförändringar (se figur 2 «gvr00069d.pdf»4)
- efter LSIL (CIN 1)-förändring (se figur 4 «gvr00069f.pdf»6), se även tilläggsmaterialet «Lisätietoa seurannasta kohdunkaulan lievien solumuutosten johdosta tehdyn diagnostisen kolposkopian jälkeen, kun loop-hoitoa ei tehdä»33.
- Det finns inte tillräcklig forskningsevidens om återfall av oförklarlig svår cellförändring
(HSIL eller stark cylindercellsatypi).
- Gemensamma möten med kolposkopisten och patologen är då nödvändiga. Se kvaliteten på kolposkopi «Lisätietoa Kolposkopian laatuvaatimuksista ja löydösten luokittelusta»23.
- För att utesluta cellförändringar i slidan bör kolposkopi med noggrann jodfärgning vara utförd.
- I allmänhet rekommenderas diagnostisk behandling med elektrisk slinga och tilläggsprover.
Recidiverande hrHPV-positivitet efter diagnostisk kolposkopi utan histologiskt konstaterad förändring
- Uppföljning av recidiverande hrHPV-positivitet efter normal kolposkopi rekommenderas att förverkligas enligt figur 1B «gvr00069b.pdf»2. Uppföljningen genomförs årligen med hrHPV-test och papaprov och uppföljningskolposkopi görs 2,5 år efter den första kolposkopin, om det inte finns anledning att utföra den redan tidigare utgående från papasvaret «Elfgren K, Elfström KM, Naucler P ym. Management o...»129.
- Särskilt en typspecifik persisterande hrHPV-infektion verkar öka risken för en förstadieförändring i uppföljningen. HPV-genotypning kan övervägas som en del av uppföljningen hos hrHPV-positiva kvinnor med normalt papaprovresultat «Elfgren K, Elfström KM, Naucler P ym. Management o...»129.
- Om hrHPV-positiviteten upprepas i minst 4 år utan avbrott och i synnerhet om samma
genotyp konstateras upprepade gånger kan diagnostisk loop-behandling övervägas.
- Vid behov kan loop-behandling övervägas redan tidigare, om inte transformationszonen är helt synlig «Elfgren K, Elfström KM, Naucler P ym. Management o...»129.
Specialsituationer, livmoderhalsen
Graviditet
- Se figur 7 «gvr00069i.pdf»9.
- Under graviditeten förekommer lika många förändringar i cellprovet som i medeltal hos befolkningen i samma ålder «Palle C, Bangsbøll S, Andreasson B. Cervical intra...»130.
- ASC-US i cellprov:
- Uppföljningsprov tas efter förlossningen.
- LSIL i cellprov:
- Hos kvinnor under 30 år tas ett nytt cellprov efter förlossningen.
- För kvinnor som fyllt 30 år (arbetsgruppens rekommendation) görs en kolposkopi under graviditeten eller senast 2–3 månader efter förlossningen enligt läkarens övervägande «Raskauden aikainen kolposkopiaa edellyttävä muutos (LSIL tai vahvempi) on syytä kontrolloida kolposkooppisesti 6–12 viikon kuluttua synnytyksestä.»C och «CIN 2–3 -tasoisten muutosten progressio raskauden aikana on harvinaista, ja muutoksen spontaanin regression todennäköisyys on suuri.»B. Uppföljningskolposkopin rekommenderas 2–3 månader efter förlossningen om en förändring som förutsätter kolposkopi har konstaterats under graviditeten (LSIL > hos 30-åringar eller ASC-H, HSIL).
- Om histologisk LSIL konstateras i kolposkopi rekommenderas kolposkopiuppföljning 2–3 månader efter förlossningen.
- LSIL som kolposkopisk diagnos:
- Biopsi rekommenderas inte.
- HSIL eller cylindercellförändring i cellprovet:
- Kolposkopi utförs för att utesluta invasion.
- HSIL i histologiskt prov:
- Uppföljningskolposkopi och cellprov tas under graviditetsvecka 30–32 och behandlingen genomförs 2–3 månader efter förlossningen.
- Sannolikheten för spontan läkning är stor, 40–70 %, och det är sällsynt att förändringen framskrider under graviditeten «Economos K, Perez Veridiano N, Delke I ym. Abnorma...»131, «Coppola A, Sorosky J, Casper R ym. The clinical co...»132, «Serati M, Uccella S, Laterza RM ym. Natural histor...»133, «Flannelly G. The management of women with abnormal...»134, «Hunter MI, Monk BJ, Tewari KS. Cervical neoplasia ...»135, «CIN 2–3 -tasoisten muutosten progressio raskauden aikana on harvinaista, ja muutoksen spontaanin regression todennäköisyys on suuri.»B.
- Under graviditeten bör konisation (elektrisk slinga) begränsas till situationer där
en invasiv förändring inte kan uteslutas «Konisaatio hoidollisena toimenpiteenä raskauden aikana tulisi rajoittaa vain tilanteisiin, joissa ei voida poissulkea invasiivista muutosta.»B.
- Risken för komplikationer (blödning, prematur förlossning) i samband med konisation ökar under graviditeten «Sadler L, Saftlas A, Wang W ym. Treatment for cerv...»136.
- Skrapningsprov av livmoderhalsen ska inte tas under graviditeten.
HIV-positivitet
- Hos HIV-positiva kvinnor är förekomsten av cellförändringar i livmodermunnen cirka 3-faldig jämfört med HIV-negativa kvinnor «HIV-positiivisilla naisilla kohdunsuun solumuutosten esiintyvyys on noin 3-kertainen HIV-negatiivisiin naisiin verrattuna. Kuitenkaan riski saada histologinen HSIL-muutos 5 vuoden seurannassa ei ole suurentunut HIV-negatiivisiin naisiin verrattuna, mikäli papakoe ja hrHPV-testi ovat negatiivisia lähtötilanteessa.»A.
- Risken för en histologisk HSIL-förändring i en 5 års uppföljning har dock inte ökat jämfört med HIV-negativa kvinnor om papaprovet och hrHPV-testet är negativa i utgångsläget.
- Kvinnor under 30 år (se figurerna 1A «gvr00069a.pdf»1, 2 «gvr00069d.pdf»4, 3 «gvr00069e.pdf»5, 4 «gvr00069f.pdf»6):
- Ett papaprov görs i samband med HIV-diagnosen. Om resultatet är normalt görs provet årligen i 3 år, varefter man övergår till ett 3 års screeningintervall.
- För kvinnor som har varit HIV-positiva sedan barndomen bör papaprov göras ett år efter att samlag inletts eller senast vid 21 års ålder.
- Om resultatet av papaprovet är ASC-US och hrHPV-testet är positivt, utförs en kolposkopi.
- Om resultatet av papaprovet är ASC-US och inget hrHPV-test görs, rekommenderas ett nytt papaprov efter 6–12 månader och om resultatet blir ASC-US eller en starkare förändring programmeras kolposkopi.
- Om ett cellprov visar LSIL eller en starkare förändring programmeras kolposkopi.
- 30 är fyllda kvinnor (se figurerna 1B «gvr00069b.pdf»2, 2 «gvr00069d.pdf»4, 3 «gvr00069e.pdf»5, 4 «gvr00069f.pdf»6):
- I samband med HIV-diagnosen tas ett papaprov och därefter årligen i 3 år. Om även hrHPV-testet görs och resultatet är negativt kan man gå direkt till ett 3 års screeningintervall (dvs. ett mellantest mellan femårsscreeningen). Om resultatet av hrHPV-testet är positivt och papaprovet negativt görs ett hrHPV-test om ett år.
- Om ett cellprov visar ASC-US utan HPV-testning görs ett uppföljningsprov efter 6–12 månader.
- Om ett cellprov visar LSIL eller en starkare förändring programmeras kolposkopi.
- Enligt den europeiska rekommendationen bör kolposkopier hos HIV-positiva kvinnor koncentreras till enheter som är specialiserade på behandling av HIV-infektioner «Arbyn M, Anttila A, Jordan J ym. European guidelin...»44.
- Cellförändringar i livmoderhalsen behandlas på samma sätt som hos HIV-negativa kvinnor.
- Se tilläggsinformation «Papa-seuranta ja kolposkopian indikaatiot HIV-positiivisilla naisilla»34. Se även evidensöversikten «Antiviraalisella lääkityksen (HAART-hoidon) vaikutus HIV-positiivisten potilaiden HPV-infektion ja kohdunkaulakanavan solumuutosten luonnolliseen kulkuun on epäselvä.»B.
- HPV-vaccinet är säkert och orsakar immunologisk respons hos HIV-positiva kvinnor och män. Immunologiska responsen kan vara kraftigare om CD4-nivån är hög. Profylaktiskt HPV-vaccin rekommenderas för alla 13–27-åriga HIV-positiva kvinnor och män «Kojic EM, Kang M, Cespedes MS ym. Immunogenicity a...»137, «Rainone V, Giacomet V, Penagini F ym. Human papill...»138, «Money DM, Moses E, Blitz S ym. HIV viral suppressi...»139.
Immunsuppressiva patienter (annat än HIV)
- Immunsuppressiva patienter löper en förhöjd risk att få förstadieförändringar till livmoderhalscancer samt livmoderhalscancer. En ökad risk har konstaterats hos transplantationspatienter samt hos patienter med en inflammatorisk tarmsjukdom eller reumatiska sjukdom med immunsuppressiv medicinering samt hos SLE-patienter.
- Vid typ I-diabetes är forskningsevidensen för förhöjd risk för livmoderhalscancer bristfällig.
- I den systematiska översikten som publicerades 2019 «Moscicki AB, Flowers L, Huchko MJ ym. Guidelines f...»140 rekommenderar den amerikanska expertpanelen en tätare screening av livmoderhalscancer för organtransplantationspatienter, personer med inflammatorisk tarmsjukdom som får immunsuppressiv medicinering, SLE-patienter samt reumapatienter med immunsuppressiv medicinering.
- För dessa patienter rekommenderas samma uppföljning som för HIV-positiva kvinnor (dvs.
ett mellantest mellan femårsscreeningar). Om uppföljningen inleds innan masscreeningarna
börjar (< 30 års ålder), görs ett papaprov i början av uppföljningen årligen under
3 år, varefter man kan övergå till ett 3 års screeningintervall.
- Om immunsuppressiv medicinering har inletts före 21 års ålder rekommenderas screening ett år efter att sexuallivet har börjat.
- För patienter med inflammatorisk tarmsjukdom och reumapatienter som inte har immunsuppressiv medicinering samt för diabetiker rekommenderas uppföljning enligt screeninganvisningarna för normalbefolkningen.
Förstadieförändringar i slidan
Riskfaktorer och naturligt förlopp
- Riskfaktorerna är desamma som vid förstadieförändringar i livmoderhalsen «Daling JR, Madeleine MM, Schwartz SM ym. A populat...»141. Se punkten Riskfaktorer.
- HPV med hög risk ligger bakom kraftiga förstadieförändringar i slidan i 96 % av fallen. De vanligaste är HPV 16 och 18 «Alemany L, Saunier M, Tinoco L ym. Large contribut...»142.
- Förstadieförändringar i slidan och livmoderhalsen samt i de yttre könsorganen förekommer ofta samtidigt. Se punkten Cancer i slidan och yttre könsorganen.
- Efter den behandlade förstadieförändringen i livmoderhalsen har risken för cancer i slidan ökat «Kalliala I, Anttila A, Pukkala E ym. Risk of cervi...»49.
- Tidigare strålbehandling i bäckenområdet ökar risken för förstadieförändringar i slidan «Rome RM, England PG. Management of vaginal intraep...»143, «Sillman FH, Fruchter RG, Chen YS ym. Vaginal intra...»144.
- Det naturliga förloppet är dåligt känt «dVIN:n malignisoitumisriski on suurempi kuin vulvan HSIL (uVIN):n.»B.
- Över hälften av förstadieförändringarna i slidan läker uppenbarligen av sig själva. Sannolikheten är större vid lindriga förändringar «Yli puolet emättimen esiastemuutoksista (histologinen LSIL-HSIL) saattaa parantua spontaanisti, todennäköisyyden ollessa selvästi suurin lievissä muutoksissa.»C.
- Hos knappt 10 % av de patienter som har en kraftig förstadieförändring i slidan (tidigare VAIN 3) kan cancer i slidan utvecklas under uppföljningen. Material från studier i ämnet har varit knapphändigt och uppföljningstiderna har varit korta «Potilailla, joilla on vahva emättimen esiastemuutos (histologinen HSIL), saattaa seurannassa kehittyä emättimen syöpä vajaassa 10 %:ssa.»C.
Klinisk bild och diagnostik
- Förstadierna hittas i allmänhet i en kolposkopi som gjorts på grund av avvikande resultat i cellprovet.
- Ungefär hälften av förändringarna är multifokala «Diakomanolis E, Stefanidis K, Rodolakis A ym. Vagi...»145, «Dodge JA, Eltabbakh GH, Mount SL ym. Clinical feat...»146, «Jentschke M, Hoffmeister V, Soergel P ym. Clinical...»147.
- Ungefär 80 % av förändringarna finns i fornix vaginae «Diakomanolis E, Stefanidis K, Rodolakis A ym. Vagi...»145, «Dodge JA, Eltabbakh GH, Mount SL ym. Clinical feat...»146, «Boonlikit S, Noinual N. Vaginal intraepithelial ne...»148.
- Diagnosen grundar sig på vävnadsprov som tagits i samband med kolposkopin.
- I kolposkopin beskrivs förändringarnas färg och blodkärlsmönster på samma sätt som
vid kontroll av livmodermunnen. Mosaikism är sällsynt «Boonlikit S, Noinual N. Vaginal intraepithelial ne...»148.
- De ättiksljusa förändringarna är platta eller något förhöjda och noggrant avgränsade och färgas inte med jod. Förändringarna kan vara veckade eller keratiniserade.
- Vid kraftiga förändringar förekommer oftare både ättiksljushet och punktat «Boonlikit S, Noinual N. Vaginal intraepithelial ne...»148.
- Skivepitelförändringar i slidan klassificeras utifrån den histologiska bilden på samma
grunder som förstadieförändringar i livmoderhalsen «Kurman RJ, Carcangiu ML, Herrington CS, Young RH (...»149.
- Infektiva förändringar:
- Low-grade squamous intraepithelial lesion LSIL (tidigare HPV/VAIN 1)
- Förstadieförändringar:
- High-grade squamous intraepithelial lesion HSIL (tidigare VAIN 2–3)
- Infektiva förändringar:
Behandling
- Målet är att förhindra att cancer i slidan utvecklas.
- Infektiva förändringar (histologisk LSIL, tidigare HPV/VAIN 1) behöver inte behandlas eftersom de har en god benägenhet att läka sig själva «Yli puolet emättimen esiastemuutoksista (histologinen LSIL-HSIL) saattaa parantua spontaanisti, todennäköisyyden ollessa selvästi suurin lievissä muutoksissa.»C, figur 8 «gvr00069j.pdf»10.
- Om den infektiva förändringen varar länge (> 2 år) väljs vårdlinjen individuellt «Frega A, Sopracordevole F, Assorgi C ym. Vaginal i...»150.
- Den vanligaste behandlingsformen vid förstadieförändringar (histologisk HSIL) är laservaporisation.
- Med den behandlas helt synliga, omfattande eller multifokala förändringar «Benedet JL, Wilson PS, Matisic JP. Epidermal thick...»151.
- Ett tillräckligt behandlingsdjup är cirka 2 mm och behandlingen bör göras med tillräckliga friskvävnadsmarginaler (7–10 mm) «Wang Y, Kong WM, Wu YM ym. Therapeutic effect of l...»152.
- Två tredjedelar av fallen läks genom engångsbehandling. Vid behov kan behandlingen upprepas «Rome RM, England PG. Management of vaginal intraep...»143, «Campagnutta E, Parin A, De Piero G ym. Treatment o...»153, «Audet-Lapointe P, Body G, Vauclair R ym. Vaginal i...»154, «Diakomanolis E, Rodolakis A, Sakellaropoulos G ym....»155, «Yalcin OT, Rutherford TJ, Chambers SK ym. Vaginal ...»156.
- Sällsynta komplikationer i behandlingen är blödning, infektioner och förträngning i slidan.
- Om laserbehandling inte är möjlig eller den inte fungerat kan imikvimodkräm användas
som behandling.
- Vid användning av imikvimodkräm i slidan har fullständig vårdrespons erhållits i 57–86 % av de histologiska LSIL-HSIL-förändringarna (tidigare VAIN 1–3) «de Witte CJ, van de Sande AJ, van Beekhuizen HJ ym...»157, «Imikimodivoide emättimen ja ulkosynnyttimien solumuutosten hoidossa»35.
- Doseringen av imikvimodkräm beskrivs i tilläggsmaterialet «Imikimodivoide emättimen ja ulkosynnyttimien solumuutosten hoidossa»35.
- Excisional behandling kan väljas när cancer inte kan uteslutas och det behövs en histologisk
bekräftelse eller när man efter en hysterektomi konstaterar histologisk HSIL i fornix
vaginae och förändringen fortsätter fram till operationsärret «Audet-Lapointe P, Body G, Vauclair R ym. Vaginal i...»154.
- Behandlingsresultatet är 65–80 % när den histologiska HSIL-förändringen (tidigare VAIN 3) tas bort kirurgiskt «Benedet JL, Sanders BH. Carcinoma in situ of the v...»158, «Curtis P, Shepherd JH, Lowe DG ym. The role of par...»159.
- Laservaporisation och excisional behandling kan vara lika effektiva vid behandling av LSIL- och HSIL-förändringar «Laservaporisaatio ja ekskisionaalinen hoito saattavat olla yhtä tehokkaitaLSIL- ja HSIL -muutosten hoidossa.»C.
- En multifokal förändring återkommer oftare och återfall konstateras i genomsnitt inom 2 år «Diakomanolis E, Rodolakis A, Sakellaropoulos G ym....»155, «Indermaur MD, Martino MA, Fiorica JV ym. Upper vag...»160.
- Återfall är vanligare hos patienter med hrHPV-infektion «Jentschke M, Hoffmeister V, Soergel P ym. Clinical...»147, «Frega A, French D, Piazze J ym. Prediction of pers...»161. I allmänhet persisterar samma virustyp «Jentschke M, Hoffmeister V, Soergel P ym. Clinical...»147, «Frega A, French D, Piazze J ym. Prediction of pers...»161.
- Behandlingen av den recidiverande förändringen väljs på samma grunder som i den primära situationen.
Uppföljning
- Risken för att en histologisk HSIL-förändring återkommer och utvecklas till cancer efter behandlingen är 2–5 %, vilket är 10 gånger större än vid histologiska förändringar i livmoderhalsen «Frega A, Sopracordevole F, Assorgi C ym. Vaginal i...»150, «Frega A, French D, Piazze J ym. Prediction of pers...»161.
- Efter behandlingen har en histologisk LSIL/HSIL-förändring en återfallsrisk på 33 %. Återfall är vanligare om det i bakgrunden finns en hrHPV-infektion, cancer i andra gynekologiska organ eller immunsuppressiv medicinering «Frega A, Sopracordevole F, Assorgi C ym. Vaginal i...»150.
- Uppföljningen av infektiva förändringar (histologisk LSIL, tidigare HPV/VAIN 1) utförs
med kolposkopi, papaprov och hrHPV-test med 12 månaders mellanrum.
- Om hrHPV är negativt vid den första uppföljningen kan patienten förflyttas till öppenvård och masscreening.
- Histologiska HSIL-förändringar i slidan bör följas upp med kolposkopier i början med
ett halvt års mellanrum (se figur 8 «gvr00069j.pdf»10).
- Om högrisk-HPV-testet som tagits i samband med den första uppföljningskolposkopin (6 mån) är negativt och det kolposkopiska fyndet är normalt, räcker det med en årlig kolposkopi under 3 års tid. Därefter kan patienten övergå till masscreening.
- Om högrisk-HPV-testet är positivt vid besöket efter behandlingen ska patienten kontrolleras kolposkopiskt med ett halvt års mellanrum tills hrHPV-testet är negativt eller under 3 års tid. Därefter rekommenderas årliga papaprov inom öppenvården, eftersom histologiska HSIL-förändringar återkommer även efter en lång tid «Jentschke M, Hoffmeister V, Soergel P ym. Clinical...»147, «Fehr MK, Baumann M, Mueller M ym. Disease progress...»162.
- Även i sådana fall då hrHPV-testet efter imikvimodbehandlingen är positivt men papaprovet är normalt, blir 69 % av patienterna hrHPV-negativa inom ett år «Lin CT, Qiu JT, Wang CJ ym. Topical imiquimod trea...»163.
Förstadieförändringar i de yttre könsorganen
Klassificering av förstadieförändringar i vulvan
- Förstadieförändringar i de yttre könsorganen indelas i intraepiteliala skivepitelförändringar och mer sällsynta icke-skivepiteliala förändringar.
- Skivepitelförändringarna i de yttre könsorganen delas vidare in i förändringar med
HPV-bakgrund och förändringar som är oberoende av HPV.
- Förändringar med HPV-bakgrund klassificeras utifrån den histologiska bilden på samma
grunder som förstadieförändringar i livmoderhalsen «Kurman RJ, Carcangiu ML, Herrington CS, Young RH (...»164
- infektiva förändringar:
- Low-grade squamous intraepithelial lesion, LSIL (HPV-atypi, kondylom, VIN 1)
- förstadieförändringar:
- High grade squamous intraepithelial lesion, HSIL (VIN usual type, VIN 2-3)
- Förstadium oberoende av HPV:
- Differentiated type vulvar intraepithelial neoplasia (dVIN)
- Förändringar med HPV-bakgrund klassificeras utifrån den histologiska bilden på samma
grunder som förstadieförändringar i livmoderhalsen «Kurman RJ, Carcangiu ML, Herrington CS, Young RH (...»164
- Icke-skivepiteliala neoplastiska förändringar i de yttre könsorganen som inte innehåller stromainvasion är bland annat Pagets sjukdom och melanom in situ.
Skivepitelförändringar med HPV-bakgrund: riskfaktorer och naturligt förlopp
- Riskfaktorerna för HPV-förändringar i vulvan är desamma som för förstadieförändringar i livmoderhalsen «de Bie RP, van de Nieuwenhof HP, Bekkers RL ym. Pa...»167, «Preti M, Igidbashian S, Costa S ym. VIN usual type...»168.
- HPV-förändringarna i yttre könsorganen har ofta samband med andra förstadieförändringar
i genitalområdet med HPV-bakgrund «Goffin F, Mayrand MH, Gauthier P ym. High-risk hum...»171
- 10–75 % av förstadieförändringar i de yttre könsorganen är förknippade med förändringar av olika grad i livmoderhalsen «de Bie RP, van de Nieuwenhof HP, Bekkers RL ym. Pa...»167, «van Esch EM, Dam MC, Osse ME ym. Clinical characte...»172.
- Histologisk HSIL:
- Incidensen av HSIL-förändringar ökar. Den åldersstandardiserade incidensen är numera 2,1/100 000 kvinnoår «van de Nieuwenhof HP, van der Avoort IA, de Hullu ...»170
- I HSIL-förändringarna har HPV 16-virus konstaterats i 71–78 % och HPV 18 i cirka 5–6 % av fallen «De Vuyst H, Clifford GM, Nascimento MC ym. Prevale...»174, «Insinga RP, Liaw KL, Johnson LG ym. A systematic r...»175, «Smith JS, Backes DM, Hoots BE ym. Human papillomav...»176.
- Risken för att en HSIL-förändring utvecklas till cancer är ca 6 % «van de Nieuwenhof HP, Massuger LF, van der Avoort ...»173.
- Histologisk LSIL:
- I de yttre könsorganen orsakas LSIL-förändringen oftast av antingen HPV 6 eller HPV 11 (31–43 %), men bakom förändringen ligger en heterogen grupp av olika HPV-typer «De Vuyst H, Clifford GM, Nascimento MC ym. Prevale...»174, «Insinga RP, Liaw KL, Johnson LG ym. A systematic r...»175, «Smith JS, Backes DM, Hoots BE ym. Human papillomav...»176. HPV 16-viruset har upptäckts i 7–24 % av VIN 1-förändringar.
- Det naturliga förloppet av LSIL-förändringen är bristfälligt känt och dess progrediering
till HSIL-förändring i vulvaområdet har inte dokumenterats på ett övertygande sätt.
- Att HPV-typerna skiljer sig från LSIL- och HSIL-förändringarna talar mot progression, men det torde vara möjligt åtminstone om HPV 16-positiviteten konstateras i bakgrunden av LSIL-förändringen.
- Vanliga kondylom är typiskt förknippade med virustyperna HPV 6 och HPV 11 med låg risk.
Skivepitelförändringar med HPV-bakgrund: klinisk bild och diagnostik
- Vanliga kondylom diagnostiseras utifrån den kliniska bilden och anamnesen, varvid
kolposkopi och biopsi inte behövs. Se God medicinsk praxis-rekommendationen Seksitaudit
«Seksitaudit»2 (på finska); Könssjukdomar, sexuellt överförda infektioner «Könssjukdomar, sexuellt överförda infektioner»3 (på svenska), «Seksitaudit. Suomalaisen Lääkäriseuran Duodecimin ...»177.
- Hos äldre kvinnor ska dock verruköst karcinom (Buschke-Löwensteins tumör) beaktas i differentialdiagnostiken av den exofytiska kondylomliknande förändringen.
- Diagnosen av övriga vulvaförändringar baserar sig på kolposkopi och ättiksyrepensling, där man förväntar sig en färgning av keratiniserat skivepitel «Cardosi RJ, Bomalaski JJ, Hoffman MS. Diagnosis an...»181.
- Hos unga kvinnor är förändringarna ofta multifokala och mångformiga (bild «VIN 1 muutos»22 och bild «Vulvan histologinen HSIL»23).
- Diagnosen på HSIL-förändringar är alltid histologisk.
- Flera prover tas av de kolposkopiskt starkaste förändringarna.
- Proverna ska vara tillräckligt djupa (minst 3–4 mm). Provet tas i lokalbedövning med en 3–4 mm stans från det mest representativa förändringsområdet.

VIN 1 muutos
© Pekka Nieminen

Vulvan histologinen HSIL
© Pekka Nieminen
Skivepitelförändringar med HPV-bakgrund: behandling och uppföljning
- Infektiva HPV-förändringar (histologisk LSIL, inklusive kondylom) behöver inte nödvändigtvis
behandlas.
- Om förändringen ger symtom väljs vårdlinjen individuellt. Lämpliga behandlingsalternativ
är podofyllotoxinpensling, behandling med imikvimodkräm, frysning dvs. kryobehandling
och i utvalda fall laservaporisation eller kirurgisk borttagning av förändringen.
Se God medicinsk praxis-rekommendationen Seksitaudit «Seksitaudit»2 (på finska); Könssjukdomar, sexuellt överförda infektioner «Könssjukdomar, sexuellt överförda infektioner»3 (på svenska), «Seksitaudit. Suomalaisen Lääkäriseuran Duodecimin ...»177.
- Om förändringen är multifokal kan behandlingen med imikvimodkräm lindra symtomen och läka förändringarna «Imikimodihoito saattaa auttaa oireisiin ja parantaa muutokset ulkosynnyttimien histologisissa LSIL/HSIL-muutoksissa»Coch «Imikimodivoide emättimen ja ulkosynnyttimien solumuutosten hoidossa»35.
- Det är vanligt att förändringarna återkommer efter behandlingen «Nelson EL, Bogliatto F, Stockdale CK. Vulvar Intra...»182.
- Läkningen av de infektiva förändringarna kan följas upp inom öppenvården. Vid långvariga (> 2 år) och atypiska förändringar rekommenderas remiss till kolposkopi. Se God medicinsk praxis-rekommendationen Seksitaudit «Seksitaudit»2 (på finska); Könssjukdomar, sexuellt överförda infektioner «Könssjukdomar, sexuellt överförda infektioner»3 (på svenska), «Seksitaudit. Suomalaisen Lääkäriseuran Duodecimin ...»177.
- Om förändringen ger symtom väljs vårdlinjen individuellt. Lämpliga behandlingsalternativ
är podofyllotoxinpensling, behandling med imikvimodkräm, frysning dvs. kryobehandling
och i utvalda fall laservaporisation eller kirurgisk borttagning av förändringen.
Se God medicinsk praxis-rekommendationen Seksitaudit «Seksitaudit»2 (på finska); Könssjukdomar, sexuellt överförda infektioner «Könssjukdomar, sexuellt överförda infektioner»3 (på svenska), «Seksitaudit. Suomalaisen Lääkäriseuran Duodecimin ...»177.
- En HSIL-förändring behandlas alltid. Målet är att förhindra en utveckling av cancer i yttre könsorganen.
- Behandlingen av HSIL-förändringen kan genomföras genom att ta bort förändringen som vävnadsprov (kniv, skärande elektrokoagulation, laser), laservaporisation eller lokal imikvimodkräm.
- Excisional behandling:
- Lokal excision rekommenderas «Kirurginen eksision jälkeen HSIL (VIN) -muutoksen uusiutuminen saattaa olla vähäisempää kuin laservaporisaation jälkeen.»C. Fördelen är att en eventuell invasiv förändring kan hittas.
- Excisionen görs med en marginal på minst 5 mm från den synliga förändringen «Modesitt SC, Waters AB, Walton L ym. Vulvar intrae...»183.
- Laservaporisation:
- Behandlingen lämpar sig för unga patienter och multipla förändringar. Fördelen med behandlingen är ett besparande resultat och nackdelen en långsam läkning.
- Lokal imikvimodmedicinering:
- Upp till 80 % av patienterna kan få fullständig behandlingsrespons «Imikimodihoito saattaa auttaa oireisiin ja parantaa muutokset ulkosynnyttimien histologisissa LSIL/HSIL-muutoksissa»C, «Imikimodivoide emättimen ja ulkosynnyttimien solumuutosten hoidossa»35.
- Behandlingen lämpar sig särskilt för omfattande förändringar när en invasiv sjukdom har uteslutits.
- Behandlingen genomförs tre gånger i veckan lokalt i 3 månader, varefter en uppföljningskolposkopi görs. Behandlingen kan inledas genom att dosera läkemedlet en gång i veckan och sedan öka doseringen till 3 doser i veckan. Om biverkningarna är starka kan doseringsintervallet förlängas «Imikimodivoide emättimen ja ulkosynnyttimien solumuutosten hoidossa»35.
- Efter behandlingen bör vulvans HSIL-förändringar följas upp med kolposkopier under
det första året halvårsvis och därefter årligen «Management of vulvar intraepithelial neoplasia. Co...»190, figur 9 «gvr00069k.pdf»11.
- Om hrHPV-testet och biopsierna är negativa vid den första uppföljningen (6 mån) efter behandlingen av den histologiska HSIL-förändringen är följande uppföljningsbesök om ett år och den totala uppföljningstiden är 3 år, om hrHPV-testet och biopsierna hålls negativa «van Esch EM, Dam MC, Osse ME ym. Clinical characte...»172.
- Om hrHPV-testet är positivt, utförs uppföljningskolposkopi efter 6 och 12 månader och därefter årligen. Den fortsatta uppföljningen görs i övrigt på basen av biopsierna (modifierad från ISSVD World congress summary «SUMMARY of the Twenty-third World Congress of the ...»191).
- Efter behandlingen återkommer HSIL-förändringen hos en betydande del av patienterna
- Risken för återfall är 16–42 % vid excisionsbehandling, 23–67 % vid laserbehandling och ca 10 % hos personer som fått imikvimodbehandling «Mathiesen O, Buus SK, Cramers M. Topical imiquimod...»186, «Tainio K, Jakobsson M, Louvanto K ym. Randomised t...»187, «Imikimodivoide emättimen ja ulkosynnyttimien solumuutosten hoidossa»35 och «VIN-muutoksen uusiminen saattaa olla yleisempää laserhoidon kuin paikallisen eksision jälkeen.»C.
- Risken för återfall är större om en förstadieförändring blir kvar på kanten av den borttagna förändringen eller det lacererade området «Jos poistetun muutoksen reunoille jää esiastemuutosta, uusiutumisen riski on 3-kertainen.»C
- Sjukdomen återkommer oftare efter en laserbehandling än efter en lokal excision «VIN-muutoksen uusiminen saattaa olla yleisempää laserhoidon kuin paikallisen eksision jälkeen.»C.
- Efter en behandling av multifokala förändringar är risken för återfall större än efter en behandling av enskilda förändringar «Multifokaalisten muutosten hoidon jälkeen uusimisriski voi olla suurempi kuin yksittäisen muutoksen hoidon jälkeen.»D.
- Återfall av HSIL-förändringar behandlas enligt samma principer som primärlesioner «Cardosi RJ, Bomalaski JJ, Hoffman MS. Diagnosis an...»181
- Uppföljningen inom öppenvården utgörs av kliniska undersökningar och papaprov. Om det finns områden med symtom (klåda, sveda, sår) kan patienten hänvisas till en kolposkopikonsultation.
dVIN, dvs. skivepitelförändring oberoende av HPV
- dVIN-förändringarnas andel av alla förstadieförändringar i de yttre könsorganen är
2–5 % «van de Nieuwenhof HP, van der Avoort IA, de Hullu ...»170
- dVIN diagnostiseras huvudsakligen hos postmenopausala kvinnor «van de Nieuwenhof HP, Massuger LF, van der Avoort ...»173, «Day T, Marzol A, Pagano R ym. Clinicopathologic Di...»192 och associeras med kroniska dermatos i vulvan, särskilt lichen sclerosus et atrophicus «Day T, Marzol A, Pagano R ym. Clinicopathologic Di...»192, «Yang B, Hart WR. Vulvar intraepithelial neoplasia ...»193
- dVIN-förändringarna är vanligen unifokala vita eller rödvita plack med symtom «Day T, Marzol A, Pagano R ym. Clinicopathologic Di...»192.
- dVIN diagnostiseras histologiskt.
- Flera prover tas av de kolposkopiskt starkaste förändringarna.
- Provet tas om möjligt med ett elliptiskt snitt från kanten av den mest representativa förändringen. För små förändringar lönar det sig att sträva efter att ta bort hela förändringen
- dVIN-förändringen är förknippad med en betydande cancerrisk (minst 30 %) och den progredierar
snabbare än HSIL-förändringen «van de Nieuwenhof HP, Massuger LF, van der Avoort ...»173, «Thuijs NB, van Beurden M, Bruggink AH ym. Vulvar i...»194. dVIN diagnostiseras ofta samtidigt med skivepitelkarcinom i vulvan «Thuijs NB, van Beurden M, Bruggink AH ym. Vulvar i...»194.
- dVIN-förändringen utesluter dock inte utvecklingen av en samtidig HPV-relaterad vulvaförändring.
- dVIN-förändringar behandlas alltid
- Behandlingen är alltid i första hand excisional «Kokka F, Singh N, Faruqi A ym. Is differentiated v...»178, «Preti M, Scurry J, Marchitelli CE ym. Vulvar intra...»184
- Efter behandlingen följs patienten upp genom kolposkopi. Den första uppföljningskolposkopin görs 6 månader efter behandlingen och upprepas därefter med ett års mellanrum under sammanlagt 5 år. Även efter detta är det skäl att fortsätta uppföljningen inom öppenvården med årliga uppföljningar «Management of vulvar intraepithelial neoplasia. Co...»190.
- Återfallsfrekvensen för en dVIN-förändring eller progressionsrisken efter behandling
torde vara stor, i en studie 86 % «McAlpine JN, Kim SY, Akbari A ym. HPV-independent ...»195
- Om en dVIN-patient också har lichen sclerosus et atrophicus är det enligt klinisk erfarenhet mycket viktigt med aktiv behandling av detta.
- Utöver dVIN-förändringen har även andra eventuella förstadieförändringar i skivepitelet som är oberoende av HPV (bl.a. differentiated exophytic vulvar intraepithelial lesion (DEVIL), vulvar acanthosis with altered differentiation (VAAD) beskrivits, men deras ställning är tills vidare oetablerad «Jenkins TM, Mills AM. Putative precancerous lesion...»196.
- I situationer där dVIN-kriterierna i provet inte uppfylls (litet prov, partiella dVIN-drag) måste man ibland nöja sig med en beskrivande histopatologisk diagnos (skivepitelatypi). Då rekommenderas att man efter kliniskt övervägande tar en större provbit, tar bort förändringen helt eller följer upp den aktivt.
Diagnostisering, vård och uppföljning av lichen sclerosus et atrophicus och lichen ruber planus
- Lichen sclerosus et atrophicus kan diagnostiseras utifrån den kliniska bilden antingen
inom primärvården eller specialsjukvården. Provbiten ska tas vid differentialdiagnostiska
problem eller om vårdresponsen är dålig – särskilt eftersom det finns en association
mellan lichen sclerosus et atrophicus och dVIN-förändring «Yang B, Hart WR. Vulvar intraepithelial neoplasia ...»193.
- Om patienten hänvisas till specialsjukvården för en diagnos på lichen sclerosus et atrophicus ska man inte inleda lokal behandling med en mycket stark kortisonkräm, eftersom användningen av den döljer diagnostiska fynd.
- När diagnosen har bekräftats används kortisonsalva i regel under en längre tid.
- Målet med behandlingen är att lindra symtomen och förebygga ärrbildning.
- En stark (mometason) eller mycket stark (klobetasol) kortisonkräm används 1–2 gånger
per dag i 1–3 månader. I lindrigare fall förlängs doseringsintervallet efter den första
månaden.
- Om symtomen återkommer inleds en ny behandlingsperiod på 3 månader och därefter fortsätter man med en underhållsdos på till exempel 2–3 gånger i veckan.
- Kalcineurinhämmare (takrolimus, pimecrolimus) kan användas som sekundär behandling.
- Uppföljningen av vårdresponsen görs efter 3 månader.
- Lichen sclerosus et atrophicus i de yttre könsorganen är förknippad med en risk på högst 4 % för skivepitelkarcinom i de yttre könsorganen «Spekreijse JJ, Streng BMM, Vermeulen RFM ym. The r...»197. dVIN-förändringen verkar ha samband med lichen sclerosus et atrophicus «Yang B, Hart WR. Vulvar intraepithelial neoplasia ...»193 och enligt den nuvarande hypotesen kan lichen sclerosus et atrophicus ge upphov till skivepitelkarcinom via dVIN-förändringen «Pouwer AW, VAN DEN Einden LCG, VAN DER Linden M ym...»198. Vid välbehandlad lichen sclerosus et atrophicus kan cancerrisken vara mindre «Lee A, Bradford J, Fischer G. Long-term Management...»189.
- Patienterna ska informeras om risken för malignitet.
- Patienter i terapeutisk balans följs upp inom primärvården till exempel årligen. Patienternas egenkontroll är också viktig. En artikel om lichen sclerosus et atrophicus har publicerats i serien Näin hoidan «Halonen P, Jakobsson M, Hiltunen-Back E. Ulkosynny...»200.
- I de yttre könsorganen konstateras tre undertyper av lichen ruber: erosiv (den vanligaste), hypertrofisk och klassisk. Erosiv lichen ruber kan också afficiera slidans slemhinna och diagnostiseringen av den hör till specialsjukvården: diagnosen kräver både en typisk klinisk bild och en histologisk verifiering «Day T, Wilkinson E, Rowan D ym. Clinicopathologic ...»201.
- Erosiv lichen ruber behandlas med mycket stark kortisonkräm på de yttre könsorganen eller på slidans slemhinna på samma sätt som vid lichen sclerosus et atrophicus. Ibland behövs också systemiska behandlingar «Ioannides D, Vakirlis E, Kemeny L ym. European S1 ...»202. Vården och uppföljningen av personer med erosiv lichen ruber genomförs multiprofessionellt inom specialsjukvården.
- Cancerrisken för lichen ruber i de yttre könsorganen är omtvistad – högst 1 % «Kennedy CM, Peterson LB, Galask RP. Erosive vulvar...»203, «Cooper SM, Wojnarowska F. Influence of treatment o...»204. Det finns ingen information om hur behandlingen påverkar cancerrisken.
Arbetsgrupp tillsatt av Finska Läkarföreningen Duodecim och Finska Kolposkopiföreningen
För mera information om arbetsgruppsmedlemmar samt anmälan om intressekonflikter, se «Kohdunkaulan, emättimen ja ulkosynnytinten solumuutokset»1 (på finska)
Översättare: Lingsoft Language Services Oy
Granskning av översättningen: Hanna Schalin
Litteratur
Cellförändringar i livmoderhalsen, slidan och yttre könsorganen. God medicinsk praxis-rekommendation. Arbetsgrupp tillsatt av Finska Läkarföreningen Duodecim och Finska Kolposkopiföreningen. Helsingfors: Finska Läkarföreningen Duodecim, 2021 (hänvisning dd.mm.åååå). Tillgänglig på internet: www.kaypahoito.fi
Närmare anvisningar: «https://www.kaypahoito.fi/sv/god-medicinsk-praxis/nyttjanderattigheter/citering»16
Ansvarsbegränsning
God medicinsk praxis- och Avstå klokt-rekommendationerna är sammandrag gjorda av experter gällande diagnostik och behandling av bestämda sjukdomar. Rekommendationerna fungerar som stöd när läkare eller andra yrkesutbildade personer inom hälso- och sjukvården ska fatta behandlingsbeslut. De ersätter inte läkarens eller annan hälsovårdspersonals egen bedömning av vilken diagnostik, behandling och rehabilitering som är bäst för den enskilda patienten då behandlingsbeslut fattas.
Litteratur
- Suomen Syöpärekisteri, tietokantaversio 2.9, tarkasteluvuodet 2015–2019. https://syoparekisteri.fi/
- Suomen Syöpärekisteri, https://tilastot.syoparekisteri.fi/syovat, datan päiväys 02.10.2020, sovelluksen versio 2020-11-06-001 «https://tilastot.syoparekisteri.fi/syovat»17
- Parkin DM, Whelan SL, Ferlay J, Teppo L, Thomas DB. Cancer incidence in Five Continents Vol. VIII. IARC Scientific Publications No. 155. International Agency for Research on Cancer & International Association of Cancer Registries, Lyon France, 2002
- World Health Organisation (WHO) Mortality Databank, Geneva. WHO Statistical information system. www.who.int/research/ «http://www.who.int/researchh/»18
- Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global Cancer Statistics 2018: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. Full text available at: https://onlinelibrary.wiley.com/doi/full/10.3322/caac.21492 «https://onlinelibrary.wiley.com/doi/full/10.3322/caac.21492»19
- Ferlay J, Ervik M, Lam F, Colombet M, Mery L, Piñeros M, Znaor A, Soerjomataram I, Bray F. Global Cancer Observatory: Cancer Today. 2018, Lyon, France: International Agency for Research on Cancer. Available from: https://gco.iarc.fr/today, accessed 27.2.2019 «https://gco.iarc.fr/today»20
- Anttila A, Pukkala E, Söderman B ym. Effect of organised screening on cervical cancer incidence and mortality in Finland, 1963-1995: recent increase in cervical cancer incidence. Int J Cancer 1999;83:59-65 «PMID: 10449609»PubMed
- International Agency for Research on Cancer. Cervical cancer screening. IARC Handbooks of cancer prevention, vol 10. IARC/WHO, Lyon 2005. www.iarc.fr/ «http://www.iarc.fr/»21
- Anttila A. Kohdunkaulansyövän seulonnan kohdistaminen ja vaikuttavuus. Suom Lääkäril 2000;55:2185-8
- Nieminen P, Hakama M, Tarkkanen J ym. Effect of type of screening laboratory on population-based occurrence of cervical lesions in Finland. Int J Cancer 2002;99:732-6 «PMID: 12115508»PubMed
- Engholm G, Ferlay J, Christensen N, Kejs AMT, Johannesen TB, Khan S, Leinonen MK, Milter MC, Ólafsdóttir E, Petersen T, Trykker H, Storm HH. NORDCAN: Cancer Incidence, Mortality, Prevalence and Survival in the Nordic Countries, Version 7.2 (16.12.2015). Association of the Nordic Cancer Registries. Danish Cancer Society. Available from http://www.ancr.nu «http://www.ancr.nu, accessed on day/month/year»22
- Engholm G, Ferlay J, Christensen N ym. NORDCAN--a Nordic tool for cancer information, planning, quality control and research. Acta Oncol 2010;49:725-36 «PMID: 20491528»PubMed
- Quinn MA, Benedet JL, Odicino F ym. Carcinoma of the cervix uteri. FIGO 26th Annual Report on the Results of Treatment in Gynecological Cancer. Int J Gynaecol Obstet 2006;95 Suppl 1:S43-103 «PMID: 17161167»PubMed
- zur Hausen H. Papillomaviruses causing cancer: evasion from host-cell control in early events in carcinogenesis. J Natl Cancer Inst 2000;92:690-8 «PMID: 10793105»PubMed
- de Villiers EM. Cross-roads in the classification of papillomaviruses. Virology 2013;445:2-10 «PMID: 23683837»PubMed
- IARC Working group on the Evaluation of Carsinogenic Risks to Humans. Biological agents. Volume 100 B. A review of human carcinogens. IARC Monogr Eval Carcinog Risks Hum 2012;100:255-268
- Anttila T, Saikku P, Koskela P ym. Serotypes of Chlamydia trachomatis and risk for development of cervical squamous cell carcinoma. JAMA 2001;285:47-51 «PMID: 11150108»PubMed
- Smith JS, Bosetti C, Muñoz N ym. Chlamydia trachomatis and invasive cervical cancer: a pooled analysis of the IARC multicentric case-control study. Int J Cancer 2004;111:431-9 «PMID: 15221973»PubMed
- Deacon JM, Evans CD, Yule R ym. Sexual behaviour and smoking as determinants of cervical HPV infection and of CIN3 among those infected: a case-control study nested within the Manchester cohort. Br J Cancer 2000;83:1565-72 «PMID: 11076670»PubMed
- Burger MP, Hollema H, Gouw AS ym. Cigarette smoking and human papillomavirus in patients with reported cervical cytological abnormality. BMJ 1993;306:749-52 «PMID: 8387842»PubMed
- Plummer M, Herrero R, Franceschi S ym. Smoking and cervical cancer: pooled analysis of the IARC multi-centric case--control study. Cancer Causes Control 2003;14:805-14 «PMID: 14682438»PubMed
- Franceschi S, Castellsagué X, Dal Maso L ym. Prevalence and determinants of human papillomavirus genital infection in men. Br J Cancer 2002;86:705-11 «PMID: 11875730»PubMed
- Castellsagué X, Ghaffari A, Daniel RW ym. Prevalence of penile human papillomavirus DNA in husbands of women with and without cervical neoplasia: a study in Spain and Colombia. J Infect Dis 1997;176:353-61 «PMID: 9237700»PubMed
- Castellsagué X, Bosch FX, Muñoz N ym. Male circumcision, penile human papillomavirus infection, and cervical cancer in female partners. N Engl J Med 2002;346:1105-12 «PMID: 11948269»PubMed
- Winer RL, Lee SK, Hughes JP ym. Genital human papillomavirus infection: incidence and risk factors in a cohort of female university students. Am J Epidemiol 2003;157:218-26 «PMID: 12543621»PubMed
- Thomas DB, Ray RM, Pardthaisong T ym. Prostitution, condom use, and invasive squamous cell cervical cancer in Thailand. Am J Epidemiol 1996;143:779-86 «PMID: 8610687»PubMed
- Birkeland SA, Storm HH, Lamm LU ym. Cancer risk after renal transplantation in the Nordic countries, 1964-1986. Int J Cancer 1995;60:183-9 «PMID: 7829213»PubMed
- Frisch M, Biggar RJ, Goedert JJ. Human papillomavirus-associated cancers in patients with human immunodeficiency virus infection and acquired immunodeficiency syndrome. J Natl Cancer Inst 2000;92:1500-10 «PMID: 10995805»PubMed
- Moreno V, Bosch FX, Muñoz N ym. Effect of oral contraceptives on risk of cervical cancer in women with human papillomavirus infection: the IARC multicentric case-control study. Lancet 2002;359:1085-92 «PMID: 11943255»PubMed
- Marks M, Gravitt PE, Gupta SB ym. Combined oral contraceptive use increases HPV persistence but not new HPV detection in a cohort of women from Thailand. J Infect Dis 2011;204:1505-13 «PMID: 21964399»PubMed
- Nielsen A, Kjaer SK, Munk C ym. Persistence of high-risk human papillomavirus infection in a population-based cohort of Danish women. J Med Virol 2010;82:616-23 «PMID: 20166190»PubMed
- Molano M, Van den Brule A, Plummer M ym. Determinants of clearance of human papillomavirus infections in Colombian women with normal cytology: a population-based, 5-year follow-up study. Am J Epidemiol 2003;158:486-94 «PMID: 12936904»PubMed
- Moscicki AB, Ma Y, Farhat S ym. Redetection of cervical human papillomavirus type 16 (HPV16) in women with a history of HPV16. J Infect Dis 2013;208:403-12 «PMID: 23599313»PubMed
- Louvanto K, Syrjänen KJ, Rintala MA ym. Genotype-specific clearance of genital human papillomavirus (HPV) infections among mothers in the Finnish family HPV study. J Clin Microbiol 2010;48:2665-71 «PMID: 20554830»PubMed
- Nasiell K, Nasiell M, Vaclavinková V. Behavior of moderate cervical dysplasia during long-term follow-up. Obstet Gynecol 1983;61:609-14 «PMID: 6835614»PubMed
- Ylitalo N, Josefsson A, Melbye M ym. A prospective study showing long-term infection with human papillomavirus 16 before the development of cervical carcinoma in situ. Cancer Res 2000;60:6027-32 «PMID: 11085523»PubMed
- Holowaty P, Miller AB, Rohan T ym. Natural history of dysplasia of the uterine cervix. J Natl Cancer Inst 1999;91:252-8 «PMID: 10037103»PubMed
- Cox JT, Schiffman M, Solomon D ym. Prospective follow-up suggests similar risk of subsequent cervical intraepithelial neoplasia grade 2 or 3 among women with cervical intraepithelial neoplasia grade 1 or negative colposcopy and directed biopsy. Am J Obstet Gynecol 2003;188:1406-12 «PMID: 12824970»PubMed
- Guido R, Schiffman M, Solomon D ym. Postcolposcopy management strategies for women referred with low-grade squamous intraepithelial lesions or human papillomavirus DNA-positive atypical squamous cells of undetermined significance: a two-year prospective study. Am J Obstet Gynecol 2003;188:1401-5 «PMID: 12824969»PubMed
- van Oortmarssen GJ, Habbema JD. Epidemiological evidence for age-dependent regression of pre-invasive cervical cancer. Br J Cancer 1991;64:559-65 «PMID: 1911199»PubMed
- Hakama M, Räsänen-Virtanen U. Effect of a mass screening program on the risk of cervical cancer. Am J Epidemiol 1976;103:512-7 «PMID: 1274953»PubMed
- Krivak TC, Rose GS, McBroom JW ym. Cervical adenocarcinoma in situ: a systematic review of therapeutic options and predictors of persistent or recurrent disease. Obstet Gynecol Surv 2001;56:567-75 «PMID: 11524622»PubMed
- Makkonen P, Heinävaara S, Sarkeala T ym. Impact of organized and opportunistic Pap testing on the risk of cervical cancer in young women - A case-control study from Finland. Gynecol Oncol 2017;147:601-606 «PMID: 28942994»PubMed
- Arbyn M, Anttila A, Jordan J ym. European guidelines for quality assurance on cervical cancer screening. 2. painos. Brussels: European Community, 2008
- THL. Terveyden ja hyvinvoinnin laitoksen asettaman papilloomavirustautien torjuntatyöryhmän selvitys. Helsinki: Terveyden ja hyvinvoinnin laitos. Raportti 4/2011. (Viitattu 27.5.2013). http://www.julkari.fi/handle/10024/80336 «http://www.julkari.fi/handle/10024/80336»23
- Melnikow J, Henderson JT, Burda BU ym. Screening for Cervical Cancer With High-Risk Human Papillomavirus Testing: Updated Evidence Report and Systematic Review for the US Preventive Services Task Force. JAMA 2018;320:687-705 «PMID: 30140883»PubMed
- Pankakoski M, Anttila A, Sarkeala T ym. Effectiveness of cervical cancer screening at age 65 - A register-based cohort study. PLoS One 2019;14:e0214486 «PMID: 30913262»PubMed
- US Preventive Services Task Force., Curry SJ, Krist AH ym. Screening for Cervical Cancer: US Preventive Services Task Force Recommendation Statement. JAMA 2018;320:674-686 «PMID: 30140884»PubMed
- Kalliala I, Anttila A, Pukkala E ym. Risk of cervical and other cancers after treatment of cervical intraepithelial neoplasia: retrospective cohort study. BMJ 2005;331:1183-5 «PMID: 16293840»PubMed
- Jakobsson M, Pukkala E, Paavonen J ym. Cancer incidence among Finnish women with surgical treatment for cervical intraepithelial neoplasia, 1987-2006. Int J Cancer 2011;128:1187-91 «PMID: 20473918»PubMed
- Anttila A, Näveri T, Sarkeala T. Kohdunkaulan syövän seulonnassa suuria alueellisia eroja. Suom Lääkäril 2014; 35: 2121-2126a
- Suomen Syöpärekisteri, https://tilastot.syoparekisteri.fi/seulonta, päivitetty 20.05.0011
- Monto K, Nieminen P. Gynekologisten irtosolunäytteiden vuosittainen kokonaismäärä ja raportointitavat Suomessa. Suom Lääkäril 2005;18-19:2093
- Salo H, Nieminen P, Kilpi T ym. Divergent coverage, frequency and costs of organised and opportunistic Pap testing in Finland. Int J Cancer 2014;135:204-13 «PMID: 24347441»PubMed
- Salo H, Nieminen P, Kilpi T, Auranen K, Leino T, Vänskä S, Tiihonen P, Lehtinen M, Anttila A. Seulontaohjelman ulkopuolinen Papatestaus ei vastaa suosituksia (Divergent coverage, frequency and costs of organised and opportunistic Pap testing in Finland). Suom Lääkäril 2014;69:2447-55A
- Salo H, Nieminen P, Kilpi T ym. Divergent coverage, frequency and costs of organised and opportunistic Pap testing in Finland. Int J Cancer 2014;135:204-13 «PMID: 24347441»PubMed
- Meijer CJ, Berkhof J, Castle PE ym. Guidelines for human papillomavirus DNA test requirements for primary cervical cancer screening in women 30 years and older. Int J Cancer 2009;124:516-20 «PMID: 18973271»PubMed
- Muñoz N, Manalastas R Jr, Pitisuttithum P ym. Safety, immunogenicity, and efficacy of quadrivalent human papillomavirus (types 6, 11, 16, 18) recombinant vaccine in women aged 24-45 years: a randomised, double-blind trial. Lancet 2009;373:1949-57 «PMID: 19493565»PubMed
- Paavonen J, Naud P, Salmerón J ym. Efficacy of human papillomavirus (HPV)-16/18 AS04-adjuvanted vaccine against cervical infection and precancer caused by oncogenic HPV types (PATRICIA): final analysis of a double-blind, randomised study in young women. Lancet 2009;374:301-14 «PMID: 19586656»PubMed
- GlaxoSmithKline Vaccine HPV-007 Study Group., Romanowski B, de Borba PC ym. Sustained efficacy and immunogenicity of the human papillomavirus (HPV)-16/18 AS04-adjuvanted vaccine: analysis of a randomised placebo-controlled trial up to 6.4 years. Lancet 2009;374:1975-85 «PMID: 19962185»PubMed
- Muñoz N, Kjaer SK, Sigurdsson K ym. Impact of human papillomavirus (HPV)-6/11/16/18 vaccine on all HPV-associated genital diseases in young women. J Natl Cancer Inst 2010;102:325-39 «PMID: 20139221»PubMed
- European Medicines Agency. Cervarix. Procedural steps taken and scientific information after the authorisation. EMA/620356/2012. Available from (accessed: 10/04/2015):http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-Procedural_steps_taken_and_scientific_information_after_authorisation/human/000721/WC500024639.pdf. «http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-Procedural_steps_taken_and_scientific_information_after_authorisation/human/000721/WC500024639.pdf»24
- European Medicines Agency. Gardasil. Procedural steps taken and scientific information after the authorisation. EMA/391688/2012. Available from (accessed 10/04/2015): http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Procedural_steps_taken_and_scientific_information_after_authorisation/human/000703/WC500021147.pdf. «http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Procedural_steps_taken_and_scientific_information_after_authorisation/human/000703/WC500021147.pdf»25
- Joura EA, Giuliano AR, Iversen OE ym. A 9-valent HPV vaccine against infection and intraepithelial neoplasia in women. N Engl J Med 2015;372:711-23 «PMID: 25693011»PubMed
- Kjaer SK, Sigurdsson K, Iversen OE ym. A pooled analysis of continued prophylactic efficacy of quadrivalent human papillomavirus (Types 6/11/16/18) vaccine against high-grade cervical and external genital lesions. Cancer Prev Res (Phila) 2009;2:868-78 «PMID: 19789295»PubMed
- Rowhani-Rahbar A, Mao C, Hughes JP ym. Longer term efficacy of a prophylactic monovalent human papillomavirus type 16 vaccine. Vaccine 2009;27:5612-9 «PMID: 19647066»PubMed
- Luostarinen T, Apter D, Dillner J ym. Vaccination protects against invasive HPV-associated cancers. Int J Cancer 2018;142:2186-2187 «PMID: 29280138»PubMed
- Lei J, Ploner A, Elfström KM ym. HPV Vaccination and the Risk of Invasive Cervical Cancer. N Engl J Med 2020;383:1340-1348 «PMID: 32997908»PubMed
- Harper DM, Franco EL, Wheeler CM ym. Sustained efficacy up to 4.5 years of a bivalent L1 virus-like particle vaccine against human papillomavirus types 16 and 18: follow-up from a randomised control trial. Lancet 2006;367:1247-55 «PMID: 16631880»PubMed
- Harper DM, Franco EL, Wheeler C ym. Efficacy of a bivalent L1 virus-like particle vaccine in prevention of infection with human papillomavirus types 16 and 18 in young women: a randomised controlled trial. Lancet 2004;364:1757-65 «PMID: 15541448»PubMed
- Koutsky LA, Ault KA, Wheeler CM ym. A controlled trial of a human papillomavirus type 16 vaccine. N Engl J Med 2002;347:1645-51 «PMID: 12444178»PubMed
- Garland SM, Hernandez-Avila M, Wheeler CM ym. Quadrivalent vaccine against human papillomavirus to prevent anogenital diseases. N Engl J Med 2007;356:1928-43 «PMID: 17494926»PubMed
- Ault KA, Future II Study Group. Effect of prophylactic human papillomavirus L1 virus-like-particle vaccine on risk of cervical intraepithelial neoplasia grade 2, grade 3, and adenocarcinoma in situ: a combined analysis of four randomised clinical trials. Lancet 2007;369:1861-8 «PMID: 17544766»PubMed
- FUTURE II Study Group. Quadrivalent vaccine against human papillomavirus to prevent high-grade cervical lesions. N Engl J Med 2007;356:1915-27 «PMID: 17494925»PubMed
- Palefsky J ym. HPV Vaccine against Anal HPV Infection and Anal Intraepithelial Neoplasia. N Engl J Med 2011; 365:1576-1585
- Giuliano AR, Palefsky JM, Goldstone S ym. Efficacy of quadrivalent HPV vaccine against HPV Infection and disease in males. N Engl J Med 2011;364:401-11 «PMID: 21288094»PubMed
- Lehtinen M, Apter D, Eriksson T ym. Effectiveness of the AS04-adjuvanted HPV-16/18 vaccine in reducing oropharyngeal HPV infections in young females-Results from a community-randomized trial. Int J Cancer 2020;147:170-174 «PMID: 31736068»PubMed
- Gertig DM, Brotherton JM, Budd AC ym. Impact of a population-based HPV vaccination program on cervical abnormalities: a data linkage study. BMC Med 2013;11:227 «PMID: 24148310»PubMed
- Baldur-Felskov B, Dehlendorff C, Munk C ym. Early impact of human papillomavirus vaccination on cervical neoplasia--nationwide follow-up of young Danish women. J Natl Cancer Inst 2014;106:djt460 «PMID: 24552678»PubMed
- Pollock KG, Kavanagh K, Potts A ym. Reduction of low- and high-grade cervical abnormalities associated with high uptake of the HPV bivalent vaccine in Scotland. Br J Cancer 2014;111:1824-30 «PMID: 25180766»PubMed
- Drolet M, Bénard É, Boily MC ym. Population-level impact and herd effects following human papillomavirus vaccination programmes: a systematic review and meta-analysis. Lancet Infect Dis 2015;15:565-80 «PMID: 25744474»PubMed
- Lehtinen M, Dillner J. Clinical trials of human papillomavirus vaccines and beyond. Nat Rev Clin Oncol 2013;10:400-10 «PMID: 23736648»PubMed
- WHO. Global Advisory Committee on Vaccine Safety, report of meeting held 11-12 December. Wkly Epidemiol Rec, vol. 89, no. 7, pp. 53-60.
- Arnheim-Dahlström L, Pasternak B, Svanström H ym. Autoimmune, neurological, and venous thromboembolic adverse events after immunisation of adolescent girls with quadrivalent human papillomavirus vaccine in Denmark and Sweden: cohort study. BMJ 2013;347:f5906 «PMID: 24108159»PubMed
- Scheller NM, Svanström H, Pasternak B ym. Quadrivalent HPV vaccination and risk of multiple sclerosis and other demyelinating diseases of the central nervous system. JAMA 2015;313:54-61 «PMID: 25562266»PubMed
- Beibei L ym. Efficacy and Safety of Prophylactic Vaccines against Cervical HPV Infection and Diseases among Women: A Systematic Review & Meta-Analysis. BMC Infect Dis. 2011; 11: 13
- Skufca J, Ollgren J, Artama M ym. The association of adverse events with bivalent human papilloma virus vaccination: A nationwide register-based cohort study in Finland. Vaccine 2018;36:5926-5933 «PMID: 30115524»PubMed
- Anttila A, Arbyn M, De Vuyst H, Dillner J, Dillner L, Franceschi S, Patnick J, Ronco G, Segnan N, Suonio E, Törnberg S & von Karsa L (eds.). European guidelines for quality assurance in cervical cancer screening. Second edition, Supplements. Office for Official Publications of the European Union, Luxembourg 2015 saatavana http://bookshop.europa.eu/en/european-guidelines-for-quality-assurance-in-cervical-cancer-screening-pbEW0115451/ «http://bookshop.europa.eu/en/european-guidelines-for-quality-assurance-in-cervical-cancer-screening-pbEW0115451/»26
- Herweijer E, Leval A, Ploner A ym. Association of varying number of doses of quadrivalent human papillomavirus vaccine with incidence of condyloma. JAMA 2014;311:597-603 «PMID: 24519299»PubMed
- Pollock KG, Kavanagh K, Potts A ym. Reduction of low- and high-grade cervical abnormalities associated with high uptake of the HPV bivalent vaccine in Scotland. Br J Cancer 2014;111:1824-30 «PMID: 25180766»PubMed
- Kavanagh K, Pollock KG, Potts A ym. Introduction and sustained high coverage of the HPV bivalent vaccine leads to a reduction in prevalence of HPV 16/18 and closely related HPV types. Br J Cancer 2014;110:2804-11 «PMID: 24736582»PubMed
- Lehtinen M, Nieminen P, Paavonen J. Pitäisikö Papa-kokeesta luopua? Suom Lääkär 2016; 71:1115
- Nayar R, Wilbur, D. (Eds.) The Bethesda System for Reporting Cervical Cytology. Definitions, Criteria, and Explanatory Notes. Springer. ISBN 978-3-319-11074-5, 2015
- Nieminen P. Miten Papalausuntoa tulee lukea? Duodecim 1998;114:1138-43
- Kinney WK, Manos MM, Hurley LB ym. Where's the high-grade cervical neoplasia? The importance of minimally abnormal Papanicolaou diagnoses. Obstet Gynecol 1998;91:973-6 «PMID: 9611007»PubMed
- Baldauf JJ, Dreyfus M, Ritter J ym. An analysis of the factors involved in the diagnostic accuracy of colposcopically directed biopsy. Acta Obstet Gynecol Scand 1997;76:468-73 «PMID: 9197451»PubMed
- HIV Indicator Conditions. http://hiveurope.eu/Finalised-Projects/Guidance-HIV-Indicator-Conditions «http://hiveurope.eu/Finalised-Projects/Guidance-HIV-Indicator-Conditions»27
- HIV-testing-guidelines-2020.pdf (bhiva.org) «https://www.bhiva.org/HIV-testing-guidelines»28
- Carlander C, Wagner P, van Beirs A ym. Suppressive antiretroviral therapy associates with effective treatment of high-grade cervical intraepithelial neoplasia. AIDS 2018;32:1475-1484 «PMID: 29746299»PubMed
- Carlander C, Marrone G, Brännström J ym. Assessing cervical intraepithelial neoplasia as an indicator disease for HIV in a low endemic setting: a population-based register study. BJOG 2017;124:1680-1687 «PMID: 28235246»PubMed
- Johnson SJ, Wadehra V. How predictive is a cervical smear suggesting invasive squamous cell carcinoma? Cytopathology 2001;12:144-50 «PMID: 11380555»PubMed
- Bowring J, Strander B, Young M ym. The Swede score: evaluation of a scoring system designed to improve the predictive value of colposcopy. J Low Genit Tract Dis 2010;14:301-5 «PMID: 20885156»PubMed
- Strander B, Ellström-Andersson A, Franzén S ym. The performance of a new scoring system for colposcopy in detecting high-grade dysplasia in the uterine cervix. Acta Obstet Gynecol Scand 2005;84:1013-7 «PMID: 16167921»PubMed
- Heatley MK, Bury JP. The correlation between the grade of dyskaryosis on cervical smear, grade of cervical intraepithelial neoplasia (CIN) on punch biopsy and the final histological diagnosis on cone biopsies of the cervix. Cytopathology 1998;9:93-9 «PMID: 9577735»PubMed
- Tainio K, Athanasiou A, Tikkinen KAO ym. Clinical course of untreated cervical intraepithelial neoplasia grade 2 under active surveillance: systematic review and meta-analysis. BMJ 2018;360:k499 «PMID: 29487049»PubMed
- Massad LS, Einstein MH, Huh WK ym. 2012 updated consensus guidelines for the management of abnormal cervical cancer screening tests and cancer precursors. Obstet Gynecol 2013;121:829-46 «PMID: 23635684»PubMed
- Salani R, Puri I, Bristow RE. Adenocarcinoma in situ of the uterine cervix: a metaanalysis of 1278 patients evaluating the predictive value of conization margin status. Am J Obstet Gynecol 2009;200:182.e1-5 «PMID: 19019325»PubMed
- Baalbergen A, Helmerhorst TJ. Adenocarcinoma in situ of the uterine cervix--a systematic review. Int J Gynecol Cancer 2014;24:1543-8 «PMID: 25238167»PubMed
- Teoh D, Musa F, Salani R ym. Diagnosis and Management of Adenocarcinoma in Situ: A Society of Gynecologic Oncology Evidence-Based Review and Recommendations. Obstet Gynecol 2020;135:869-878 «PMID: 32168211»PubMed
- Anderson MC. Invasive carcinoma of the cervix following local destructive treatment for cervical intraepithelial neoplasia. Br J Obstet Gynaecol 1993;100:657-63 «PMID: 8369250»PubMed
- Martin-Hirsch PP, Paraskevaidis E, Bryant A ym. Surgery for cervical intraepithelial neoplasia. Cochrane Database Syst Rev 2013;12:CD001318 «PMID: 24302546»PubMed
- Berget A, Andreasson B, Bock JE ym. Outpatient treatment of cervical intra-epithelial neoplasia. The CO2 laser versus cryotherapy, a randomized trial. Acta Obstet Gynecol Scand 1987;66:531-6 «PMID: 3321872»PubMed
- Townsend DE, Richart RM. Cryotherapy and carbon dioxide laser management of cervical intraepithelial neoplasia: a controlled comparison. Obstet Gynecol 1983;61:75-8 «PMID: 6401855»PubMed
- Gunasekera PC, Phipps JH, Lewis BV. Large loop excision of the transformation zone (LLETZ) compared to carbon dioxide laser in the treatment of CIN: a superior mode of treatment. Br J Obstet Gynaecol 1990;97:995-8 «PMID: 2252879»PubMed
- Oyesanya OA, Amerasinghe CN, Manning EA. Outpatient excisional management of cervical intraepithelial neoplasia. A prospective, randomized comparison between loop diathermy excision and laser excisional conization. Am J Obstet Gynecol 1993;168:485-8 «PMID: 8438914»PubMed
- Bostofte E, Berget A, Falck Larsen J ym. Conization by carbon dioxide laser or cold knife in the treatment of cervical intra-epithelial neoplasia. Acta Obstet Gynecol Scand 1986;65:199-202 «PMID: 3090849»PubMed
- Kristensen GB, Jensen LK, Hølund B. A randomized trial comparing two methods of cold knife conization with laser conization. Obstet Gynecol 1990;76:1009-13 «PMID: 2234708»PubMed
- Partington CK, Turner MJ, Soutter WP ym. Laser vaporization versus laser excision conization in the treatment of cervical intraepithelial neoplasia. Obstet Gynecol 1989;73:775-9 «PMID: 2649822»PubMed
- Martin-Hirsch PL, Kitchener H. Interventions for preventing blood loss during the treatment of cervical intraepithelial neoplasia. Cochrane Database Syst Rev 2000;:CD001421 «PMID: 10796789»PubMed
- Santesso N, Mustafa RA, Wiercioch W ym. Systematic reviews and meta-analyses of benefits and harms of cryotherapy, LEEP, and cold knife conization to treat cervical intraepithelial neoplasia. Int J Gynaecol Obstet 2016;132:266-71 «PMID: 26643302»PubMed
- Ferenczy A. Comparison of cryo- and carbon dioxide laser therapy for cervical intraepithelial neoplasia. Obstet Gynecol 1985;66:793-8 «PMID: 3934610»PubMed
- Kalliala I, Athanasiou A, Veroniki AA ym. Incidence and mortality from cervical cancer and other malignancies after treatment of cervical intraepithelial neoplasia: a systematic review and meta-analysis of the literature. Annals of Oncology 2020;31:213-27
- Cuschieri K, Bhatia R, Cruickshank M ym. HPV testing in the context of post-treatment follow up (test of cure). J Clin Virol 2016;76 Suppl 1:S56-61 «PMID: 26525202»PubMed
- Costa S, Venturoli S, Negri G ym. Factors predicting the outcome of conservatively treated adenocarcinoma in situ of the uterine cervix: an analysis of 166 cases. Gynecol Oncol 2012;124:490-5 «PMID: 22188786»PubMed
- Kocken M, Helmerhorst TJ, Berkhof J ym. Risk of recurrent high-grade cervical intraepithelial neoplasia after successful treatment: a long-term multi-cohort study. Lancet Oncol 2011;12:441-50 «PMID: 21530398»PubMed
- Heinonen A, Jakobsson M, Kiviharju M ym. Role of Colposcopy after Treatment for Cervical Intraepithelial Neoplasia. Cancers (Basel) 2020;12: «PMID: 32599929»PubMed
- Arbyn M, Redman CWE, Verdoodt F ym. Incomplete excision of cervical precancer as a predictor of treatment failure: a systematic review and meta-analysis. Lancet Oncol 2017;18:1665-1679 «PMID: 29126708»PubMed
- Strander B, Andersson-Ellström A, Milsom I ym. Long term risk of invasive cancer after treatment for cervical intraepithelial neoplasia grade 3: population based cohort study. BMJ 2007;335:1077 «PMID: 17959735»PubMed
- Elfgren K, Elfström KM, Naucler P ym. Management of women with human papillomavirus persistence: long-term follow-up of a randomized clinical trial. Am J Obstet Gynecol 2017;216:264.e1-264.e7 «PMID: 27825977»PubMed
- Palle C, Bangsbøll S, Andreasson B. Cervical intraepithelial neoplasia in pregnancy. Acta Obstet Gynecol Scand 2000;79:306-10 «PMID: 10746847»PubMed
- Economos K, Perez Veridiano N, Delke I ym. Abnormal cervical cytology in pregnancy: a 17-year experience. Obstet Gynecol 1993;81:915-8 «PMID: 8497355»PubMed
- Coppola A, Sorosky J, Casper R ym. The clinical course of cervical carcinoma in situ diagnosed during pregnancy. Gynecol Oncol 1997;67:162-5 «PMID: 9367700»PubMed
- Serati M, Uccella S, Laterza RM ym. Natural history of cervical intraepithelial neoplasia during pregnancy. Acta Obstet Gynecol Scand 2008;87:1296-300 «PMID: 18951206»PubMed
- Flannelly G. The management of women with abnormal cervical cytology in pregnancy. Best Pract Res Clin Obstet Gynaecol 2010;24:51-60 «PMID: 19805007»PubMed
- Hunter MI, Monk BJ, Tewari KS. Cervical neoplasia in pregnancy. Part 1: screening and management of preinvasive disease. Am J Obstet Gynecol 2008;199:3-9 «PMID: 18585520»PubMed
- Sadler L, Saftlas A, Wang W ym. Treatment for cervical intraepithelial neoplasia and risk of preterm delivery. JAMA 2004;291:2100-6 «PMID: 15126438»PubMed
- Kojic EM, Kang M, Cespedes MS ym. Immunogenicity and safety of the quadrivalent human papillomavirus vaccine in HIV-1-infected women. Clin Infect Dis 2014;59:127-35 «PMID: 24723284»PubMed
- Rainone V, Giacomet V, Penagini F ym. Human papilloma virus vaccination induces strong human papilloma virus specific cell-mediated immune responses in HIV-infected adolescents and young adults. AIDS 2015;29:739-43 «PMID: 25849837»PubMed
- Money DM, Moses E, Blitz S ym. HIV viral suppression results in higher antibody responses in HIV-positive women vaccinated with the quadrivalent human papillomavirus vaccine. Vaccine 2016;34:4799-806 «PMID: 27544584»PubMed
- Moscicki AB, Flowers L, Huchko MJ ym. Guidelines for Cervical Cancer Screening in Immunosuppressed Women Without HIV Infection. J Low Genit Tract Dis 2019;23:87-101 «PMID: 30907775»PubMed
- Daling JR, Madeleine MM, Schwartz SM ym. A population-based study of squamous cell vaginal cancer: HPV and cofactors. Gynecol Oncol 2002;84:263-70 «PMID: 11812085»PubMed
- Alemany L, Saunier M, Tinoco L ym. Large contribution of human papillomavirus in vaginal neoplastic lesions: a worldwide study in 597 samples. Eur J Cancer 2014;50:2846-54 «PMID: 25155250»PubMed
- Rome RM, England PG. Management of vaginal intraepithelial neoplasia: A series of 132 cases with long-term follow-up. Int J Gynecol Cancer 2000;10:382-390 «PMID: 11240702»PubMed
- Sillman FH, Fruchter RG, Chen YS ym. Vaginal intraepithelial neoplasia: risk factors for persistence, recurrence, and invasion and its management. Am J Obstet Gynecol 1997;176:93-9 «PMID: 9024096»PubMed
- Diakomanolis E, Stefanidis K, Rodolakis A ym. Vaginal intraepithelial neoplasia: report of 102 cases. Eur J Gynaecol Oncol 2002;23:457-9 «PMID: 12440826»PubMed
- Dodge JA, Eltabbakh GH, Mount SL ym. Clinical features and risk of recurrence among patients with vaginal intraepithelial neoplasia. Gynecol Oncol 2001;83:363-9 «PMID: 11606098»PubMed
- Jentschke M, Hoffmeister V, Soergel P ym. Clinical presentation, treatment and outcome of vaginal intraepithelial neoplasia. Arch Gynecol Obstet 2016;293:415-9 «PMID: 26232937»PubMed
- Boonlikit S, Noinual N. Vaginal intraepithelial neoplasia: a retrospective analysis of clinical features and colpohistology. J Obstet Gynaecol Res 2010;36:94-100 «PMID: 20178533»PubMed
- Kurman RJ, Carcangiu ML, Herrington CS, Young RH (Eds.) WHO classification of tumours of female reproductive organs, Fourth edition. International Agency for Research on Cancer, Lyon (2014), pp. 208-211
- Frega A, Sopracordevole F, Assorgi C ym. Vaginal intraepithelial neoplasia: a therapeutical dilemma. Anticancer Res 2013;33:29-38 «PMID: 23267125»PubMed
- Benedet JL, Wilson PS, Matisic JP. Epidermal thickness measurements in vaginal intraepithelial neoplasia. A basis for optimal CO2 laser vaporization. J Reprod Med 1992;37:809-12 «PMID: 1453403»PubMed
- Wang Y, Kong WM, Wu YM ym. Therapeutic effect of laser vaporization for vaginal intraepithelial neoplasia following hysterectomy due to premalignant and malignant lesions. J Obstet Gynaecol Res 2014;40:1740-7 «PMID: 24888942»PubMed
- Campagnutta E, Parin A, De Piero G ym. Treatment of vaginal intraepithelial neoplasia (VAIN) with the carbon dioxide laser. Clin Exp Obstet Gynecol 1999;26:127-30 «PMID: 10459459»PubMed
- Audet-Lapointe P, Body G, Vauclair R ym. Vaginal intraepithelial neoplasia. Gynecol Oncol 1990;36:232-9 «PMID: 2404839»PubMed
- Diakomanolis E, Rodolakis A, Sakellaropoulos G ym. Conservative management of vaginal intraepithelial neoplasia (VAIN) by laser CO2. Eur J Gynaecol Oncol 1996;17:389-92 «PMID: 8933838»PubMed
- Yalcin OT, Rutherford TJ, Chambers SK ym. Vaginal intraepithelial neoplasia: treatment by carbon dioxide laser and risk factors for failure. Eur J Obstet Gynecol Reprod Biol 2003;106:64-8 «PMID: 12475584»PubMed
- de Witte CJ, van de Sande AJ, van Beekhuizen HJ ym. Imiquimod in cervical, vaginal and vulvar intraepithelial neoplasia: a review. Gynecol Oncol 2015;139:377-84 «PMID: 26335596»PubMed
- Benedet JL, Sanders BH. Carcinoma in situ of the vagina. Am J Obstet Gynecol 1984;148:695-700 «PMID: 6702936»PubMed
- Curtis P, Shepherd JH, Lowe DG ym. The role of partial colpectomy in the management of persistent vaginal neoplasia after primary treatment. Br J Obstet Gynaecol 1992;99:587-9 «PMID: 1525101»PubMed
- Indermaur MD, Martino MA, Fiorica JV ym. Upper vaginectomy for the treatment of vaginal intraepithelial neoplasia. Am J Obstet Gynecol 2005;193:577-80; discussion 580-1 «PMID: 16098901»PubMed
- Frega A, French D, Piazze J ym. Prediction of persistent vaginal intraepithelial neoplasia in previously hysterectomized women by high-risk HPV DNA detection. Cancer Lett 2007;249:235-41 «PMID: 17070990»PubMed
- Fehr MK, Baumann M, Mueller M ym. Disease progression and recurrence in women treated for vulvovaginal intraepithelial neoplasia. J Gynecol Oncol 2013;24:236-41 «PMID: 23875073»PubMed
- Lin CT, Qiu JT, Wang CJ ym. Topical imiquimod treatment for human papillomavirus infection in patients with and without cervical/vaginal intraepithelial neoplasia. Taiwan J Obstet Gynecol 2012;51:533-8 «PMID: 23276555»PubMed
- Kurman RJ, Carcangiu ML, Herrington CS, Young RH (toim.) WHO classification of tumours of female reproductive organs, Fourth edition. International Agency for Research on Cancer, Lyon (2014), pp. 230-234
- Sideri Sideri M, Spinaci L, Spolti N ym. Evaluation of CO(2) laser excision or vaporization for the treatment of vulvar intraepithelial neoplasia. Gynecol Oncol 1999;75:277-81 «PMID: 10525386»PubMed
- Husseinzadeh N, Recinto C. Frequency of invasive cancer in surgically excised vulvar lesions with intraepithelial neoplasia (VIN 3). Gynecol Oncol 1999;73:119-20 «PMID: 10094891»PubMed
- de Bie RP, van de Nieuwenhof HP, Bekkers RL ym. Patients with usual vulvar intraepithelial neoplasia-related vulvar cancer have an increased risk of cervical abnormalities. Br J Cancer 2009;101:27-31 «PMID: 19513077»PubMed
- Preti M, Igidbashian S, Costa S ym. VIN usual type-from the past to the future. Ecancermedicalscience 2015;9:531 «PMID: 25987900»PubMed
- Planner RS, Hobbs JB. Intraepithelial and invasive neoplasia of the vulva in association with human papillomavirus infection. J Reprod Med 1988;33:503-9 «PMID: 2841459»PubMed
- van de Nieuwenhof HP, van der Avoort IA, de Hullu JA. Review of squamous premalignant vulvar lesions. Crit Rev Oncol Hematol 2008;68:131-56 «PMID: 18406622»PubMed
- Goffin F, Mayrand MH, Gauthier P ym. High-risk human papillomavirus infection of the genital tract of women with a previous history or current high-grade vulvar intraepithelial neoplasia. J Med Virol 2006;78:814-9 «PMID: 16628584»PubMed
- van Esch EM, Dam MC, Osse ME ym. Clinical characteristics associated with development of recurrence and progression in usual-type vulvar intraepithelial neoplasia. Int J Gynecol Cancer 2013;23:1476-83 «PMID: 24257562»PubMed
- van de Nieuwenhof HP, Massuger LF, van der Avoort IA ym. Vulvar squamous cell carcinoma development after diagnosis of VIN increases with age. Eur J Cancer 2009;45:851-6 «PMID: 19117749»PubMed
- De Vuyst H, Clifford GM, Nascimento MC ym. Prevalence and type distribution of human papillomavirus in carcinoma and intraepithelial neoplasia of the vulva, vagina and anus: a meta-analysis. Int J Cancer 2009;124:1626-36 «PMID: 19115209»PubMed
- Insinga RP, Liaw KL, Johnson LG ym. A systematic review of the prevalence and attribution of human papillomavirus types among cervical, vaginal, and vulvar precancers and cancers in the United States. Cancer Epidemiol Biomarkers Prev 2008;17:1611-22 «PMID: 18628412»PubMed
- Smith JS, Backes DM, Hoots BE ym. Human papillomavirus type-distribution in vulvar and vaginal cancers and their associated precursors. Obstet Gynecol 2009;113:917-924 «PMID: 19305339»PubMed
- Seksitaudit. Suomalaisen Lääkäriseuran Duodecimin ja Sukupuolitautien Vastustamisyhdistys ry:n asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim, 2018 (viitattu 22.1.2021). Saatavilla internetissä: www.kaypahoito.fi
- Kokka F, Singh N, Faruqi A ym. Is differentiated vulval intraepithelial neoplasia the precursor lesion of human papillomavirus-negative vulval squamous cell carcinoma? Int J Gynecol Cancer 2011;21:1297-305 «PMID: 21946295»PubMed
- Cooper SM, Wojnarowska F. Influence of treatment of erosive lichen planus of the vulva on its prognosis. Arch Dermatol 2006;142:289-94 «PMID: 16549703»PubMed
- Moore RA, Edwards JE, Hopwood J ym. Imiquimod for the treatment of genital warts: a quantitative systematic review. BMC Infect Dis 2001;1:3 «PMID: 11401728»PubMed
- Cardosi RJ, Bomalaski JJ, Hoffman MS. Diagnosis and management of vulvar and vaginal intraepithelial neoplasia. Obstet Gynecol Clin North Am 2001;28:685-702 «PMID: 11766145»PubMed
- Nelson EL, Bogliatto F, Stockdale CK. Vulvar Intraepithelial Neoplasia (VIN) and Condylomata. Clin Obstet Gynecol 2015;58:512-25 «PMID: 26133495»PubMed
- Modesitt SC, Waters AB, Walton L ym. Vulvar intraepithelial neoplasia III: occult cancer and the impact of margin status on recurrence. Obstet Gynecol 1998;92:962-6 «PMID: 9840558»PubMed
- Preti M, Scurry J, Marchitelli CE ym. Vulvar intraepithelial neoplasia. Best Pract Res Clin Obstet Gynaecol 2014;28:1051-62 «PMID: 25106700»PubMed
- Junge J, Poulsen H, Horn T ym. Prognosis of vulvar dysplasia and carcinoma in situ with special reference to histology and types of human papillomavirus (HPV). APMIS 1997;105:963-71 «PMID: 9463515»PubMed
- Mathiesen O, Buus SK, Cramers M. Topical imiquimod can reverse vulvar intraepithelial neoplasia: a randomised, double-blinded study. Gynecol Oncol 2007;107:219-22 «PMID: 17655918»PubMed
- Tainio K, Jakobsson M, Louvanto K ym. Randomised trial on treatment of vaginal intraepithelial neoplasia-Imiquimod, laser vaporisation and expectant management. Int J Cancer 2016;139:2353-8 «PMID: 27428506»PubMed
- Guideline on Lichen Sclerosus. Developed by the Guideline Subcommittee of the European Dermatology Forum, 2014. http://www.euroderm.org/edf/index.php/edf-guidelines «http://www.euroderm.org/edf/index.php/edf-guidelines»29
- Lee A, Bradford J, Fischer G. Long-term Management of Adult Vulvar Lichen Sclerosus: A Prospective Cohort Study of 507 Women. JAMA Dermatol 2015;151:1061-7 «PMID: 26070005»PubMed
- Management of vulvar intraepithelial neoplasia. Committee Opinion No. 509. American College of Obstetricians and Gynecologists. (Reaffirmed 2014) Obstet Gynecol 2011;118:1192–4.
- SUMMARY of the Twenty-third World Congress of the ISSVD. July 27-29, 2015
- Day T, Marzol A, Pagano R ym. Clinicopathologic Diagnosis of Differentiated Vulvar Intraepithelial Neoplasia and Vulvar Aberrant Maturation. J Low Genit Tract Dis 2020;24:392-398 «PMID: 32976294»PubMed
- Yang B, Hart WR. Vulvar intraepithelial neoplasia of the simplex (differentiated) type: a clinicopathologic study including analysis of HPV and p53 expression. Am J Surg Pathol 2000;24:429-41 «PMID: 10716158»PubMed
- Thuijs NB, van Beurden M, Bruggink AH ym. Vulvar intraepithelial neoplasia: Incidence and long-term risk of vulvar squamous cell carcinoma. Int J Cancer 2021;148:90-98 «PMID: 32638382»PubMed
- McAlpine JN, Kim SY, Akbari A ym. HPV-independent Differentiated Vulvar Intraepithelial Neoplasia (dVIN) is Associated With an Aggressive Clinical Course. Int J Gynecol Pathol 2017;36:507-516 «PMID: 28319571»PubMed
- Jenkins TM, Mills AM. Putative precancerous lesions of vulvar squamous cell carcinoma. Semin Diagn Pathol 2021;38:27-36 «PMID: 32948383»PubMed
- Spekreijse JJ, Streng BMM, Vermeulen RFM ym. The risk of developing squamous cell carcinoma in patients with anogenital lichen sclerosis: A systematic review. Gynecol Oncol 2020;157:671-677 «PMID: 32089333»PubMed
- Pouwer AW, VAN DEN Einden LCG, VAN DER Linden M ym. Clonal Relationship Between Lichen Sclerosus, Differentiated Vulvar Intra-epithelial Neoplasia and Non HPV-related Vulvar Squamous Cell Carcinoma. Cancer Genomics Proteomics 2020;17:151-160 «PMID: 32108037»PubMed
- Lee A, Bradford J, Fischer G. Long-term Management of Adult Vulvar Lichen Sclerosus: A Prospective Cohort Study of 507 Women. JAMA Dermatol 2015;151:1061-7 «PMID: 26070005»PubMed
- Halonen P, Jakobsson M, Hiltunen-Back E. Ulkosynnytinten valkojäkälä. Duodecim. 2019;135(3):297-302
- Day T, Wilkinson E, Rowan D ym. Clinicopathologic Diagnostic Criteria for Vulvar Lichen Planus. J Low Genit Tract Dis 2020;24:317-329 «PMID: 32205763»PubMed
- Ioannides D, Vakirlis E, Kemeny L ym. European S1 guidelines on the management of lichen planus: a cooperation of the European Dermatology Forum with the European Academy of Dermatology and Venereology. J Eur Acad Dermatol Venereol 2020;34:1403-1414 «PMID: 32678513»PubMed
- Kennedy CM, Peterson LB, Galask RP. Erosive vulvar lichen planus: a cohort at risk for cancer? J Reprod Med 2008;53:781-4 «PMID: 19004404»PubMed
- Cooper SM, Wojnarowska F. Influence of treatment of erosive lichen planus of the vulva on its prognosis. Arch Dermatol 2006;142:289-94 «PMID: 16549703»PubMed

