Minnessjukdomar
Hur kan man hänvisa till God medicinsk praxis-rekommendationen? «K1»1
Den här svenskspråkiga God medicinsk praxis-rekommendationen har översatts från den finska God medicinsk praxis-rekommendationen (Käypä hoito -suositus Muistisairaudet «Muistisairaudet»1). Om det finns skillnader i texterna gäller den uppdaterade finskspråkiga versionen.
Huvudsakligen finns evidenssammandragen och bakgrundsmaterialen samt internetlänkarna på finska.
Centrala rekommendationer
- Minnessjukdomar, även Alzheimers sjukdom (AS), kan sannolikt förebyggas genom att påverka kända riskfaktorer, såsom högt blodtryck.
- 5,3–16,3 procent av dem som är 45 år eller äldre och upp till var tredje person över 65 år upplever problem med informationsbearbetningen. Se «Taylor CA, Bouldin ED, McGuire LC. Subjective Cogn...»1, «https://www.cdc.gov/aging/data/subjective-cognitive-decline-brief.html»1.
- 0,6 procent av européerna under 65 år har bedömts ha en minnessjukdom som uppfyller kriterier för demens. Demens blir vanligare med åldern; 22 procent av 85–89-åringarna och hela 41 procent av dem som är 90 år och äldre har en demenssjukdom. Se «https://www.alzheimer-europe.org/dementia/prevalence-dementia-europe»2.
- I Finland diagnostiseras i genomsnitt 23 000 personer per år med en minnessjukdom och över 150 000 personer har en diagnostiserad minnessjukdom.
- En betydande del av minnessjukdomarna förblir odiagnostiserade.
- Enligt FPA:s statistik över läkemedelsersättningar använde cirka 86 000 personer något läkemedel för minnessjukdom i Finland 2019. Dessutom finns det en stor grupp människor med minnessjukdom som inte har någon indikation för läkemedel för minnessjukdom eller som har lindrigare problem med informationsbearbetningen. Se «https://thl.fi/fi/web/kansantaudit/muistisairaudet/muistisairauksien-yleisyys»3.
- De vanligaste progressiva minnessjukdomarna är AS, vaskulär kognitiv försämring (VCI) eller minnessjukdom i samband med cerebrovaskulär sjukdom (CVS: storkärlssjukdom, småkärlssjukdom och infarkter i områden som är kritiska för informationsbearbetningen), AS + CVS, sjukdomar i anslutning till Lewykroppspatologin, såsom Lewykroppssjukdom (LBD), minnessjukdom vid Parkinsons sjukdom samt pann-tinninglobsdegeneration (pannlobsdemens och primär progressiv afasi). Särskilt hos äldre personer konstateras ofta fynd som passar in på flera sjukdomar.
- Orsaken till problem med informationsbearbetningen som patienten uttrycker ska utredas.
- Hörnstenarna i utredningen är en klinisk intervju och undersökning som genomförs av
en läkare, minnesenkäter och minnestester, laboratorieundersökningar och bilddiagnostiska
undersökningar av hjärnan.
- Undersökningarna och uppföljningen av vården ska koncentreras till särskilt insatta vårdenheter, till exempel regionala minnespolikliniker.
- Personer i arbetsför ålder hänvisas till en neurologisk poliklinik.
- Diagnosen Alzheimers sjukdom (AS) kräver förtrogenhet med hur den kliniska symtombilden och resultaten av de biologiska markörerna kombineras. Diagnosen ska inte ställas enbart utifrån biologiska faktorer, såsom bilddiagnostiska fynd.
- Vid diagnosen AS, minnessjukdom vid Parkinsonssjukdom, LBD, AS + CVS, AS + LBD eller
AS + minnessjukdom vid Parkinsons sjukdom ska man alltid överväga riktad symtomatisk
behandling med läkemedel för minnessjukdom.
- Vid behandling av AS används läkemedel för minnessjukdom (en av tre acetylkolinesterashämmare eller memantin). Vid tidig och lindrig AS rekommenderas någon av de tre acetylkolinesterashämmarna. Acetylkolinesterashämmare och memantin är den primära behandlingen av medelsvår eller svår AS.
- Vid minnessjukdom i samband med cerebrovaskulär sjukdom kan läkemedel för minnessjukdom vara till nytta för kognitionen (informationsbearbetningen) men inte för självständigheten. VCI eller vaskulär demens (VD) är inte en officiell indikation för något undersökt läkemedel i Europa (EMA) eller USA (FDA), men dessa läkemedel kan användas enligt individuell prövning.
- AS-patienter med samtidig cerebrovaskulär sjukdom kan ha nytta av läkemedel för minnessjukdom.
- Den primära behandlingen av symtom på minnessjukdom vid Parkinsons sjukdom är läkemedel som innehåller acetylkolinesterashämmare. Av läkemedlen i denna grupp är det endast officiell indikation för rivastigmin.
- Acetylkolinesterashämmare är också till nytta vid behandling av symtom vid Lewykroppssjukdom, men är inte en officiell indikation för det.
- Vid pann-tinninglobsdegeneration, inklusive språkliga varianter, ska i regel inte acetylkolinesterashämmare eller memantin användas.
- Efter diagnosen minnessjukdom inleds alltid läkemedelsfri behandling «Muistisairauden lääkkeetön hoito»1.
- Förebyggande och regelbunden kartläggning av neuropsykiatriska symtom ingår i uppföljningen av patienter med minnesjukdom.
- Vid behandling av de flesta neuropsykiatriska symtom är läkemedelsfria behandlingar primära.
- Den primära läkemedelsbehandlingen av neuropsykiatriska symtom är ändamålsenlig läkemedelsbehandling av minnessjukdomen.
- Vid användning av psykofarmaka ska behovet av dem följas upp regelbundet.
- Depressions- eller psykosmedicinering kan behövas vid behandling av svåra symtom på depression, rastlöshet och psykos. En del av de svåra neuropsykiatriska symtomen, såsom att personen skriker och vandrar omkring, reagerar inte på läkemedelsbehandling.
- Psykosläkemedel kan öka antalet cirkulationsstörningar i hjärnan och dödligheten hos patienter med minnessjukdomar, och därför ska användningen av dem begränsas till svårare psykotiska och neuropsykiatriska symtom som ger sig uttryck i form av rastlöshet eller aggressivitet.
- Särskilt äldre personer med minnessjukdom har nytta av en helhetsbedömning där man samtidigt tar ställning till andra sjukdomar och medicineringen i sin helhet.
- Att ta hand om hjärnhälsan är ett effektivt sätt att förebygga minnessjukdomar.
Målsättning
- Målsättningen med rekommendationen är att
- främja förebyggandet av de vanligaste minnessjukdomarna samt identifieringen och behandlingen av riskfaktorer
- effektivisera och förenhetliga diagnostiseringen samt den övergripande vården och rehabiliteringen av personer med kognitiva symtom och personer med progressiva minnessjukdomar.
Målgrupper
- Rekommendationen är avsedd för
- läkare och andra yrkesgrupper inom hälso- och sjukvården, socialarbetet och apoteksbranschen samt studerande inom branschen
- beslutsfattare inom social- och hälsovården
- i tillämpliga delar för patienter med minnessjukdom och deras närstående.
Avgränsning av ämnet
- Rekommendationen behandlar förebyggande, diagnostik och behandling av de vanligaste progressiva minnessjukdomarna.
- Behandlingen av minnessjukdomar består av mycket olika slags åtgärder som stöder patienten och dennes närstående. Denna rekommendation tar upp åtgärder som det finns forskningsdata om. Arbetsgruppen vill betona att läkemedelsbehandling är till nytta endast när den ingår i en omfattande vårdhelhet.
Definitioner
- Definitionerna beskrivs i tilläggsmaterialet «Muistisairauksiin liittyviä määritelmiä»2.
Förekomsten av minnesssymtom och minnessjukdomar
- 5,3–16,3 procent av dem som är 45 år eller äldre och upp till var tredje vithyad person över 65 år upplever problem med informationsbearbetningen. Många av dem har ingen minnessjukdom. Se «Taylor CA, Bouldin ED, McGuire LC. Subjective Cogn...»1, «https://www.cdc.gov/aging/data/subjective-cognitive-decline-brief.html»1.
- 0,6 procent av européerna under 65 år har bedömts ha en demenssjukdom. Demens blir vanligare med åldern; 22 procent av 85–89-åringarna och hela 41 procent av dem som är 90 år och äldre har en demenssjukdom (se «https://www.alzheimer-europe.org/dementia/prevalence-dementia-europe»2).
- I Finland har man tidigare bedömt att det utifrån internationella epidemiologiska undersökningar finns 200 000 personer som har lindrigt försämrad informationsbearbetning «Lobo A, Launer LJ, Fratiglioni L, ym. Prevalence o...»2. I Finland finns det över 150 000 personer som har en diagnostiserad minnessjukdom «Roitto HM, Lindell E, Koskinen S, Sarnola K, Kopon...»3.
- Enligt FPA:s statistik över läkemedelsersättningar använde cirka 86 000 personer något läkemedel för minnessjukdom i Finland 2019. Dessutom finns det ett stort antal personer med minnessjukdom som inte har någon indikation för läkemedel för minnessjukdom, som inte tål dem, som har en odiagnostiserad sjukdom eller som har lindrigare problem med informationsbearbetningen. Se «https://thl.fi/fi/web/kansantaudit/muistisairaudet/muistisairauksien-yleisyys»3.
- Cirka 7 000–10 000 personer i arbetsför ålder har minnessjukdomar «Lobo A, Launer LJ, Fratiglioni L, ym. Prevalence o...»2, «Gardner RC, Valcour V, Yaffe K. Dementia in the ol...»4.
- I Finland diagnostiseras minnessjukdom hos i genomsnitt 23 000 personer årligen «Roitto HM, Lindell E, Koskinen S, Sarnola K, Kopon...»3.
- Om en hälsocentralläkare vårdar en befolkning på 2 200 personer, finns det uppskattningsvis 20 personer som lider av minnessjukdom bland dem och årligen framkommer 5 nya fall «Viramo P, Sulkava R. Muistihäiriöiden ja dementian...»5.
- Största delen av patienterna som får permanent vård dygnet runt har demens «Noro A, Finne-Soveri H, Björkgren M ym. Quality an...»6.
- AS ligger bakom progressiva minnessymtom och demens i över 60 procent av fallen «Jellinger K, Danielczyk W, Fischer P, ym. Clinicop...»7, «Neuropathology Group. Medical Research Council Cog...»8.
- Minnessjukdom i samband med cerebrovaskulär sjukdom, dvs. vaskulär kognitiv försämring, utgör 15–20 procent av fallen och Alzheimers sjukdom i kombination med cerebrovaskulär sjukdom (AS + CVS) 10 procent av fallen. I tidigare finländska undersökningar har prevalenstalen varit likartade «Mölsä PK, Marttila RJ, Rinne UK. Epidemiology of d...»9, «Sulkava R, Wikström J, Aromaa A, ym. Prevalence of...»10, «Juva K, Sulkava R, Erkinjuntti T ym. Prevalence of...»11, «Muistihäiriöt ja dementia. Alhainen K, Erkinjuntti...»12.
- Lewykroppssjukdom (minnessjukdom vid Parkinsons sjukdom, LBD och AS + LBD) utgör cirka 10–15 procent av fallen. Minnessjukdom vid Parkinsons sjukdom uppskattas utgöra cirka 3–4 procent av alla fall av minnesjukdomar «Emre M, Aarsland D, Brown R, ym. Clinical diagnost...»13, «Aarsland D, Zaccai J, Brayne C. A systematic revie...»14.
- Hos äldre personer är det vanligt att flera patologier förekommer samtidigt «Jellinger KA, Attems J. Challenges of multimorbidi...»15, «Jellinger KA, Attems J. Prevalence of dementia dis...»16.
- Pann-tinninglobsdegeneration är den näst vanligaste orsaken till progressiv demenssjukdom hos personer i arbetsför ålder «Chiari A, Vinceti G, Adani G, ym. Epidemiology of ...»17, «Devenney EM, Ahmed RM, Hodges JR. Frontotemporal d...»18, «Kelley BJ, Boeve BF, Josephs KA. Young-onset demen...»19.
- Pannlobsdemens omfattar cirka hälften av fallen av panntinninglobsdegeneration «Ioannidis P, Konstantinopoulou E, Maiovis P, ym. T...»20.
Riskfaktorer för minnessjukdomar och möjligheter att förebygga dem
- Åldern är den viktigaste riskfaktorn för exponering och därmed försämrad informationsbearbetning, minnessymtom och demens. Största delen av personerna med minnessjukdom är äldre.
- Åldersrelaterade förändringar bidrar tillsammans med andra faktorer som försämrar (eller skyddar) hjärnans funktion till uppkomsten av kliniska symtom.
- Hos äldre personer är minnessjukdom ofta ett multifaktoriellt syndrom.
- Riskfaktorer som enligt epidemiologiska undersökningar i huvudsak förknippas med minnessymtom
presenteras i tabell «Faktorer som enligt epidemiologiska undersökningar är förknippade med hjärnans funktion
och risken för minnessjukdom. Listan är inte fullständig, samband innebär inte nödvändigtvis
orsakssamband och faktorerna har inte presenterats i prioritetsordning. Källor , ,
, , , , , , , , , , , , , , , , , ....»1.
- Centrala bland dessa är vanliga riskfaktorer för artärsjukdomar, såsom högt blodtryck, dyslipidemi, störningar i sockeromsättningen, rökning, övervikt i medelåldern och låg fysisk aktivitet.
- Det har också konstaterats att flera andra faktorer, såsom riklig alkoholkonsumtion, hörselnedsättning och psykosociala faktorer, har samband med nedsatt kognition.
- Orsaken till neurodegenerativa sjukdomar (Alzheimers sjukdom, pannlobsdemens, Lewykroppsdemens) är dock fortfarande okänd med undantag av genetiska orsaker.
- Utifrån epidemiologiska observationer har riskindikatorer utvecklats (bl.a. CAIDE «Kivipelto M, Ngandu T, Laatikainen T, ym. Risk sco...»21). De används för att försöka bedöma den framtida risken för minnessjukdom hos personer i medelåldern «Muistisairauden riskimittari»3. Prognosvärdet hos sådana indikatorer har dock kritiserats «Kivimäki M, Livingston G, Singh-Manoux A, ym. Esti...»22.
- Man ska ingripa i observerade riskfaktorer i tid med livsstilsförändringar och vid behov med läkemedelsbehandling. Detta är beaktansvärt redan på rådgivningen samt inom skol- och företagshälsovården.
- Man kan också tänka sig att det bästa sättet att förebygga försämrad informationsbearbetning,
minnessjukdomar och demens är att iaktta sunda levnadsvanor och ta hand om hjärnans
hälsa under hela livet.
- Dock torde det i stället för en preventiv metod snarare vara fråga om att skjuta upp sjukdomsutbrottet till senare i livet «Chen Y, Araghi M, Bandosz P, ym. Impact of hyperte...»23, vilket också är ett viktigt mål.
- I randomiserade behandlingsstudier har man utöver den egentliga kliniska sjukdomen (diagnostiserad minnessjukdom, såsom AS) som ändpunkter använt mild kognitiv nedsättning (mild cognitive impairment, MCI «Lievä tiedonkäsittelyn heikentyminen (MCI)»4), försämring av informationsbearbetningen eller biologiska markörer på minnessjukdomar «Andrieu S, Coley N, Lovestone S, ym. Prevention of...»24.
- Centrala resultat av kliniska undersökningar för att förebygga minnessjukdomar har
samlats i tilläggsmaterialet «Keskeisiä satunnaistettuja kognitiivisten toimintojen heikentymisen tai vanhuusiän muistisairauden ehkäisytutkimuksia»5.
- Det finns många studier, men de har varit kortvariga med tanke på den långa utvecklingskurvan för minnessjukdom och oftast inriktade på endast en riskfaktor. I regel har resultaten varit negativa.
- När resultaten från flera undersökningar kombineras verkar det som om en medicinsk sänkning av blodtrycket motverkar lindrig kognitiv nedsättning och klinisk minnessjukdom «Verenpaineen lääkkeellinen alentaminen estää lievää kognitiivista heikentymistä ja kliinistä muistisairautta.»A under behandlingstiden «Hughes D, Judge C, Murphy R, ym. Association of Bl...»25.
- I en studie (FINGER) kunde man genom multifaktoriell intervention förhindra eller bromsa upp kognitiv försämring «Ngandu T, Lehtisalo J, Solomon A, ym. A 2 year mul...»26.
- Undersökningarna om förebyggande av minnessjukdomar och demens och tolkningen av dem innehåller flera problem och felkällor som beskrivs närmare i översikterna «Andrieu S, Coley N, Lovestone S, ym. Prevention of...»24 och «Solomon A, Mangialasche F, Richard E, ym. Advances...»27 och i tilläggsmaterialet «Muistisairauksien ehkäisyä ja hoitoa koskevien tutkimusten ongelmia ja virhelähteitä»6.
- Sammandraget Lancet Commission 2020 «Livingston G, Huntley J, Sommerlad A, ym. Dementia...»28 om förebyggande av minnessjukdomar på befolknings- och individnivå presenteras i tabell «Metoder för att förebygga demenssjukdomar enligt Lancet Commission 2020 ...»2.
- Tills vidare finns det ingen stark evidens på hur behandlingen av riskfaktorer påverkar
förloppet av en minnessjukdom som redan har brutit ut (sekundärprevention).
- Med beaktande av patientens helhetssituation är det dock skäl att behandla riskfaktorerna för artärsjukdomar även efter diagnosen demenssjukdom.
- Rehabiliterande motion har konstaterats förbättra minnessjuka personers fysiska funktionsförmåga och förmåga att klara av de dagliga funktionerna «Liikunta kohentaa muistisairaiden fyysistä toimintakykyä ja suoriutumista päivittäistoiminnoista.»A.
- Se Hjärnhuset/Demenssjukdomar på webbplatsen Hälsobyn «https://www.terveyskyla.fi/sv/hjarnhuset/hjarnsjukdomar/demenssjukdoma»4r samt riskmätare i tilläggsmaterialet «Muistisairauden riskimittari»3 eller THL:s risktest för minnessjukdom «https://thl.fi/fi/web/kansantaudit/muistisairaudet/muistisairauden-riskitesti»5.
- Rekommendationer om förebyggande av demenssjukdomar har utfärdats av bland annat social- och hälsovårdsministeriet (SHM) i det nationella åldersprogrammet «https://stm.fi/sv/det-nationella-aldersprogrammet»6, WHO, Lancet Commission 2 och det nationella programmet för hjärnhälsa «https://www.aivoliitto.fi/se/nationellaprogrammetforhjarnhalsa/»7.
PÅ BEFOLKNINGSNIVÅ
PÅ INDIVIDNIVÅ
|
Orsaker till minnessymtom och andra kognitiva symtom
- Minnet är en komplicerad intellektuell funktion som bygger på omfattande samverkan mellan nervnätverken i hjärnan.
- Mekanismerna vid minnessymtom är
- en lokal skada i det område av hjärnan som är kritiskt för informationsbearbetningen
- störningar i hjärnans ämnesomsättning, nervceller och nervnät.
- Vanliga orsaker till minnessymtom är övergående orsaker, bestående följdtillstånd och progressiva sjukdomar (tabell «Vanliga orsaker till minnessymtom och andra kognitiva symtom ...»3) samt orsaker som kan botas med behandling (tabell «Orsaker till minnessymtom som kan botas...»4), oberoende av minnesstörningens mekanism.
- Särskilt hos äldre personer förekommer betydande multipatologi, vilket innebär att de till exempel kan ha flera neurodegenerativa sjukdomar samtidigt och dessutom faktorer som förvärrar symtomen.
- Läkemedel som försvagar acetylkolinfunktionen (antikolinergiskt) förvärrar problem med informationsbearbetningen (tabell «De vanligaste antikolinerga läkemedlen ...»5), «Muistisairaille ongelmalliset lääkevalmisteet ja niiden haittavaikutukset»8, «Carrière I, Fourrier-Reglat A, Dartigues JF, ym. D...»47.
- Hos personer som länge använt bensodiazepiner har förekomsten av minnessjukdomar ökat, men för att bättre förstå associationen mellan dem och den ökade risken för minnessjukdomar och ett eventuellt orsakssammanhang behövs ännu fler prospektiva undersökningar «Bentsodiatsepiineja pitkään käyttäneillä muistisairauksien esiintyminen on lisääntynyt, mutta bentsodiatsepiinien ja muistisairauksien riskin kasvun välisen assosiaation ja mahdollisen syy-seuraussuhteen ymmärtämiseksi paremmin tarvitaan vielä lisää prospektiivisia tutkimuksia.»C.
- Utöver grundorsaken har patienten med minnessjukdom ofta andra faktorer som försämrar
prestationsförmågan och som kräver behandling (tabell «Faktorer som sekundärt försämrar prestationsförmågan hos personer med minnessymtom
och personer med minnessjukdom ...»6).
- Alkoholkonsumtion samt användning av läkemedel och berusningsmedel och deras inverkan på informationsbearbetningen ska beaktas vid utredning av minnessymtom «Alkoholin käyttöön liittyvä muistisairaus»9.
| Övergående | Bestående följdtillstånd | Progressiva |
|---|---|---|
| Cerebrovaskulär sjukdom | Hjärnskada | Alzheimers sjukdom |
| Lindrig hjärnskada | Cerebrovaskulär sjukdom | Cerebrovaskulär sjukdom |
| Epileptiskt anfall | Inflammatoriska hjärnsjukdomar | Lewykroppssjukdom |
| Läkemedel | B1-vitaminbrist | Minnessjukdom vid Parkinsons sjukdom och andra former av minnessjukdom i samband med extrapyramidala sjukdomar (bl.a. multipel systematrofi, progressiv supranukleär pares, kortikobasal degeneration) |
| Berusningsmedel | Operation och strålbehandling | Pann-tinninglobsdegeneration |
| Psykiatriska sjukdomar | Alkoholrelaterad hjärnskada | Prionsjukdomar |
| Förvirring | Sällsynta former av ärftlig demens | |
| Vissa inflammatoriska hjärnsjukdomar (MS) |
| Psykiatriska sjukdomar | Depression Ångest Psykossjukdomar |
| Funktionella kognitiva symtom | En av de vanligaste orsakerna till minnessymtom Minnesproblem eller annat kognitivt problem som patienten upplever och som kan påverka funktionsförmågan men som inte ens i grundliga undersökningar kan förklaras med neurologiska eller psykiatriska orsaker |
| Störningar i ämnesomsättningen | Hypo- och hypertyreos Hypo- och hyperparatyreos Funktionsstörningar i binjuren Lever- och njursvikt Hyponatremi Hypoglykemi |
| Bristtillstånd | B12-vitamin (kobalamin) Nikotinsyra (niacin, B3-vitamin) Folsyra (vitamin B9) B1-vitamin (tiamin) |
| Infektioner i centrala nervsystemet | Lues Tuberkulos Borrelios HIV-infektion Herpes |
| Intrakraniella orsaker | Benign hjärntumör Subduralhematom Normaltryckshydrocefalus |
| Neuroimmunologiska orsaker | Autoimmuna encefaliter Paraneoplastiska orsaker |
| Hjärnhypoxi och ischemi | Kronisk lungsjukdom Sömnapné Hypotension Hypoperfusion Svår anemi Polycytemi |
| Läkemedel och gifter som angriper det centrala nervsystemet | Antikolinergika Sedativa Organiska lösningsmedel Alkohol och andra berusningsmedel Vissa metaller |
| Läkemedelsgrupp | Läkemedel |
|---|---|
| 1) Effekten i det centrala nervsystemet kan vara mindre än för andra läkemedel i gruppen på basis av några genomförda studier. | |
| Antikolinergika för urinvägsbesvär (läkemedel avsedda för behandling av trängningsinkontinens) | Oxybutynin Trospium Fesoterodin Tolterodin1) Darifenacin1) Solifenacin1) |
| Gamla läkemedel mot Parkinsons sjukdom | Biperiden |
| Traditionella psykosläkemedel | Levomepromazin Perfenazin Proklorperazin Flufenazin Periciazin Zuklopentixol Klorprotixen Flupentixol |
| Tricykliska antidepressiva medel | Doxepin Amitriptylin Nortriptylin Klomipramin |
| Andra antikolinerga läkemedel | Orfenadrin Hydroxizin |
| Läkemedel som används vid behandling av KOL (COPD), tiotropium, ipratropium, glykopyrroniumbromid och umeklidiniumbromid, är rena antikolinergika, men hypoxemi orsakad av KOL är sannolikt farligare för hjärnan än antikolinergikan i dessa läkemedel! | |
| Olämplig medicinering och interaktioner |
| Berusningsmedel |
| Infektioner |
| Undernäring, uttorkning |
| Funktionsstörning i hjärtat och lungorna |
| Störning i ämnesomsättningen |
| Bristtillstånd |
| Störning i sömn-/vakenhetsrytmen |
| Affektiva störningar och ångeststörning |
| Agitation, paranoia, vanföreställningar, hallucinationer (ofta symtom på demenssjukdom) |
| Miljö som är för stimulerande eller inte tillräckligt stimulerande |
| Svår social situation, social isolering |
Diagnostik och bedömning av symtom
- Orsaken till minnessymtom och andra kognitiva symtom ska utredas. Se rekommendation från the European Academy of Neurology «https://www.ean.org/Reference-Center.2699.0.html»8 ja American Academy of Neurology «https://www.aan.com/Guidelines/Home/ByTopic?topicId=15»9, «Suhonen J, Alhainen K, Eloniemi-Sulkava U ym. Hyvä...»48, «Sorbi S, Hort J, Erkinjuntti T, ym. EFNS-ENS Guide...»49, «Suomen muistitutkimusyksiköiden asiantuntijaryhmä....»50, «Lindsberg P, Rinne J (toim.) Teema: Alzheimerin ta...»51, «Teema: Muistisairaudet. Suom Lääkäril 2022;77;574-...»52.
- Undersökningarna består av
- grundläggande utredningar
- tilläggsundersökningar (Interaktivt schema för grundläggande utredning av demenssymtom «https://www.kaypahoito.fi/khi00016»10).
- För att diagnostisera minnessjukdomar och för vårdbedömning krävs specialkompetens
och erfarenhet.
- Undersökningarna och uppföljningen av vården ska koncentreras till särskilt insatta vårdplatser, till exempel en regional minnespoliklinik «Suhonen J, Alhainen K, Eloniemi-Sulkava U ym. Hyvä...»48, «Krüger, Rosenvall, Solje. Muistisairauden varhaine...»53, «Melkas S, Jokinen H Putaala J, Valanne L, Hietanen...»54, «Krüger J, Katisko K, Suhonen N-M, Haapasalo A, Rem...»55, «Kaakkola S ja Laaksovirta H. Tunnistatko harvinais...»56, «Eloniemi-Sulkava U, Rahkonen T, Erkinjuntti T, Kar...»57.
- Personer i arbetsför ålder hänvisas till en neurologisk poliklinik «Juva K, Paajanen T, Remes A. Työikäisen etenevä mu...»58.
- Om misstanke om progressiv minnessjukdom uppstår och diagnos ännu inte kan ställas, ska patienten följas upp regelbundet med 6–12 månaders mellanrum.
- Tillförlitlig diagnostik av minnessjukdom och tolkning av diagnostiska indikatorer störs avsevärt av samtidig förvirring, svåra psykiatriska symtom eller till exempel utmattning i anslutning till en annan sjukdom.
- Diagnostik, symtombedömning och uppföljning av patienten beskrivs närmare i tilläggsmaterialet «Muistisairauden diagnostiikka, oireiden arviointi ja sairauden seuranta»10.
- Mer information om diagnostiska kriterier finns i tabell «Diagnostiska kriterier för minnessjukdomar. Patientanvisningar se Hjärnhuset/Minnessjukdomar ....»7 och i tilläggsmaterialet «Vaskulaarisen muistisairauden NINDS-AIREN-kriteerit vuodelta 1993»11, «Uudet Alzheimerin taudin diagnostiset kriteerit vuodelta 2021»12 och «Otsa-ohimolohkorappeumien diagnostiset kriteerit»13.
- Information till patienten vid misstanke om minnessjukdom, se Hjärnhuset/Demenssjukdomar på webbplatsen Hälsobyn «https://www.terveyskyla.fi/sv/hjarnhuset/hjarnsjukdomar/minnessjukdomar»11.
Grundläggande utredningar
- Syftet med de grundläggande utredningarna är att
- hitta tillstånd som kräver specifik behandling, varav den viktigaste är depression (tabell «Orsaker till minnessymtom som kan botas...»4)
- identifiera de vanligaste minnessjukdomarna med typisk symtombild «Soininen H. Muistihäiriöpotilaan neurologisten löy...»66, (tabellerna «Symtom som i början av en minnessjukdom tyder på en mer sällsynt orsak till minnessjukdom än Alzheimers sjukdom. Källa ....»8, «De viktigaste tidiga fynden för minnessjukdomar. Källa ....»9 och «Neurologiskt fynd som diagnostiskt tips i tidigt stadium av minnessjukdom. Källa ....»10)
- identifiera situationer som kräver specialkompetens.
- En omsorgsfull anamnes och en intervju med en närstående är hörnstenar i diagnostiken «Pulliainen V, Kuikka P, Salo J, Viramo P, Erkinjun...»67.
- Följande ska utredas:
- den så kallade grundkapaciteten för patientens informationsbearbetning och uppnådd prestationsnivå (skolframgång, utbildningsnivå, eventuella särskilda svårigheter, såsom läs- och skrivsvårigheter, arbetshistoria)
- det allmänna hälsotillståndet
- faktorer som försämrar hjärnans funktion (se tabell «Faktorer som enligt epidemiologiska undersökningar är förknippade med hjärnans funktion och risken för minnessjukdom. Listan är inte fullständig, samband innebär inte nödvändigtvis orsakssamband och faktorerna har inte presenterats i prioritetsordning. Källor , , , , , , , , , , , , , , , , , , , ....»1)
- medicinering (se tabell «De vanligaste antikolinerga läkemedlen ...»5)
- användning av berusningsmedel.
- Bedömning av minnessymtom «Pulliainen V, Kuikka P, Salo J, Viramo P, Erkinjun...»67, «Pulliainen V, Hänninen T, Kuikka P, Erkinjuntti T....»68, «Kuikka P, Pulliainen V, Salo J, Erkinjuntti T. Mui...»69:
- första symtom (symtom i anslutning till informationsbearbetning och eventuella neuropsykiatriska symtom)
- hur symtomen utvecklas och framskrider samt hur de påverkar funktionsförmågan och hjälpbehovet
- Se även Suomen muistiasiantuntijat ry – Välineitä työhösi «http://www.sumut.fi/valineita-tyohosi»12
- Minnesenkät till patienten på finska «https://sumut.fi/wp-content/uploads/2020/02/Muistikysely-potilaalle.pdf»13 och på svenska «https://sumut.fi/wp-content/uploads/2020/02/minnesfrgan-till-patienten.pdf»14
- Minnesenkät till närstående på finska «https://sumut.fi/wp-content/uploads/2020/02/Muistikysely-omaiselle.pdf»15 och på svenska «https://sumut.fi/wp-content/uploads/2020/02/Minnesformulr-till-nrstende.pdf»16.
- Klinisk undersökning:
- klinisk neurologisk undersökning: gång och rörelseförmåga, halvsidiga symtom, symtom av Parkinsontyp, tal, ögonrörelser och apraxi
- allmäntillstånd och cirkulationsorganens tillstånd
- Direkta antikoagulantia kan vara till nytta för den kognitiva funktionen hos patienter med förmaksflimmer «Suorista antikoagulanteista saattaa olla hyötyä kognitiivisen toiminnan kannalta eteisvärinäpotilailla.»C, «Bezabhe WM, Bereznicki LR, Radford J, ym. Oral Ant...»70.
- Bedömning av minne och informationsbearbetning (kognition) (se även tilläggsmaterial
«Muistipotilaan arviointi ja arvioinnin työkalut»18)
- intervju med patienten: vakenhetsnivå, koncentration och orientering, omdömes- och resonemangsförmåga, minne samt talförståelse och talproduktion
- i första hand den kognitiva uppgiftsserien CERAD (Consortium to Establish a Registry
for Alzheimer's Disease) «https://sites.duke.edu/centerforaging/cerad/»17 finsk CERAD-sida «http://www.cerad.fi»18, «Hänninen T, Pulliainen V, Salo J ym. Kognitiiviset...»71, «Hokkanen L, Hänninen T, Pulliainen V ym. Dementian...»72, «Poutiainen E, Hokkanen L, Pulliainen V ym. Neurops...»73, «Sotaniemi M, PirttiläT, Remes A ym. CERAD-tehtäväs...»74, «Pulliainen V, Hänninen T, Hokkanen L ym. Muistihäi...»75, «Hallikainen I, Alenius M, Hokkanen L, Karrasch M, ...»76
- Uppgiftsserien CERAD har validerats för den finländska befolkningen som fyllt 60 år «Hallikainen I, Alenius M, Hokkanen L, Karrasch M, ...»76.
- Se även tilläggsmaterialet «Muistipotilaan arviointi ja arvioinnin työkalut»18.
- en neuropsykologisk undersökning ingår i grundundersökningarna av en person i arbetsför ålder som lider av kognitiva symtom. En neuropsykologisk undersökning är enligt prövning från fall till fall dessutom ofta befogad för patienter med lindriga symtom eller vid differentialdiagnostiska problem «Muistipotilaan neuropsykologinen tutkimus»19.
- i framskridna fall och vid uppföljning Mini-Mental State Examination (MMSE)
- Se Suomen muistiasiantuntijat ry – Välineitä työhösi «http://www.sumut.fi/valineita-tyohosi»12
- Bedömning av neuropsykiatriska symtom «Muistisairaan neuropsykiatristen oireiden arviointi»20:
- intervju med patienten och anhöriga: sinnesstämning och ångest, psykotiska symtom (t.ex. hallucinationer och vanföreställningar), rastlöshet, plötsligt utvecklad förvirring eller annat avvikande beteende och personlighetsförändring
- Vid behov:
- allmänna indikatorer (Suomen muistiasiantuntijat ry - Välineitä työhösi «http://www.sumut.fi/valineita-tyohosi»12: neuropsykiatriset oireet, NPI «https://sumut.fi/wp-content/uploads/2020/02/NPI_150210.pdf»19 och den korta versionen NPI-Q «http://www.sumut.fi/valineita-tyohosi»12)
- symtomspecifika indikatorer, till exempel depressionsmätare, för screening och uppföljning
- GDS (Suomen muistiasiantuntijat ry - Välineitä työhösi «http://www.sumut.fi/valineita-tyohosi»12: geriatrisk depressionsskala «https://sumut.fi/wp-content/uploads/2020/02/GDS-15.pdf»20)
- BDI (depressionsskala)
- FBI-mod (pannlobssymtom)
- stöd för intervjun vid medelsvår och svår demenssjukdom
- Cornells depressionsskala (Suomen muistiasiantuntijat ry - Välineitä työhösi «http://www.sumut.fi/valineita-tyohosi»12: Cornells depressionsskala «https://sumut.fi/wp-content/uploads/2020/02/Cornellin-masennusasteikko.pdf»21)
- hjälpmedlet Muistikka för bedömning och uppföljning av symtom i informationsbearbetningen hos personer med utvecklingsstörning «https://asiakas.kotisivukone.com/files/muistikka.fi.kotisivukone.com/MSV_opasvihko.pdf»22
- bedömning av rastlöshet och ångestsymtom
- Cohen-Mansfields agitationsskala (Suomen muistiasiantuntijat ry - Välineitä työhösi «http://www.sumut.fi/valineita-tyohosi»12: Cohen–Mansfieldin levottomuusasteikko «https://sumut.fi/wp-content/uploads/2020/02/Cohen_Mansfield_levottomuusasteikko_20151023.pdf»23)
- Laboratorieundersökningar:
- blodbild, glukos, natrium, kalium, kalcium, sköldkörtelns, leverns och njurarnas funktion samt vitamin B12
- enligt prövning lipider, sänka och folat
- EKG, särskilt när acetylkolinesterashämmande medicinering övervägs «Muistisairauslääkkeiden haitat ja käytössä huomioitavaa»21
- Bilddiagnostiska undersökningar av hjärnan:
- En bilddiagnostisk undersökning av hjärnan ska göras åtminstone en gång när orsaken
till minnessymtomen utreds. Med hjälp av bilddiagnostik kan man utesluta andra behandlingsbara
orsaker till symtomen, påvisa vaskulära förändringar i hjärnan och identifiera specifika
fynd som tyder på olika typer av progressiva demenssjukdomar.
- Magnetundersökning av hjärnan (MRT enligt minnesprotokollet) är den primära undersökningen när man letar efter drag som är karakteristiska för minnessjukdomar. Om MRT inte finns att tillgå eller är kontraindicerat kan en CT-undersökning utesluta förändringar, större infarkter och hydrocefalus. Multisnitts-CT enligt minnesprotokollet är en bra alternativ bilddiagnostisk metod för patienter som inte kan genomgå MRT «Filippi M, Agosta F, Barkhof F, ym. EFNS task forc...»77, «Magneetti- ja tietokonetomografiakuvausten osuvuus aivoatrofian arvioinnissa muistisairailla»22.
- MRT är känsligare och mer exakt än datortomografi (CT) för att påvisa strukturella förändringar som är typiska för minnessjukdomar och är inte heller förknippad med strålningsbelastning «Magneetti- ja tietokonetomografiakuvausten osuvuus aivoatrofian arvioinnissa muistisairailla»22.
- MRT-programmet för patienter med minnessymtom ska åtminstone innehålla axiala T2-viktade och FLAIR-sekvenser, SWI- eller T2*-sekvens samt en tredimensionell T1-viktad sekvens (t.ex. sagittala bilder med 1 mm:s snittjocklek och koronala reformater vinkelrätt mot långa axeln av hippocampus) «Radiologisten muutosten arvioinnista muistisairauksissa»23, som man utgår från för att bedöma graden av atrofisk förändring (vävnadsförlust). Rutinmässigt kontrastmedel behövs inte. Diffusionsviktad bildtagning (DWI) kan hjälpa till att påvisa förändringar i hjärnbarken och basalganglierna hos patienter med färska infarkter och Creutzfeldt-Jakobs sjukdom (CJD). En upprepad strukturell MRT kan bidra till att identifiera atrofi med ett snabbare förlopp än vid normalt åldrande, vilket kan stödja en klinisk misstanke om neurodegenerativ minnessjukdom. Specialsekvenser, såsom funktionell MRT, MRT-perfusion, diffusionstensoravbildning och magnetspektroskopi, används inom forskning.
- Bedömningen av kortikal atrofi, atrofi i inre tinningloben och förändringar i samband
med cerebrovaskulär sjukdom presenteras i tilläggsmaterialet Mallilausunto muistipotilaan
neuroradiologisesta MK-tutkimuksesta «Mallilausunto muistipotilaan pään MK-tutkimuksesta»24 och i ett bildmontage som innehåller bland annat Scheltens klassificering av atrofi
i den inre tinningloben, hippocampus (MTA), Koedams klassificering av posterior atrofi,
Fazekas klassificering av förändringar i den vita substansen och huvudtyperna av vaskulära
förändringar «Radiologisten muutosten arvioinnista muistisairauksissa»23.
- I rapporteringen från strukturell MRT förbättrar användningen av visuella klassificeringsskalor och automatiska klassificeringsmetoder uppenbarligen magnetundersökningens träffsäkerhet som bilddiagnostisk undersökning av minnessjukdomar «Rakenteellisen magneettikuvauksen (MK) raportoinnissa visuaalisten luokitteluasteikoiden ja automaattisten luokittelumenetelmien käyttö ilmeisesti parantaa magneettikuvauksen osuvuutta muistisairauksien kuvantamistutkimuksena.»B. Under de senaste åren har man för kliniskt bruk fått tillgång till program som kan användas för att analysera normativa rapporter om hjärnans volym från en rutinmässig MRT. Automatiska volymetriska analysprogram förbättrar uppenbarligen diagnostikens noggrannhet och reproducerbarhet vid magnetundersökning av demenspatienters hjärna «Automaattiset volymetriset analyysiohjelmistot ilmeisesti parantavat diagnostiikan tarkkuutta ja toistettavuutta muistipotilaan aivojen magneettikuvauksessa.»B.
- CT görs om det finns kontraindikation för MRT (pacemaker, i synnerhet pacemaker som inte är kompatibel med magneter «Magneettikuvaukset muistipotilailla, joilla on sydämentahdistin»25, andra ferromagnetiska föremål, klaustrofobi), om MRT inte är tillgängligt, patientens kooperationsförmåga är dålig eller det finns en jourmässig anledning för undersökning (t.ex. misstanke om trauma).
- Med CT (vanlig) kan man utesluta centrala orsaker som kan behandlas, såsom blödning under den hårda hjärnhinnan, normaltryckshydrocefalus och tumörer, samt påvisa hjärnbarksatrofi och vaskulära förändringar, såsom spår av infarkter i hjärnbarken och lakunära infarkter och måttliga eller svåra förändringar i vita substansen.
- Det rekommenderas att CT av minnespatienter (multisnitts-CT av huvudet) «Radiologisten muutosten arvioinnista muistisairauksissa»23 görs med en multisnittsapparat och enligt minnesprogrammet. Då kan man utifrån reformatbilderna
relativt tillförlitligt bedöma graden av atrofi i hjärnbarken och den inre tinningloben
samt småkärlssjukdom i den vita substansen i hjärnan.
- Multisnitts-CT av huvudet kan erbjuda information som kan jämföras med en MRT-undersökning om hjärnstrukturen hos patienter med minnessyntom för vilka MRT inte är möjligt eller inte finns att tillgå «Pään 64-rivinen monileiketietokonekerroskuvaus (monileike-TT) saattaa tarjota magneettikuvaukseen (MK) verrattavissa olevaa tietoa aivojen rakenteesta muistipotilailla, joille magneettikuvaus ei ole mahdollinen tai sitä ei ole saatavilla.»C.
- Strålningsbelastningen från en CT-undersökning är cirka 1,2 mSv, vilket motsvarar cirka 4,5 månaders naturlig bakgrundsstrålning.
- En bilddiagnostisk undersökning av hjärnan ska göras åtminstone en gång när orsaken
till minnessymtomen utreds. Med hjälp av bilddiagnostik kan man utesluta andra behandlingsbara
orsaker till symtomen, påvisa vaskulära förändringar i hjärnan och identifiera specifika
fynd som tyder på olika typer av progressiva demenssjukdomar.
| Minnet är relativt välbevarat som vid pann-tinninglobsdegeneration |
| Beteendeförändringar som vid pann-tinninglobsdegeneration |
| Asymmetriska neurologiska symtom och fynd som vid vaskulär kognitiv försämring |
| Tremor-rigiditet-hypokinesi som vid Parkinsons sjukdom och Lewykroppssjukdom samt vid progressiv supranukleär pares och kortikobasal degeneration |
| Afasi |
| Apraxi |
| Balanssvårigheter, ataxi |
| Minnessjukdom | De viktigaste tidiga fynden |
|---|---|
| Alzheimers sjukdom |
|
| Vaskulär kognitiv försämring |
|
| Lewykroppssjukdom |
|
| Pann-tinninglobsdegeneration |
|
| Normaltryckshydrocefalus |
|
| Neurologiskt fynd | Minnessjukdom |
|---|---|
| Det episodiska minnets (händelseminnets) svaghet dominerar |
|
| Försämrade exekutiva funktioner |
|
| Plötslig fullständig oförmåga att lägga saker på minnet |
|
| Försämrade språkliga funktioner |
|
| Nedsatt visuell funktion |
|
| Neuropsykiatriska symtom |
|
| Ensidiga fynd |
|
| Spasticitet, livligare senreflexer |
|
| Hypokinesi, rigiditet |
|
| Myokloni |
|
| Ofrivilliga rörelser |
|
| Gångsvårigheter |
|
| Amyotrofi, muskelförtvining |
|
| Balanssvårigheter, fallolyckor |
|
| Primitivreflexer |
|
|
|
| Stereotypa upprepningar |
|
Bedömning av funktionsförmågan och tillståndets svårighetsgrad
- Svårighetsgraden för en progressiv minnessjukdom har vanligtvis bedömts med hjälp av en indelning i lindrig, medelsvår och svår minnessjukdom.
- En noggrannare och mer användbar allmän bedömning kan göras med
- CDR-skalor (Clinical Dementia Rating) «CDR ja sen käyttötarkoitus»26
- GDS/FAST-skalan (Global Deterioration Scale/Functional Assessment and Staging)
- Se Suomen muistiasiantuntijat ry - Välineitä työhösi «http://www.sumut.fi/valineita-tyohosi»12: CDR-klassificering och GDS/FAST på finska «https://sumut.fi/wp-content/uploads/2020/02/CDR-ja-GDS-FAST-suomi.pdf»24 och på svenska «https://sumut.fi/wp-content/uploads/2020/02/CDR-och-GDS-FAST-p-svenska.pdf»25.
- Självständigheten kan bedömas med hjälp av olika enkla skalor (bedömning av självständighet, bADL, IADL).
- För bedömning i olika skeden av en minnessjukdom lämpar sig den mer omfattande ADCS-ADL-skalan
«Suomen muistitutkimusyksiköiden asiantuntijatyöryh...»78:
- Se tilläggsmaterial «ADCS-ADL:n käyttötarkoitus ja keskimääräinen muutos seurannassa»27 och «Muistipotilaan arviointi ja arvioinnin työkalut»18 och Suomen muistiasiantuntijat ry - Välineitä työhösi «http://www.sumut.fi/valineita-tyohosi»12: ADCS-ADL-intervju på finska «https://sumut.fi/wp-content/uploads/2020/02/ADCS-ADL-fi.pdf»26 och på svenska «https://sumut.fi/wp-content/uploads/2020/02/ADCS-ADL-swe.pdf»27.
- För ergoterapibedömning lämpar sig till exempel Assessment of Motor and Process Skills, AMPS.
Ytterligare undersökningar
- Utöver de grundläggande utredningarna kan det behövas specialkompetens (neurolog,
neurokirurg, geriatriker, neuropsykolog, psykogeriatriker, talterapeut eller psykiater)
och ytterligare undersökningar.
- Personer i arbetsför ålder ska remitteras för neurologisk bedömning.
- Anledningar till konsultation med specialist beskrivs i tabell «Situationer som ofta kräver specialkompetens i vården av patienter med minnessymtom...»11.
- En omfattande neuropsykologisk undersökning ska övervägas i följande patientgrupper
och situationer «Muistipotilaan neuropsykologinen tutkimus»19:
- personer i arbetsför ålder
- personer med lindriga symtom
- högutbildade och tränade
- för att skilja mellan minnessjukdom och psykiatriska sjukdomar, såsom depression
- för att skilja mellan andra neuropsykologiska specialstörningar och minnessjukdom
- problematiska differentialdiagnostiska situationer
- bedömning av arbetsförmågan
- problematiska bedömningar av rättshandlingsförmåga och körförmåga
- atypiska drag i sjukdomsbilden.
- Övriga ytterligare undersökningar består av
- markörer i likvor «Andreasen N, Vanmechelen E, Vanderstichele H, ym. ...»79
- genetiska undersökningar enligt övervägande (t.ex. vid misstanke om sjukdomen CADASIL, tidigt debuterande AS, frontallobsdegeneration och Hakolas sjukdom)
- bilddiagnostiska undersökningar av funktionen i hjärnan (i första hand PET med olika
markörämnen och med eftertanke SPET «PET ja SPET muistisairauksien kuvantamistutkimuksina»28)
- Undersökning av dopaminfunktionen i hjärnan med PET eller SPET med hjälp av markörer för dopamintransportörer är till hjälp vid differentialdiagnostik av LBD och AS. I basalganglierna har bindningen av dopamintransportörmarkörer minskat vid LBD men är vanligtvis normal vid AS.
- Med FDG-PET-undersökning kan glukosomsättningen i hjärnan undersökas.
- I FDG-PET kan man konstatera hypometabolism, som vid AS vanligen förekommer på båda sidor om hjässloben eller i området kring tinning- och hjässloben samt vid precuneus eller gyrus cinguli.
- Vid pannlobsdemens koncentreras hypometabolismen till pannloberna och de främre delarna av tinningloberna. Denna skillnad i fördelningen av hypometabolismen jämfört med vid AS är till hjälp vid differentialdiagnostiken av dessa sjukdomar.
- Vid LBD förekommer hypometabolism i tinning- och hjässloberna och ibland även i pannloberna. Typiskt för LBD är s.k. cingulate island sign, vilket innebär att glukosmetabolismen bevaras i posteriora gyrus cinguli vid LBD, medan metabolismen vid AS har försämrats i området i fråga. Hypometabolism upptäcks ofta också i nackloben, som i allmänhet har bibehållits vid AS.
- Med hjälp av en PET-undersökning är det också möjligt att avbilda ansamlingar av beta-amyloid i hjärnan, vilket kan användas för att stödja en tidig diagnos av Alzheimers sjukdom. Bilddiagnostik av tau-protein är också möjlig med denna metod, men är ännu inte en undersökning inom klinisk diagnostik.
- hjärnbiopsi och histopatologisk undersökning av hjärnan (t.ex. i samband med insättning av shunt).
| Lindriga symtom som tyder på begynnande minnessjukdom |
| Misstanke om minnessjukdom hos personer i arbetsför ålder |
| Differentialdiagnostik av minnessjukdomar i ett tidigt stadium |
| Orsaken till minnessymtom förblir oklar |
| Bedömning av arbetsförmågan |
| Vid behov bedömning av körförmågan |
| Vid behov bedömning av rättshandlingsförmågan |
| Svåra neuropsykiatriska symtom eller symtom som reagerar dåligt på behandlingen |
| Problemsituation eller behov av konsultation som konstaterats av läkare |
Typiska kliniska bilder av minnessjukdomar
- Diagnosen grundar sig på kliniska kriterier som utarbetats för varje sjukdom.
- Mer information om diagnostiska kriterier finns i följande tilläggsmaterial:
- Diagnostiska kriterier för Alzheimers sjukdom som uppdaterades 2021 «Uudet Alzheimerin taudin diagnostiset kriteerit vuodelta 2021»12
- NINDS-AIREN-kriterier för vaskulär demens «Vaskulaarisen muistisairauden NINDS-AIREN-kriteerit vuodelta 1993»11
- Kriterier för minnessjukdom vid Parkinsons sjukdom «Parkinsonin taudin dementian ominaispiirteet sekä todennäköisen ja mahdollisen Parkinsonin taudin dementian diagnostiset kriteerit vuodelta 2007»15
- Diagnostiska kriterier för Lewykroppssjukdom «Lewyn kappale -dementian kliinisen diagnoosin kriteerit vuodelta 2017»14
- Kriterier för klinisk diagnos av pannlobsdemens «Otsa-ohimolohkorappeumien diagnostiset kriteerit»13.
- Se även tabell «Diagnostiska kriterier för minnessjukdomar. Patientanvisningar se Hjärnhuset/Minnessjukdomar ....»7.
- Patienten kan ha drag av många minnessjukdomar samtidigt och alla dessa ska beaktas
i planeringen av vården.
- Med åldern konstateras också betydande cerebrovaskulär sjukdom hos 30–50 procent av AS-patienterna och hos upp till 70 procent lindriga förändringar i samband med cerebrovaskulär sjukdom «Hampel H, Teipel SJ, Fuchsberger T, ym. Value of C...»80, «Wharton SB, Simpson JE, Ince PG, ym. Insights into...»81, «Fisher RA, Miners JS, Love S. Pathological changes...»82.
- Hos AS-patienter kan även symtom på LBD förekomma. Hos över hälften av dem som fått diagnosen LBD konstateras samtidig AS «Noguchi-Shinohara M, Ono K. The Mechanisms of the ...»83.
- 30–70 procent av patienterna med minnessjukdom vid Parkinsons sjukdom har vid neuropatologiska undersökningar observerats ha betydande Alzheimer-patologi «Emre M, Aarsland D, Brown R, ym. Clinical diagnost...»13, «Aarsland D, Zaccai J, Brayne C. A systematic revie...»14. Om en Parkinson-patient har en betydande progressiv försämring av händelseminnet (det episodiska minnet) tyder det på samtidig AS.
Alzheimers sjukdom
- AS är den vanligaste enskilda progressiva neurodegenerativa minnesssjukdomen.
- Av alla som lider av progressiv minnessjukdom har cirka 70 procent drag av AS.
- Förekomsten av AS ökar med åldern.
- Typisk AS är en hjärnsjukdom som framskrider långsamt och i jämn takt och är förknippad med selektiva skador i områden i hjärnan, på förbindelserna mellan dem och på neurokemiska system.
- Med undantag av förändringar i minnet och annan informationsbearbetning är andra neurologiska symtom och fynd sällsynta i ett tidigt stadium av sjukdomen.
- Diagnosen AS är inte en uteslutningsdiagnos, utan den grundar sig på en typisk symtombild
och kliniska förändringar som bekräftar sjukdomen. Följande är typiskt vid den vanligaste
formen av AS som inleds med förändringar i den inre tinningloben:
- av anamnesen framgår att händelseminnet eller det episodiska minnet försämrats, att personen har svårt att lägga nya saker på minnet och särskilt svårt att komma ihåg saker samt progressivt glömmer färska minnen
- försämring av det episodiska minnet konstateras till exempel med hjälp av uppgiftsserien CERAD eller vid en neuropsykologisk undersökning
- som biologisk markör konstateras vävnadsförlust i den inre tinningloben vid MRT eller CT
- biologiska markörer konstateras i ryggmärgsvätskan «Andreasen N, Vanmechelen E, Vanderstichele H, ym. ...»79:
- Avvikelser i markörerna i ryggmärgsvätskan stöder diagnosen Alzheimers sjukdom «Selkäydinnesteen merkkitekijöiden poikkeavuus tukee Alzheimerin taudin diagnoosia.»A, «Muistisairauden diagnostiikka, oireiden arviointi ja sairauden seuranta»10.
- Typiska förändringar vid AS är minskning av halten amyloid-beta-peptid 42, ökning av halten fosforylerat tau-protein och i synnerhet minskning av halten beta-amyloid 42 och 40 eller förändring av förhållandet mellan beta-amyloid 42 och fosforylerat tau-protein.
- En ökning av halten fosforylerat tau-protein anses vara känsligare för AS än en förändring i total-tau. En minskad halt beta-amyloid 42 i ryggmärgsvätskan tillsammans med en ökad fosfo-tau-proteinhalt ökar avsevärt sannolikheten för en klinisk diagnos av AS och hjärnpatologi av AS-typ «Selkäydinnesteen merkkitekijöiden poikkeavuus tukee Alzheimerin taudin diagnoosia.»A.
- En avvikelse i markörerna i ryggmärgsvätskan (beta-amyloid 42 tillsammans med tau och/eller fosforylerad tau) stöder diagnosen AS hos patienter med lindriga symtom «Selkäydinnesteen merkkitekijöiden poikkeavuus tukee Alzheimerin taudin diagnoosia.»A.
- Det bör observeras att en ökning av total-tau och även en minskning av halten beta-amyloid också kan observeras vid andra hjärnsjukdomar, i allmänhet i lindrigare form än vid AS.
- Normala fynd utesluter inte AS.
- PET-förändringar som är typiska för AS konstateras (är också en biologisk markör).
- AS kan diagnostiseras redan före en omfattande försämring av informationsbearbetningen som påverkar hur man klarar vardagen, dvs. utifrån en symtombild som är typisk för demens och biologiska markörer.
- AS debuterar vanligtvis med demenssymtom. Minnet är det delområde inom informationsbearbetningen
(kognitionen) som är mest försvagat under hela sjukdomstiden.
- Amnestisk AS är den vanligaste typen av AS. Den utgör cirka 85 procent av alla fall.
- Ett tidigt symtom på varianter kan vara försämrad uppfattning (posterior kortikal atrofi), försämrade språkliga funktioner (logopenisk variant av progressiv afasi) eller försämrade exekutiva funktioner innan tydligare minnessymtom debuterar.
- Försämrad självständighet har ett nära samband med försämring av minnet och informationsbearbetningen.
- De neuropsykiatriska symtomen varierar i olika stadier av sjukdomen.
- Avvikelser från sjukdomens typiska förlopp tyder på associerade sjukdomar som ändrar sjukdomsförloppet (såsom cerebrovaskulär sjukdom eller hjärnskada) eller miljöfaktorer som ska identifieras och behandlas/åtgärdas.
- I tilläggsmaterialet ingår diagnostiska kriterier för AS som uppdaterades 2021 «Uudet Alzheimerin taudin diagnostiset kriteerit vuodelta 2021»12.
- Normalt åldrande är förknippat med ansamling av beta-amyloid i hjärnan, vilket kan konstateras med ryggmärgsprov eller PET-röntgen. Åldersrelaterad "amyloidos" ska särskiljas från begynnande Alzheimers sjukdom. Diagnosen kan inte ställas enbart utifrån biologiska markörer (såsom ryggmärgsprov eller bilddiagnostik), utan resultaten ska alltid ställas i relation till patientens kliniska tillstånd. Uppföljningsundersökningar har visat att framskridandet av tidig Alzheimers sjukdom till demensnivå är långsammare hos dem som i diagnosskedet endast har avvikelser i halten beta-amyloid än hos dem som också har en avvikande halt av tau- eller fosfo-tau-protein «Vos SJ, Verhey F, Frölich L, ym. Prevalence and pr...»84.
- Patientanvisning se Hjärnhuset/Demenssjukdomar på webbplatsen Hälsobyn «https://www.terveyskyla.fi/sv/hjarnhuset/hjarnsjukdomar/demenssjukdomar»28.
Sjukdomsförlopp vid Alzheimers sjukdom
- Typisk AS är en hjärnsjukdom som framskrider långsamt och i jämn takt.
- De tidigaste symtomen på sjukdomen är svårigheter att lägga nya saker på minnet och särskilt att komma ihåg saker (försämring av händelseminnet dvs. det episodiska minnet).
- Sjukdomsbilden domineras av en tilltagande försämring av informationsbearbetningen.
- Minnesfunktionerna är i alla stadier det delområde inom informationsbearbetningen som är mest skadat.
- När sjukdomen framskrider ökar förekomsten av neuropsykiatriska symtom som förvärras och självständigheten försämras.
- Den kliniska symtombilden kan delas in i följande stadier (bild «Alzheimerin taudin (AT) tyypillinen kulku ja taudin eri vaiheet»1):
- symtomfri, dvs. prekliniska stadiet
- begynnande AS
- lindrig AS (tabell «Lindrig, medelsvår och svår Alzheimers sjukdom ...»12)
- medelsvår AS (tabell «Lindrig, medelsvår och svår Alzheimers sjukdom ...»12)
- svår AS (tabell «Lindrig, medelsvår och svår Alzheimers sjukdom ...»12).
- Mätarna som använts vid bedömningen av symtomen (bl.a. CDR och GDS/FAST samt MMSE) «Muistisairauden diagnostiikka, oireiden arviointi ja sairauden seuranta»10, «Muistipotilaan arviointi ja arvioinnin työkalut»18, «Muistisairaan neuropsykiatristen oireiden arviointi»20 ger poäng som antyder sjukdomens svårighetsgrad, men det finns inga exakta gränsvärden mellan de olika stadierna.
- Det är viktigt att känna till AS:s neuropatologiska stadier och de typiska symtombilderna i anslutning till dem, eftersom det ger en bakgrund till förväntningarna på sjukdomens progression och hjälper till att identifiera associerade sjukdomar som förvärrar tillståndet och som kan orsaka oväntade avvikelser i sjukdomens naturliga förlopp.
- Mer information om AS:s förlopp finns i tilläggsmaterialet «Alzheimerin taudin kulku»29.
| Kognitiva symtom | Förändringar i funktionsförmågan | Neuropsykiatriska symtom | Somatiska symtom |
|---|---|---|---|
| Lindrig sjukdom (MMSE 18–26, GDS/FAST 3–4, CDR 0,5–1) | |||
| Försämrad inlärning | Svårare att följa med i samtal | Apati | Viktminskning |
| Ökad glömska | Minskad läsning | Tillbakadragande | |
| Långsammare exekutiva funktioner | Tillbakadragande från komplicerade hobbyer | Ökad irritation | |
| Försämrad slutledningsförmåga | Svårare att planera ekonomin | Ångest | |
| Försämrad koncentrationsförmåga | Problem med att hantera pengar och uträtta ärenden | Depression | |
| Svårt att hitta ord | Problem med att sköta medicinering | Vanföreställningar | |
| Försämrad räkneförmåga | Försämrad arbetsförmåga | ||
| Försämrad körförmåga | |||
| Användning av minnesstöd | |||
| Kognitiva symtom | Förändringar i funktionsförmågan | Neuropsykiatriska symtom | Somatiska symtom |
| Medelsvår sjukdom (MMSE 10–22, GDS 4–6, CDR 1–2) | |||
| Svagt närminne | Instrumentella aktiviteter (IADL) lyckas inte | Vanföreställningar | Viktminskning |
| Svårigheter att producera tal | Matlagning lyckas inte | Hallucinationer | |
| Perceptuella svårigheter | Svårigheter att klä sig korrekt | Rastlöshet | |
| Orienteringsstörningar | Tappar bort saker | Vandrar omkring | |
| Försämrad sjukdomsinsikt | Går vilse | Störningar i sömn-/vakenhetsrytmen | |
| Problem med fingerfärdigheten | Behov av påminnelser vid aktiviteter i dagliga livet (ADL) | Depression | |
| Visuospatiala svårigheter | Ytliga sociala färdigheter finns kvar | ||
| Kognitiva symtom | Förändringar i funktionsförmågan | Neuropsykiatriska symtom | Somatiska symtom |
| Svår sjukdom (MMSE 0–12, GDS/FAST 6–7, CDR 2–3) | |||
| Begränsad talproduktion | Aktiviteter i dagliga livet (ADL) lyckas inte utan hjälp | Rastlöshet och aggressivitet | Apraxi, stapplande gång |
| Betydande svårigheter att förstå tal | Inkontinens | Avvikande motoriskt beteende och inkontinens | Primitivreflexer |
| Oförmåga att koncentrera sig | Störningar i sömn-/vakenhetsrytmen | Extrapyramidala symtom | |
| Svår apraxi | Depression eller apati | Sekundärt skörhetssyndrom | |

Alzheimerin taudin (AT) tyypillinen kulku ja taudin eri vaiheet. Mukailtu: Reisberg et al. Alzh Dis Assoc Disord 1994, 8
Minnessjukdom i samband med cerebrovaskulär sjukdom
- Minnessjukdom i samband med cerebrovaskulär sjukdom (vascular cognitive impairment,
VCI) omfattar begränsade symtom inom ett eller flera delområden av informationsbearbetningen
och å andra sidan progressiva tillstånd med omfattande symtombild som leder till svår
demenssjukdom (gammal term: vaskulär demens) «Vaskulaarinen kognitiivinen heikentymä (VCI) ja vaskulaarinen muistisairaus (VD)»30
- Till VCI-gruppen hör också AS-patienter som har en kliniskt betydande cerebrovaskulär sjukdom (AS + CVS).
- VCI är ett syndrom som är förknippat med många typer av blodkärlsrelaterade faktorer och förändringar i hjärnan med bakomliggande orsaker och kliniska sjukdomsbilder som avviker från varandra.
- Centrala undertyper av VCI är småkärlssjukdom, storkärlssjukdom och tillstånd orsakade av infarkt i ett område som är kritiskt för informationsbearbetningen «Radiologisten muutosten arvioinnista muistisairauksissa»23.
- Cerebrovaskulär sjukdom är förknippad med en stor risk för försämrad informationsbearbetning och minnessjukdom.
- Efter en stroke är det vanligt med symtom som drabbar minnet och annan informationsbearbetning. Till exempel hos patienter i åldern 55–85 år som haft en stroke har en försämring av något delområde i informationsbearbetningen konstaterats hos 83 procent av alla patienter och hos 71 procent av patienterna som återhämtat sig kliniskt väl (modified Rankin scale 0–1).
- Efter en stroke är det vanligt med försämringar i minnet, perceptionsförmågan och de exekutiva funktionerna.
- En mer omfattande försämring av informationsbearbetningen, demens, förekommer hos 25 procent av dem som har haft en stroke.
- Tysta hjärninfarkter (silent brain infarcts) och förändringar i den vita hjärnsubstansen (white matter hyperintensities) är förknippade med en ökad risk för demenssjukdom.
- Vid progressiva demenssjukdomar är cerebrovaskulär sjukdom orsaken i 15–20 procent av fallen, och av dessa utgör småkärlssjukdom cirka 70 procent.
- I Finland finns det cirka 250 000 personer med symtom på småkärlssjukdom.
- Vanliga riskfaktorer för hjärtsjukdomar och cerebrovaskulära sjukdomar (högt blodtryck, hög kolesterolhalt i blodet, diabetes, övervikt, brist på motion, rökning) i medelåldern är förknippade med ökad risk för demenssjukdom vid högre ålder. Även låg utbildningsnivå har konstaterats öka risken för demenssjukdom.
- Omfattande förändringar vid småkärlssjukdom i hjärnan (förändringar i vit substans Fazekas 3) är förknippade med en ökad risk för dåliga resultat (försämrad informationsbearbetning, demens, depression, gångsvårigheter, fallolyckor, urineringssymtom, stroke, institutionsvård, död).
Småkärlssjukdom i hjärnan
- Ett typiskt tidigt symtom är försämrade exekutiva funktioner och långsammare informationsbearbetning.
- Minnessymtomen är ofta mindre markanta än vid AS.
- Neuropsykiatriska symtom förekommer i form av depression, personlighetsförändringar
och psykomotorisk fördröjning.
- Tidiga kliniska fynd är lindriga tecken på skada på en övre motoneuron (nedgång i grundprov, ensidigt accelererade reflexer, koordinationssvårigheter), förändring i gången (apraxi-ataxi, korta steg, stapplande gång), försämrad balans och fallolyckor, urineringssymtom (tätare urineringsbehov och svårigheter att hålla urinen), så kallade pseudobulbära symtom såsom lindrig försämring av talmotoriken (dysartri) och lindriga sväljsvårigheter (dysfagi), och så kallade extrapyramidala symtom (långsamma rörelser dvs. hypokinesi, muskelstelhet dvs. rigiditet).
- De lokala neurologiska fynden är få och de begränsas till exempelvis försämrad balans och nedsatt gångförmåga.
- Symtomens debut är varierande. Till patienternas kliniska bakgrundsuppgifter hör ofta endast övergående störningar i hjärnans blodcirkulation (transient ischemic attack, TIA), tillfälliga gångsvårigheter eller förvirring utan tydliga lokala neurologiska symtom eller fynd som tyder på stroke.
- Det är vanligare med en smygande debut än en akut, och symtomen framskrider i jämn takt hos en stor del av patienterna utan gradvisa försämringsskov. Symtomen kan dock variera. Det är skillnader mellan dagarna och patienterna har ofta långa, jämna faser som varar i flera månader.
- Vid magnetundersökning av hjärnan konstateras en omfattande förändring av den vita substansen, lakunärinfarkter i den djupa gråa och vita substansen eller båda samtidigt. Dessutom kan man se mikroblödningar, förstorade perivaskulära utrymmen och hjärnatrofi.
Storkärlssjukdom
- Symtomen i anslutning till informationsbearbetningen varierar från fall till fall. Ofta konstateras symtom i de exekutiva funktionerna, minnesrelaterade symtom och bland annat verbala symtom och symtom i anslutning till den visuella perceptionen samt ouppmärksamhet (neglect).
- Som kliniska fynd kan enligt infarkternas läge konstateras till exempel synfältsbortfall, hängande mungipa, ensidig förlamning eller förändrad gång (hemiplegi eller apraxi-ataxi).
- Symtomen debuterar oftast snabbt (timmar, dagar). Symtomen förvärras gradvis (återhämtning efter försämringsskov), och de varierar. När riskfaktorerna är under kontroll har patienterna ofta jämna stadier som varar i upp till ett år.
- Vid bilddiagnostisk undersökning konstateras vanligen kortikala och kortikosubkortikala infarkter som är typiska för storkärlssjukdomar eller kardiella embolier. Patienten kan också ha hjärnblödningar.
- Övriga undersökningsfynd:
- Det finns inga typiska fynd i dagens laboratorieundersökningar.
- Det finns ingen markör i ryggmärgsvätskan som är typisk bara för VCI.
- I funktionella undersökningar av hjärnan (SPECT, PET) observeras ofta fläckvisa förändringar.
Alzheimers sjukdom och cerebrovaskulär sjukdom
- AS och cerebrovaskulär sjukdom har många gemensamma riskfaktorer: högt blodtryck, hög kolesterolhalt i blodet, diabetes och artärsjukdomar.
- AS och samtidig cerebrovaskulär sjukdom är en viktig undertyp av progressiv minnessjukdom särskilt i äldre åldersgrupper: bland personer över 80 år förekommer det hos minst hälften. I framtiden är det sannolikt den vanligaste enskilda orsaksgruppen bakom minnessjukdom.
- Det är svårt att identifiera fallen kliniskt, eftersom patienterna har lokala neurologiska symtom och fynd som tyder på cerebrovaskulär sjukdom samt förändringar i hjärnröntgenbilden som orsakas av cerebrovaskulär sjukdom.
- Konstaterandet av samtidig AS stöds bland annat av ett syndrom som framhäver tidig försämring av händelseminnet: vävnadsförlust i den inre tinningloben på hjärnröntgenbilden och minskad halt av peptid beta-amyloid 42 (Ab42) i likvor.
- AS-patienter med samtidig cerebrovaskulär sjukdom har nytta av demensläkemedel.
- De kliniska diagnostiska kriterier som allmänt används för VD är NINDS-AIREN-kriterierna «Vaskulaarisen muistisairauden NINDS-AIREN-kriteerit vuodelta 1993»11. Det finns också egna kriterier för småkärlssjukdom som behandlas i tilläggsmaterialet «Vaskulaarinen kognitiivinen heikentymä (VCI) ja vaskulaarinen muistisairaus (VD)»30.
- Patientanvisning se Hjärnhuset/Demenssjukdomar på webbplatsen Hälsobyn «https://www.terveyskyla.fi/sv/hjarnhuset/hjarnsjukdomar/demenssjukdomar»28.
Sjukdomar i anslutning till Lewykroppspatologi
Lewykroppssjukdom
- Intracellulära Lewykroppar förekommer vanligtvis vid Parkinsons sjukdom i svarta substansen (substantia nigra), basalganglierna, hjärnstammen, autonoma nervsystemet och i varierande grad även i hjärnbarken. Vid Lewykroppssjukdom (LBD) förekommer det rikligt med dem särskilt i det limbiska systemets strukturer (bl.a. amygdala) och i hjärnbarken.
- Hälften av patienterna har även AS-förändringar i hjärnan.
- Lewykroppssjukdom börjar långsamt och dess drag är (läs mer «Lewyn kappale -dementian kliinisen diagnoosin kriteerit vuodelta 2017»14)
- variation i uppmärksamhet, vakenhet och informationsbearbetning
- upprepade detaljerade synvillor
- beteendestörning under REM-sömn (RBD)
- ett eller flera extrapyramidala symtom av Parkinson-typ (stelhet, långsamhet, gångsvårigheter, tremor). De vanligaste symtomen i anslutning till informationsbearbetningen är perceptionsstörningar (visuospatiala funktioner) och försämrade exekutiva funktioner (uppmärksamhet, exekutiva funktioner).
- Förändringar i anslutning till minnet är inte typiska i det inledande stadiet. En progressiv försämring av händelseminnet i det inledande stadiet tillsammans med LBD-drag tyder på samtidig AS, dvs. AS + LBD.
- Patienterna är känsliga för psykosläkemedel och kan bli förvirrade och oförmögna att gå redan av små doser.
- Det är bra att komma ihåg att även om man för det kliniska syndrom som beskrivs här använder termen Lewykroppssjukdom, är bland annat Parkinsons sjukdom också en sjukdom som är förknippad med Lewykroppspatologin.
- Kriterierna för den kliniska diagnosen LBD har behandlats i tilläggsmaterialet «Lewyn kappale -dementian kliinisen diagnoosin kriteerit vuodelta 2017»14.
- Patientanvisning om Lewykroppssjukdom se Hjärnhuset/Demenssjukdomar på webbplatsen Hälsobyn «https://www.terveyskyla.fi/sv/hjarnhuset/hjarnsjukdomar/demenssjukdomar»28.
Minnessjukdom vid Parkinsons sjukdom
- Förekomsten av progressiva symtom i anslutning till informationsbearbetningen är 4–6 gånger större hos personer med Parkinsons sjukdom än hos normalbefolkningen. Symtom i anslutning till informationsbearbetningen förekommer hos 60–70 procent av Parkinson-patienterna, men endast hos en del framskrider tillståndet till demensnivå.
- Bakgrunden till sådana symtom hos en Parkinson-patient kan också vara till exempel depression eller AS, som ska beaktas i diagnostiken och vården.
- Hög ålder, svår parkinsonism med långsamma rörelser, osäker balans, gångsvårigheter och tidigt debuterande minnessymtom ökar risken för minnessjukdom vid Parkinsons sjukdom.
- Kriterier för minnessjukdom vid Parkinsons sjukdom «Parkinsonin taudin dementian ominaispiirteet sekä todennäköisen ja mahdollisen Parkinsonin taudin dementian diagnostiset kriteerit vuodelta 2007»15:
- Diagnosen förutsätter diagnosen Parkinsons sjukdom och minnessjukdom som utvecklas tidigast ett år därefter «Parkinsonin taudin dementian ominaispiirteet sekä todennäköisen ja mahdollisen Parkinsonin taudin dementian diagnostiset kriteerit vuodelta 2007»15, «Emre M, Aarsland D, Brown R, ym. Clinical diagnost...»13, «Suhonen J, Keränen T, Rinne J. Parkinsonin taudin ...»85.
- Symtomen på informationsbearbetning är nedsatt och långsammare uppmärksamhet, exekutiva funktioner, visuospatiala funktioner och minnesfunktioner.
- De neuropsykiatriska symtomen är nedsatt initiativförmåga, personlighetsförändring, depression, apati, synvillor, vanföreställningar och överdriven trötthet dagtid.
- Orsaken är Lewykroppar i hjärnbarken, samtidiga Alzheimer-förändringar, skador i olika signalsubstanssystem eller en kombination av dessa processer. informationsbearbetningssymtom och synvillor korrelerar med en försämring av det kolinerga systemet.
- 30–70 procent av de Parkinson-patienter som har minnessjukdom har vid neuropatologiska undersökningar observerats ha betydande Alzheimer-patologi «Emre M, Aarsland D, Brown R, ym. Clinical diagnost...»13. Om en Parkinson-patient har en betydande progressiv försämring av händelseminnet (det episodiska minnet) tyder det på samtidig AS (AS+ Parkinsons sjukdom eller AS + minnessjukdom vid Parkinsons minnessjukdom).
- Patientanvisning om minnessjukdom vid Parkinsons sjukdom, se Hjärnhuset/Demenssjukdomar på webbplatsen Hälsobyn «https://www.terveyskyla.fi/sv/hjarnhuset/hjarnsjukdomar/demenssjukdomar»28.
Pann-tinninglobsdegeneration
- Vid pann-tinninglobsdegeneration koncentreras vävnadsförlusten (atrofin) i hjärnbarken till pannloberna och de främre delarna av tinningloberna, men i början av sjukdomen kan atrofi ännu saknas, dvs. MRT kan vara normalt.
- De typiska kliniska symtombilderna vid pann-tinninglobsdegeneration är
- pannlobsdemens
- primär progressiv afasi som indelas i progressiv icke-flytande afasi, semantisk demens och logopenisk variant av progressiv afasi.
- pannlobsdemens + ALS
- ofta är pann-tinninglobsdegeneration även förknippad med PSP «Progressiivisen supranukleaarisen pareesin (PSP) kliinisiä piirteitä»16 eller CBD «Kortikobasaalisen degeneraation (CBD) kliinisiä diagnostisia piirteitä»17
- Mer information «Krüger J, Katisko K, Suhonen N-M, Haapasalo A, Rem...»55.
- Patientanvisning se Hjärnhuset/Demenssjukdomar på webbplatsen Hälsobyn «https://www.terveyskyla.fi/sv/hjarnhuset/hjarnsjukdomar/demenssjukdomar»28.
Pannlobsdemens
- Pannlobsdemens debuterar vanligtvis vid 45–75 års ålder. Hos ungefär hälften förekommer sjukdomen i släkthistorien.
- Pannlobsdemens omfattar cirka hälften av fallen av pann-tinninglobsdegeneration och dessa uppskattningsvis 5 procent av alla progressiva minnessjukdomar och 10–30 procent av minnessjukdomarna hos personer i arbetsför ålder. En ändring av de diagnostiska kriterierna och utmaningar med differentialdiagnostiken har lett till variation i bedömningarna, men i nyare studier som genomförts med modernare metoder är prevalenstalen vanligtvis högre «Leroy M, Bertoux M, Skrobala E, ym. Characteristic...»86.
- De kliniska särdragen är
- gradvis framskridande
- symtomen börjar ofta med affektiva symtom eller neuropsykiatriska symtom: hämningslöshet, taktlöshet, bristande omdöme, apati
- svårigheter med exekutiva funktioner (målmedvetenhet, koncentrationsförmåga, uppmärksamhet)
- tidig försämring av de sociala färdigheterna samt försämring av förmågan att känna sympati och empati
- stereotypiskt upprepande beteende
- försämrad slutledningsförmåga och problemlösningsförmåga
- försämrad talproduktion
- försämrad sjukdomsinsikt
- minnet och de spatiala färdigheterna är bevarade i det första stadiet, men hos en del förekommer redan i ett tidigt skede betydande avvikelser i det episodiska minnet
- de så kallade primitiva reflexerna framträder.
- Vid MRT av hjärnan förekommer atrofi i främre pannloben eller främre delen av tinningloben eller försämring av blodflödet och ämnesomsättningen i motsvarande område i funktionella undersökningar av hjärnan (PET och SPET «PET ja SPET muistisairauksien kuvantamistutkimuksina»28).
- Inga typiska förändringar i laboratorieproverna.
- Pannlobsdemens verkar vara särskilt vanligt förekommande i Finland, och det verkar ha att göra med att genen C9orf72 upprepas i ett mycket stort antal hos befolkningen «Logroscino G, Piccininni M, Graff C, ym. Incidence...»87.
- De diagnostiska kriterierna behandlas i tilläggsmaterialet «Otsa-ohimolohkorappeumien diagnostiset kriteerit»13.
Primär progressiv afasi
- Primär progressiv afasi debuterar vanligen i relativt ung ålder (50–70 år, hos cirka 75 procent under 65 år), förutom logopenisk afasi som anses vara en variant av AS och som debuterar i senare ålder.
- Ett centralt symtom är en progressiv språklig störning.
- Svårigheter med händelseminnet och personlighets- och beteendeförändringar är inte typiska.
- För diagnostiska kriterier se «Otsa-ohimolohkorappeumien diagnostiset kriteerit»13.
Progressiv icke-flytande afasi
- Progressiv icke-flytande afasi debuterar i yngre ålder än AS. Ungefär hälften av fallen debuterar före 65 års ålder.
- De kliniska särdragen är
- smygande debut och gradvis framskridande
- svårigheter med talproduktionen, fonologiska och grammatiska fel, korta meningar och enkel satsstruktur
- eventuella läs- och skrivsvårigheter
- hur enkel talförståelse fungerar i vardagssamtal
- andra områden för informationsbearbetning bibehålls i det inledande stadiet.
- Vid MRT av hjärnan förekommer atrofi vanligen i vänster pannlob och i de främre delarna av tinningloben (runt sidofåran fissura Sylvii).
- För diagnostiska kriterier för progressiv icke-flytande afasi, se tilläggsmaterialet «Otsa-ohimolohkorappeumien diagnostiset kriteerit»13.
Semantisk demens
- Hos patienter med semantisk demens är talet flytande men innehållet tomt och patienterna
har svårt att namnge saker och förstå tal.
- Förmågan att skriva efter diktamen, upprepa tal och läsa bevaras, men förståelsen av innehållet försvinner och betydelsen av språkliga uttryck försvinner.
- Svårigheter med visuell perception och identifiering av ansikten och föremål.
- Vid MRT av hjärnan förekommer degeneration i de främre delarna av tinningloben, som koncentreras till vänster.
Logopenisk progressiv afasi
- Neuropatologiskt har man hos patienter i denna grupp konstaterat patologi som är typisk
för både AS och pann-tinninglobsdegeneration.
- Patienterna har svårigheter med både spontant tal och med att namnge saker och kan inte upprepa meningar.
- Förståelsen av enskilda ord och förmågan att identifiera ansikten och föremål har bevarats, och inga betydande grammatiska fel förekommer.
- Ljudfel förekommer i spontant tal och vid namngivning.
- Talet är motoriskt obehindrat.
- Demenssymtom uppkommer under de första åren.
- Vid bilddiagnostiska undersökningar förekommer atrofi i trakten av vänster sidofåra eller i området vid parietala cortex.
Läkemedelsbehandling av minnessjukdomar
Inledning av behandlingen
- När AS, minnessjukdom vid Parkinsons sjukdom, LBD, AS + CVS, AS + LBD eller AS + minnessjukdom
vid Parkinsons sjukdom har diagnostiserats ska man alltid överväga att inleda läkemedelsbehandling
genom att diskutera med patienten och dennes närstående.
- Som primärt läkemedel mot begynnande och lindrig AS rekommenderas någon av de tre acetylkolinesterashämmarna.
- För behandling av medelsvår eller svår AS rekommenderas acetylkolinesterashämmare och memantin.
- Den primära medicineringen av minnessjukdom vid Parkinsons sjukdomoch LBD-symtom är acetylkolinesterashämmare. Rivastigmin är det enda läkemedlet vars officiella indikation också är behandling av minnessjukdom vid Parkinsons sjukdom.
- LBD är inte officiell indikation för något läkemedel för minnessjukdom, så grundersättning är möjlig endast för patienter med AS + LBD.
- Vid minnessjukdom i samband med cerebrovaskulär sjukdom (VCI) förbättrar donepezil och galantamin kognitionen. Även rivastigmin och memantin kan förbättra den, men läkemedel mot minnessjukdomar påverkar inte helhetsintrycket av personer med lindrig eller medelsvår VCI. VCI eller VD är dock inte officiella indikationer för något demensläkemedel. Se även tilläggsmaterialet «Vaskulaarinen kognitiivinen heikentymä (VCI) ja vaskulaarinen muistisairaus (VD)»30.
- Innan läkemedelsbehandlingen inleds beaktas andra faktorer som försämrar informationsbearbetningen, såsom olämplig medicinering (tabell «De vanligaste antikolinerga läkemedlen ...»5), det allmänna hälsotillståndet och andra orsaker som leder till försämrad funktionsförmåga samt eventuella kontraindikationer för behandlingen (tabell «Kontraindikationer för medicinering mot minnessjukdomar...»13).
- Bedömningen av läkemedelsbehandlingens effekt grundar sig på förändringar i symtomen och funktionsförmågan under behandlingen, så i inledningsskedet utreds informationsbearbetning (CERAD eller MMSE) «Muistipotilaan arviointi ja arvioinnin työkalut»18, självständighet (t.ex. ADCS/ADL, bADL, IADL), neuropsykiatriska symtom och tillståndets svårighetsgrad «Muistisairauslääkkeiden käyttö»31, «Muistisairauden neuropsykiatristen oireiden hoito»32.
- Patienten och dennes närstående informeras om hurdant terapisvar som förväntas:
- i ett lindrigt stadium att tillståndet stabiliseras eller att symtomen framskrider långsammare än väntat
- i ett medelsvårt stadium att självständigheten bevaras eller förbättras (förbättrad allmän aktivitet, vakenhet, koncentration och initiativförmåga) och att vardagssysslor löper smidigare
- i ett svårt stadium att självständigheten bevaras eller att behandlingen av neuropsykiatriska symtom underlättas.
- Läkemedelsbehandling som visat sig vara ineffektiv ska inte fortsätta, se Avstå klokt-rekommendationen «Muistisairauden lääkehoidon jatkaminen tehottomaksi osoittautuneella lääkkeellä»33.
| Acetylkolinesterashämmare | Memantin |
|---|---|
| Absoluta kontraindikationer | |
|
|
| Undvik användning eller iaktta stor försiktighet | |
|
|
- Mer information om användningen av läkemedel för minnessjukdom och biverkningarna av dem finns i tilläggsmaterialet «Muistisairauslääkkeiden käyttö»31 och «Muistisairauslääkkeiden haitat ja käytössä huomioitavaa»21.
Praktiskt genomförande och uppföljning av vården
- Läkemedelsresponsen och dess varaktighet är individuella och olika beroende på sjukdomens svårighetsgrad när behandlingen inleds.
- Vanligt svar vid AS
- i ett lindrigt stadium stabiliseras tillståndet eller symtomen framskrider långsammare än väntat
- i ett medelsvårt stadium bevaras eller förbättras självständigheten (förbättrad allmän aktivitet, vakenhet, koncentration och initiativförmåga) och vardagssysslor löper smidigare
- i ett svårt stadium bevaras självständigheten eller behandlingen av neuropsykiatriska symtom underlättas.
- Läkemedelstoleransen och dosens lämplighet kontrolleras 2–3 månader efter att läkemedelsbehandlingen
har inletts.
- Terapisvaret kan då ännu inte bedömas vid AS.
- Vid minnessjukdom vid Parkinsons sjukdom kan positiv respons (t.ex. färre hallucinationer) konstateras redan tidigare.
- Efter ett halvt års behandling bedöms läkemedelstoleransen och effekten samt i synnerhet
om tillståndet eventuellt har stabiliserats.
- Om läkemedlet inte verkar vara till nytta eller om toleransen är dålig, ska det bytas ut mot ett annat läkemedel.
- När sjukdomen framskrider till ett medelsvårt stadium kan memantin kombinerat med acetylkolinesterashämmare vara till nytta «Matsunaga S, Kishi T, Iwata N. Combination therapy...»88, «McShane R, Westby MJ, Roberts E, ym. Memantine for...»89.
- Senare är det skäl att bedöma responsen med 6–12 månaders mellanrum.
- Uppföljningen ska intensifieras om det förekommer problem i behandlingen (biverkningar, snabb försämring av informationsbearbetningen eller självständigheten eller försvårade neuropsykiatriska symtom).
- Kontinuiteten i uppföljningen ska säkerställas särskilt i vårdvägens etappunkter som vid byte av vårdinstans (t.ex. vid övergång från den specialiserade sjukvården eller den privata sektorn till primärvården).
- Läkemedlet byts ut om patientens tillstånd försämras snabbt trots behandlingen. I samband med bytet behöver man inte ta en paus i medicineringen.
- Läkemedelsbehandlingen ska inte pausas längre än 6 veckor, eftersom responsen kan försämras permanent efter en lång paus [ «Doody RS, Geldmacher DS, Gordon B, ym. Open-label,...»90.
- I genomförandet av läkemedelsbehandling ska eventuella biverkningar beaktas «Muistisairauslääkkeiden haitat ja käytössä huomioitavaa»21.
- Regelbunden uppföljning av en minneskoordinator eller minnesskötare är viktig i genomförandet av läkemedelsbehandlingen. Minneskoordinatorverksamheten (care management) kan skjuta upp behovet av vård dygnet runt «Muistikoordinaattoritoiminta (care management) saattaa lykätä ympärivuorokautisen hoidon alkua.»C, «Suhonen J, Alhainen K, Eloniemi-Sulkava U ym. Hyvä...»48, «Michalowsky B, Xie F, Eichler T, ym. Cost-effectiv...»91.
Utvärdering av responsen på läkemedelsbehandlingen
- Utvärderingen av läkemedelsbehandlingens effekt grundar sig på utredning av informationsbearbetning, självständighet och neuropsykiatriska symtom.
- Det centrala är intervjuer med patienten och dennes närstående för att utreda förändringar
i tillståndet.
- Bedömning av informationsbearbetningen:
- Utan läkemedelsbehandling försämras resultatet i MMSE-testet för en patient med lindrig AS årligen 1–3 poäng och för en patient med medelsvår AS 3–6 poäng «Muistipotilaan arviointi ja arvioinnin työkalut»18.
- Vid minnessjukdom vid Parkinsons sjukdom framträder responsen som en förbättring av vakenheten och koncentrationen.
- Vid lindrig AS, VCI och minnessjukdom vid Parkinsons sjukdom kan man i bedömningen av terapisvaret också använda tester som mäter informationsbearbetningen (CERAD, MMSE, Trail Making A & B «https://sumut.fi/wp-content/uploads/2020/02/TMT-u.pdf»29) och tester av den språkliga förmågan (kategori i CERAD och fonemisk förmåga).
- Självständighet; se även tilläggsmaterialet «Muistipotilaan toimintakyvyn arviointi»34:
- Självständigheten hos den som lider av lindrig minnessjukdom är måttlig, och ett positivt terapisvar framträder i form av ökad aktivitet och stabilisering av tillståndet. Självständigheten försämras alltså inte nämnvärt och inga nya besvärliga symtom uppkommer. Användningen av intervjun ADCS-ADL har undersökts bland annat i materialet från en finländsk longitudinell studie av personer som till en början haft mycket lindrig eller lindrig Alzheimers sjukdom. Antalet ADCS-ADL-poäng sjunker i genomsnitt med 5–7 poäng på ett år för personer som använder acetylkolinesterashämmare. Om poängantalet sjunker så här mycket eller mindre kan det anses vara bra respons på läkemedelsbehandlingen. När sjukdomen framskrider till ett medelsvårt stadium sjunker poängantalet med i genomsnitt 9 poäng på ett år «Hallikainen I, Hänninen T, Fraunberg M, ym. Progre...»92.
- Vid medelsvår demenssjukdom har självständigheten redan försämrats betydligt när behandlingen inleds. Effekterna av behandlingen observeras således till exempel i vakenheten, koncentrationsförmågan, orienteringen och smidigheten i olika funktioner, såsom påklädning eller tal.
- Neuropsykiatriska symtom:
- Neuropsykiatriska symtom bedöms genom en intervju med patienten och dennes anhöriga och vid behov med hjälp av en NPI-intervju (Suomen muistiasiantuntijat ry – Välineitä työhösi «http://www.sumut.fi/valineita-tyohosi»12: NPI «https://sumut.fi/wp-content/uploads/2020/02/NPI_150210.pdf»19), med den förkortade enkätversionen NPI-Q eller till exempel på CMAI-skalan (Suomen muistiasiantuntijat ry - Välineitä työhösi «http://www.sumut.fi/valineita-tyohosi»12: CMAI-asteikko «https://sumut.fi/wp-content/uploads/2020/02/Cohen_Mansfield_levottomuusasteikko_20151023.pdf»23) eller med enkäten FBI-mod som lämpar sig särskilt för frontala symtom (enkäten kommer att publiceras på webbplatsen Suomen muistiasiantuntijat ry - Välineitä työhösi «http://www.sumut.fi/valineita-tyohosi»12). Vid minnessjukdom vid Parkinsons sjukdom kan acetylkolinesterashämmare minska synvillor eller andra hallucinationer eller vanföreställningar och förvirring.
- Vid pann-tinninglobsdegeneration kan acetylkolinesterashämmare och memantin förstärka neuropsykiatriska symtom.
- Bedömning av informationsbearbetningen:
- I undersökningarna av minnessjukdom i samband med cerebrovaskulär sjukdom (VCI) har man tillämpat metoder för bedömning av terapisvar som använts i undersökningar som gäller AS, vilket kan ha påverkat resultaten.
Avslutande av användning av demensläkemedel
- Avslutande av användningen av läkemedel övervägs om
- det inte går att övervaka läkemedelsbehandlingen
- patienten har svåra biverkningar eller
- medicineringen vid svår demenssjukdom inte längre kan ge någon nytta med tanke på funktionsförmågan eller de neuropsykiatriska symtomen.
- I oklara situationer kan man prova en högst 3 veckor lång paus i medicineringen, eftersom en eventuell försämring av tillståndet framträder redan under denna tid.
- Inledande av vård dygnet runt är i sig inte en grund för att avsluta användningen av ett läkemedel för minnessjukdom.
- Hos en del patienter kan ett plötsligt avslutande av medicinering med läkemedel för
minnessjukdom leda till att symtomen snabbt förvärras och svåra neuropsykiatriska
symtom uppkommer.
- Då inleds läkemedelsbehandlingen på nytt.
Läkemedel mot minnessjukdom
Acetylkolinesterashämmare
- Det finns tre acetylkolinesterashämmare som effektiviserar det kolinerga systemets
funktion: donepezil, galantamin och rivastigmin.
- De ger sannolikt inga betydande kliniska effektskillnader i långvarig behandling av
AS.
- Det torde inte finnas några betydande kliniska skillnader mellan donepezil och galantamin vid långvarig behandling av Alzheimers sjukdom «Donepetsiilillä ja galantamiinilla ei liene merkittäviä kliinisiä eroja Alzheimerin taudin pitkäkestoisessa hoidossa.»C.
- Den officiella indikationen för acetylkolinesterashämmare är lindrig eller medelsvår AS och för rivastigmin även symtomatisk behandling av lindrig och måttligt svår demens hos personer med idiopatisk Parkinsons sjukdom.
- Minnessjukdom i samband med cerebrovaskulär sjukdom eller VCI är inte officiell indikation för något undersökt läkemedel i Europa (EMA) eller USA (FDA).
- Acetylkolinesterashämmare ska inte användas vid oklara minnessymtom eller lindrig kognitiv nedsättning.
- Enligt metaanalyser är NNT-talet för en kliniskt betydande skillnad mellan placebo- och läkemedelsbehandlingsgruppen i storleksklassen 4–7 «Li DD, Zhang YH, Zhang W, ym. Meta-Analysis of Ran...»93.
- De vanligaste biverkningarna är kolinerga (tabell «Prevalensen av de vanligaste biverkningarna av kolinerga läkemedel i NNH-tal (antal patienter som ska behandlas för att en ska få en biverkning). 95 % konfidensintervall inom parentes. ...»14). Orala acetylkolinesterashämmare ska tas efter måltid.
- De vanligaste kontraindikationerna för acetylkolinesterashämmare har sammanställts i tabell «Kontraindikationer för medicinering mot minnessjukdomar...»13 och interaktionerna i tilläggsmaterialet «Muistisairauslääkkeiden haitat ja käytössä huomioitavaa»21.
- De ger sannolikt inga betydande kliniska effektskillnader i långvarig behandling av
AS.
| Biverkning | Donepezil | Rivastigmin 9,5 mg/dygn (plåster)1 | Galantamin 16–24 mg | |
|---|---|---|---|---|
| 1 I en jämförelsestudie «Isaac MG, Quinn R, Tabet N. Vitamin E for Alzheime...»30 (rivastigmin 9,5 mg vs. 13,3 mg) orsakade en högre dos något fler biverkningar, främst illamående, kräkningar och svindel. | ||||
| 5 mg | 10 mg | |||
| Illamående | = placebo | 13 (10–20) | = placebo | 5,5 (5–6) |
| Kräkningar | = placebo | 15 (10–24) | = placebo | 10 (9–13) |
| Diarré | 25 (16–59) | 12 (9–17) | = placebo | 50 (27–486) |
| Aptitlöshet | = placebo | 19 (13–32) | = placebo | 21 (15–35) |
| Svindel | = placebo | 36 (20–164) | = placebo | 18 (12–37) |
| Huvudvärk | = placebo | = placebo | = placebo | 20 (12–69) |
| Sömnlöshet | 29 (15–265) | 17 (11–34) | = placebo | = placebo |
| Muskelkramper | 28 (15–199) | 18 (11–49) | inga uppgifter | inga uppgifter |
Donepezil
- Donepezil är en icke-kompetitiv, reversibel acetylkolinesterashämmare. Startdosen är 5 mg en gång per dygn.
- Efter en månad kan dosen höjas till 10 mg en gång per dygn.
- För äldre personer är det bra att höja dosen långsammare för att undvika biverkningar.
- I produktresumén står det att läkemedlet tas på kvällen före läggdags. Den praktiska kliniska erfarenheten har dock visat att det är bra att ta läkemedlet på morgonen eller förmiddagen, för att bland annat minska risken för störd nattsömn.
- Donepezil tolereras väl, men interaktioner med andra läkemedel ska beaktas «Muistisairauslääkkeiden haitat ja käytössä huomioitavaa»21.
- Betydande bradykardi eller AV-ledningsstörning är möjlig om patienten använder andra läkemedel som orsakar bradykardi: digoxin, adrenerga betablockerare eller kalciumblockerare «Tavassoli N, Sommet A, Lapeyre-Mestre M, ym. Drug ...»94.
- Det är skäl att kontrollera EKG vid bedömningen av läkemedelsbehandlingens tolerabilitet, eftersom donepezil har beskrivits orsaka förlängning av QT-tiden «Malone K, Hancox JC. QT interval prolongation and ...»95.
- Donepezil ska inte användas tillsammans med antikolinergika «Leinonen E, Alanen HM. Antikolinergiset lääkehaita...»96, «Muistisairaille ongelmalliset lääkevalmisteet ja niiden haittavaikutukset»8. Se tabell «De vanligaste antikolinerga läkemedlen ...»5.
- CYP-hämmare, särskilt amiodaron, paroxetin och fluoxetin, kan höja donepezilhalten «Tavassoli N, Sommet A, Lapeyre-Mestre M, ym. Drug ...»94.
- De vanligaste kontraindikationerna för acetylkolinesterashämmare har sammanställts i tabell «Kontraindikationer för medicinering mot minnessjukdomar...»13 och interaktionerna samt de vanligaste biverkningarna i tilläggsmaterialet «Muistisairauslääkkeiden haitat ja käytössä huomioitavaa»21.
Galantamin
- Galantamin är en icke-kompetitiv, reversibel acetylkolinesterashämmare som också har en modulerande effekt på nikotinreceptorn. Startdosen är 8 mg en gång per dygn.
- Dosen höjs efter en månad till 16 mg en gång per dygn, vilket är den minsta effektiva
dosen, och efter ytterligare en månad till 24 mg en gång per dygn.
- För äldre personer är det bra att höja dosen långsammare för att undvika biverkningar.
- Galantamin tolereras väl, men interaktioner med andra läkemedel ska beaktas «Muistisairauslääkkeiden haitat ja käytössä huomioitavaa»21.
- Betydande bradykardi eller AV-ledningsstörning är möjlig om patienten använder andra läkemedel som orsakar bradykardi: digoxin, adrenerga betablockerare eller kalciumblockerare «Tavassoli N, Sommet A, Lapeyre-Mestre M, ym. Drug ...»94.
- Det är skäl att kontrollera EKG vid bedömningen av läkemedelsbehandlingens tolerabilitet.
- Galantamin ska inte användas tillsammans med antikolinergika «Leinonen E, Alanen HM. Antikolinergiset lääkehaita...»96, «Muistisairaille ongelmalliset lääkevalmisteet ja niiden haittavaikutukset»8. Se tabell «De vanligaste antikolinerga läkemedlen ...»5.
- De vanligaste kontraindikationerna för acetylkolinesterashämmare har sammanställts i tabell «Kontraindikationer för medicinering mot minnessjukdomar...»13 och interaktionerna och de vanligaste biverkningarna i tilläggsmaterialet «Muistisairauslääkkeiden haitat ja käytössä huomioitavaa»21.
Rivastigmin
- Rivastigmin hämmar acetyl- och butyrylkolinesteras.
- Vid användning av kapslar är startdosen 1,5 mg två gånger per dygn. Dosen ökas med en månads mellanrum till 3 mg, 4,5 mg och 6 mg två gånger per dygn. Den minsta effektiva dosen är 3 mg två gånger per dygn.
- Behandling med plåster inleds med dosen 4,6 mg per dygn och dosen höjs efter en månad till 9,5 mg per dygn «Winblad B, Cummings J, Andreasen N, ym. A six-mont...»97. Senare är det möjligt att vid behov öka dosen ytterligare till 13,3 mg per dygn.
- Med plåsterbehandling kan man undvika många biverkningar i anslutning till oralt bruk «Winblad B, Cummings J, Andreasen N, ym. A six-mont...»97, men det orsakar hudsymtom hos en del patienter.
- För äldre patienter är det bra att höja dosen långsammare för att undvika biverkningar.
- Rivastigmin tolereras väl, men interaktioner med andra läkemedel ska beaktas «Muistisairauslääkkeiden haitat ja käytössä huomioitavaa»21.
- Betydande bradykardi eller AV-ledningsstörning är möjlig om patienten använder andra läkemedel som orsakar bradykardi: digoxin, adrenerga betablockerare eller kalciumblockerare «Tavassoli N, Sommet A, Lapeyre-Mestre M, ym. Drug ...»94.
- Det är skäl att kontrollera EKG vid bedömningen av läkemedelsbehandlingens tolerabilitet.
- Rivastigmin ska inte användas tillsammans med antikolinergika «Leinonen E, Alanen HM. Antikolinergiset lääkehaita...»96, «Muistisairaille ongelmalliset lääkevalmisteet ja niiden haittavaikutukset»8. Se tabell «De vanligaste antikolinerga läkemedlen ...»5.
- Interaktioner kan förekomma i mindre utsträckning än hos andra acetylkolinesterashämmare «Tavassoli N, Sommet A, Lapeyre-Mestre M, ym. Drug ...»94.
- De vanligaste kontraindikationerna för acetylkolinesterashämmare har sammanställts i tabell «Kontraindikationer för medicinering mot minnessjukdomar...»13 och interaktionerna och de vanligaste biverkningarna i tilläggsmaterialet «Muistisairauslääkkeiden haitat ja käytössä huomioitavaa»21.
Antiglutamat medicinering
Memantin
- Memantin är en icke-kompetitiv antagonist till NMDA-receptorn för glutamat, och dämpar överdriven glutamateffekt «Alhainen K. Alzheimer-lääkkeiden vaikutusmekanismi...»98, «Keränen T. Alzheimerin taudin lääkkeiden farmakolo...»99.
- Den officiella indikationen för memantin är måttlig eller svår AS.
- Startdosen är 5 mg en gång per dygn.
- Dosen höjs med en veckas mellanrum (5 mg per vecka) och inom en månad uppnås en underhållsdos på 20 mg en gång per dygn.
- Memantin tolereras väl, men interaktioner med andra läkemedel ska beaktas och vid svår njursvikt ska dosen minskas. Se tilläggsmaterial «Muistisairauslääkkeiden haitat ja käytössä huomioitavaa»21.
- De vanligaste kontraindikationerna för memantin har sammanställts i tabell «Kontraindikationer för medicinering mot minnessjukdomar...»13 och interaktionerna och de vanligaste biverkningarna i tilläggsmaterialet «Muistisairauslääkkeiden haitat ja käytössä huomioitavaa»21.
Läkemedelsbehandling av Alzheimers sjukdom
- Som primärt läkemedel vid AS rekommenderas någon av de tre acetylkolinesterashämmarna
eller memantin.
- Vid behandling av tidig och lindrig AS är acetylkolinesterashämmare primära läkemedel.
- Vid behandling av lindrig AS har memantin däremot uppenbarligen ingen inverkan på kognitionen, helhetsintrycket, självständigheten eller de neuropsykiatriska symtomen under en uppföljningstid på ett halvt år «Memantiinilla ei ilmeisesti ole vaikutusta kognitioon, yleisvaikutelmaan, omatoimisuuteen eikä neuropsykiatrisiin oireisiin lievää Alzheimerin tautia sairastavilla puolen vuoden seuranta-aikana.»B. Dessutom löper personer med lindrig Alzheimers sjukdom större risk att avsluta memantinbehandling på grund av biverkningar av läkemedlet än vid placebobehandling.
- Vid behandling av lindrig AS ska memantin inte användas utan särskilda skäl (se Avstå klokt-rekommendationen «Memantiinin välttäminen lievää Alzheimerin tautia sairastavilla»35).
- Vid behandling av medelsvår eller svår AS kan acetylkolinesterashämmare eller memantin användas «Memantiini kohentaa kognitiota, yleisvaikutelmaa ja omatoimisuutta keskivaikeaa ja vaikeaa Alzheimerin tautia sairastavilla.»A, «Memantiini vähentää neuropsykiatrisia oireita keskivaikeaa ja vaikeaa Alzheimerin tautia sairastavilla.»A.
- Vid medelsvår eller långt framskriden AS är tillägg av memantin vid sidan av acetylkolinesterashämmaren till nytta «Asetyylikoliiniesteraasiestäjän ja memantiinin yhteiskäyttö kohentaa kognitiota, omatoimisuutta ja yleisvaikutelmaa sekä vähentää neuropsykiatrisia oireita keskivaikeassa–vaikeassa Alzheimerin taudissa verrattuna pelkkään AKE-estäjähoitoon.»A.
- Om en acetylkolinesterashämmare inte passar när läkemedelsbehandlingen inleds är det viktigt att regelbundet följa upp patientens tillstånd och inleda behandling med memantin när sjukdomen närmar sig det medelsvåra stadiet.
Donepezil
- Donepezil stöder kognitionen, helhetsintrycket och självständigheten hos personer med Alzheimers sjukdom i alla skeden av sjukdomen «Donepetsiili tukee Alzheimerin tautia sairastavien kognitiota, yleisvaikutelman säilymistä ja omatoimisuutta kaikissa taudin vaiheissa.»A.
- Donepezil med dosen 10 mg en gång per dygn minskar uppenbarligen de neuropsykiatriska symtomen i alla stadier av Alzheimers sjukdom «Donepetsiili annoksella 10 mg/vrk ilmeisesti vähentää neuropsykiatrisia oireita kaikissa Alzheimerin taudin vaiheissa.»B.
- Acetylkolinesterashämmare (t.ex. donepezil) är inte till någon nytta vid lindrig kognitiv nedsättning med oklar etiologi (MCI) «Asetyylikoliiniesteraasin estäjistä ei ole hyötyä etiologialtaan epäselvässä lievässä kognitiivisessa heikentymisessä (MCI).»A.
Galantamin
- Galantamin stöder kognitionen i alla skeden av Alzheimers sjukdom och bromsar upp försämringen av självständigheten i ett lindrigt eller medelsvårt stadium «Galantamiini tukee kognitiota Alzheimerin taudissa sairauden kaikissa vaiheissa ja hidastaa omatoimisuuden heikkenemistä lievässä–keskivaikeassa vaiheessa.»A.
- Galantamin minskar uppenbarligen de neuropsykiatriska symtomen vid lindrig eller medelsvår Alzheimers sjukdom «Galantamiini ilmeisesti vähentää neuropsykiatrisia oireita lievässä tai keskivaikeassa Alzheimerin taudissa.»B.
- Vid svår AS torde galantamin endast förbättra kognitionen i liten utsträckning och torde inte påverka funktionsförmågan.
- Acetylkolinesterashämmare (t.ex. galantamin) är inte till någon nytta vid lindrig kognitiv nedsättning med oklar etiologi (MCI) «Asetyylikoliiniesteraasin estäjistä ei ole hyötyä etiologialtaan epäselvässä lievässä kognitiivisessa heikentymisessä (MCI).»A.
Rivastigmin
- Rivastigmin förbättrar kognitionen hos personer med lindrig eller medelsvår Alzheimers sjukdom. Läkemedlet är uppenbarligen till nytta vid långvarig användning (över 6 månader) även i fråga om funktionsförmågan och helhetsintrycket «Rivastigmiini kohentaa kognitiota lievää tai keskivaikeaa Alzheimerin tautia sairastavilla. Siitä on ilmeisesti hyötyä pitkäaikaisessa (yli 6 kuukautta) käytössä myös toimintakyvyn ja yleisvaikutelman osalta.»A.
- Rivastigmin torde inte vara effektivt vid behandling av neuropsykiatriska symtom vid lindrig eller medelsvår Alzheimers sjukdom «Rivastigmiini ei liene tehokas lievän tai keskivaikean Alzheimerin taudin neuropsykiatristen oireiden hoidossa.»C.
- Acetylkolinesterashämmare (t.ex. rivastigmin) är inte till någon nytta vid lindrig kognitiv nedsättning med oklar etiologi (MCI) «Asetyylikoliiniesteraasin estäjistä ei ole hyötyä etiologialtaan epäselvässä lievässä kognitiivisessa heikentymisessä (MCI).»A.
Memantin
- Memantin förbättrar kognitionen, helhetsintrycket och självständigheten hos personer med medelsvår och svår Alzheimers sjukdom «Memantiini kohentaa kognitiota, yleisvaikutelmaa ja omatoimisuutta keskivaikeaa ja vaikeaa Alzheimerin tautia sairastavilla.»A.
- Memantin minskar också de neuropsykiatriska symtomen vid medelsvår och svår AS «Memantiini vähentää neuropsykiatrisia oireita keskivaikeaa ja vaikeaa Alzheimerin tautia sairastavilla.»A.
- Memantin har uppenbarligen ingen inverkan på kognitionen, helhetsintrycket, självständigheten
eller de neuropsykiatriska symtomen vid lindrig AS under en uppföljningstid på ett
halvt år «Memantiinilla ei ilmeisesti ole vaikutusta kognitioon, yleisvaikutelmaan, omatoimisuuteen eikä neuropsykiatrisiin oireisiin lievää Alzheimerin tautia sairastavilla puolen vuoden seuranta-aikana.»B.
- Vid lindrig Alzheimers sjukdom är kombinationen av memantin med acetylkolinesterashämmare inte till någon ytterligare nytta, se Avstå klokt-rekommendationen «Memantiinin yhdistäminen asetyylikoliiniesteraasin estäjään lievässä Alzheimerin taudissa»36.
- Vid lindrig AS löpte personer som använder memantin större risk att avsluta läkemedelsbehandlingen på grund av biverkningar jämfört med personer som fick placebo «Memantiinilla ei ilmeisesti ole vaikutusta kognitioon, yleisvaikutelmaan, omatoimisuuteen eikä neuropsykiatrisiin oireisiin lievää Alzheimerin tautia sairastavilla puolen vuoden seuranta-aikana.»B.
- Det finns ingen evidens för att memantin har effekt på kognitionen vid MCI-tillstånd «Peters O, Lorenz D, Fesche A, ym. A combination of...»100, «Tricco AC, Soobiah C, Berliner S, ym. Efficacy and...»101.
Samtidig användning
- Samtidig användning av acetylkolinesterashämmare (donepezil, galantamin eller rivastigmin) och memantin förbättrar kognitionen, självständigheten och helhetsintrycket samt minskar de neuropsykiatriska symtomen hos personer med medelsvår eller svår Alzheimers sjukdom jämfört med behandling med endast acetylkolinesterashämmare «Asetyylikoliiniesteraasiestäjän ja memantiinin yhteiskäyttö kohentaa kognitiota, omatoimisuutta ja yleisvaikutelmaa sekä vähentää neuropsykiatrisia oireita keskivaikeassa–vaikeassa Alzheimerin taudissa verrattuna pelkkään AKE-estäjähoitoon.»A.
- Samtidig användning av memantin och acetylkolinesterashämmare (donepezil, galantamin eller rivastigmin) vid medelsvår och svår AS kan senarelägga behovet av permanent institutionsvård «Lopez OL, Becker JT, Wahed AS, ym. Long-term effec...»102.
- Vid lindrig AS ger det ingen ytterligare nytta att kombinera memantin med en acetylkolinesterashämmare, se Avstå klokt-rekommendationen «Memantiinin yhdistäminen asetyylikoliiniesteraasin estäjään lievässä Alzheimerin taudissa»36.
Läkemedelsbehandling av vaskulär kognitiv försämring
- Symtomatiska läkemedelsprövningar för VCI har varit inriktade på en patientgrupp med VD, som NINDS-AIREN-anvisningarna använts som diagnostiska kriterier för «Vaskulaarisen muistisairauden NINDS-AIREN-kriteerit vuodelta 1993»11. I gruppen har det ingått patienter med såväl småkärls- som storkärlssjukdom och patienter med infarkt i ett område som är kritiskt för kognitionen.
- Läkemedlen som undersöks vid behandling av VCI är acetylkolinesterashämmare (donepezil,
galantamin, rivastigmin) och memantin.
- Läkemedel mot minnessjukdomar är uppenbarligen till nytta vid vaskulär minnessjukdom och vaskulär kognitiv försämring (VCI) «Muistisairauslääkkeistä on ilmeisesti hyötyä aivoverenkiertosairauden (AVH) muistisairaudessa ja kognitiivisessa heikentymisessä (vascular cognitive impairment, VCI).»B.
- Memantin kan förbättra kognitionen men påverkar inte helhetsintrycket vid lindrig eller medelsvår VD «Muistisairauslääkkeistä on ilmeisesti hyötyä aivoverenkiertosairauden (AVH) muistisairaudessa ja kognitiivisessa heikentymisessä (vascular cognitive impairment, VCI).»B.
- VCI eller VD är inte officiell indikation för något undersökt läkemedel varken i Europa (EMA) eller USA (FDA).
- Det är viktigt att behandla vaskulära riskfaktorer hos patienter med minnessjukdomar.
Läkemedelsbehandling av Alzheimers sjukdom och samtidig cerebrovaskulär sjukdom
- Galantamin förbättrar uppenbarligen kognitionen, självständigheten och helhetsintrycket hos patienter med Alzheimers sjukdom och samtidig cerebrovaskulär sjukdom «Galantamiini ilmeisesti kohentaa kognitiota, omatoimisuutta ja yleisvaikutelmaa potilailla, joilla on Alzheimerin tauti ja samanaikainen aivoverenkiertosairaus.»B.
- Galantamin kan minska de neuropsykiatriska symtomen hos patienter med AS och samtidig cerebrovaskulär sjukdom «Galantamiini saattaa vähentää neuropsykiatrisia oireita potilailla, joilla on Alzheimerin tauti ja samanaikainen aivoverenkiertosairaus.»C.
- I fråga om donepezil, rivastigmin och memantin har inga motsvarande omfattande placebokontrollerade dubbelblinda studier genomförts.
Läkemedelsbehandling av minnessjukdomar vid Parkinsons sjukdom och Lewykroppssjukdom
- Donepezil
- kan förbättra kognitionen och helhetsintrycket vid minnessjukdom vid Parkinsons sjukdom «Donepetsiili saattaa kohentaa kognitiota ja yleisvaikutelmaa Parkinsonin tautiin liittyvässä dementiassa.»C (C)
- kan vara till nytta för kognitionen, de neuropsykiatriska symtomen och helhetsintrycket hos en person med Lewykroppssjukdom «Donepetsiilistä voi olla hyötyä Lewyn kappale -taudin kognitioon, neuropsykiatrisiin oireisiin ja yleisvaikutelmaan.»C.
- Rivastigmin
- förbättrar uppenbarligen kognitionen och helhetsintrycket samt minskar de neuropsykiatriska
symtomen vid minnessjukdom vid Parkinsons sjukdom «Rivastigmiini ilmeisesti kohentaa kognitiota ja yleisvaikutelmaa sekä vähentää neuropsykiatrisia oireita Parkinsonin taudin dementiassa.»B
- kan vara till nytta vid behandling av Lewykroppssjukdom för att förbättra kognitionen och minska de neuropsykiatriska symtomen «Rivastigmiinista saattaa olla hyötyä Lewyn kappale -taudin hoidossa kognition kohentamisessa ja neuropsykiatristen oireiden vähentämisessä.»C.
- Enligt Cochrane-översikten «Rolinski M, Fox C, Maidment I, ym. Cholinesterase ...»103 kan läkemedel som innehåller acetylkolinesterashämmare vara till nytta vid behandling av minnessjukdom vid Parkinsons sjukdom för att förbättra helhetsintrycket, kognitionen och självständigheten samt för att minska neuropsykiatriska symtom.
- Memantin kan vara till nytta vid behandling av LBD och minnessjukdom vid Parkinsons sjukdom för att förbättra helhetsintrycket, men inte för att minska de neuropsykiatriska symtomen «Memantiinista saattaa olla hyötyä Lewyn kappale -taudin ja Parkinsonin taudin dementian yleisvaikutelmaan, mutta ei neuropsykiatrisiin oireisiin.»C.
- förbättrar uppenbarligen kognitionen och helhetsintrycket samt minskar de neuropsykiatriska
symtomen vid minnessjukdom vid Parkinsons sjukdom «Rivastigmiini ilmeisesti kohentaa kognitiota ja yleisvaikutelmaa sekä vähentää neuropsykiatrisia oireita Parkinsonin taudin dementiassa.»B
Pann-tinninglobsdegeneration
- Det finns ingen evidens för nyttan med acetylkolinesterashämmare eller memantin och de ska inte användas vid behandling av pann-tinninglobsdegeneration, men annan medicinering enligt symtombilden kan övervägas.
Övriga läkemedelspreparat och kosttillskott som undersökts för minnessjukdomar
- Det är motiverat att undvika och åtgärda vitaminbrister, men i övrigt är den nuvarande kunskapen inte tillräcklig för att man ska kunna ge en allmän rekommendation om användningen av vitaminer och antioxidanter för att förebygga minnessjukdomar, åtminstone inte hos kognitivt normala personer «Vitamiinien ja antioksidanttien vaikutus kognitioon»37.
- Statinbehandling och en minskning av kolesterolhalten kan vara till nytta med tanke på den kognitiva funktionen «Statiinihoidosta ja kolesterolitason pienentämisestä saattaa olla hyötyä kognitiivisen toiminnan kannalta.»C.
- Användningen av ett kliniskt näringspreparat som särskilt utvecklats för behandling av Alzheimers sjukdom kan påverka sjukdomens framskridande vid tidig minnessjukdom av Alzheimerstyp, om patienten inte använder ett läkemedel för minnessjukdom «Erityisesti Alzheimerin taudin hoitoon suunnitellun kliinisen ravintovalmisteen käytöllä voi olla vaikutusta taudin etenemiseen varhaisessa Alzheimer-tyyppisessä muistisairaudessa, jossa potilailla ei ole käytössä muistisairauslääkettä.»C.
Behandling av neuropsykiatriska symtom
- I stället för termen beteendesymptom rekommenderas termen neuropsykiatriskt symtom, som bättre beskriver symtomens karaktär och som är den term som oftast används i litteraturen «Muistisairauden neuropsykiatristen oireiden hoito»32.
- Neuropsykiatriska symtom förekommer i något skede hos 90 procent av patienterna med olika minnessjukdomar.
- De försämrar livskvaliteten, ökar servicebehovet och är den viktigaste orsaken till att vård dygnet runt inleds.
- Regelbunden kartläggning och behandling av neuropsykiatriska symtom är en väsentlig del av uppföljningen av patienten.
- Om neuropsykiatriska symtom uppkommer eller förvärras ska man utreda vilken roll somatiska sjukdomar eller andra utlösande faktorer, såsom värk, spelar (tabell «Möjliga orsaker till plötslig förändring i det kliniska tillståndet och neuropsykiatriska symtom...»15), se även tilläggsmaterialet «Kipu ja muistisairaus»38.
- Neuropsykiatriska symtom ska behandlas om de belastar patienten eller försämrar patientens självständighet eller sociala interaktion.
- Behandling är också motiverad om symtomen orsakar farliga situationer för patienten själv eller andra.
- Läkemedelsfria metoder är primära vid behandling av de flesta neuropsykiatriska symtomen. Enligt undersökningar är åtminstone musikterapi, gruppverksamhet och interventioner riktade till anhöriga eller vårdpersonal som främjar kommunikation och patientcentrerad vård effektiva vid behandling av neuropsykiatriska symtom i anslutning till demenssjukdomar (tabell «Läkemedelsfria behandlingsmöjligheter för neuropsykiatriska symtom...»16). Evidensen för fördelarna med ljusterapi och aromaterapi är otillräcklig. Se mer information om läkemedelsfri behandling av neuropsykiatriska symtom «Lääkkeettömät hoidot neuropsykiatristen oireiden hoidossa»39.
- En del av de neuropsykiatriska symtomen i anslutning till minnessjukdomar kan ha varierande varaktighet, och därför ska behovet av behandling med antidepressiva läkemedel och psykosläkemedel bedömas efter cirka en månad och regelbundet med 3–4 månaders mellanrum för fortsatt läkemedelsbehandling «Ryu SH, Katona C, Rive B, ym. Persistence of and c...»104, «Reus VI, Fochtmann LJ, Eyler AE ym: The American P...»105. Läkemedelsresponsen kan också följas upp av en minnesskötare och uppföljningen kan genomföras som distanskontakt.
- För symtomspecifik behandling av neuropsykiatriska symtom se tilläggsmaterialet «Muistisairauden neuropsykiatristen oireiden hoito»32.
- Patientanvisning om neuropsykiatriska symtom se Hjärnhuset/Demenssjukdomar på webbplatsen Hälsobyn «https://www.terveyskyla.fi/sv/hjarnhuset/hjarnsjukdomar/demenssjukdomar»28.
| Infektion |
| Störning i vätskebalansen |
| Metabol rubbning, såsom hypo- eller hyperglykemi |
| Epileptiskt anfall |
| Hjärtsvikt |
| Rytmrubbning |
| Cirkulationsrubbningar i hjärnan |
| Tumörer |
| Delirium |
| Smärta |
| Annan faktor som orsakar obehag, till exempel förstoppning eller urinretention |
| Frustration |
| Förändringar i vårdmiljön |
| Olämplig medicinering |
| Skadeverkningar av berusningsmedel |
| Trauma: huvudskada, fraktur, subduralhematom |
| Stöd och handledning till anhöriga |
| God grundläggande vård (näring, vätsketillförsel, smärtbehandling m.m.) |
| Eliminering av utlösande faktorer (t.ex. smärta, olämplig medicinering) |
| Förbättring av vårdpersonalens kommunikationsfärdigheter |
| Vårdarrangemang och utredning av vårdåtgärder för att tillgodose behov av patienter med minnessjukdomar |
| Musikterapi, ergoterapi |
| Terapier som stöder känslolivet och kognitivt inriktade terapier (minnes- och valideringsterapi) |
| Metoder som betonar betydelsefulla upplevelser (stimulans, sinnesaktivering) |
| Metoder som stöder beteende och interaktionssätt (behaviorala terapier) |
| Motion |
| Andra kreativa aktiviteter, såsom musik, bildkonst, dans och hantverk |
Läkemedelsbehandling av neuropsykiatriska symtom
- Den primära läkemedelsbehandlingen av neuropsykiatriska symtom är ändamålsenlig läkemedelsbehandling av minnessjukdomen.
- Psykofarmaka kan behövas kortvarigt för behandling av depressionssymtom, svår rastlöshet
och svåra psykossymtom.
- Symtom som läkemedelsbehandling inte hjälper mot är bland annat om patienten vandrar omkring, samlar ihop och gömmer saker, klär på sig och av sig planlöst, ropar, äter föremål, är hypersexuell och skadar sig själv (klöser, slår).
- Responsen kan bedömas mer tillförlitligt cirka en månad efter att användningen av psykofarmaka har inletts.
- Vid genomförande av läkemedelsbehandling kan man tillämpa det flödesschema om presenteras i denna rekommendation (bild «Muistisairauksiin liittyvän levottomuuden ja aggressiivisuuden hoitomuotojen porrastus»2).
- I fråga om psykofarmaka används i regel små doser och endast ett preparat.
- I synnerhet ska samtidigt användning av flera läkemedel med likartad effekt undvikas.
- I genomförandet av läkemedelsbehandling ska eventuella biverkningar beaktas «Muistisairauksien ja neuropsykiatristen oireiden hoidossa käytettävien lääkkeiden haittavaikutuksia ja hoidossa huomioitavaa»40.

Muistisairauksiin liittyvän levottomuuden ja aggressiivisuuden hoitomuotojen porrastus
Avaa kaavion tulostettava versio tästä linkistä «hoi50044x.pdf»
© Suomalainen Lääkäriseura Duodecim
Bensodiazepiner
- Enligt klinisk erfarenhet kan små doser medellångverkande bensodiazepiner användas vid tillfällig eller kortvarig behandling av neuropsykiatriska symtom.
- Bensodiazepiner försämrar de kognitiva informationsbearbetningsfunktionerna och ökar risken för förvirring och fallolyckor. Hos personer som länge använt bensodiazepiner har förekomsten av minnessjukdomar ökat, men för att bättre förstå associationen mellan bensodiazepiner och den ökade risken för minnessjukdomar och ett eventuellt orsakssammanhang behövs ännu fler prospektiva undersökningar «Bentsodiatsepiineja pitkään käyttäneillä muistisairauksien esiintyminen on lisääntynyt, mutta bentsodiatsepiinien ja muistisairauksien riskin kasvun välisen assosiaation ja mahdollisen syy-seuraussuhteen ymmärtämiseksi paremmin tarvitaan vielä lisää prospektiivisia tutkimuksia.»C.
- Användningen av bensodiazepinläkemedel kan vara förknippad med så kallad paradoxal respons, dvs. i stället för en lugnande effekt kan patienten bli upprörd och ångestfylld.
- Fördelarna och nackdelarna ska bedömas och dessutom ska förändringar i läkemedlens metabolism och distributionsvolym i anslutning till åldrande beaktas.
Antidepressiva läkemedel
- Antidepressiva läkemedel torde inte ha någon effekt vid behandling av depression i samband med minnessjukdom «Masennuslääkkeillä ei liene tehoa muistisairauteen liittyvän masennuksen hoidossa.»C. Till undersökningarna har dock patienter med relativt lindriga depressionssymtom valts ut, och deras läkemedelsrespons kan också förväntas vara obetydlig.
- Enligt klinisk erfarenhet är depressionsmedicinering motiverad särskilt om patienten tidigare har haft depressiva episoder.
- Antidepressiva läkemedel med antikolinerga effekter, såsom tricykliska antidepressiva,
ökar svårigheterna i informationsbearbetningen och kan till och med vara förknippade
med utvecklingen av en symtombild på demensnivå «Muistisairaille ongelmalliset lääkevalmisteet ja niiden haittavaikutukset»8, «Carrière I, Fourrier-Reglat A, Dartigues JF, ym. D...»47. Se tabell «De vanligaste antikolinerga läkemedlen ...»5.
- SSRI-läkemedel och trazodon kan vara effektiva och säkra vid behandling av neuropsykiatriska symtom, såsom upprördhet, i anslutning till minnessjukdom «SSRI-lääkkeet ja tratsodoni saattavat olla tehokkaita ja turvallisia muistisairauksiin liittyvien neuropsykiatristen oireiden, kuten kiihtyneisyysoireiden, hoidossa.»C. Vid behandling av agitationssymtom kan de vara ett alternativ till psykosläkemedel.
- Behandlingen med antidepressiva läkemedel som används vid behandling av neuropsykiatriska
symtom hos äldre inlagda patienter som lider av en minnessjukdom torde kunna avslutas
utan betydande försämring av depressionssymtomen efter minst 3 månaders behandling
«Iäkkäiden muistisairautta sairastavien vanhainkotipotilaiden neuropsykiatristen oireiden hoidossa käytetyn masennuslääkehoidon voinee lopettaa ilman merkittävää depressio-oireiden vaikeutumista vähintään 3 kuukauden hoidon jälkeen.»C. Avslutande av läkemedel kan leda till att symtomen ökar på nytt och därför ska patienternas
tillstånd följas upp när användningen avslutas.
- Sertralin och citalopram verkar ha mindre kliniskt betydande interaktioner än andra serotoninåterupptagshämmare «Solai LK, Mulsant BH, Pollock BG. Selective seroto...»106.
Antipsykotiska läkemedel
- Användning av psykosläkemedel för äldre patienter med minnessjukdom som lider av svåra neuropsykiatriska symtom medför uppenbarligen risk för cirkulationsstörningar i hjärnan och ökad dödlighet «Psykoosilääkkeiden käyttöön vaikeista neuropsykiatrisista oireista kärsivillä iäkkäillä muistisairauspotilailla ilmeisesti liittyy aivoverenkiertohäiriöiden ja kuolleisuuden lisääntymisen riski.»B, «Schneider LS, Dagerman KS, Insel P. Risk of death ...»107, «Raivio MM, Laurila JV, Strandberg TE, ym. Psychotr...»108, «Wang PS, Schneeweiss S, Avorn J, ym. Risk of death...»109. De kan således endast användas vid kortvarig behandling av de svåraste formerna av psykotiska symtom och neuropsykiatriska symtom som framträder som rastlöshet eller aggressivitet. Behovet ska bedömas regelbundet.
- Behandling med antipsykotiska läkemedel som används för att behandla neuropsykiatriska symtom i anslutning till minnessjukdomar kan uppenbarligen avslutas efter 3–4 månader för patienter med lindriga symtom. Fördelarna med fortsatt behandling med antipsykotiska läkemedel och eventuella risker i anslutning till avslutande av användningen ska bedömas individuellt, särskilt för patienter med svåra symtom «Muistisairauksien neuropsykiatristen oireiden hoidossa käytetyn psykoosilääkehoidon voi ilmeisesti lopettaa lieväoireisilla potilailla 3– 4 kuukauden kuluttua. Psykoosilääkehoidon jatkamisen hyödyt ja mahdolliset lopettamiseen liittyvät riskit tulisi arvioida yksilöllisesti erityisesti vaikeaoireisilla potilailla.»B.
- Risken att neuropsykiatriska symtom återkommer efter avslutad psykosmedicinering är större ju svårare agitationssymtomen var när medicineringen inleddes.
- Svåra neuropsykiatriska symtom i samband med demens är bara officiell indikation för
risperidon.
- Risperidon och aripiprazol är effektiva vid behandling av agitations- och psykossymtom i samband med minnessjukdomar «Risperidoni ja aripipratsoli ovat tehokkaita muistisairauksiin liittyvien agitaatio- ja psykoosioireiden hoidossa.»A.
- Haloperidol är också effektivt vid behandling av demensrelaterad aggressivitet och
psykossymtom «Haloperidoli on tehokas dementiaan liittyvän aggressiivisuuden ja psykoosioireiden hoidossa.»A.
- Haloperidol har ingen inverkan på demensrelaterad agitation «Haloperidolilla ei ole vaikutusta muistisairauksiin liittyvään agitaatioon.»A.
- Olanzapin och kvetiapin kan vara effektiva vid behandling av agitations- och psykossymtom i samband med minnessjukdomar «Olantsapiini ja ketiapiini saattavat olla tehokkaita muistisairauksiin liittyvien agitaatio- ja psykoosioireiden hoidossa.»C.
- Brexpiprazol är uppenbarligen effektivt vid behandling av agitation i samband med Alzheimers sjukdom «Brekspipratsoli on ilmeisesti tehokas Alzheimerin tautiin liittyvän kiihtyneisyyden (agitaatio) hoidossa.»B.
- Andra generationens psykosläkemedel orsakar färre neurologiska biverkningar än äldre läkemedel.
- Långvarig användning av psykosläkemedel bör undvikas särskilt för minnespatienter med lindriga neuropsykiatriska symtom, se Avstå klokt-rekommendationen «Psykoosilääkkeiden pitkäaikainen käyttö neuropsykiatrisista oireista kärsivillä muistisairauspotilailla»41.
Övriga läkemedel
- Det finns otillräcklig evidens på effekten och säkerheten hos valproat vid behandling av rastlöshet i samband med minnessjukdomar «Näyttö valproaatin tehosta ja turvallisuudesta muistisairauksiin liittyvien levottomuusoireiden hoidossa on riittämätön.»D. Valproat kan ändå vara till nytta för maniska patienter.
- Metylfenidat kan vara effektivt och säkert vid behandling av apati i samband med Alzheimers sjukdom «Metyylifenidaatti saattaa olla tehokas ja turvallinen Alzheimerin tautiin liittyvän apatian hoidossa.»C. Patienterna lider sällan själva av apati, så användningen av läkemedlet bör begränsas till de relativt sällsynta situationer där apati antas vara ett centralt symtom som begränsar funktionsförmågan eller livskvaliteten och där läkemedlet kan vara till nytta.
- Mer information om läkemedelsbehandling av neuropsykiatriska symtom och om doseringar finns i tilläggsmaterialet «Muistisairauden neuropsykiatristen oireiden hoito»32.
Helhetsvården för minnespatienter
- Det växande antalet minnespatienter och behovet av vård medför en betydande utmaning
för folkhälsan och samhällsekonomin.
- Minnespatienter inom öppenvården behöver många skräddarsydda tjänster inom hälso- och socialvården.
- Vården av en minnespatient ska genomföras som närservice så att utgångspunkten är patientens behov «Suhonen J, Alhainen K, Eloniemi-Sulkava U ym. Hyvä...»48. Se även patienters och anhörigas synpunkter på behandlingen av minnessjukdomar «Potilaiden ja omaisten näkemyksiä muistisairauden hoidosta»42, «Näkökulmia potilasosallisuutta käsittelevään muistisairauksien tutkimuskirjallisuuteen»43.
- En fungerande vårdkedja för minnespatienter tryggar kontinuitet i vård- och rehabiliteringstjänsterna trots att minnet är svagt och kommunikationen försämras (bild «Vårdkedja för patienter med minnessjukdomar, exempel Alzheimers sjukdom (AS)»3)
- I slutskedet av demenssjukdomen kräver dygnetruntvården mycket specialkompetens och resurser.
- Vård som genomförs i form av samarbete ger minskad belastning och sänker kostnaderna för både patienten och de vårdande enheterna utan att vårdkvaliteten äventyras.
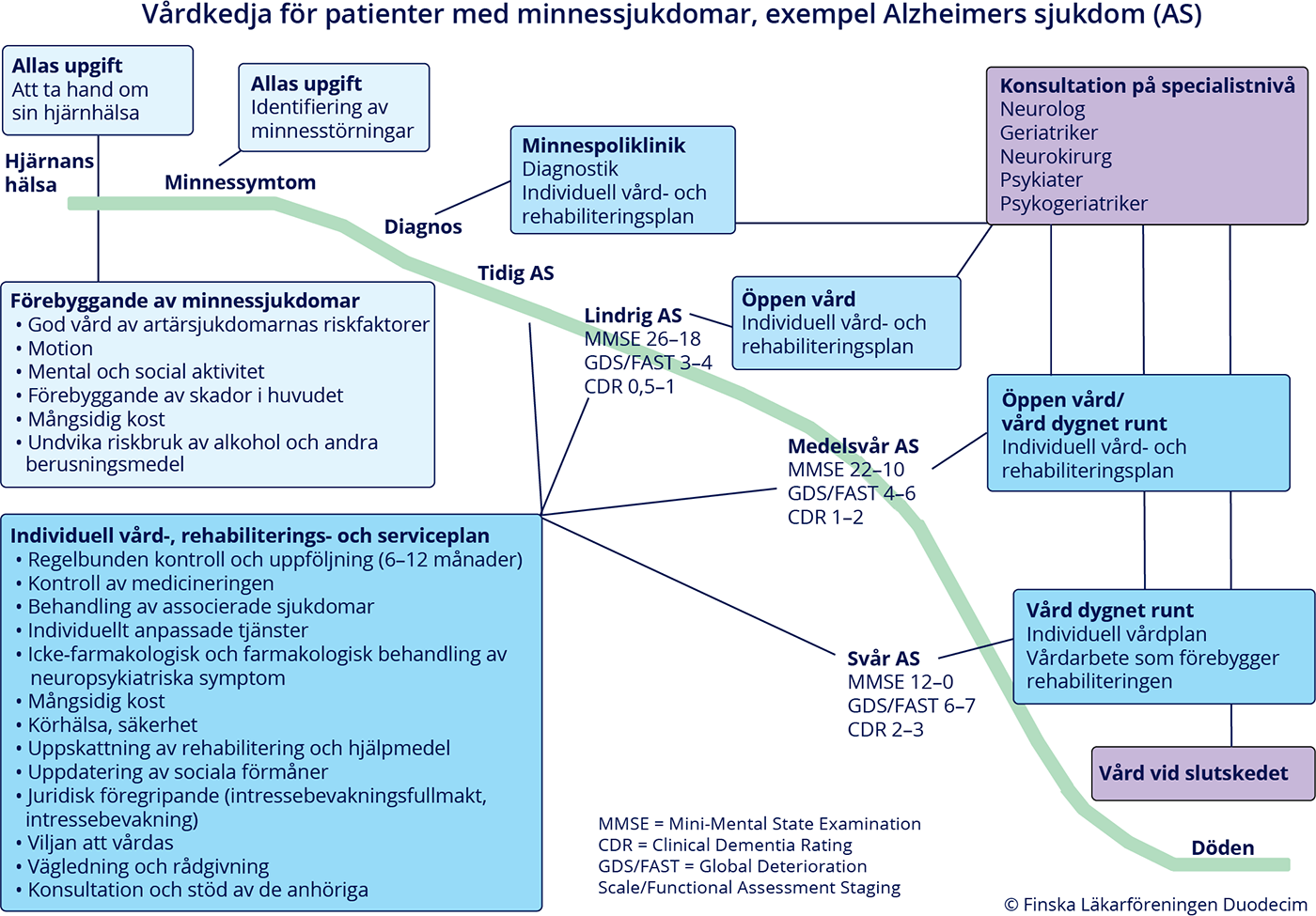
Vårdkedja för patienter med minnessjukdomar, exempel Alzheimers sjukdom (AS). MMSE = Mini-mental State Examination, GDS = Global Deterioration Scale, CDR= Clinical Dementia Rating. Öppna den utskrivbara versionen av diagrammet via denna länk «gvr00014a.pdf»
En obruten vårdkedja tryggar god vård
- Ett viktigt mål för vården av en patient med minnessjukdom är att trygga livskvaliteten
i alla stadier av sjukdomen. Se även ytterligare information «Muistisairaan elämänlaadun seuranta»44. I vården ingår att
- värna om patientens livsstil och bakgrund
- upprätthålla patientens värdighet och sociala nätverk
- trygga patientens autonomi.
- För patienten och de anhöriga är det viktigt att olika tjänster som stöder förmågan att klara sig ordnas på ett smidigt sätt när sjukdomen framskrider: rätt tjänster på rätt plats vid rätt tidpunkt både hemma och inom dygnetruntvården.
- Centrala frågor med tanke på vårdkedjan för patienter med minnessjukdomar har sammanställts
i tabell «God vårdpraxis för minnessjukdomar ...»17.
- De olika delarna i vårdkedjan för patienter med minnessjukdomar presenteras på bild «Vårdkedja för patienter med minnessjukdomar, exempel Alzheimers sjukdom (AS)»3.
| Det är allas uppgift att förebygga minnessjukdomar. |
| Demenssymtom ska identifieras så tidigt som möjligt. |
| Orsaken till minnessymtom ska utredas. |
| Det är bra att koncentrera diagnostiken och organiseringen av vården till en minnespoliklinik. |
| Diagnosen ska klargöras för patienten och dennes närstående. |
| Efter diagnosen utarbetas en vård-, rehabiliterings- och serviceplan. |
| En minneskoordinator säkerställer att patientens öppenvård genomförs. |
| Symtomatisk läkemedelsbehandling av en progressiv minnessjukdom kräver uppföljning. |
| Förebyggande och behandling av neuropsykiatriska symtom kräver kompetens. |
| Övergripande behandling av somatiska sjukdomar hos patienter med minnessjukdomar lönar sig. |
| Munhälsa av patienter med minnessjukdomar ska ombesörjas «Muistisairaan suunhoito»45, «Kun henkilö vastustelee suun puhdistusta – vinkkejä haastaviin tilanteisiin»46. |
| Bedömning av näringstillståndet ingår i uppföljningen av en patient med minnessjukdom. |
| Intressebevakningsfullmakt, upprättande av livstestamente och bedömning av körhälsan är en del av den förebyggande vården. |
| Minnessjukdomar förekommer också hos personer i arbetsför ålder, och i dessa fall kräver diagnostiseringen och behandlingen specialkompetens. |
| Dygnetruntvården av demenspatienter kräver specialkompetens. |
| Även den privata sektorn och tredje sektorn producerar tjänster som patienter med minnessjukdomar behöver. |
Minnespoliklinik och minnesteam
- Minnespolikliniken och minnesteamet är centrala aktörer i vårdkedjan.
- Det är skäl att koncentrera diagnostiken av en patient med minnessjukdom till en regional
minnespoliklinik som har specialkompetens i behandlingen av minnessjukdomar och förmåga
att göra en övergripande lägesbedömning.
- En minnespoliklinik kan fungera bra när den ansvarar för att utreda kognitiva symtom hos minst 20 000–30 000 personer.
- Den regionala minnespolikliniken fungerar som expertstöd för mottagningar inom öppenvården och hemvårdens minnesteam.
- Diagnostiken av patienter med minnessjukdomar i arbetsför ålder ska koncentreras till en neurologisk poliklinik.
- Efter minnespoliklinikens utredningar ansvarar egenläkaren oftast för patientens vård
och regelbunden uppföljning tillsammans med mottagningen inom öppenvården eller hemvårdens
minnesteam.
- Minneskoordinatorn och/eller minnesskötaren arbetar i par med läkaren på mottagningen inom öppenvården «Eloniemi-Sulkava U, Rahkonen T, Erkinjuntti T, Kar...»57.
- Till minnesteamet inom primärvården kan utöver de ovan nämnda även höra andra yrkesutbildade personer inom hälso- och sjukvården och socialarbetet.
- Sammansättningen av minnesteamet som byggts upp som stöd för patienten förändras i takt med att sjukdomen framskrider och behovet av omsorg och service förändras.
- Det är bra att koncentrera den regelbundna uppföljningen av patienten till minneskoordinatorn
för att trygga smidighet och kontinuitet i vården. Minneskoordinatorverksamheten kan
skjuta upp behovet av vård dygnet runt «Muistikoordinaattoritoiminta (care management) saattaa lykätä ympärivuorokautisen hoidon alkua.»C.
- Minneskoordinatorn säkerställer att öppenvården är smidig och handleder patienten och de anhöriga vid problem i vardagen.
- Ett gemensamt drag för effektiva vårdinterventioner är helhetsvård som grundar sig på regelbunden uppföljning och handledning som tillhandahålls av minneskoordinatorn.
- Se en video om minneskoordinatorns roll (längd 3:54) «Muistikoordinaattorin rooli (video)»47
- Det är skäl att koncentrera diagnostiken av en patient med minnessjukdom till en regional
minnespoliklinik som har specialkompetens i behandlingen av minnessjukdomar och förmåga
att göra en övergripande lägesbedömning.
Diagnostisering av minnessjukdom
- Målet är att diagnostisera minnessjukdomen tidigt.
- Att berätta om diagnosen med allmänspråkliga ord gör situationen lättare att förstå för patienten och dennes närstående. Diagnosbeskedet är en del av behandlingen efter diagnosen, likaså att påbörja medicinering mot minnessjukdom och eventuella neuropsykiatriska symtom, behandling av andra sjukdomar, förebyggande åtgärder och nödvändiga utlåtanden (ersättning för läkemedel, förmåner, körhälsa, intressebevakning osv.).
Individuell vård-, rehabiliterings- och serviceplan
- För varje patient med minnessjukdom utarbetas en egen individuell vård-, rehabiliterings- och serviceplan (tabell «Det centrala innehållet i demenspatientens individuella vård-, rehabiliterings- och serviceplan...»18) som granskas regelbundet med 6–12 månaders mellanrum när sjukdomen framskrider.
- Förutseende av förändringar och riskhantering hjälper till att klara av nya situationer när sjukdomen framskrider. När man planerar för framtiden är det viktigt att upptäcka eventuella avvikelser i sjukdomsbilden, förbereda sig på krissituationer, ordna ett stödnätverk för familjen och höra patientens egen vilja.
- Möjligheterna att bo kvar hemma kan stödas på många olika sätt (tabell «Exempel på åtgärder som stöder förmågan att klara sig hemma...»19). Dessa är
- rehabiliterande åtgärder som stöder förmågan att klara sig och självständigheten
- lämplig medicinsk behandling
- stödåtgärder och -tjänster i rätt tid samt lösningar som ökar säkerheten
- ekonomiska stödåtgärder och säkerställande av förmåner, se mer information om C-utlåtande «C-lausunnon laatiminen ja muistisairaudet»48
- stöd till närståendevårdare och patienternas familjer.
- Flerdimensionella interventioner (minneskoordinatorer som arbetar med familjerna,
rådgivnings- och stödtjänster för familjerna, förbättring av närståendevårdarnas mående)
kan skjuta upp patienters behov av dygnetruntvård samt förbättra livskvaliteten för
patienterna och deras anhöriga «Laakkonen ML, Kautiainen H, Hölttä E, ym. Effects ...»110.
- En förutsättning för lyckad vård är en sömlös individuell vårdkedja (bild «Vårdkedja för patienter med minnessjukdomar, exempel Alzheimers sjukdom (AS)»3) som möjliggör systematisk uppföljning samt genomförande av åtgärder som stöder patientens och de anhörigas förmåga att klara sig i rätt tid.
- Många läkemedelsfria behandlingar har också visat sig ge tydlig kostnadseffektivitet «Muistisairauden lääkkeetön hoito»1
- Individuella rehabiliteringsåtgärder genomförs på ett omfattande och multiprofessionellt sätt tillsammans med läkare, minnesskötare, minneskoordinator, hemvård och andra specialarbetare, såsom socialarbetare, fysio-, ergo-, tal- och näringsterapeut.
- Att sörja för säkerheten (såsom körtillstånd «Muistisairaan ajokyvyn arviointi»49 och innehav av skjutvapen «Muistisairaan ampuma-aselupa»50) är en del av vården av demenspatienter.
| Regelbunden uppföljning och bedömning av helhetssituationen med 6–12 månaders mellanrum |
| Kontroll av läkemedelsbehandlingen |
| Behandling av associerade sjukdomar |
| Behandling av riskfaktorer för minnessjukdomar |
| Individuellt skräddarsydda tjänster |
| Behandling av neuropsykiatriska symtom |
| Bedömning av körhälsa och -säkerhet |
| Bedömning av fysisk, social och psykisk rehabilitering |
| Bedömning av minneshjälpmedel |
| Bedömning av näringstillståndet |
| Bedömning av munvården «Muistisairaan suunhoito»45 |
| Uppdatering av sociala förmåner |
| Intressebevakningsfullmakt, intressebevakning |
| Livstestamente |
| Handledning och rådgivning |
| Höra och stödja anhöriga |
| Överenskommelse om följande uppföljningsbesök |
| Kontaktuppgifter (t.ex. minneskoordinator eller minnespoliklinik) |
| Individuell vård-, rehabiliterings- och serviceplan |
|---|
| Rehabiliterande åtgärder som stöder förmågan att klara sig och självständigheten |
|
|
|
|
|
|
| Lämplig medicinsk behandling |
|
|
|
| Stödåtgärder i rätt tid |
|
|
|
|
| Lösningar som ökar säkerheten |
|
|
|
| Säkerställande av förmåner och ekonomiska stödåtgärder |
|
|
|
| De anhörigas rättigheter och stöd |
|
|
Körhälsa
- En viktig del av den individuella vårdplanen i det tidiga skedet av en minnessjukdom är också regelbunden bedömning av körhälsan «Muistisairaan ajokyvyn arviointi»49.
- Enligt anvisningarna om bedömning av körhälsa «https://www.traficom.fi/sv/foreskrifter/anvisningar-om-bedomning-av-korhalsa-halso-och-sjukvardspersonal»30 utgör demenssjukdom alltid ett hinder för körtillstånd i grupp 2 (tunga fordon, yrkeskörning). För grupp 1 (personbilar) kan dock kraven på körhälsa fortfarande uppfyllas om minnessjukdomen är lindrig (CDR 0,5–1).
- Lindrig minnessjukdom (CDR 1) förutsätter i allmänhet att en läkare gör en regelbunden bedömning med 6–12 månaders mellanrum. Även då kan särskilda störningar (såsom perceptionsstörning) eller impulsivitet i samband med pann-tinninglobsdegeneration, svårigheter med exekutiva funktioner och omedvetenhet om symtomen utgöra ett hinder för körrätt redan i ett tidigare skede av sjukdomen.
- Vid bedömningen av körhälsan används kognitiva test (urtavla, MMSE, CERAD, MoCa (Montreal Cognitive Assessment), TMT (Trail Making Test) A), bedömning av funktionsförmågan (IADL, ADL), neuropsykologisk undersökning, intervju med patienten och dennes anhöriga samt vid behov en bedömning av körförmågan på medicinska grunder.
- En patient med minnessjukdom kan också behöva genomföra ett körprov för att få en tilläggsutredning.
Fullmakter, intressebevakningsfullmakt, testamente och livstestamente
- Det är bra att upprätta fullmakter, intressebevakningsfullmakt och testamente i tid
medan patienten ännu har kvar sin rättshandlingsförmåga. Dessa tryggar skötseln av
ekonomiska ärenden i patientens intresse.
- Närmare information om fullmakt och blanketter finns på Minnesförbundets webbplats «http://www.muistiliitto.fi»31.
- Se social- och hälsovårdsministeriets anvisningar om intressebevakningsutlåtandets innehåll och utformning «http://www.stm.fi»32, «Juva K, Erkinjuntti T, Hietanen M ym. Alzheimerin ...»111, «Pirttilä T, Juva K, Hietanen M ym. Alzheimerin tau...»112, «Juva K. Lääkärinlausunnot edunvalvonta-asioissa, S...»113.
- Genom att upprätta ett livstestamente i tillräckligt god tid – redan i det lindriga
stadiet av sjukdomen – säkerställer man att patientens egna värderingar följs i vården
och att eventuella vårdlösningar grundar sig på patientens egen vilja.
- Upprättandet av ett livstestamente främjar den demenssjuka personens självbestämmanderätt.
- Vårdpersonalen har en skyldighet att följa livstestamentet.
- Det är bra att bifoga ett skriftligt livstestamente till journalhandlingarna och till den elektroniska patientdatabasen «https://www.kanta.fi/sv/mittkanta»33.
- På Minnesförbundets och THL:s webbplats finns en blankett för livstestamente «http://www.muistiliitto.fi»31 och «http://www.thl.fi»34, men det kan också formuleras fritt.
- Suomen muistiasiantuntijat ry har utarbetat en blankett för ett så kallat livskvalitetstestamente «https://sumut.fi/wp-content/uploads/2020/02/SUMUelaatutestamentti_10.pdf»35.
Vård dygnet runt av patienter med minnessjukdom
- Patienten har rätt att delta i beslutsfattandet om sin egen vård och vårdplats enligt sin kognitiva funktionsförmåga (Lagen om patientens ställning och rättigheter 785/1992 «https://www.finlex.fi»36).
- Vården i slutskedet av sjukdomen genomförs oftast som dygnetruntvård, även om närståendevården hemma kan ha pågått i flera år dessförinnan.
- Att vara närståendevårdare är oftast ett tungt arbete. Att flytta en person med demens till dygnetruntvård är en process som inte alltid är lätt för de närstående «Saarenheimo M. Exploring the borderlines of family...»114.
- Inom dygnetruntvården av demenspatienter behövs specialkompetens, se Institutet för
hälsa och välfärd «https://thl.fi/sv/teman/aldre»37.
- Grunden för god vård är en mångsidig bedömning av patientens behov och resurser, en så kallad behovsbaserad bedömning.
- Att höra patienten och dennes närstående och beakta patientens livshistoria är förutsättningar för individuell vård.
- Vården ska främja funktionsförmågan och rehabiliteringen.
- Vid mötet med en person med minnessjukdom ska patientens självaktning bevaras och patientens autonomi respekteras oberoende av sjukdomens stadium.
- För att trygga god vård krävs en tillräcklig mängd kompetent personal.
- Se även god vårdpraxis för minnessjuka «Hallikainen M, Immonen A, Jämsä M, Kotisaari S, Mö...»115.
God vård i livets slutskede
- De vanligaste demenssjukdomarna är progressiva hjärnsjukdomar och för dem finns det tills vidare ingen botande behandling «Antikainen R, Konttila T, Virolainen J, Strandberg...»116.
- Vården i livets slutskede ska diskuteras i god tid med patienten och dennes närstående.
- Särskild uppmärksamhet ska fästas vid kontinuiteten i vården när byte av vårdplats är nödvändigt i livets slutskede.
- Målet kan vara god, mänskovärdig vård på en bekant enhet ända till livets slut.
- Särskilt i slutskedet av demenssjukdomen ska belastande överföringar till sjukhus undvikas «Antikainen R, Konttila T, Virolainen J, Strandberg...»116, «Aaltonen M, Raitanen J, Forma L, ym. Burdensome tr...»117
- Genom att dra upp riktlinjer för vården och genom tydlig dokumentation kan man minska överföringarna «Antikainen R, Konttila T, Virolainen J, Strandberg...»116, «Vanttaja K, Seinelä L, Valvanne J. Elämän loppuvai...»118.
- Patienten har rätt till god, symtomatisk vård och en värdig död med respekt för patientens
livstestamente (Lagen om patientens ställning och rättigheter 785/1992 «http://www.finlex.fi»38 och «Suomalainen Lääkäriseura Duodecim, Suomen Akatemia...»119).
- Se tilläggsmaterial om smärta och demenssjukdom «Kipu ja muistisairaus»38.
- Se God medicinsk praxis-rekommendationen om palliativ vård och vård i livets slutskede «Palliativ vård och vård i livets slutskede»2.
Anvisningar för patienter med minnessjukdomar och deras närstående
- Anvisningar till patienter och närstående, se Hjärnhuset/Demenssjukdomar på webbplatsen Hälsobyn «https://www.terveyskyla.fi/sv/hjarnhuset/hjarnsjukdomar/demenssjukdomar»28.
- Mer information för patienter finns också på adresserna www.muistiliitto.fi «http://www.muistiliitto.fi»31, www.stroke.fi «http://www.stroke.fi»39 och www.liikehairio.fi «http://www.liikehairio.fi»40.
Arbetsgrupp tillsatt av Finska Läkarföreningen Duodecim, Societas Gerontologica Fennica, Finlands Geriatriker, Neurologiska Föreningen i Finland, Finlands Psykogeriatriska Förening och Allmänmedicinska föreningen i Finland.
För mer information om arbetsgruppsmedlemmar samt anmälan om intressekonflikter, se «Muistisairaudet»1 (på finska)
Översättare: Lingsoft Language Services Oy
Granskning av översättningen: Susanna Melkas
Litteratur
Minnessjukdomar. God medicinsk praxis-rekommendation. Arbetsgrupp tillsatt av Finska Läkarföreningen Duodecim, Societas Gerontologica Fennica, Finlands Geriatriker, Neurologiska Föreningen i Finland, Finlands Psykogeriatriska Förening och Allmänmedicinska föreningen i Finland. Helsingfors: Finska Läkarföreningen Duodecim, 2025 (hänvisning dd.mm.åååå). Tillgänglig på internet: www.kaypahoito.fi
Närmare anvisningar: «https://www.kaypahoito.fi/sv/god-medicinsk-praxis/nyttjanderattigheter/citering»41
Ansvarsbegränsning
God medicinsk praxis- och Avstå klokt-rekommendationerna är sammandrag gjorda av experter gällande diagnostik och behandling av bestämda sjukdomar. Rekommendationerna fungerar som stöd när läkare eller andra yrkesutbildade personer inom hälso- och sjukvården ska fatta behandlingsbeslut. De ersätter inte läkarens eller annan hälsovårdspersonals egen bedömning av vilken diagnostik, behandling och rehabilitering som är bäst för den enskilda patienten då behandlingsbeslut fattas.
Litteratur
- Taylor CA, Bouldin ED, McGuire LC. Subjective Cognitive Decline Among Adults Aged ≥45 Years - United States, 2015-2016. MMWR Morb Mortal Wkly Rep 2018;67(27):753-757 «PMID: 30001562»PubMed
- Lobo A, Launer LJ, Fratiglioni L, ym. Prevalence of dementia and major subtypes in Europe: A collaborative study of population-based cohorts. Neurologic Diseases in the Elderly Research Group. Neurology 2000;54(11 Suppl 5):S4-9 «PMID: 10854354»PubMed
- Roitto HM, Lindell E, Koskinen S, Sarnola K, Koponen P, Ngandu T. Diagnosoitujen muistisairauksien ilmaantuvuus ja esiintyvyys Suomessa vuosina 2016–2021. Duodecim 2023 (painossa/in Press).
- Gardner RC, Valcour V, Yaffe K. Dementia in the oldest old: a multi-factorial and growing public health issue. Alzheimers Res Ther 2013;5(4):27 «PMID: 23809176»PubMed
- Viramo P, Sulkava R. Muistihäiriöiden ja dementian epidemiologia. Kirjassa Dementia. Erkinjuntti T, Rinne J, Alhainen K, Soininen H (toim.) Duodecim 2006
- Noro A, Finne-Soveri H, Björkgren M ym. Quality and productivity in institutional care for elderly residents - benchmarking with the RAI. 1st ed. Helsinki: National Research and Development Centre for Wellfare and Health (STAKES); 2005
- Jellinger K, Danielczyk W, Fischer P, ym. Clinicopathological analysis of dementia disorders in the elderly. J Neurol Sci 1990;95(3):239-58 «PMID: 2358819»PubMed
- Neuropathology Group. Medical Research Council Cognitive Function and Aging Study. Pathological correlates of late-onset dementia in a multicentre, community-based population in England and Wales. Neuropathology Group of the Medical Research Council Cognitive Function and Ageing Study (MRC CFAS). Lancet 2001;357(9251):169-75 «PMID: 11213093»PubMed
- Mölsä PK, Marttila RJ, Rinne UK. Epidemiology of dementia in a Finnish population. Acta Neurol Scand 1982;65(6):541-52 «PMID: 7113661»PubMed
- Sulkava R, Wikström J, Aromaa A, ym. Prevalence of severe dementia in Finland. Neurology 1985;35(7):1025-9 «PMID: 4010941»PubMed
- Juva K, Sulkava R, Erkinjuntti T ym. Prevalence of dementia in the city of Helsinki. Acta Neurol Scand 1993;87:106-10 PMID: 8442392
- Muistihäiriöt ja dementia. Alhainen K, Erkinjuntti T, Rinne J, Soininen H. Kustannus Oy Duodecim. 3. uudistettu painos 2010
- Emre M, Aarsland D, Brown R, ym. Clinical diagnostic criteria for dementia associated with Parkinson's disease. Mov Disord 2007;22(12):1689-707; quiz 1837 «PMID: 17542011»PubMed
- Aarsland D, Zaccai J, Brayne C. A systematic review of prevalence studies of dementia in Parkinson's disease. Mov Disord 2005;20(10):1255-63 «PMID: 16041803»PubMed
- Jellinger KA, Attems J. Challenges of multimorbidity of the aging brain: a critical update. J Neural Transm (Vienna) 2015;122(4):505-21 «PMID: 25091618»PubMed
- Jellinger KA, Attems J. Prevalence of dementia disorders in the oldest-old: an autopsy study. Acta Neuropathol 2010;119(4):421-33 «PMID: 20204386»PubMed
- Chiari A, Vinceti G, Adani G, ym. Epidemiology of early onset dementia and its clinical presentations in the province of Modena, Italy. Alzheimers Dement 2021;17(1):81-88 «PMID: 32914938»PubMed
- Devenney EM, Ahmed RM, Hodges JR. Frontotemporal dementia. Handb Clin Neurol 2019;167():279-299 «PMID: 31753137»PubMed
- Kelley BJ, Boeve BF, Josephs KA. Young-onset dementia: demographic and etiologic characteristics of 235 patients. Arch Neurol 2008;65(11):1502-8 «PMID: 19001170»PubMed
- Ioannidis P, Konstantinopoulou E, Maiovis P, ym. The frontotemporal dementias in a tertiary referral center: classification and demographic characteristics in a series of 232 cases. J Neurol Sci 2012;318(1-2):171-3 «PMID: 22541253»PubMed
- Kivipelto M, Ngandu T, Laatikainen T, ym. Risk score for the prediction of dementia risk in 20 years among middle aged people: a longitudinal, population-based study. Lancet Neurol 2006;5(9):735-41 «PMID: 16914401»PubMed
- Kivimäki M, Livingston G, Singh-Manoux A, ym. Estimating Dementia Risk Using Multifactorial Prediction Models. JAMA Netw Open 2023;6(6):e2318132 «PMID: 37310738»PubMed
- Chen Y, Araghi M, Bandosz P, ym. Impact of hypertension prevalence trend on mortality and burdens of dementia and disability in England and Wales to 2060: a simulation modelling study. Lancet Healthy Longev 2023;4(9):e470-e477 «PMID: 37573867»PubMed
- Andrieu S, Coley N, Lovestone S, ym. Prevention of sporadic Alzheimer's disease: lessons learned from clinical trials and future directions. Lancet Neurol 2015;14(9):926-944 «PMID: 26213339»PubMed
- Hughes D, Judge C, Murphy R, ym. Association of Blood Pressure Lowering With Incident Dementia or Cognitive Impairment: A Systematic Review and Meta-analysis. JAMA 2020;323(19):1934-1944 «PMID: 32427305»PubMed
- Ngandu T, Lehtisalo J, Solomon A, ym. A 2 year multidomain intervention of diet, exercise, cognitive training, and vascular risk monitoring versus control to prevent cognitive decline in at-risk elderly people (FINGER): a randomised controlled trial. Lancet 2015;385(9984):2255-63 «PMID: 25771249»PubMed
- Solomon A, Mangialasche F, Richard E, ym. Advances in the prevention of Alzheimer's disease and dementia. J Intern Med 2014;275(3):229-50 «PMID: 24605807»PubMed
- Livingston G, Huntley J, Sommerlad A, ym. Dementia prevention, intervention, and care: 2020 report of the Lancet Commission. Lancet 2020;396(10248):413-446 «PMID: 32738937»PubMed
- Peters R, Beckett N, Forette F, ym. Incident dementia and blood pressure lowering in the Hypertension in the Very Elderly Trial cognitive function assessment (HYVET-COG): a double-blind, placebo controlled trial. Lancet Neurol 2008;7(8):683-9 «PMID: 18614402»PubMed
- Isaac MG, Quinn R, Tabet N. Vitamin E for Alzheimer's disease and mild cognitive impairment. Cochrane Database Syst Rev 2008;(3):CD002854 «PMID: 18646084»PubMed
- Boothby LA, Doering PL. Vitamin C and vitamin E for Alzheimer's disease. Ann Pharmacother 2005;39(12):2073-80 «PMID: 16227450»PubMed
- Coley N, Andrieu S, Gardette V, ym. Dementia prevention: methodological explanations for inconsistent results. Epidemiol Rev 2008;30():35-66 «PMID: 18779228»PubMed
- Devore EE, Grodstein F, van Rooij FJ, ym. Dietary intake of fish and omega-3 fatty acids in relation to long-term dementia risk. Am J Clin Nutr 2009;90(1):170-6 «PMID: 19474131»PubMed
- Hamer M, Chida Y. Physical activity and risk of neurodegenerative disease: a systematic review of prospective evidence. Psychol Med 2009;39(1):3-11 «PMID: 18570697»PubMed
- Kröger E, Verreault R, Carmichael PH, ym. Omega-3 fatty acids and risk of dementia: the Canadian Study of Health and Aging. Am J Clin Nutr 2009;90(1):184-92 «PMID: 19474137»PubMed
- Malouf R, Grimley Evans J. Folic acid with or without vitamin B12 for the prevention and treatment of healthy elderly and demented people. Cochrane Database Syst Rev 2008;(4):CD004514 «PMID: 18843658»PubMed
- McGuinness B, Craig D, Bullock R, ym. Statins for the prevention of dementia. Cochrane Database Syst Rev 2009;(2):CD003160 «PMID: 19370582»PubMed
- Peters R, Peters J, Warner J, ym. Alcohol, dementia and cognitive decline in the elderly: a systematic review. Age Ageing 2008;37(5):505-12 «PMID: 18487267»PubMed
- Szekely CA, Thorne JE, Zandi PP, ym. Nonsteroidal anti-inflammatory drugs for the prevention of Alzheimer's disease: a systematic review. Neuroepidemiology 2004;23(4):159-69 «PMID: 15279021»PubMed
- Dietz A, Iso-Mustajärvi M, Hartikainen S. Kuulonalenema: sisäkorvaan rajoittuva ongelma vai laajempi neurodegeneratiivinen kokonaisuus? Suom Lääkäril 2023;1-2:38-41
- Sipilä PN, Heikkilä N, Lindbohm JV, ym. Hospital-treated infectious diseases and the risk of dementia: a large, multicohort, observational study with a replication cohort. Lancet Infect Dis 2021;21(11):1557-1567 «PMID: 34166620»PubMed
- Itzhaki RF, Lathe R, Balin BJ, ym. Microbes and Alzheimer's Disease. J Alzheimers Dis 2016;51(4):979-84 «PMID: 26967229»PubMed
- Wang S, Molassiotis A, Guo C, ym. Association between social integration and risk of dementia: A systematic review and meta-analysis of longitudinal studies. J Am Geriatr Soc 2023;71(2):632-645 «PMID: 36307921»PubMed
- Becker T. The effect of the psychosocial working environment on cognition and dementia. Occup Environ Med 2014;71(5):305-6 «PMID: 24578488»PubMed
- Richmond-Rakerd LS, D'Souza S, Milne BJ, ym. Longitudinal Associations of Mental Disorders With Dementia: 30-Year Analysis of 1.7 Million New Zealand Citizens. JAMA Psychiatry 2022;79(4):333-340 «PMID: 35171209»PubMed
- Fong TG, Inouye SK. The inter-relationship between delirium and dementia: the importance of delirium prevention. Nat Rev Neurol 2022;18(10):579-596 «PMID: 36028563»PubMed
- Carrière I, Fourrier-Reglat A, Dartigues JF, ym. Drugs with anticholinergic properties, cognitive decline, and dementia in an elderly general population: the 3-city study. Arch Intern Med 2009;169(14):1317-24 «PMID: 19636034»PubMed
- Suhonen J, Alhainen K, Eloniemi-Sulkava U ym. Hyvät hoitokäytännöt etenevien muistisairauksien kaikissa vaiheissa. Suom Lääkäril 2008;63:9-22
- Sorbi S, Hort J, Erkinjuntti T, ym. EFNS-ENS Guidelines on the diagnosis and management of disorders associated with dementia. Eur J Neurol 2012;19(9):1159-79 «PMID: 22891773»PubMed
- Suomen muistitutkimusyksiköiden asiantuntijaryhmä. Muistihäiriöt ja dementia. Suom Lääkäril 1996;29:2949-57
- Lindsberg P, Rinne J (toim.) Teema: Alzheimerin tauti. Duodecim 2018;134: 2507-53
- Teema: Muistisairaudet. Suom Lääkäril 2022;77;574-585
- Krüger, Rosenvall, Solje. Muistisairauden varhainen tunnistaminen perusterveydenhuollossa, Suom Lääkäril 2022;77:586-88
- Melkas S, Jokinen H Putaala J, Valanne L, Hietanen M ja Erkinjuntti T. Yleisimmät kognition seulontamenetelmät eivät tunnista VCI toiminnanohjauksen häiriötä. Suom Lääkäril 2015;780:41-7
- Krüger J, Katisko K, Suhonen N-M, Haapasalo A, Remes AM ja Solje E. Otsa-ohimolohkorappeumat – miten tunnistan ja hoidan? Duodecim 2021;137:2307-316
- Kaakkola S ja Laaksovirta H. Tunnistatko harvinaisia aivojen rappeumasairauksia? Duodecim 2022;138:1895-1904
- Eloniemi-Sulkava U, Rahkonen T, Erkinjuntti T, Karhu K, Pitkälä K, Pirttilä T, Vuori U, Suhonen J. Moniammatilliset tietotaidot ovat muistisairauksien hyvän hoidon edellytys. Suom Lääkäril 2010;65; 3144-314
- Juva K, Paajanen T, Remes A. Työikäisen etenevä muistisairaus. Kirjassa: Muistisairaudet. Erkinjuntti T, Remes A, Rinne J, Soininen H (toim). Kustannus Oy Duodecim 2015, s. 586-91
- Dubois B, Villain N, Frisoni GB, ym. Clinical diagnosis of Alzheimer's disease: recommendations of the International Working Group. Lancet Neurol 2021;20(6):484-496 «PMID: 33933186»PubMed
- Román GC, Tatemichi TK, Erkinjuntti T, ym. Vascular dementia: diagnostic criteria for research studies. Report of the NINDS-AIREN International Workshop. Neurology 1993;43(2):250-60 «PMID: 8094895»PubMed
- McKeith IG, Boeve BF, Dickson DW, ym. Diagnosis and management of dementia with Lewy bodies: Fourth consensus report of the DLB Consortium. Neurology 2017;89(1):88-100 «PMID: 28592453»PubMed
- Rascovsky K, Hodges JR, Knopman D, ym. Sensitivity of revised diagnostic criteria for the behavioural variant of frontotemporal dementia. Brain 2011;134(Pt 9):2456-77 «PMID: 21810890»PubMed
- Gorno-Tempini ML, Hillis AE, Weintraub S, ym. Classification of primary progressive aphasia and its variants. Neurology 2011;76(11):1006-14 «PMID: 21325651»PubMed
- Höglinger GU, Respondek G, Stamelou M, ym. Clinical diagnosis of progressive supranuclear palsy: The movement disorder society criteria. Mov Disord 2017;32(6):853-864 «PMID: 28467028»PubMed
- Armstrong MJ, Litvan I, Lang AE, ym. Criteria for the diagnosis of corticobasal degeneration. Neurology 2013;80(5):496-503 «PMID: 23359374»PubMed
- Soininen H. Muistihäiriöpotilaan neurologisten löydösten diagnostiset vihjeet. Suom Lääkäril 2009;47:4049-53
- Pulliainen V, Kuikka P, Salo J, Viramo P, Erkinjuntti T. Omaisen haastattelu tärkeä muistihäiriöpotilaan tutkimuksessa. Suom Lääkäril 2001;5:527-35
- Pulliainen V, Hänninen T, Kuikka P, Erkinjuntti T. Ikääntyvien aivojen terveys ja sairaus tietoyhteiskunnassa. Suom Lääkäril 2006;61:2961-6
- Kuikka P, Pulliainen V, Salo J, Erkinjuntti T. Muistihäiriösairauksien alkuvaiheessa tarvitaan toiminnanohjauksen osa-alueiden tuntemusta. Suom Lääkäril 2007;44:4097-102
- Bezabhe WM, Bereznicki LR, Radford J, ym. Oral Anticoagulant Treatment and the Risk of Dementia in Patients With Atrial Fibrillation: A Population-Based Cohort Study. J Am Heart Assoc 2022;11(7):e023098 «PMID: 35301852»PubMed
- Hänninen T, Pulliainen V, Salo J ym. Kognitiiviset testit muistihäiriöiden ja alkavan dementian varhaisdiagnostiikassa: CERAD-tehtäväsarja. Suom Lääkäril 1999;54:1967-75 «http://www.gernet.fi/ohjeet/CERAD.html»42
- Hokkanen L, Hänninen T, Pulliainen V ym. Dementian diagnosoinnista etenevän muistihäiriön varhaiseen tunnistamiseen - neuropsykologinen näkökulma. Suom Lääkäril 2002;57:4575-82
- Poutiainen E, Hokkanen L, Pulliainen V ym. Neuropsykologinen tutkimus dementiaa ennakoivan kognitiivisen heikentymisen arvioinnissa. Psykologia 2003;38:216-29
- Sotaniemi M, PirttiläT, Remes A ym. CERAD-tehtäväsarja iäkkäiden muistihäiriöpotilaiden tutkimusmenetelmänä. Psykologia 2005;40:156-63
- Pulliainen V, Hänninen T, Hokkanen L ym. Muistihäiriöiden seulonta - suomalaiset normit CERAD-tehtäväsarjalle. Suom Lääkäril 2007;62:1235-41
- Hallikainen I, Alenius M, Hokkanen L, Karrasch M, Krüger J, Ngandu T, Paajanen T, Rosenvall A, Suhonen N, Hänninen T. CERAD-tehtäväsarjan koulutustason huomioivat katkaisurajat ja kokonaispistemäärä muistisairauksien varhaisessa tunnistamisessa. Suom Lääkäril 2023;78:716-720
- Filippi M, Agosta F, Barkhof F, ym. EFNS task force: the use of neuroimaging in the diagnosis of dementia. Eur J Neurol 2012;19(12):e131-40, 1487-501 «PMID: 22900895»PubMed
- Suomen muistitutkimusyksiköiden asiantuntijatyöryhmä. Muistihäiriö- ja dementiapotilaan toimintakyvyn ja sairauden vaikeusasteen arviointi. Suom Lääkäril 2000:21:2299-304
- Andreasen N, Vanmechelen E, Vanderstichele H, ym. Cerebrospinal fluid levels of total-tau, phospho-tau and A beta 42 predicts development of Alzheimer's disease in patients with mild cognitive impairment. Acta Neurol Scand Suppl 2003;179():47-51 «PMID: 12603251»PubMed
- Hampel H, Teipel SJ, Fuchsberger T, ym. Value of CSF beta-amyloid1-42 and tau as predictors of Alzheimer's disease in patients with mild cognitive impairment. Mol Psychiatry 2004;9(7):705-10 «PMID: 14699432»PubMed
- Wharton SB, Simpson JE, Ince PG, ym. Insights into the pathological basis of dementia from population-based neuropathology studies. Neuropathol Appl Neurobiol 2023;49(4):e12923 «PMID: 37462105»PubMed
- Fisher RA, Miners JS, Love S. Pathological changes within the cerebral vasculature in Alzheimer's disease: New perspectives. Brain Pathol 2022;32(6):e13061 «PMID: 35289012»PubMed
- Noguchi-Shinohara M, Ono K. The Mechanisms of the Roles of α-Synuclein, Amyloid-β, and Tau Protein in the Lewy Body Diseases: Pathogenesis, Early Detection, and Therapeutics. Int J Mol Sci 2023;24(12): «PMID: 37373401»PubMed
- Vos SJ, Verhey F, Frölich L, ym. Prevalence and prognosis of Alzheimer's disease at the mild cognitive impairment stage. Brain 2015;138(Pt 5):1327-38 «PMID: 25693589»PubMed
- Suhonen J, Keränen T, Rinne J. Parkinsonin taudin dementia. Suom Lääkäril 2008;63:843-7
- Leroy M, Bertoux M, Skrobala E, ym. Characteristics and progression of patients with frontotemporal dementia in a regional memory clinic network. Alzheimers Res Ther 2021;13(1):19 «PMID: 33419472»PubMed
- Logroscino G, Piccininni M, Graff C, ym. Incidence of Syndromes Associated With Frontotemporal Lobar Degeneration in 9 European Countries. JAMA Neurol 2023;80(3):279-286 «PMID: 36716024»PubMed
- Matsunaga S, Kishi T, Iwata N. Combination therapy with cholinesterase inhibitors and memantine for Alzheimer's disease: a systematic review and meta-analysis. Int J Neuropsychopharmacol 2014;18(5): «PMID: 25548104»PubMed
- McShane R, Westby MJ, Roberts E, ym. Memantine for dementia. Cochrane Database Syst Rev 2019;3(3):CD003154 «PMID: 30891742»PubMed
- Doody RS, Geldmacher DS, Gordon B, ym. Open-label, multicenter, phase 3 extension study of the safety and efficacy of donepezil in patients with Alzheimer disease. Arch Neurol 2001;58(3):427-33 «PMID: 11255446»PubMed
- Michalowsky B, Xie F, Eichler T, ym. Cost-effectiveness of a collaborative dementia care management-Results of a cluster-randomized controlled trial. Alzheimers Dement 2019;15(10):1296-1308 «PMID: 31409541»PubMed
- Hallikainen I, Hänninen T, Fraunberg M, ym. Progression of Alzheimer's disease during a three-year follow-up using the CERAD-NB total score: Kuopio ALSOVA study. Int Psychogeriatr 2013;25(8):1335-44 «PMID: 23676340»PubMed
- Li DD, Zhang YH, Zhang W, ym. Meta-Analysis of Randomized Controlled Trials on the Efficacy and Safety of Donepezil, Galantamine, Rivastigmine, and Memantine for the Treatment of Alzheimer's Disease. Front Neurosci 2019;13():472 «PMID: 31156366»PubMed
- Tavassoli N, Sommet A, Lapeyre-Mestre M, ym. Drug interactions with cholinesterase inhibitors: an analysis of the French pharmacovigilance database and a comparison of two national drug formularies (Vidal, British National Formulary). Drug Saf 2007;30(11):1063-71 «PMID: 17973542»PubMed
- Malone K, Hancox JC. QT interval prolongation and Torsades de Pointes with donepezil, rivastigmine and galantamine. Ther Adv Drug Saf 2020;11():2042098620942416 «PMID: 32874532»PubMed
- Leinonen E, Alanen HM. Antikolinergiset lääkehaitat ovat varsin tavallisia vanhuksilla. Suom Lääkäril 2009;48:4164-6
- Winblad B, Cummings J, Andreasen N, ym. A six-month double-blind, randomized, placebo-controlled study of a transdermal patch in Alzheimer's disease--rivastigmine patch versus capsule. Int J Geriatr Psychiatry 2007;22(5):456-67 «PMID: 17380489»PubMed
- Alhainen K. Alzheimer-lääkkeiden vaikutusmekanismit. Duodecim 2003;119:1959-66
- Keränen T. Alzheimerin taudin lääkkeiden farmakologiaa. Suom Lääkäril 2005;15:1683-4
- Peters O, Lorenz D, Fesche A, ym. A combination of galantamine and memantine modifies cognitive function in subjects with amnestic MCI. J Nutr Health Aging 2012;16(6):544-8 «PMID: 22659994»PubMed
- Tricco AC, Soobiah C, Berliner S, ym. Efficacy and safety of cognitive enhancers for patients with mild cognitive impairment: a systematic review and meta-analysis. CMAJ 2013;185(16):1393-401 «PMID: 24043661»PubMed
- Lopez OL, Becker JT, Wahed AS, ym. Long-term effects of the concomitant use of memantine with cholinesterase inhibition in Alzheimer disease. J Neurol Neurosurg Psychiatry 2009;80(6):600-7 «PMID: 19204022»PubMed
- Rolinski M, Fox C, Maidment I, ym. Cholinesterase inhibitors for dementia with Lewy bodies, Parkinson's disease dementia and cognitive impairment in Parkinson's disease. Cochrane Database Syst Rev 2012;2012(3):CD006504 «PMID: 22419314»PubMed
- Ryu SH, Katona C, Rive B, ym. Persistence of and changes in neuropsychiatric symptoms in Alzheimer disease over 6 months: the LASER-AD study. Am J Geriatr Psychiatry 2005;13(11):976-83 «PMID: 16286441»PubMed
- Reus VI, Fochtmann LJ, Eyler AE ym: The American Psychiatric Association practive guodeline on the use of antipsychotics to treat agitation or psychosis with dementia. «http://psychiatryonline.org/doi/book/10.1176/appi.books.9780890426807»43
- Solai LK, Mulsant BH, Pollock BG. Selective serotonin reuptake inhibitors for late-life depression: a comparative review. Drugs Aging 2001;18(5):355-68 «PMID: 11392444»PubMed
- Schneider LS, Dagerman KS, Insel P. Risk of death with atypical antipsychotic drug treatment for dementia: meta-analysis of randomized placebo-controlled trials. JAMA 2005;294(15):1934-43 «PMID: 16234500»PubMed
- Raivio MM, Laurila JV, Strandberg TE, ym. Psychotropic medication and stroke outcome. Am J Psychiatry 2005;162(5):1027; author reply 1027-8 «PMID: 15863825»PubMed
- Wang PS, Schneeweiss S, Avorn J, ym. Risk of death in elderly users of conventional vs. atypical antipsychotic medications. N Engl J Med 2005;353(22):2335-41 «PMID: 16319382»PubMed
- Laakkonen ML, Kautiainen H, Hölttä E, ym. Effects of Self-Management Groups for People with Dementia and Their Spouses--Randomized Controlled Trial. J Am Geriatr Soc 2016;64(4):752-60 «PMID: 27060101»PubMed
- Juva K, Erkinjuntti T, Hietanen M ym. Alzheimerin tauti ja edunvalvonta. Suom Lääkäril 2005;60:4645-9
- Pirttilä T, Juva K, Hietanen M ym. Alzheimerin tauti ja oikeudellinen toimintakyky. Suom Lääkäril 2005;60:4517-21
- Juva K. Lääkärinlausunnot edunvalvonta-asioissa, Suom Lääkäril 2021;76:2810-11
- Saarenheimo M. Exploring the borderlines of family caregiving in Finland. Kirjassa: Family Caregiving for Older Disabled People: Relational and Institutional Issues. Paoletti (toim.) New York: Nova Science Publishers, 2007
- Hallikainen M, Immonen A, Jämsä M, Kotisaari S, Mönkäre R, Pihlakari P (toim.). Muistisairaan hoidon hyvät käytännöt. Kustannus Oy Duodecim, 2. uudistettu painos, 2023
- Antikainen R, Konttila T, Virolainen J, Strandberg T. Vaikeasti dementoituneen vanhuksen elämän loppuvaiheen hoito. Suom Lääkäril 2013;68:909-15
- Aaltonen M, Raitanen J, Forma L, ym. Burdensome transitions at the end of life among long-term care residents with dementia. J Am Med Dir Assoc 2014;15(9):643-8 «PMID: 24913211»PubMed
- Vanttaja K, Seinelä L, Valvanne J. Elämän loppuvaiheen sairaalasiirrot ja hoidon suunnittelu tehostetussa palveluasumisessa Tampereella 2011.Gerontologia 2015;2:61-74
- Suomalainen Lääkäriseura Duodecim, Suomen Akatemia. Konsensuslausuma: Vanhuuskuolema. Duodecim 2014;130:115-123

