Hypotyreos
Hur kan man hänvisa till God medicinsk praxis-rekommendationen? «K1»1
Den här svenskspråkiga God medicinsk praxis-rekommendationen har översatts från den finska God medicinsk praxis-rekommendationen (Käypä hoito -suositus Kilpirauhasen vajaatoiminta «Kilpirauhasen vajaatoiminta»1). Om det finns skillnader i texterna gäller den uppdaterade finskspråkiga versionen.
Huvudsakligen finns evidenssammandragen och bakgrundsmaterialen samt internetlänkarna på finska.
Centrala rekommendationer
- Diagnostik och behandling av primär hypotyreos med tyroxin är i allmänhet rätlinjig och genomförs i regel inom öppenvården (primärvården, företagshälsovården eller den privata sektorn). Behandlingen av hypotyreos hos barn leds av en barnläkare.
- Misstanke om hypotyreos kan uppstå på basis av symtom, men diagnosen ska grunda sig på laboratorieanalyser.
- Symtomen på hypotyreos är ofta ospecifika och liknande symtom förekommer även vid många andra somatiska och psykiska sjukdomar.
- Vanliga symtom och fynd vid klinisk hypotyreos är trötthet, torr hud, svullnad, tendens att frysa, minnesstörningar, menstruationsstörningar, infertilitet, hög kolesterolhalt och anemi. Hos barn kan längdtillväxten bli långsammare och vikten i proportion till längden samtidigt öka.
- Vid typiska symtom eller fynd bör hypotyreos uteslutas genom bestämning av tyreotropin (TSH). För barn rekommenderas också bestämning av fritt tyroxin (T4-V).
- Vid klinisk primär hypotyreos ligger TSH-värdet över den övre gränsen för referensområdet och T4-V under den nedre gränsen för referensområdet.
- Klinisk hypotyreos behandlas alltid.
- Vid subklinisk hypotyreos är TSH-värdet upprepade gånger över den övre gränsen för referensområdet och T4-V-värdet inom referensområdet.
- Subklinisk hypotyreos behandlas i vissa specialsituationer, såsom hos patienter med symtom och patienter som planerar en graviditet, samt oftast när TSH-halten upprepade gånger är minst 10 mU/l.
- Tyroxinbehandling bör inte inledas om sköldkörtelvärdena ligger inom referensområdet, även om personen har symtom, såsom övervikt och trötthet, som tyder på hypotyreos.
- Om behandlingen med sköldkörtelhormon har inletts utan diagnostisk grund kan tyroxinbehandlingen avslutas på prov.
- Målet med behandlingen av hypotyreos är att korrigera symtomen och fynden vid hypotyreos samt att normalisera TSH-värdet till referensområdet. Behandlingen av hypotyreos genomförs med syntetiskt tyroxin.
- I allmänhet räcker TSH-mätning som laboratorieprov i uppföljningen. En T4-V-bestämning bör göras i början av behandlingen om patienten har symtom trots att TSH-värdet ligger inom referensområdet, om man misstänker adherensproblem, om man följer upp central hypotyreos eller om patienten är ett barn.
- Hypotyreos kräver regelbunden uppföljning eftersom dosbehovet av tyroxin kan förändras.
- I en stabil situation kan uppföljningsintervallet vara 1–2 år. En mer frekvent uppföljning (med 6–12 veckors mellanrum) behövs om dosen för sköldkörtelhormonmedicineringen ändras eller om vikten, tillståndet eller annan medicinering förändras väsentligt.
- En för stor eller liten tyroxindos ökar sjukligheten och dödligheten, och därför strävar man till att hålla TSH-värdet inom referensområdet. En alltför stor tyroxindos (TSH-värde under 0,1 mU/l) ökar särskilt risken för förmaksflimmer och osteoporos.
- Hos äldre patienter framhävs riskerna med en för stor tyroxindos.
- I patienthandledningen är det väsentligt att ge anvisningar för hur läkemedlet skall tas och hur laboratiorieuppföljningen skall ske.
- En patient i arbetsför ålder kan behöva stöd för att upprätthålla arbetsförmågan, eftersom hypotyreospatienter löper ökad risk för sjukfrånvaro och sjukpension.
- Om patienten har symtom trots att man uppnått den eftersträvade TSH-nivån och inverkan av andra sjukdomar, läkemedel, livssituationen och levnadsvanor på symtomen redan har undersökts och behandlats, kan en specialist i endokrinologi eller en specialist i inremedicin insatt i behandlingen av sköldkörtelsjukdomar planera ett behandlingsförsök genom kombinationsbehandling med syntetiskt levotyroxin (T4) och liotyronin (T3). TSH-värdet bör hållas inom referensområdet under kombinationsbehandlingen.
- Kombinationsbehandling med T4 + T3 förbättrar uppenbarligen inte patientens livskvalitet, trötthet, depression, ångest eller smärta jämfört med tyroxinmonoterapi hos patienter med klinisk hypotyreos.
- T3-monoterapi eller animaliska preparat rekommenderas inte.
- Det finns särdrag i vården av barn, gravida och patienter med sköldkörtelcancer.
Avgränsning av ämnet
- Differentialdiagnostiken vid symtom och fynd som tyder på hypotyreos behandlas inte i detalj i denna rekommendation, utan rekommendationen har kompletterats med länkar till andra anvisningar och rekommendationer som behandlar dessa symtom och fynd.
Målsättningar
- Målet med rekommendationen är att
- förtydliga och förenhetliga diagnostiken och behandlingen av hypotyreos
- minska hälsoriskerna förknippade med en för stor eller för liten dos av sköldkörtelhormon
- förbättra patientinformationen gällande grunderna för diagnostik och behandling av hypotyreos, behandlingsmålen och uppföljningsplanen
- främja identifiering, utredning och behandling av orsakerna till fortsatta symtom trots tyroxinbehandling
- förbättra patienternas livskvalitet, arbets- och funktionsförmåga.
Målgrupp
- Läkare som ansvarar för diagnostiken och behandlingen av hypotyreos, övrig utbildad personal som följer upp vården inom hälso- och sjukvården, studerande inom medicin och hälsovård samt apotekens farmaceutiska personal.
Definitioner
- Hypotyreos innebär underfunktion i sköldkörteln, dvs. att det i proportion till behovet finns för lite sköldkörtelhormon i kroppen.
- Definitionen av hypotyreos grundar sig på laboratorieundersökningar, eftersom symtombilden för hypotyreos inte är specifik (se bild «Hypotyreoosin oireiden ja löydösten esiintyminen terveillä ja hypotyreoosia sairastavilla»1).
- Vid klinisk hypotyreos ligger TSH-värdet (tyreotropin) över den övre gränsen för referensområdet och T4-V-värdet (fritt tyroxin) under den nedre gränsen för referensområdet (se bild «Diagnostikschema för hypotyreos»2, «gvr00101a.pdf»1 (PDF) och tabell «Tolkning av sköldkörtelundersökningar vid hypotyreos....»1).
- Vid subklinisk hypotyreos ligger TSH-värdet upprepat över den övre gränsen för referensområdet,
men T4-V-värdet inom referensområdet (se bild «Diagnostikschema för hypotyreos»2, «gvr00101a.pdf»1 (PDF) och tabell «Tolkning av sköldkörtelundersökningar vid hypotyreos....»1).
- Vid lindrig subklinisk hypotyreos är TSH-halten under 10 mU/l (se tabell «Tolkning av sköldkörtelundersökningar vid hypotyreos....»1).
- Vid signifikant subklinisk hypotyreos är TSH-halten minst 10 mU/l (se tabell «Tolkning av sköldkörtelundersökningar vid hypotyreos....»1).
- Vid primär hypotyreos producerar sköldkörteln inte tillräckligt med sköldkörtelhormon i proportion till kroppens behov.
- Vid central hypotyreos producerar sköldkörteln inte tillräckligt med sköldkörtelhormon på grund av en störning i hypofys-sköldkörtelaxelns funktion (se bild «Diagnostikschema för hypotyreos»2, «gvr00101a.pdf»1 (PDF) och tabell «Tolkning av sköldkörtelundersökningar vid hypotyreos....»1).
- Perifer hypotyreos, som är mycket sällsynt, beror på en ökad förbrukning av sköldkörtelhormoner eller resistens mot sköldkörtelhormon.
| * bestämning av T3-V är inte till nytta vid diagnostik av hypotyreos. N = normal, dvs. inom referensområdet ↑= över den övre gränsen för referensområdet ↓ = under den nedre gränsen för referensområdet |
||||
| Klassificering av hypotyreos | Lindrig subklinisk hypotyreos TSH ≤ 10 mU/l |
Subklinisk hypotyreos TSH > 10 mU/l |
Primär klinisk hypotyreos |
Central hypotyreos |
| Symtombild | inga eller lindriga symtom |
inga eller lindriga symtom |
symtom | symtom |
| TSH | ↑ | ↑ | ↑ | N eller ↓ |
| T4-V | N | N | ↓ | ↓ |
| T3-V* | N | N | N eller ↓ | N eller ↓ |
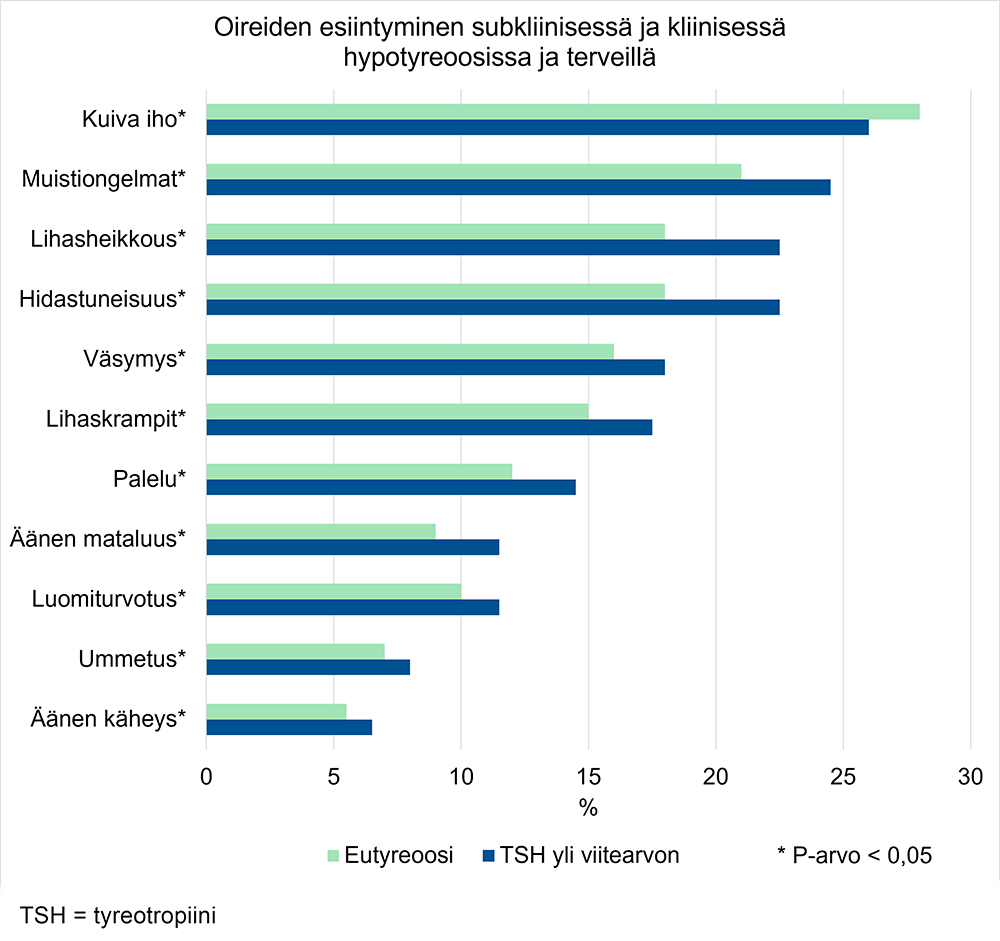
Hypotyreoosin oireiden ja löydösten esiintyminen terveillä ja hypotyreoosia sairastavilla
Mukailtu lähteestä: Canaris GJ, Manowitz NR, Mayor G ym. The Colorado Thyroid Disease Prevalence Study. Arch Intern Med 2000;160:526-34
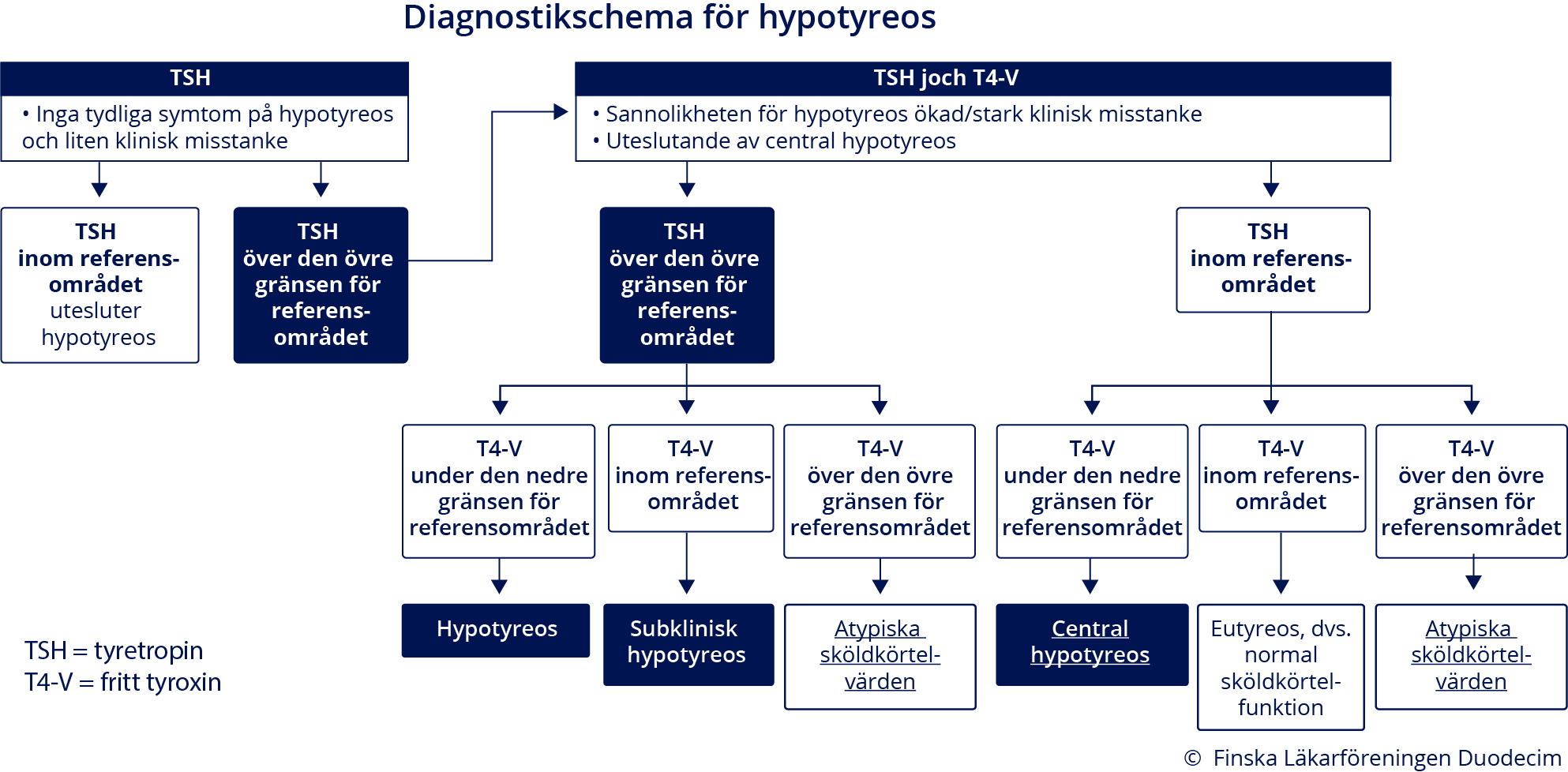
Diagnostikschema för hypotyreos. Öppna schemats PDF-version via denna länk «gvr00101a.pdf»1
Bearbetad från källan: Chaker L, Bianco AC, Jonklaas J mf.l. Hypothyroidism. Lancet 2017;390:1550-62
Patogenes
Primär hypotyreos
- I största delen av hypotyreosfallen är det fråga om primär hypotyreos, dvs. hypotyreos som härstammar från sköldkörteln (se bild «Diagnostikschema för hypotyreos»2, «gvr00101a.pdf»1 (PDF) och tabell «Tolkning av sköldkörtelundersökningar vid hypotyreos....»1).
- Den vanligaste orsaken till primär hypotyreos är kronisk autoimmun tyreoidit (se tabell «Orsaker till hypotyreos ....»2), «Chaker L, Bianco AC, Jonklaas J, ym. Hypothyroidis...»1.
- Hypotyreos på grund av jodbrist är sällsynt i Finland; se avsnittet Jod, selen och järn «A14»2.
- Hypotyreos kan också vara en följd av partiell eller total resektion av sköldkörteln, radiojodbehandling av hypertyreos, strålbehandling i halsområdet, utvecklingsstörning i sköldkörteln eller en ärftlig defekt i syntesen av sköldkörtelhormoner.
- Flera läkemedel kan orsaka klinisk hypotyreos: de vanligaste är litium och amiodaron (se tabell «Läkemedel och kosttillskott som orsakar hypotyreos....»3 och «Läkemedel och kosttillskott som orsakar avvikande fynd i sköldkörtelns funktionstest och som kan påverka tyroxindosen, men som inte nödvändigtvis påverkar sköldkörtelns funktion....»4).
- Amiodaron kan orsaka klinisk hypo- eller hypertyreos. Hypertyreos uppkommer antingen på grund av en inflammatorisk vävnadsskada eller jodbelastning. Risken för hypertyreos är förhöjd hos patienter med multinodulär struma, autonomt adenom eller Basedows sjukdom. Risken för klinisk hypotyreos är större hos patienter som har kronisk autoimmun tyreoidit eller som tidigare har fått radiojodbehandling (se tabell «Läkemedel och kosttillskott som orsakar hypotyreos....»3).
- Dessutom påverkar amiodaron laboratorieproverna så att T4-V-halten ökar och T3-V-halten minskar på grund av amiodaronets funktionshämmande effekt på dejodinas 2 (se tabell «Läkemedel och kosttillskott som orsakar avvikande fynd i sköldkörtelns funktionstest och som kan påverka tyroxindosen, men som inte nödvändigtvis påverkar sköldkörtelns funktion....»4), «Rao RH, McCready VR, Spathis GS. Iodine kinetic st...»2, «Franklyn JA, Davis JR, Gammage MD, ym. Amiodarone ...»3, «van Beeren HC, Bakker O, Wiersinga WM. Structure-f...»4, «Stanbury JB, Ermans AE, Bourdoux P, ym. Iodine-ind...»5, «Roti E, Minelli R, Gardini E, ym. Thyrotoxicosis f...»6.
Central hypotyreos
- Central hypotyreos beror på en störning i hypofys- eller hypotalamusfunktionen «Persani L, Brabant G, Dattani M, ym. 2018 European...»7.
- T4-V-värdet ligger under den nedre gränsen för referensområdet och TSH-värdet inom referensområdet eller under den nedre gränsen för referensområdet (se avsnittet Central hypotyreos «A1»3, bild «Diagnostikschema för hypotyreos»2, «gvr00101a.pdf»1 (PDF) och tabell «Tolkning av sköldkörtelundersökningar vid hypotyreos....»1).
- Mindre än 1 procent av hypotyreosfallen är centrala.
- Viktigast i differentialdiagnostiken av central hypotyreos är funktionella orsaker till hypotyreos, såsom systemsjukdom, undernäring eller läkemedel (se tabell «Orsaker till hypotyreos ....»2 och «Läkemedel och kosttillskott som orsakar hypotyreos....»3).
| Primär hypotyreos |
|
| Central hypofys- och hypotalamusrelaterad hypotyreos |
|
| Perifer hypotyreos |
|
| Verkningsmekanism | Läkemedel | Att beakta i vården och diagnostiken |
|---|---|---|
| Sköldkörtelns hormonutsöndring minskar | Aminoglutetimid Etionamid Hostmediciner som innehåller guaifenesin Jod, läkemedel som innehåller jod (amiodaron, kaliumjodid, algtabletter och röntgenkontrastmedel*) Karbimazol Ketiapin Litium Perklorat Propyltiouracil Sulfonamider Talidomid, lenalidomid |
* Kan även orsaka hypertyreos |
| Minskar absorptionen av T4 i tarmen | Aluminiumhydroxid* Ferrosulfat (järnpreparat)* Magnesium Protonpumpshämmare** Kalciumpreparat* Orlistat Gallsyrabindare* (kolesevelam, kolestipol kolestyramin) Sevelamer Sukralfat* |
Om ett preparat som förhindrar T4-absorption inte kan ersättas med ett annat läkemedel,
ska man se till att det finns ett tillräckligt doseringsintervall mellan tyroxinet
och läkemedlet i fråga * Läkemedlet ska tas minst 4 timmar efter intaget av tyroxin ** På grund av läkemedlets långa verkningstid kan man bli tvungen att öka tyroxindosen |
| Stimulerar T4-metabolismen i levern (utsöndringen via levern ökar) | Amiodaron Fenobarbital* Fenytoin* Karbamazepin* Mitotan Rifampicin Sertralin Valproat* |
* En ökning av tyroxindosen kan vara nödvändig särskilt hos patienter som genomgått en sköldkörteloperation |
| Dejodiseringen av T4 till T3 minskar (inhiberar dejodinas 2) | Amiodaron Betablockerare Glukokortikoider (suprafysiologiska doser) Röntgenkontrastmedel som innehåller jod Propyltiouracil |
|
| Ökad dejodinas 3-aktivitet (dejodisering av T4 och T3 till inaktiv form) | Tyrosinkinashämmare** (speciellt sunitinib, axitinib, imatinib, cabozantinib, lenvatinib, sorafenib, vandetanib) |
** Hypotyreos utvecklas vanligtvis sekundärt efter en destruktiv tyreoidit med hypertyreos |
| Utsöndringen av TSH minskar eller förhindras (central hypotyreos) | Dopamin Dopaminagonister (kabergolin, bromokriptin) Levodopa Dobutamin Glukortikoider Immunkontrollpunktshämmare
Interleukin 1b och 6 Mitotan Neuroleptika (ketiapin och olanzapin i stora doser) Oktreotid, lanreotid |
Enbart en TSH-bestämning räcker inte för uppföljning av tyroxinbehandling (därtill
T4-V-bestämning) * Central hypotyreos utvecklas till följd av hypofysit |
| Ökad utsöndring av T4 och hämning av TSH-utsöndring | Bexaroten |
|
| Sköldkörtelinflammation (immunologisk, destruktiv) | Alemtuzumab* Interferon beta Amiodaron Granulocyt-makrofagtillväxtfaktor Interferon alfa** Interleukin 2* Immunkontrollpunktshämmare
Litium Tyrosinkinashämmare** (speciellt sunitinib, axitinib, imatinib, cabozantinib, sorafenib, vandetanib) |
Sköldkörtelfunktionstest ska följas upp och tyroxin inledas om hypotyreos konstateras * Kan ge överfunktion av sköldkörteln vid Basedows sjukdom (hypertyreos) ** Hypotyreos utvecklas vanligtvis sekundärt efter destruktiv tyreoidit med hypertyreos *** Kan orsaka subklinisk eller klinisk hypotyreos med immunologisk mekanism eller central hypotyreos till följd av hypofysit |
| Verkningsmekanism | Läkemedel | Att beakta i vården och diagnostiken |
|---|---|---|
| T4-bärarproteinhalten (TBG) minskar T4-V-halten ökar |
Anabola steroider Androgener Danazol Glukokortikoider Nikotinsyra L-asparaginas |
Läkemedelsdosen hos en person som använder tyroxin kan behöva minskas |
| TBG-halten ökar T4-V-halten minskar |
Estrogen (särskilt p.o.) 5-fluorouracil Morfin Kapecitabin Klofibrat Metadon Mitoan SERM (raloxifen) Tamoxifen |
Läkemedelsdosen hos en person som använder tyroxin kan behöva ökas |
| Bindningen av T4 till bärarproteinet minskar T4-V-halten ökar |
Salicylater, ASA Diklofenak Fenytoin Furosemid (i större doser) Heparin Mitotan Småmolekylärt heparin |
Läkemedelsdosen hos en person som använder tyroxin kan behöva minskas |
| Stimulerar levermetabolismen av T4 (utsöndringen via levern ökar) T4-V-halten minskar |
Fenobarbital Fenytoin Karbamazepin Mitotan Rifampicin Sertralin Vissa tyrosinkinashämmare (imatinib) |
Läkemedelsdosen hos en person som använder tyroxin kan behöva ökas |
| Dejodiseringen av T4 till T3 minskar (inhibition av dejodinas 2) T4-V-halten ökar och T3-V-halten minskar |
Amiodaron Betablockerare (propranolol) Glukokortikoider (suprafysiologiska doser) Röntgenkontrastmedel som innehåller jod Nadolol Propyltiouracil |
Tyroxindosen regleras i regel utgående från TSH-halten |
Prevalens
- Det är svårt att få tillförlitlig information om förekomsten av klinisk hypotyreos. I Finland beräknades prevalensen utgående från utfärdade tyroxinrecept år 2007 vara 3,6 procent «Virta LJ, Eskelinen SI. Prevalence of hypothyroidi...»8.
- Enligt en metaanalys som publicerades 2014 är prevalensen för hypotyreos i Europa 3,05 procent, varav merparten, 85 procent, är subklinisk hypotyreos «Garmendia Madariaga A, Santos Palacios S, Guillén-...»9.
- Prevalensen för klinisk hypotyreos är 0,48 procent hos kvinnor och 0,18 procent hos män. Prevalensen för subklinisk hypotyreos är 4,61 procent hos kvinnor och 2,83 procent hos män.
- I slutet av 2022 använde 343 496 finländare sköldkörtelhormonpreparat «Kela. Sairausvakuutuksesta korvattavat lääketoimit...»10, «https://tietotarjotin.fi/sv/statistik-och-data»1. Antalet personer som använder sköldkörtelpreparat har mer än fördubblats under de senaste 15 åren «Metso S, Hakala T, Attanasio R ym. Kilpirauhashorm...»11.
- Cirka 1 procent av alla patienter som använde sköldkörtelpreparat använde sköldkörtelhormoner med specialtillstånd «Metso S, Hakala T, Attanasio R ym. Kilpirauhashorm...»11.
- Största delen av ökningen av antalet patienter som använder sköldkörtelpreparat förklaras av att behandlingen av subklinisk hypotyreos blivit vanligare «Asvold BO, Vatten LJ, Bjøro T. Changes in the prev...»12, «Taylor PN, Iqbal A, Minassian C, ym. Falling thres...»13, «Mendes D, Alves C, Silverio N, ym. Prevalence of U...»14.
- Hypotyreos är klart vanligare hos kvinnor än hos män «Virta LJ, Eskelinen SI. Prevalence of hypothyroidi...»8, «Asvold BO, Vatten LJ, Bjøro T. Changes in the prev...»12.
Riskfaktorer
- Faktorer som ökar risken för hypotyreos är:
- Kvinnligt kön. Kronisk autoimmun tyreoidit är vanligare hos kvinnor.
- Ålder. Hos personer över 60 år konstateras oftare hypotyreos än hos yngre personer.
- Annan autoimmun sjukdom såsom celiaki, typ 1-diabetes eller Addisons sjukdom «Bothra N, Shah N, Goroshi M, ym. Hashimoto's thyro...»15
- Downs eller Turners syndrom «Karlsson B, Gustafsson J, Hedov G, ym. Thyroid dys...»16, «Gravholt CH, Andersen NH, Conway GS, ym. Clinical ...»17
- Familjära funktionsstörningar i sköldkörteln och autoimmuna sjukdomar. Hashimotos tyreoidit hos en första gradens släkting niodubblar risken för hypotyreos «Bothra N, Shah N, Goroshi M, ym. Hashimoto's thyro...»15.
- Operation av sköldkörteln
- Strålbehandling av området kring sköldkörteln eller huvudet
- För litet eller för stort jodintag «Surks M. Iodine-induced thyroid dysfunction. UpToD...»18
- Viktökning i barndomen och övervikt i ungdomen «Ong KK, Kuh D, Pierce M, ym. Childhood weight gain...»19
- Många miljö- och industrikemikalier (endocrine disrupting chemicals, EDC) som stör hormonfunktionen «Hormonitoimintaa häiritsevät ympäristökemikaalit»1, «Gore AC, Chappell VA, Fenton SE, ym. EDC-2: The En...»20. Effekter har konstaterats i hormonernas biosyntes, transport, metabolism och sköldkörtelhormonreceptorns aktivitet.
- I vanlig finländsk kost finns det inga betydande mängder födoämnen som påverkar sköldkörteln (kassava, hirs).
- Även om glutenfri kost associeras med en minskning av TPOAb-värdet, finns det inga bevis på att glutenfri kost skulle påverka uppkomsten eller progressionen av autoimmun tyreoidit «Szczuko M, Syrenicz A, Szymkowiak K, ym. Doubtful ...»21. Utgående från nuvarande evidens kan man inte rekommendera glutenfri kost för att förebygga autoimmun tyreoidit «Szczuko M, Syrenicz A, Szymkowiak K, ym. Doubtful ...»21.
Jod, selen och järn
- Jod behövs vid syntesen av sköldkörtelhormoner.
- Tyroxin innehåller 4 jodatomer och efter dejodisering innehåller det aktiva hormonet trijodtyronin 3 jodatomer «Rayman MP. Multiple nutritional factors and thyroi...»22.
- Hos största delen av finländarna är jodintaget tillräckligt «Valsta L, Kaartinen N, Tapanainen H ym. (toim). Ra...»23 (se Livsmedelsverket - Jod «https://www.ruokavirasto.fi/elintarvikkeet/terveytta-edistava-ruokavalio/ravintoaineet/jodi/»2)
- I den finländska kosten får man cirka en tredjedel av joden från mjölk och mjölkprodukter. En annan betydande jodkälla är spannmålsprodukter (bröd), som tillverkas med joderat salt (se Livsmedelsverket - Jod «https://www.ruokavirasto.fi/elintarvikkeet/terveytta-edistava-ruokavalio/ravintoaineet/jodi/»2).
- Jodbrist ökar risken för struma och hypotyreos «Surks M. Iodine-induced thyroid dysfunction. UpToD...»18, «Zimmermann MB, Boelaert K. Iodine deficiency and t...»24.
- Ett överintag av jod är skadligt «Jodin merkitys kilpirauhassairauksissa»2.
- Jodbrist under graviditeten kan leda till hypotyreos hos den nyfödda.
- Hos vuxna är jodbehovet 150 μg per dygn. Detta behov uppfylls om man äter enligt näringsrekommendationerna. Om kosten inte innehåller mjölkprodukter eller joderade växtdrycker, fisk, ägg och joderat salt, är jodintaget sannolikt mindre än behovet.
- Det rekommenderas att vegankost och andra undvikande jodfattiga koster som används till exempel på grund av allergier, kompletteras med multivitamin-mineralämnespreparat som ger 100–175 μg jod per dygn (se Livsmedelsverket - Vegankost «https://www.ruokavirasto.fi/elintarvikkeet/terveytta-edistava-ruokavalio/ravitsemus–ja-ruokasuositukset/vegaaninen-ruokavalio/»3).
- På grund av det ökade behovet hör gravida och ammande mammor till riskgrupperna för jodbrist. För dessa rekommenderas multivitamin-mineralämnespreparat som innehåller jod, om dygnsbehovet av jod inte uppfylls genom kosten (för gravida kvinnor 175 μg/dygn och för ammande kvinnor 200 μg/dygn).
- På befolkningsnivå kan jodintaget undersökas genom att fastställa halten av jod i urinen och förekomsten av struma samt genom att undersöka halterna av tyreoglobulin (S-Tygl) och TSH i blodcirkulationen.
- I diagnostiken av sköldkörtelsjukdomar är det inte ändamålsenligt att bedöma individens jodintag genom jodidbestämning, eftersom jodidbestämningen i urin och blod endast beskriver jodintaget under de senaste 24–48 timmarna och följderna av jodbrist uppkommer långsamt på individnivå «Zimmermann MB, Boelaert K. Iodine deficiency and t...»24, «Zimmermann MB. Methods to assess iron and iodine s...»25, «Ma ZF, Venn BJ, Manning PJ, ym. Iodine Supplementa...»26.
- Betydelsen av selen och järn i patogenesen för sköldkörtelsjukdomar är oklar «Seleenin ja raudan merkitys kilpirauhassairauksissa»3, «Wu Q, Rayman MP, Lv H, ym. Low Population Selenium...»27. I Finland förekommer inte selenbrist (se Livsmedelsverket - Selengödsling «https://www.ruokavirasto.fi/kasvit/lannoitevalmisteet/laatuvaatimukset/seleeni/»4).
Symtom och fynd
Symtom
- Sköldkörtelhormonerna påverkar nästan alla vävnader och därför kan bristen på sköldkörtelhormon leda till mycket varierande och omfattande symtom (se tabell «Symtom på klinisk hypotyreos, fynd och differentialdiagnostik enligt organsystem. Översatt och bearbetat från källa ....»5). Symtomen och fynden på hypotyreos beskrivs närmare i tilläggsmaterialet «Hoitamattoman kliinisen hypotyreoosin oireet ja löydökset»4.
- Symtomen på hypotyreos är individuella och deras svårighetsgrad varierar enligt graden av funktionsstörning i sköldkörteln.
- Karakteristiskt för svår hypotyreos är att ämnesomsättningen blir långsammare. Hos barn hämmas längdtillväxten och samtidigt ökar vikten i proportion till längden.
- Vanliga symtom och fynd på klinisk hypotyreos är trötthet, torr hud, svullnad i ögonlocken, tendens att frysa, minnesstörningar och förstoppning (se tabell «Förekomsten av symtom och fynd vid obehandlad klinisk hypotyreos....»6).
- Hos unga kvinnor kan de första symtomen vara menstruationsstörningar eller infertilitet.
- Hypotyreos är en möjlig orsak till hög kolesterolhalt och normocytär anemi.
- Ett isolerat symtom som i sig är typiskt för hypotyreos är sällan förorsakat av hypotyreos.
- Ibland kan patienten även vid djup hypotyreos vara symtomfri eller ha mycket lindriga symtom «Carlé A, Pedersen IB, Knudsen N, ym. Hypothyroid s...»28.
- Ungefär hälften av barnpatienterna är symtomfria i diagnosskedet, se avsnittet Barn «A2»4.
- Hos äldre personer kan hypotyreos vara ett bifynd med lindriga symtom eller symtomfrihet «Ojala A, Strandberg T, Schalin-Jäntti C. Iäkkään p...»29. Hos äldre personer är sjukdomsbilden ofta atypisk och symtomen kan påminna om symtom på hjärtsvikt eller simulera demens «Biondi B, Cappola AR, Cooper DS. Subclinical Hypot...»30. Ibland är symtomen hos en äldre person fallolyckor och klumpighet, se avsnittet De äldre «A3»5.
- Subklinisk hypotyreos förklarar i allmänhet inte symtom som hör till det normala symtomspektrumet för hypotyreos. Hos upp till 70 procent «Carlé A, Pedersen IB, Knudsen N, ym. Hypothyroid s...»28 av personer med normal sköldkörtelfunktion (eutyreos) kan man konstatera minst ett typsymtom för hypotyreos (se bild «Hypotyreoosin oireiden ja löydösten esiintyminen terveillä ja hypotyreoosia sairastavilla»1), «Canaris GJ, Manowitz NR, Mayor G, ym. The Colorado...»31. I en sådan situation är det skäl att överväga differentialdiagnostiska alternativ (se tabell «Symtom på klinisk hypotyreos, fynd och differentialdiagnostik enligt organsystem. Översatt och bearbetat från källa ....»5).
- Hypotyreos ska uteslutas (se bild «Diagnostikschema för hypotyreos»2, «gvr00101a.pdf»1 (PDF)) när patienten har typiska symtom eller fynd på hypotyreos. Dessutom ska andra differentialdiagnostiska alternativ beaktas (se tabell «Symtom på klinisk hypotyreos, fynd och differentialdiagnostik enligt organsystem. Översatt och bearbetat från källa ....»5).
| Organsystem | Förekomst/symtom | Fynd | Differentialdiagnostik (artiklarna i Lääkärin tietokannat kräver inloggning) |
|---|---|---|---|
| * sällsynt förekomst | |||
| Ämnesomsättning | Viktökning Tendens att frysa Trötthet Svaghet |
Förhöjt viktindex, långsammare ämnesomsättning, svullnader, myxödem*, nedsatt kroppstemperatur* | Trötthet «Väsymysoire»1 Viktökning «Lihavuuden puheeksiotto ja arviointi»2 Sömnapné «Uniapnea aikuisilla»3 Sömnstörningar «Unettomuus»2 |
| Kardiorespiratoriska organen | Nedsatt prestationsförmåga Andnöd |
Bradykardi och retledningsstörningar, hypertension, diastolisk hjärtsvikt*, perikardium- och pleuravätska*, homocysteinemi* | Andnöd «Hengenahdistus»4 Högt blodtryck «Kohonnut verenpaine»3 |
| Neurosensoriska | Heshet Förlust av smaksinnet Nedsatt syn eller hörsel |
Neuropati, funktionsstörning i innerörat, nedsatt lukt- eller smaksinne | Polyneuropati «Polyneuropatiat»5 Heshet och röststörningar «Käheys ja äänihäiriöt»6 Störningar i smaksinnet «Makuaistin häiriöt»7 Nedsatt hörsel «Kuulokäyrän tulkinta ja heikentynyt kuulo»8 |
| Neurologiska och psykiska | Minnesproblem Parestesier Humörförändringar |
Nedsatta kognitiva funktioner, långsammare senreflexer, depression, demens, ataxi*, nervinklämningssymtom*, koma* | Depression «Depressio»9 Trötthet «Väsymysoire»1 Undersökningar av minnespatient «Muistipotilaan tutkimukset»10 |
| Tarmsystemet | Förstoppning Aptitlöshet |
Nedsatt motilitet i matstrupen, NASH*, ascites* | Förstoppning hos vuxna «Aikuisen ummetus»11 |
| Andra endokrina effekter | Infertilitet Menstruationsstörningar Galaktorré |
Infertilitet, problem med sexuella funktioner, förhöjt prolaktin, hypofyshyperplasi
*, störningar i glukosomsättningen, hyperkolesterolemi och hypertriglyceridemi, struma |
Barnlöshet «Lapsettomuus»12 Störningar i menstruationscykeln «Gynekologiset vuotohäiriöt»13 Galaktorré «Erittävä rinta ja imettämättömän rintatulehdus»14 Klimakteriet «Vaihdevuosioireet ja hormonihoito»15 Metabolt syndrom «Metabolinen oireyhtymä»16 |
| Muskuloskeletala | Muskelsvaghet Muskelkramper Ledvärk |
Förhöjt kreatinkinas eller förhöjda aminotransferaser | Smärta «Kipu»4 |
| Blodbild och koagulationssystemet | Trötthet Svaghet Blödningsbenägenhet |
Lindrig normocytär anemi, förvärvad von Willebrands sjukdom*, minskad halt av protein C och S*, förstorad MCV*, förstorad trombocytstorlek* | Utredning av anemi hos vuxna «Aikuisten anemian selvittely»17 Undersökning av en patient med blödningssjukdom «Verenvuotopotilaan tutkiminen ja hoito»18 |
| Hud och hår | Torr hud Håravfall |
Sträv hud, lossnande ögonbryn*, gulaktiga handflator*, fläckvis håravfall* | Håravfall och skallighet «Hiustenlähtö ja kaljuuntuminen»19 |
| Elektrolyter och njurfunktion | Nedsatt njurfunktion | Minskad GFR, hyponatremi* | Hyponatremi «Hyponatremia»20 |
| Barnets tillväxt | Förlångsammad längdtillväxt och viktökning | Minskad relativ längd och ökad vikt i proportion till längden (BMI SDS eller vikt/längdförhållande) | Barnets normala och avvikande tillväxt «Lapsen normaali ja poikkeava kasvu»21 |
| Symtom | Förekomst vid hypotyreos (%) |
|---|---|
| Svaghet, trötthet | 99 |
| Torr hud | 76–97 |
| Ögonlocks- eller ansiktssvullnad | 79–90 |
| Tendens att frysa, kall hud | 64–89 |
| Nedsatt svettning | 89 |
| Minnesstörningar | 66 |
| Koncentrationssvårigheter, glömska | 46 |
| Förstoppning | 48–61 |
| Viktökning | 54–59 |
| Håravfall | 57 |
| Perifer svullnad | 55–60 |
| Heshet | 34–52 |
| Menstruationsstörningar | 32 |
| Palpitation, bradykardi | 31 |
Screening
- I Finland screenas alla nyfödda för primär medfödd hypotyreos.
- I övrigt rekommenderas inte oriktad screening (inte begränsad till nedan uppräknade specialgrupper eller symtom) för hypotyreos, eftersom screening ökar risken för överdiagnostik och onödig tyroxinbehandling och eftersom det inte finns evidens för dess hälsofördelar «LeFevre ML, U.S. Preventive Services Task Force. S...»32, «Vanderpump MP, Ahlquist JA, Franklyn JA, ym. Conse...»33, «Birtwhistle R, Morissette K, Dickinson JA, ym. Rec...»34, «Taylor PN, Iqbal A, Minassian C, ym. Falling thres...»13, «Hegedüs L, Bianco AC, Jonklaas J, ym. Primary hypo...»35.
- Det finns skillnader i olika länders rekommendationer gällande screeningen. I en del uppmanas till screening av hypotyreos hos äldre patienter (AAFP «Wilson SA, Stem LA, Bruehlman RD. Hypothyroidism: ...»36, ATA/AACE «Garber JR, Cobin RH, Gharib H, ym. Clinical practi...»37), medan andra (U.S. Preventive Services Task Force «LeFevre ML, U.S. Preventive Services Task Force. S...»32, Royal College of Physicians of London «Vanderpump MP, Ahlquist JA, Franklyn JA, ym. Conse...»33, kanadensiska Task Force «») rekommenderar att man undviker screening hos symtomfria patienter som inte är gravida. Brittiska NICE «NICE guideline [NG145]. Thyroid disease: assessmen...»38 rekommenderar screening av hypotyreos hos personer med symtom samt hos vissa patientgrupper (bland annat typ 1-diabetes eller annan autoimmun sjukdom, depression eller ångest), men påpekar att diagnosen inte kan basera sig enbart på symtom.
- I tabell «Specialgrupper för vilka man bör överväga screening eller uteslutande av hypotyreos
också hos symtomfria personer....»7 uppräknas de specialgrupper för vilka man bör överväga screening eller uteslutande
av hypotyreos också hos symtomfria personer.
- Hypotyreos utvecklas hos cirka 10 procent av patienter med typ 1-diabetes och därför rekommenderas screening i diagnosskedet och med 3–5 års mellanrum (se God medicinsk praxis-rekommendationen Insuliininpuutosdiabetes, tabell 3: Aikuisen diabeetikon arviokäynnin sisältö «https://www.kaypahoito.fi/hoi50116#T3»5) eller vid symtom på hypotyreos.
- Hos cirka 8 procent av vuxna med Downs syndrom kan man konstatera klinisk hypotyreos. Screening för hypotyreos görs hos nyfödda, vid 1 månads och 12 månaders ålder, och därefter med 2 års mellanrum «Karlsson B, Gustafsson J, Hedov G, ym. Thyroid dys...»16.
- Hypotyreos utvecklas hos cirka 10–30 procent av patienter med Turners syndrom och därför rekommenderas årlig screening «Gravholt CH, Andersen NH, Conway GS, ym. Clinical ...»17.
- Efter cancerbehandling i barndomen förekommer både primär och central hypotyreos, vilket bör beaktas i screeningen «Viikari L, Jahnukainen J, Lähteenmäki P. Endokriin...»39.
| Personer som planerar en graviditet och som tidigare haft missfall, prematura förlossningar eller infertilitet |
| Personer med autoimmuna sjukdomar (typ 1-diabetes, vitiligo, alopecia areata, Addisons sjukdom, celiaki, perniciös anemi, APECED) «Garber JR, Cobin RH, Gharib H, ym. Clinical practi...»37, «Mäkimattila S, Harjutsalo V, Forsblom C, ym. Respo...»40 |
| Personer som har behandlats för cancer i barndomen «Viikari L, Jahnukainen J, Lähteenmäki P. Endokriin...»39 |
| Personer med Turners eller Downs syndrom «Karlsson B, Gustafsson J, Hedov G, ym. Thyroid dys...»16, «Gravholt CH, Andersen NH, Conway GS, ym. Clinical ...»17 |
| Personer med medicinering som eventuellt påverkar sköldkörtelns funktion: amiodaron, litium, interferon alfa, interferon gamma, immunkontrollpunktshämmare (immune check point inhibitors), tyrosinkinashämmare (se tabell «Läkemedel och kosttillskott som orsakar hypotyreos....»3 och «Läkemedel och kosttillskott som orsakar avvikande fynd i sköldkörtelns funktionstest och som kan påverka tyroxindosen, men som inte nödvändigtvis påverkar sköldkörtelns funktion....»4), «Garber JR, Cobin RH, Gharib H, ym. Clinical practi...»37, «Taylor PN, Albrecht D, Scholz A, ym. Global epidem...»41 |
Laboratoriediagnostik
- Diagnostiken av hypotyreos grundar sig på laboratorieundersökningar av sköldkörtelhormoner, av vilka de viktigaste är hormonet som stimulerar sköldkörteln, dvs. tyreotropin (TSH) och fritt tyroxin (T4-V) (se tabell «Tolkning av sköldkörtelundersökningar vid hypotyreos....»1 och bild «Diagnostikschema för hypotyreos»2, «gvr00101a.pdf»1 (PDF)), «Demers LM, Spencer CA. Laboratory medicine practic...»42.
- Stora doser av biotinnäringstillskott orsakar missvisande resultat i de immunologiska laboratorieundersökningarna, och därför ska de pausas 24 timmar före laboratorieprovstagningen
- T3-V-bestämning är inte till nytta i diagnostiken av hypotyreos, förutom i vissa undantagssituationer där man utreder sköldkörtelvärden som beter sig atypiskt (se tabell «Orsaker till atypiska sköldkörtelvärden och utredning av dem , , ....»9).
- Funktionstest av sköldkörteln tas före doseringen av tyroxinläkemedel.
Tyreotropin (TSH)
- Bestämningen av tyreotropinhalten i plasma (TSH) är den primära laboratorieundersökningen vid screening av sköldkörtelns hormonfunktion, inklusive klinisk eller subklinisk hypotyreos.
- TSH-bestämning används också när man följer effekten av tyroxinsubstitutionsbehandling av primär hypotyreos.
- TSH-provet kan tas klockan 7–16, eftersom dygnsvariationen i TSH-halten är liten under denna period «Russell W, Harrison RF, Smith N, ym. Free triiodot...»43, «Roelfsema F, Pereira AM, Veldhuis JD, ym. Thyrotro...»44.
- TSH-halten varierar mellan årstiderna. TSH-halten är i genomsnitt högre på vintern än på sommaren. Variationen i halten är dock i genomsnitt liten, så den har ingen betydelse för bedömningen av TSH-halten «Kuzmenko NV, Tsyrlin VA, Pliss MG, ym. Seasonal va...»45, «Wang D, Cheng X, Yu S, ym. Data mining: Seasonal a...»46, «Konno N, Morikawa K. Seasonal variation of serum t...»47.
- Vid uppföljningen av en tyroxinbehandling tas TSH-provet före tyroxinintaget. Tyroxin minskar resultatet med cirka 0,5 mU/l. Eftersom effekten är marginell, är tyroxin som tagits av misstag inte ett hinder för TSH-provtagningen, men tyroxinintaget ska antecknas i tilläggsuppgifterna om laboratorieresultatet.
- De TSH-värden som fastställts i olika laboratorier är inte direkt jämförbara, eftersom de har metodspecifika nivåskillnader «Thienpont LM, Faix JD, Beastall G. Standardization...»48, «Thienpont LM, Van Uytfanghe K, Beastall G, ym. Rep...»49, «Kilpirauhasen toimintakokeiden laboratoriokohtaisia viitearvoja Suomessa»5.
- Eftersom man i flera undersökningar har observerat att TSH-halten ökar med åldern, har detta i vissa laboratorier beaktats i TSH-referensvärdena «Kilpirauhasen toimintakokeiden laboratoriokohtaisia viitearvoja Suomessa»5.
- Se mer information i «Tyreotropiini (TSH)»6.
Fritt tyroxin (T4-V)
- Halten av fritt tyroxin (T4-V) i plasma som underskrider den nedre gränsen för referensområdet tyder på hypotyreos, men värden som ligger något under den nedre gränsen för referensområdet ses också hos friska personer.
- Vid primär sköldkörtelrelaterad hypotyreos är T4-V-halten låg och TSH-halten förhöjd.
- Vid central hypofys- eller hypotalamusrelaterad hypotyreos är T4-V-halten låg och TSH-halten låg eller inom referensområdet.
- Fritt tyroxin har ingen betydande dygnsvariation, så provtagningstidpunkten har ingen betydelse «Russell W, Harrison RF, Smith N, ym. Free triiodot...»43.
- Hos patienter som får tyroxinbehandling mot hypotyreos bör T4-V-provet tas på morgonen före följande läkemedelsdos, eftersom tyroxinmedicineringen ökar T4-V-halten med upp till 20 procent. Toppen på T4-V-halten uppnås cirka 3,5 timmar efter läkemedelsintaget och halten kan vara förhöjd i upp till 9 timmar efter läkemedelsintaget «Ain KB, Pucino F, Shiver TM, ym. Thyroid hormone l...»50.
- Se mer information i «Vapaa tyroksiini (T4-V)»7.
Fritt trijodtyronin (T3-V)
- Bestämningen av halten fritt trijodtyronin (T3-V) används endast i specialfall i diagnostiken av hypotyreos, och nyttan är begränsad (se tabell «Orsaker till atypiska sköldkörtelvärden och utredning av dem , , ....»9) «Dora JM, Biscolla RPM, Caldas G, ym. Choosing Wise...»51.
- T3-V-halten är okänslig vid diagnostik av hypotyreos. T3-V-halten minskar sist eftersom ökad TSH-halt stimulerar T4- och T3-syntesen i sköldkörteln och bildandet av T3 på vävnadsnivå genom ökad aktivitet i jodtyronindejodinas typ 2 (se bild «Hormonimuutokset primaarisen hypotyreoosin vaikeusasteen mukaan»3).
- Vid allvarliga systemsjukdomar är T3-V-halten låg, eftersom den perifera konversionen av T3 från T4 minskar och T3 omvandlas till inaktivt rT3.
- Se bild Hormonförändringar enligt svårighetsgraden för primär hypotyreos «Hormonimuutokset primaarisen hypotyreoosin vaikeusasteen mukaan»3.
- Se mer information i «Vapaa trijodityroniini (T3-V)»8 och tabell «Tolkning av sköldkörtelundersökningar vid hypotyreos....»1.
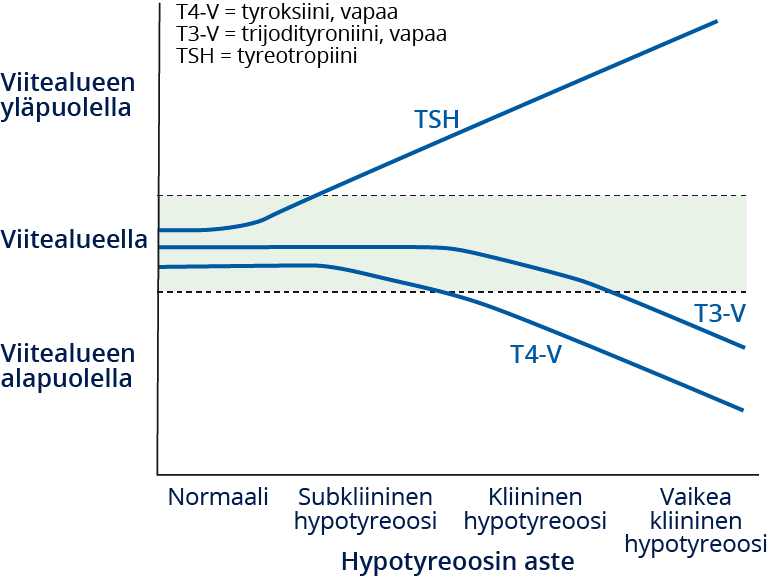
Hormonimuutokset primaarisen hypotyreoosin vaikeusasteen mukaan.
Mukailtu lähteestä: McDermott MT. In the clinic. Hypothyroidism. Ann Intern Med 2009;151:ITC61, PMID: 19949140
Omvänt trijodtyronin (rT3)
- Bestämningar av omvänt trijodtyronin (rT3) bör inte göras «Dora JM, Biscolla RPM, Caldas G, ym. Choosing Wise...»51.
- Bestämningen av rT3 är inte till nytta vid diagnostiken av hypotyreos eller planeringen av behandlingsdoser.
- Bestämningen är inte heller användbar vid hormonförändringar i anslutning till en systemsjukdom (NTI, non-thyroidal illness) för att särskilja om patienten har verklig hypotyreos eller om förändringarna i sköldkörtelhormonet är förknippade med systemsjukdomen.
- rT3-bestämningen kan i undantagsfall användas inom specialsjukvården för diagnostik av mycket sällsynta genetiska störningar i sköldkörteln eller av konsumtionshypotyreos (consumptive hypothyroidism) i samband med vissa tumörer.
- rT3-molekylen (reverse T3) uppstår från T4- och T3-hormoner genom dejodisering. Syftet med inaktiveringen är sannolikt att skydda vävnaderna mot för hög sköldkörtelhormoneffekt «Halsall DJ, Oddy S. Clinical and laboratory aspect...»52, «Gomes-Lima C, Wartofsky L, Burman K. Can Reverse T...»53.
- rT3-molekylen är biologiskt inaktiv. Den har mycket liten affinitet för kärnreceptorerna och rT3 tränger i praktiken därför inte undan det aktiva T3-hormonet och hindrar inte dess funktion.
Antikroppar mot sköldkörtelperoxidas (TPO)
- Antikroppar mot sköldkörtelperoxidas (TPO) konstateras i autoimmun tyreoidit (Hashimoto), som är den vanligaste orsaken till primär hypotyreos.
- TPO-antikroppar används för att utreda etiologin för konstaterad subklinisk eller klinisk hypotyreos och för att planera uppföljningen.
- En engångsmätning räcker. TPO-antikroppar kan inte och ska inte behandlas och bör därför inte följas upp «Dora JM, Biscolla RPM, Caldas G, ym. Choosing Wise...»51.
- TPO-antikroppar förekommer hos 5–20 procent av kvinnorna, men hos de flesta utvecklas ingen hypotyreos.
- TPO-antikroppar undersöks inte om patienten inte har subklinisk eller klinisk hypotyreos, förutom hos riskpatienter inom specialsjukvården (till exempel APECED-patienter). Om TPO-antikropparna dock har konstaterats behöver man inte rutinmässigt följa upp sköldkörtelprover på grund av detta.
- Förhöjda TPO-antikroppar är associerade med prognosen för subklinisk hypotyreos «Vanderpump MP, Tunbridge WM, French JM, ym. The in...»54.
- Patienter med förhöjda TPO-antikroppar och subklinisk hypotyreos har en ökad benägenhet att utveckla klinisk hypotyreos jämfört med dem som inte har TPO-antikroppar. Se avsnittet Genomförande av behandlingsförsök av subklinisk hypotyreos «A15»6.
Utredning av atypiska sköldkörtelvärden
- Med atypiska sköldkörtelvärden avses att symtomen och resultaten av sköldkörtelns funktionstest är motstridiga eller att tolkningen av TSH- och T4-V-värdena står i konflikt med varandra.
- I sådana situationer lönar det sig att kontrollera om det finns tidigare sköldkörtelvärden tillgängliga för en jämförelse.
- Därefter upprepas TSH- och T4-V-bestämningarna.
Vanliga orsaker och utredning av dem
- Akut eller kronisk sjukdom (icke-sköldkörtelrelaterad sjukdom, non-thyroidal illness,
NTI) (se tabell «Icke-sköldkörtelrelaterad sjukdom (NTI) och tolkning av sköldkörtelfunktionsprov ,
....»8 och bild «Kilpirauhasarvot akuutin sairauden yhteydessä»4)
- Värdena kontrolleras senare när patienten har tillfrisknat.
- Eftersom halterna av sköldkörtelhormoner varierar i samband med en akut sjukdom ska de inte bestämmas i samband med en akut sjukdom, om man inte särskilt misstänker en allvarlig funktionsstörning i sköldkörteln i bakgrunden av en akut sjukdom.
- Den kroniska sjukdomens inverkan på laboratorieundersökningarna beaktas (se tabell «Icke-sköldkörtelrelaterad sjukdom (NTI) och tolkning av sköldkörtelfunktionsprov , ....»8).
- Graviditet
- Medicinering, till exempel ketiapin «Khoodoruth MAS, Abdo AKA, Ouanes S. Quetiapine-Ind...»55, karbamazepin eller amiodaron «Franklyn JA, Davis JR, Gammage MD, ym. Amiodarone ...»3 (se tabell «Läkemedel och kosttillskott som orsakar hypotyreos....»3 och «Läkemedel och kosttillskott som orsakar avvikande fynd i sköldkörtelns funktionstest och som kan påverka tyroxindosen, men som inte nödvändigtvis påverkar sköldkörtelns funktion....»4)
- Kosttillskott och naturprodukter, till exempel biotin
- Förändringar i tyroxinbehandlingen
- Oregelbunden användning av tyroxin
- Nyligen ändrad tyroxindos
- Problem med tyroxinabsorptionen
- Järn-, kalk- eller magnesiummedicinering
- Tarmsjukdom, såsom celiaki
- Laboratoriefel
- Ytterligare undersökningar övervägs som minimerar den störande faktorn i laboratorieanalyserna (se tabell «Orsaker till atypiska sköldkörtelvärden och utredning av dem , , ....»9).
- Utredningen av atypiska sköldkörtelvärden beskrivs närmare i tabell «Orsaker till atypiska sköldkörtelvärden och utredning av dem , , ....»9.
- Se bild «Epätyypillisesti käyttäytyvien kilpirauhasen toimintakokeiden syyt ja niiden selvittely»5.
| TSH | T4-V | T3-V | |
|---|---|---|---|
| N = normal, dvs. inom referensområdet ↑= över den övre gränsen för referensområdet ↓ = under den nedre gränsen för referensområdet |
|||
| Akut fas | N | ↓ eller N eller ↑ |
↓ |
| Kronisk fas | ↓ | ↓ | ↓ |
| Återhämtningsfas | N eller ↑ | ↓ eller N | ↓ eller N |
| T4-V-värdet ligger under den nedre gränsen för referensområdet, men TSH-värdet är lågt i proportion till T4-V-värdet |
|
| T4-V-värdet ligger över den övre gränsen för referensområdet, men TSH- och T3-V-värdena ligger inom referensområdet |
|
| T4-V-värdet ligger över den övre gränsen för referensområdet men TSH-värdet är inom referensområdet eller över den övre gränsen för referensområdet, och T3-V-värdet ligger över den övre gränsen för referensområdet |
|
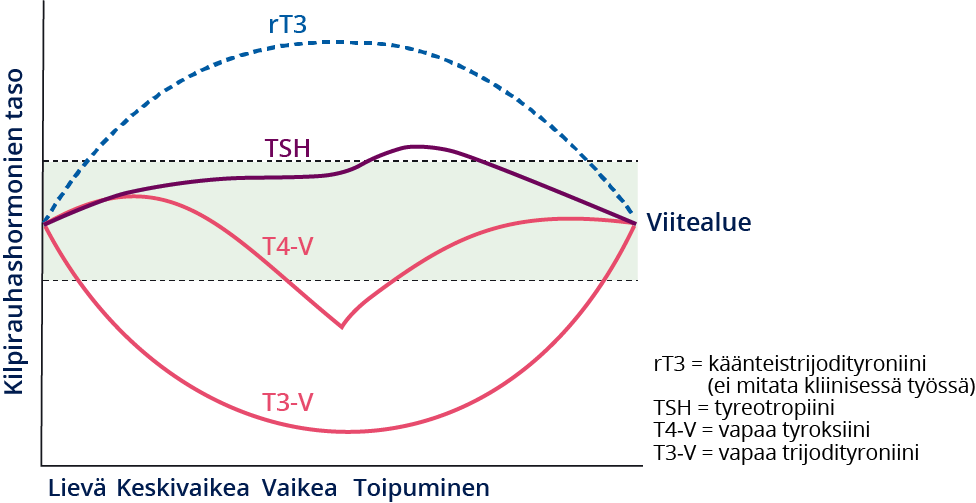
Kilpirauhasarvot akuutin sairauden yhteydessä.
Mukailtu lähteestä: Patki V, Kumbhojkar A, Khilnani P. Sick Euthyroid Syndrome: A Myth or Reality. Journal of Pediatric Critical Care 2017;4:4, DOI-10.21304/2017.0403.00213

Epätyypillisesti käyttäytyvien kilpirauhasen toimintakokeiden syyt ja niiden selvittely.
Indikationer för inledning av behandling
Klinisk hypotyreos
- Klinisk hypotyreos (TSH-värdet är över den övre gränsen för referensområdet och T4-V under den nedre gränsen för referensområdet) behandlas alltid.
- Beviljande av rätt till specialersättning förutsätter att man påvisat en klinisk underfunktion av sköldkörteln. Den kliniska bilden av underfunktionen, starttidpunkten och en eventuell etiologi ska framgå av utlåtandet. Dessutom ska resultaten av laboratorieprover som beskriver sköldkörtelns funktion (t.ex. TSH och T4-V) innan sköldkörtelhormonbehandlingen inletts framgå. Se FPA «https://www.kela.fi/laake104»6.
- Subklinisk hypotyreos betraktas inte som en svår sjukdom som berättigar till specialersättning.
Subklinisk hypotyreos
- Vid subklinisk hypotyreos är en förhöjd TSH-halt en kompensationsmekanism i kroppen som leder till att halterna av sköldkörtelhormon hålls på en tillräcklig nivå.
- En förhöjd TSH-halt är inte nödvändigtvis ett tecken på sköldkörtelsjukdom «Biondi B, Cappola AR, Cooper DS. Subclinical Hypot...»30, «Somwaru LL, Rariy CM, Arnold AM, ym. The natural h...»61, «Surks MI, Hollowell JG. Age-specific distribution ...»62, «Bremner AP, Feddema P, Leedman PJ, ym. Age-related...»63, «Waring AC, Arnold AM, Newman AB, ym. Longitudinal ...»64.
- Hos cirka 90 procent av de personer som har konstaterats ha subklinisk hypotyreos är TSH-halten under 10 mU/l «Biondi B, Cappola AR, Cooper DS. Subclinical Hypot...»30.
- Hos cirka 60 procent återgår TSH-värdet till referensområdet av sig självt i 5 års uppföljning, om TSH-halten i början är under 10 mU/l. Endast hos 2–4 procent framskrider tillståndet årligen till klinisk hypotyreos. Positiva TPO-antikroppar och kvinnligt kön ökar denna risk «Meyerovitch J, Rotman-Pikielny P, Sherf M, ym. Ser...»65, «Biondi B, Cooper DS. The clinical significance of ...»66.
- I en treårig uppföljning framskred 40 procent av fallen med en TSH-halt på 10–14,9 mU/l till klinisk hypotyreos och 85 procent av fallen med en TSH-halt på 15–19,9 mU/l «Díez JJ, Iglesias P. Spontaneous subclinical hypot...»67.
- Personer med lindrig subklinisk hypotyreos (TSH-halt under 10 mU/l) har i genomsnitt
lika mycket symtom som personer vars värden i sköldkörtelfunktionstesterna ligger
inom referensområdet.
- Hos personer med lindrig subklinisk hypotyreos förekommer neuropsykiatriska symtom samt försämrad kognition och försämrat upplevt psykiskt välbefinnande i samma utsträckning som hos normalbefolkningen «Biondi B, Cappola AR, Cooper DS. Subclinical Hypot...»30.
- Hos medelålders personer med betydande subklinisk hypotyreos (TSH-halten minst 10 mU/l) har en lindrig försämring observerats i vissa kognitiva funktioner (sakminne, arbetsminne, humör) jämfört med kontrollpersoner. Ingen skillnad har observerats i livskvaliteten jämfört med normalbefolkningen «Klaver EI, van Loon HC, Stienstra R, ym. Thyroid h...»68, «Correia N, Mullally S, Cooke G, ym. Evidence for a...»69.
- TSH-halten är i allmänhet högre hos överviktiga och feta personer «Valdés S, Maldonado-Araque C, Lago-Sampedro A, ym....»70.
- En viktminskning minskar TSH-halten.
- Enligt en befolkningsstudie (n = 3 928) är referensområdet för TSH hos friska personer 0,6–5,5 mU/l när BMI är 25–29,9 kg/m2, 0,5–5,9 mU/l när BMI är 30–39,9 kg/m2 och 0,7–7,5 mU/l när BMI är minst 40 kg/m2 «Valdés S, Maldonado-Araque C, Lago-Sampedro A, ym....»70.
- Särskilt hos äldre personer är det skäl att vara försiktig med överdiagnostik och
överbehandling.
- Befolkningsstudier visar en ökning i TSH-halten hos äldre personer som överskrider den övre gränsen för referensområdet för friska vuxna.
- Inledningsgränsen för tyroxinsubstitutionsbehandling och TSH-målet för behandlingen är högre hos äldre personer (över 70 år) och särskilt hos mycket äldre personer «Waring AC, Arnold AM, Newman AB, ym. Longitudinal ...»64, «Leng O, Razvi S. Hypothyroidism in the older popul...»71.
- Eftersom man i flera undersökningar har observerat att TSH-halten ökar med åldern, har detta beaktats i vissa laboratoriers TSH-referensvärden «Kilpirauhasen toimintakokeiden laboratoriokohtaisia viitearvoja Suomessa»5.
- Subklinisk hypotyreos har samband med förhöjda halter av totalkolesterol, LDL-kolesterol och triglycerid «Treister-Goltzman Y, Yarza S, Peleg R. Lipid profi...»72.
- Signifikant subklinisk hypotyreos har samband med lindriga hjärt- och kärlavvikelser, såsom nedsatt systolisk och diastolisk funktion i vänster kammare och försvagad relaxation av blodkärl «Biondi B, Palmieri EA, Lombardi G, ym. Effects of ...»73. I kontrollerade studier har det inte påvisats att behandlingen av subklinisk hypotyreos skulle minska hjärthändelser «Subkliininen hypotyreoosi sydän- ja verisuonisairauksien riskitekijänä»10.
Indikationer för behandling av subklinisk hypotyreos
- Tyroxinbehandling påverkar uppenbarligen inte symtomen, humöret, livskvaliteten eller kognitionen hos personer med subklinisk hypotyreos «Tyroksiinihoito ei ilmeisesti vaikuta oireisiin, mielialaan, elämänlaatuun tai kognitioon henkilöillä, joilla on subkliininen hypotyreoosi.»B.
- Tyroxinbehandling kan inledas i situationer där TSH-halten upprepade gånger är minst
10 mU/l «Biondi B, Cappola AR, Cooper DS. Subclinical Hypot...»30, «Pearce SH, Brabant G, Duntas LH, ym. 2013 ETA Guid...»74, (se bild «Behandling av subklinisk hypotyreos hos vuxna»6, «gvr00101b.pdf»2 (PDF)).
- Å andra sidan har en internationell expertgrupp föreslagit en TSH-halt på minst 20 mU/l som inledningsgräns för tyroxinbehandling, om patienten är symtomfri och över 30 år «Bekkering GE, Agoritsas T, Lytvyn L, ym. Thyroid h...»75.
- För dem som är gravida eller planerar en graviditet rekommenderas att tyroxin inleds vid subklinisk hypotyreos (se avsnittet Graviditet «A4»7 och bild «Behandling av subklinisk hypotyreos hos vuxna»6, «gvr00101b.pdf»2 (PDF))
- Vid lindrig subklinisk hypotyreos (TSH < 10 mU/l) kan man överväga 6 månaders försök
med tyroxinbehandling hos personer med symtom. Det bör dock observeras att forskningsevidensen
för behandlingseffekten för lindrig subklinisk hypotyreos är knapp (se bild «Behandling av subklinisk hypotyreos hos vuxna»6, «gvr00101b.pdf»2(PDF)).
- I den prospektiva och randomiserade TRUST-studien (n = 737) observerades ingen skillnad mellan tyroxin- och placebogruppen när man undersökte livskvalitet, händernas kompressionskraft, hypotyreossymtom och trötthet. Personerna var minst 65 år gamla och det genomsnittliga TSH-värdet var 6,4 mU/l i början av studien «Stott DJ, Rodondi N, Kearney PM, ym. Thyroid Hormo...»76.
- I en metaanalys (21 studier där man utrett subklinisk hypotyreos) observerades ingen skillnad mellan tyroxin och placebo när det gäller livskvalitetsmätare, kognitiv prestation, trötthet, muskelstyrka, systoliskt blodtryck eller BMI. Den stora TRUST-studien ingick i metaanalysen, vilket hade en betydande inverkan på resultatet «Feller M, Snel M, Moutzouri E, ym. Association of ...»77.
- Hos personer under 70 år som har lindrig subklinisk hypotyreos (TSH < 10 mU/l) kan man överväga tyroxinbehandling också om TPO-antikropparna ligger över den övre gränsen för referensområdet, TSH-halten ökar fortlöpande i uppföljningen eller om personen har struma (se bild «Behandling av subklinisk hypotyreos hos vuxna»6, «gvr00101b.pdf»2 (PDF)).
- Tyroxinbehandling kan övervägas vid lindrig subklinisk hypotyreos även hos personer
som har förhöjd risk för hjärt- och kärlsjukdomar, såsom hyperkolesterolemi.
- Det finns stark forskningsevidens om behandlingseffekten av traditionella riskfaktorer i förebyggandet av hjärt- och kärlsjukdomar. Det finns inte tillräcklig evidens om att tyroxinbehandling är effektiv för att förebygga hjärt- och kärlsjukdomar.
- För personer som haft cancer i barndomen rekommenderas att man överväger att inleda tyroxinbehandling av subklinisk hypotyreos, eftersom cancerbehandlingar i barndomen kan öka benägenheten för sköldkörtelcancer «Waguespack SG. Thyroid Sequelae of Pediatric Cance...»78, se avsnittet Personer som insjuknat i cancer som barn, ung eller ung vuxen «A5»8.
- Ett samband mellan subklinisk hypotyreos och demens har observerats hos personer under 75 år, men inte hos personer över 75 år «Pasqualetti G, Pagano G, Rengo G, ym. Subclinical ...»79. Det finns dock inga forskningsrön om att behandling av subklinisk hypotyreos skulle minska risken för demens.
- Hos personer över 70 år rekommenderas tyroxinbehandling endast när TSH-värdet är minst 10 mU/l «Pearce SH, Brabant G, Duntas LH, ym. 2013 ETA Guid...»74.
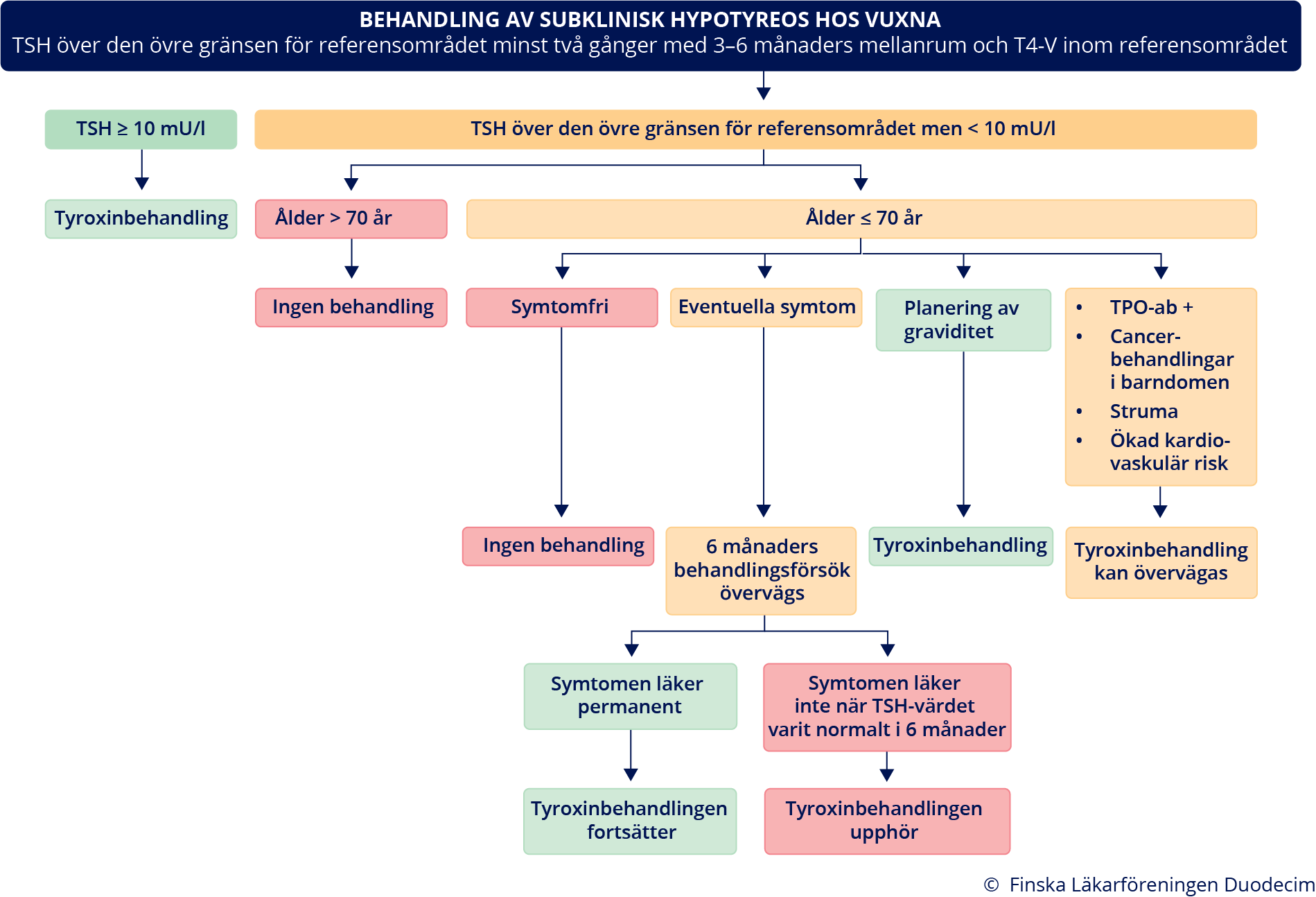
Behandling av subklinisk hypotyreos hos vuxna. Öppna schemats PDF-version via denna länk «gvr00101b.pdf»2
Genomförande av behandlingsförsök av subklinisk hypotyreos
- Innan behandlingsförsöket inleds
- Säkerställs att det är fråga om permanent subklinisk hypotyreos. I detta fall är TSH-värdet i minst två undersökningar som utförts med 3–6 månaders mellanrum högre än den övre gränsen för referensområdet och T4-V-värdet ligger inom referensområdet. (se bild «Behandling av subklinisk hypotyreos hos vuxna»6, «gvr00101b.pdf»2 (PDF))
- Dokumenteras målsättningen för behandlingen, dvs. de symtom man försöker lindra.
- Förklaras för patienten att behandlingens effekt på symtomen är osäker och att behandlingen avslutas «Biondi B, Cappola AR, Cooper DS. Subclinical Hypot...»30 om man inte under 6 månaders behandling observerar effekt på symtomen, även om TSH-värdet fås till referensområdet.
- I samband med att läkemedelsbehandling inleds är det också skäl att beakta en eventuell placebo- eller vårdrelationseffekt, vars längd är oklar och beror bland annat på vårdrelationens kontinuitet.
- Vid subklinisk hypotyreos är tyroxinbehovet i allmänhet mindre än vid klinisk hypotyreos.
- I allmänhet rekommenderas att tyroxin inleds med dosen 25–50 μg per dygn.
- Tyroxindosen justeras med 6–8 veckors mellanrum tills TSH-värdet har stabiliserat sig inom referensområdet. Därefter fortsätter man med samma dos.
- Efter ett resultatlöst behandlingsförsök undersöks TSH- och T4-V-halten på nytt om ett år för att upptäcka en eventuell utveckling till klinisk hypotyreos.
Om TSH-värdet efter ett års uppföljning är under 10 mU/l är det inte nödvändigt att ordna regelbunden uppföljning, eftersom endast 2–4 procent av fallen årligen progredierar till klinisk hypotyreos «Meyerovitch J, Rotman-Pikielny P, Sherf M, ym. Ser...»65.
- Patienter som har ett TSH-värde på minst 10 mU/l eller för vilka tyroxinbehandling
varit framgångsrik behandlas i allmänhet permanent med tyroxin.
- Om man ändå beslutar sig för en uppföljningslinje, rekommenderas att TSH- och T4-V-halten följs upp årligen så att en eventuell klinisk hypotyreos upptäcks. Uppföljningen avslutas om TSH-värdet återgår till referensområdet utan tyroxinbehandling.
Symtom som tyder på hypotyreos, men TSH- och T4-V-värdena ligger inom referensområdet
- Tyroxinbehandling lindrar symtom som tyder på hypotyreos lika mycket som placebo hos personer vars värden i sköldkörtelfunktionstest (TSH och T4-V) ligger inom referensområdet «Pollock MA, Sturrock A, Marshall K, ym. Thyroxine ...»80, «Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines fo...»81.
- Tyroxinbehandling bör inte inledas om sköldkörtelvärdena ligger inom referensområdet, även om personen har symtom som tyder på hypotyreos, såsom övervikt och trötthet «Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines fo...»81, «Kaptein EM, Beale E, Chan LS. Thyroid hormone ther...»82.
Behandling av klinisk hypotyreos
- Målet med behandlingen är att normalisera symtom, fynd och TSH-halt i samband med hypotyreos «Salmela P, Metso S, Moilanen L, ym. [Treatment of ...»83, «Biondi B, Wartofsky L. Treatment with thyroid horm...»84.
- I behandlingen används i första hand syntetiskt tyroxin (T4-hormon) (se bild «Startdos för tyroxinbehandling och dosändringar hos vuxna»7, «gvr00101c.pdf»3 (PDF))
- De största fördelarna med tyroxin är den förutsägbara och stabila effekten tack vare
den långa halveringstiden (6–7 dygn), den långa användarerfarenheten samt starka belägg
på effekt och säkerhet.
- T4-hormonet omvandlas med jämn hastighet till T3-hormon med hjälp av vävnadernas dejodiseringsenzymer. T3-hormonet binds till cellernas sköldkörtelhormonreceptorer, vilket leder till den biologiska effekten.
- För i övrigt friska personer under 65 år kan man vid klinisk hypotyreos med tanke på hjärtat inleda tyroxinbehandling direkt med dosen cirka 1,6 μg/kg/dygn «Biondi B, Wartofsky L. Treatment with thyroid horm...»84, «Roos A, Linn-Rasker SP, van Domburg RT, ym. The st...»85, «Vasileiou M, Gilbert J, Fishburn S, ym. Thyroid di...»86, (se bild «Startdos för tyroxinbehandling och dosändringar hos vuxna»7, «gvr00101c.pdf»3 (PDF))
- Det är också möjligt att börja med en mindre dos. Då tar det i allmänhet lite längre att uppnå biokemisk eutyreos, men symtomen lindras dock lika snabbt «Roos A, Linn-Rasker SP, van Domburg RT, ym. The st...»85.
- För patienter med hjärtsjukdom samt personer över 65 år rekommenderas att tyroxinbehandling inleds med en mindre dos (25–50 μg/dygn) och att dosen ökas gradvis.
- Efter att behandlingen inletts är doshöjningarna vanligen 12,5–25 μg/dygn «Salmela P, Metso S, Moilanen L, ym. [Treatment of ...»83.
- Tyroxin tas i första hand på morgonen på tom mage minst 30 minuter före frukost. Tyroxinet
kan också tas på tom mage efter 2 timmars fasta före läggdags «Bach-Huynh TG, Nayak B, Loh J, ym. Timing of levot...»87. Tyroxin som administreras på det sistnämnda sättet är ett möjligt alternativ om
det förbättrar adherensen.
- Man inte observerat någon betydande skillnad i sköldkörtelhormonhalterna om sköldkörtelmedicineringen tas före morgonmålet eller före kvällsmålet «Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines fo...»81, «Pang X, Pu T, Xu L, ym. Effect of l-thyroxine admi...»88.
- En måltid i samband med tyroxinintaget försämrar absorptionen med 40–80 procent. Tyroxin som tas i samband med måltider kan leda till varierande TSH-halter.
- Absorptionen av tyroxin försämras av bland annat läkemedel som minskar utsöndringen av syra i magsäcken, järn och kalciumpreparat samt bypassoperation av magsäcken.
- På grund av den långa halveringstiden för tyroxin kan dagsdoserna vara olika stora, men jämnstora dagsdoser underlättar genomförandet av behandlingen.
- Under kortvarig intensivvård eller parenteral nutrition behövs inget intravenöst tyroxin, eftersom tyroxin har en lång halveringstid.
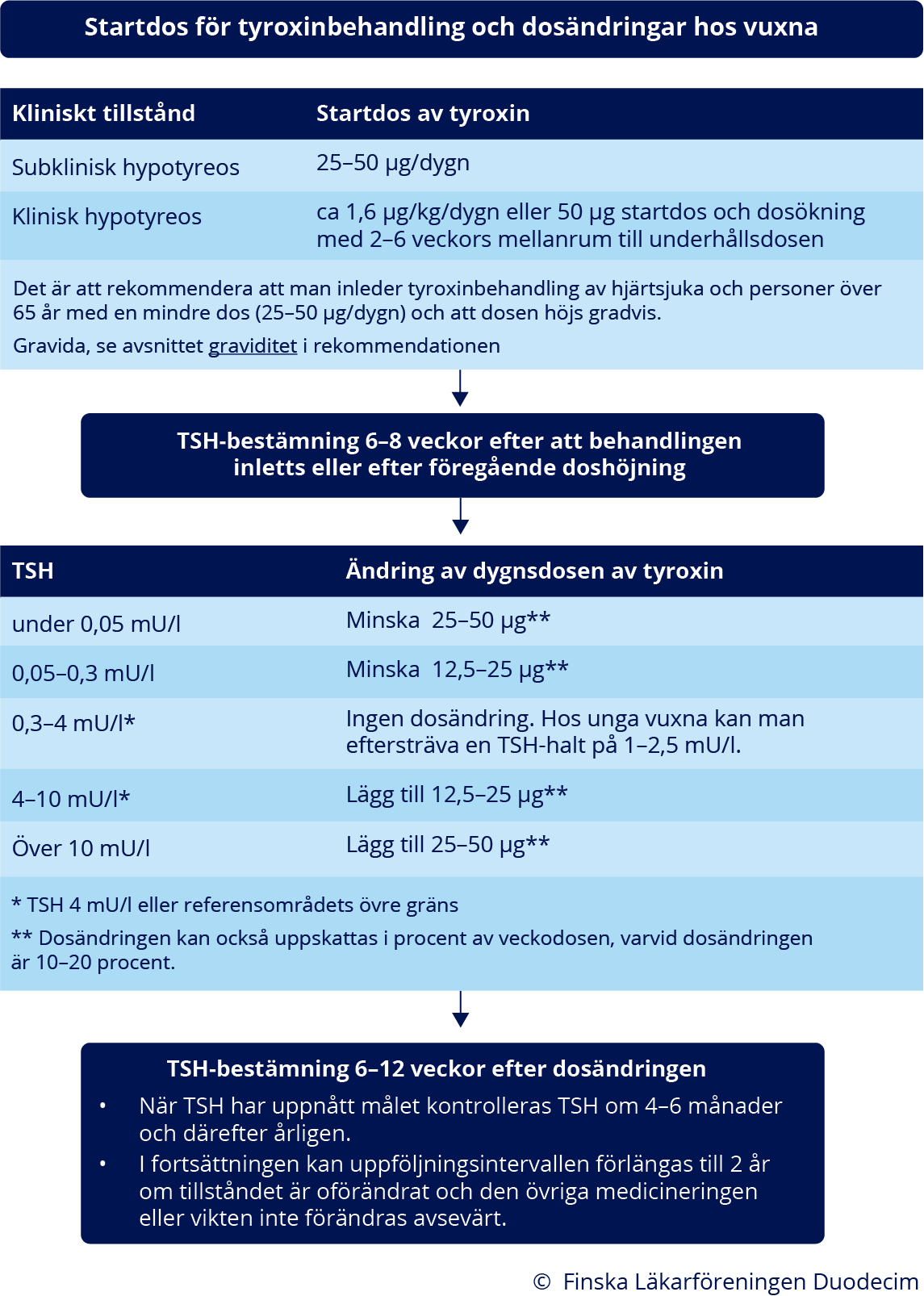
Startdos för tyroxinbehandling och dosändringar hos vuxna. Öppna schemats PDF-version via denna länk «gvr00101c.pdf»3
Justering av tyroxindosen hos vuxna
- Dosökningens storlek beror på patientens tyroxindos och TSH-värde. I bilden «Startdos för tyroxinbehandling och dosändringar hos vuxna»7, «gvr00101c.pdf»3 (PDF) beskrivs dosjusteringen av tyroxin.
- Om TSH-värdet är något utanför referensområdet, tyroxindosen har länge varit stabil och patienten är symtomfri, behöver dosen inte nödvändigtvis ändras, utan TSH-värdet kan först kontrolleras efter 6–12 veckor «Ross DS. Treatment of primary hypothyroidism in ad...»89.
- Om TSH-halten är förhöjd, säkerställs först att patienten regelbundet tar tyroxin
enligt anvisningen på tom mage och att patienten inte använder läkemedel som försämrar
tyroxinabsorptionen.
- Dosändringen kan också uppskattas i procent av veckodosen, varvid dosändringen är 10–20 procent. För till exempel en patient med en dagsdos på 100 μg kan dosen ökas genom att lägga till en tablett på 100 μg för en dag eller en halv tablett under två dagar i veckan, varvid en ändring av en veckodosen på 100 μg motsvarar en ändring av dygnsdosen på cirka 14 procent och 14 μg «Ross DS. Treatment of primary hypothyroidism in ad...»89.
- Vid finjustering av doserna kan tyroxin på 25 μg eller 13 μg vara användbara, dock med försiktighet så att man i titreringsskedet undviker den förvirring som kan orsakas av flera olika dosstyrkor.
- Om TSH-halten länge har varit låg på grund av en för hög tyroxindos, kan en lägre dos tolereras bättre när dosen minskas långsammare. Om TSH-halten är under 0,05 kan det ta längre (upp till 6 månader) innan den ligger inom referensområdet.
- Normaliseringen av TSH-halten kan ta upp till 6 månader, om halten i utgångsläget är mycket hög eller den kliniska hypotyreosen har pågått länge innan behandlingen inleddes «Vasileiou M, Gilbert J, Fishburn S, ym. Thyroid di...»86. Därför kan T4-V-bestämning i början av behandlingen användas som hjälp vid dostitrering, om TSH-värdet inte normaliseras genom att justera dosen enligt bild «Startdos för tyroxinbehandling och dosändringar hos vuxna»7, «gvr00101c.pdf»3 (PDF).
- När dosen har stabiliserats är det värt att sträva efter så lika stora dagsdoser som möjligt och en lätt genomförbar dosering «Ross DS. Treatment of primary hypothyroidism in ad...»89.
Uppföljning av vården
Blodprov som används i uppföljningen
- Det är viktigt att hitta en indiviuellt lämplig dosering för substitutionsbehandlingen med sköldkörtelhormon.
- Vid primär hypotyreos ärTSH det mest tillförlitliga laboratorieprovet för att bedöma om tyroxindosen är lämplig., TSH borde vara inom referensområdet (cirka 0,3–4 mU/l) «NICE guideline [NG145]. Thyroid disease: assessmen...»38, «Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines fo...»81, «Kilpirauhasen toimintakokeiden laboratoriokohtaisia viitearvoja Suomessa»5.
- I synnerhet för personer över 70 år kan TSH-målet vara högre än den övre gränsen för referensområdet «Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines fo...»81.
- Hos unga vuxna kan TSH-halten 1–2,5 mU/l vara att rekommendera «Wartofsky L, Dickey RA. The evidence for a narrowe...»90, men evidensen gällande detta är inte entydig «Walsh JP, Ward LC, Burke V, ym. Small changes in t...»91, «Surks MI, Goswami G, Daniels GH. The thyrotropin r...»92.
- Inom referensområdet för TSH-halten kan man individuellt söka den nivå med vilken
patienten mår bäst.
- Om patienten fortfarande har symtom, även om TSH-värdet ligger inom referensområdet, kan dosen av sköldkörtelhormonpreparatet justeras, eftersom en del patienter upplever att de mår bättre när TSH-värdet är i referensområdets nedre del och en del i den övre delen.
- Iatrogen suppression av TSH och tyreotoxikos bör alltid undvikas «NICE guideline [NG145]. Thyroid disease: assessmen...»38, «Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines fo...»81.
- Om patienten trots att TSH-värdet är inom referensområdet har symtom ska andra sjukdomar och tillstånd som orsakar symtom utredas och behandlas enligt tabell «Symtom på klinisk hypotyreos, fynd och differentialdiagnostik enligt organsystem. Översatt och bearbetat från källa ....»5.
- Det kan ta upp till 6 månader för TSH-värdet att återgå till referensområdet hos patienter vars TSH-värde har varit mycket högt eller lågt innan behandlingen inleddes eller intensifierades «Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines fo...»81.
- TSH bestäms 6–12 veckor efter att tyroxinbehandlingen inletts och efter dosändringar.
- När TSH-värdet uppnått målet kontrolleras det om 4–6 månader och därefter årligen «NICE guideline [NG145]. Thyroid disease: assessmen...»38, «Okosieme O, Gilbert J, Abraham P, ym. Management o...»93.
- På lång sikt kan uppföljningsintervallen förlängas till 2 år, om tillståndet är oförändrat och den övriga medicineringen eller vikten inte förändras avsevärt.
- Om TSH-värdet är inom referensområdet i uppföljningen av en symtomfri patient räcker det med att följa upp enbart TSH. Även om det är viktigt att följa upp och utreda symtomen i uppföljningen av hypotyreos, bedöms symtomen alltid i relation till TSH-värdet och medicineringen regleras aldrig enbart utgående från symtomen «Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines fo...»81.
- Det är skäl att göra en T4-V-bestämning om patienten har symtom trots att TSH-värdet ligger inom referensområdet eller om man misstänker adherensproblem «NICE guideline [NG145]. Thyroid disease: assessmen...»38. Vid primär hypotyreos kan tyroxinsubstitutionsbehandling ibland leda till en T4-V-halt som överskrider den övre gränsen för referensområdet. Detta har ingen klinisk betydelse om TSH-värdet ligger inom målområdet «Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines fo...»81.
- T3-V-bestämning behövs inte vid uppföljning av hypotyreos, om det inte finns misstanke om sköldkörtelvärden som beter sig atypiskt, se avsnittet Utredning av atypiska sköldkörtelvärden «A6»9.
- I uppföljningen av hypotyreos finns ingen evidens för att uppföljning av andra blodprov (t.ex. TPO-antikroppar, SHBG, kolesterol, myoglobin, kreatininkinas eller ferritin) «Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines fo...»81 skulle vara användbara.
- Gällande patienter som planerar en graviditet samt barnpatienter beskrivs behandlingsmålen i ett eget kapitel, se punkterna Graviditet samt Barn «A2»4.
- Gällande uppföljningen av patienter med sköldkörtelcancer beskrivs dosering och behandlingsmål i avsnittet som beskriver substitutionsbehandling med sköldkörtelhormon för patienter med sköldkörtelcancer. Se avsnittet Patienter med sköldkörtelcancer «A7»10.
Avslutning av en långvarig tyroxinbehandling
- Om indikationen för inledningen av behandlingen varit oklar, eller om tyroxindosen
är liten, om dosen inte har behövt ökas och om behandlingens effekt är osäker, kan
man försöka avsluta tyroxinbehandlingen.
- En tredjedel av patienterna upprätthåller eutyreos efter att tyroxinet har avslutats och detta är särskilt sannolikt hos dem som fått behandling för subklinisk hypotyreos «Burgos N, Toloza FJK, Singh Ospina NM, ym. Clinica...»94.
- Hypotyreos kan vara övergående (transient hypotyreos), varvid behovet av tyroxinsubstitution är tillfälligt.
- Den inledande hypertyreosfasen vid tyreoidit följs av en hypotyreosfas, som för de flesta är övergående.
- Avslutning av en tyroxinbehandling:
- Om tyroxindosen är högst 50 μg/dygn kan tyroxinet avslutas utan att dosen först minskas. TSH- och T4-V-halterna undersöks efter 6–12 veckor «Burgos N, Toloza FJK, Singh Ospina NM, ym. Clinica...»94.
- Om tyroxindosen är högre, halveras behandlingsdosen och TSH- och T4-V-halten undersöks efter 6 veckor. Om TSH-värdet inte överskrider den övre gränsen för referensområdet kan behandlingen avslutas och TSH- och T4-V-halterna kontrolleras på nytt efter 6–12 veckor.
- Om TSH-värdet hålls inom referensområdet i 3–6 månader efter att tyroxinet avslutats behöver man inte fortsätta tyroxinbehandlingen. Om TSH-halten är under 10 mU/l 12 månader efter att tyroxinet har avslutats och patientens tillstånd inte förändras väsentligt, behövs ingen regelbunden TSH-uppföljning i fortsättningen, eftersom endast 2–4 procent av lindriga subkliniska hypotyreosfall per år progredierar till klinisk hypotyreos «Meyerovitch J, Rotman-Pikielny P, Sherf M, ym. Ser...»65.
- I en uppföljningsstudie med 1 103 patienter förblev sköldkörtelfunktionen normal hos en tredjedel (37 %) «Burgos N, Toloza FJK, Singh Ospina NM, ym. Clinica...»94 efter att tyroxinet avslutats. Största delen av dessa hade ursprungligen haft subklinisk hypotyreos. Om behandlingen hade inletts mot klinisk hypotyreos var det mer osannolikt att sköldkörtelns funktion förblev normal (11 %) . I dessa fall hade den sannolika orsaken till hypotyreos varit övergående hypotyreos efter en sköldkörtelinflammation.
Läkemedel och kliniska situationer som påverkar tyroxindosen
- Tyroxin absorberas i ileum och jejunum. Det låga pH-värdet i magsäcken i samband med fasta främjar absorptionen. Under optimala förhållanden absorberas 70–80 procent av tyroxinet.
- Om patientens tillstånd och TSH-halt förändras under tyroxinsubstitutionsbehandlingen, ska förändringar i doseringen av tyroxin (tidpunkt för intaget av läkemedlet, preparat och dosstyrka), läkemedel som påverkar doseringen (se tabell «Läkemedel och kosttillskott som orsakar hypotyreos....»3 och «Läkemedel och kosttillskott som orsakar avvikande fynd i sköldkörtelns funktionstest och som kan påverka tyroxindosen, men som inte nödvändigtvis påverkar sköldkörtelns funktion....»4), andra sjukdomar och en eventuell viktförändring (en förändring på 10 % påverkar tyroxindosen) utredas. Tyroxindosen bör titreras så att den lämpar sig för den aktuella situationen «Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines fo...»81 (se tabell «Läkemedel och kosttillskott som orsakar hypotyreos....»3 och «Läkemedel och kosttillskott som orsakar avvikande fynd i sköldkörtelns funktionstest och som kan påverka tyroxindosen, men som inte nödvändigtvis påverkar sköldkörtelns funktion....»4).
- Om en medicinering som påverkar absorptionen, metabolismen eller bindningsproteinhalten
för sköldkörtelhormoner inleds eller avslutas, kontrolleras sköldkörtelproverna ca
6–12 veckor efter läkemedelsförändringen (se tabell «Läkemedel och kosttillskott som orsakar hypotyreos....»3 och «Läkemedel och kosttillskott som orsakar avvikande fynd i sköldkörtelns funktionstest
och som kan påverka tyroxindosen, men som inte nödvändigtvis påverkar sköldkörtelns
funktion....»4).
- Kalcium- och järnpreparat försämrar absorptionen av tyroxin. Det rekommenderas att de tas först 4 timmar efter att tyroxinet har tagits, men det finns ingen evidens för att detta förbättrar absorptionen av tyroxin «Jonklaas J. Optimal Thyroid Hormone Replacement. E...»95.
- Patienterna använder ofta kalcium- och järnpreparat med relativa indikationer och inom egenvården. När det är svårt att hitta en lämplig tyroxindos är det bra att kritiskt bedöma om patienten överhuvudtaget behöver järn- och kalciumpreparat.
- Protonpumpshämmare höjer magsäckens pH-värde och försämrar därför absorptionen av tyroxin, vilket ökar behovet av tyroxin. Oregelbunden användning av PPI-läkemedel kan orsaka variationer i sköldkörtelvärdena «Jonklaas J. Optimal Thyroid Hormone Replacement. E...»95.
- Estrogenpreparat som tas oralt ökar mängden tyroxinbindande protein och behovet av tyroxin, medan en minskning av estrogenhalten i klimakteriet eller när en estrogensubstitutionsbehandlingen avslutas minskar behovet av tyroxin.
- Celiaki, atrofisk gastrit, gastrit orsakad av Helicobacter pylori samt gastrisk bypass kan försämra absorptionen av tyroxin «Jonklaas J. Optimal Thyroid Hormone Replacement. E...»95, se avsnittet Behandlingsföljsamhet (adherens) «A8»11.
- Även åldern (dosbehovet minskar), fetma (dosbehovet ökar) och viktminskning (dosbehovet minskar) kan påverka dosbehovet av tyroxin.
Behandlingsföljsamhet (adherens)
- Vid behandling av hypotyreos uppnår endast 66–68 procent av patienterna en tillräcklig, dvs. 80 procents behandlingsföljsamhet eller adherens vid T4-behandling, vilket är i samma klass som vid andra kroniska sjukdomar «Briesacher BA, Andrade SE, Fouayzi H, ym. Comparis...»96, «Briesacher BA, Andrade SE, Fouayzi H, ym. Medicati...»97, «Caron P, Declèves X. The Use of Levothyroxine Abso...»98.
- Adherensen kan förbättras genom god inledande information och repetition gällande indikationerna för tyroxinbehandling, målsättningen för behandlingen samt de faktorer som påverkar absorptionen av läkemedlet.
- En jämnstor daglig dos tyroxin kan förbättra adherensen, liksom också användningen av en dosett och påminnelser som ställts in på mobiltelefonen.
- Ett TSH-värde som överskrider den övre gränsen för referensområdet och ett samtidigt T4-V-värde inom referensområdet kan tyda på otillräcklig adherens.
- Regelbundna uppgifter om expediering av elektroniska recept vittnar om god adherens och dessa uppgifter kan utnyttjas om patienten har en vårdrelation.
- Om tyroxindosen överstiger 1,9 μg/kg/dygn och TSH-halten förblir hög trots att tyroxindosen
höjs, bör man misstänka problem med absorptionen av tyroxin. Om ingen förklarande
orsak hittas kan man inom den specialiserade sjukvården göra ett absorptionstest,
som skiljer malabsorption från adherensproblem «Walker JN, Shillo P, Ibbotson V, ym. A thyroxine a...»99, «Caron P, Declèves X. The Use of Levothyroxine Abso...»98. Se avsnittet Läkemedel och kliniska situationer som påverkar tyroxindosen «A9»12.
- I testet ges patienterna under övervakning en veckodos tyroxin som engångsdos (ca 1,6 μg/kg x 7, ofta 1 000 μg) på tom mage efter fasta över natten. TSH- och T4-V-halterna mäts före tyroxinintaget och T4-V-halten med 1 timmes mellanrum under 4 timmar. Upptaget av tyroxin anses vara normalt om T4-V-halten stiger med minst 60 procent. Ett mindre tal än detta tyder på malabsorption och ett större tal på problem med adherensen «Walker JN, Shillo P, Ibbotson V, ym. A thyroxine a...»99, «Caron P, Declèves X. The Use of Levothyroxine Abso...»98.
Riskerna med en för liten eller för stor tyroxindos i proportion till behovet
- En för hög tyroxindos leder till en TSH-halt som underskrider den nedre gränsen för referensområdet och en för låg tyroxindos till en TSH-halt som överskrider den övre gränsen för referensområdet.
- Undersökningar visar att 35 procent av patienterna tror att tyroxindosen förblir densamma under hela livet, även om dosen hos en tredjedel av patienterna i verkligheten måste ändras redan under 12 månaders uppföljning «McMillan M, Rotenberg KS, Vora K, ym. Comorbiditie...»100.
- Hos över hälften av hypotyreospatienterna är TSH-halten inte på målnivån: Hos 12–20 procent är halten under den nedre gränsen för referensområdet och hos 17–32 procent över den övre gränsen «Thayakaran R, Adderley NJ, Sainsbury C, ym. Thyroi...»101, «Lillevang-Johansen M, Abrahamsen B, Jørgensen HL, ...»102, «Perros P, Nirantharakumar K, Hegedüs L. Recent evi...»103, «Flynn RW, Bonellie SR, Jung RT, ym. Serum thyroid-...»104, «Flinterman LE, Kuiper JG, Korevaar JC, ym. Impact ...»105, «Okosieme OE, Belludi G, Spittle K, ym. Adequacy of...»106.
- Patienterna ska informeras om att tyroxindosen inte kommer att vara densamma genom hela livet, och att man därför bör gå till provtagning regelbundet med 1–2 års mellanrum samt vid behov, om det förekommer väsentliga förändringar i tillståndet, vikten eller i den övriga medicineringen «NICE guideline [NG145]. Thyroid disease: assessmen...»38.
- En alltför stor tyroxindos medför biverkningar, såsom förmaksflimmer, palpitationer, bröstsmärtor, nervositet, dålig koncentrationsförmåga, försämrad kognition, osteoporos och benfrakturer «Biondi B, Wartofsky L. Treatment with thyroid horm...»84, «Thayakaran R, Adderley NJ, Sainsbury C, ym. Thyroi...»101, «Lillevang-Johansen M, Abrahamsen B, Jørgensen HL, ...»102, «Flynn RW, Bonellie SR, Jung RT, ym. Serum thyroid-...»104. Biverkningarna av en för stor dos accentueras hos personer över 65 år och postmenopausala kvinnor.
- Hos personer under 70 år kan biverkningarna av en för liten tyroxindos vara t.ex. hypotyreos, hyperkolesterolemi, ateroskleros och hjärtsvikt «Rodondi N, den Elzen WP, Bauer DC, ym. Subclinical...»107, «Razvi S, Weaver JU, Butler TJ, ym. Levothyroxine t...»108.
- Hos personer över 70 år finns det ingen evidens för risker med en underbehandling av hypotyreos.
- Enligt en studie låg TSH-halten hos 41 procent av hypotyreospatienter över 65 år under den nedre gränsen för referensområdet, vilket associerades med ökad risk för förmaksflimmer och osteoporos «Somwaru LL, Arnold AM, Joshi N, ym. High frequency...»109.
- Ju längre TSH-halten hos en patient med hypotyreos ligger under referensområdets nedre gräns eller över referensområdets övre gräns, desto större är dödlighetsrisken. Risken ökar med 18 procent för varje 6-månadersperiod då TSH-halten är under 0,1 mU/l och med 5 procent för varje 6-månadersperiod då TSH-halten är över 4 mU/l «Lillevang-Johansen M, Abrahamsen B, Jørgensen HL, ...»102, «Perros P, Nirantharakumar K, Hegedüs L. Recent evi...»103.
Behandling av myxödemkoma
- Myxödemkoma är ett livshotande tillstånd som kräver omedelbar vård «Olkkola K,Kiviluoma K, Saari T ym. (toim.). Aneste...»110.
- En operation, infektion eller annan stress kan utlösa myxödemkoma hos en patient med obehandlad hypotyreos «Ross DS, Cooper DS, Mulder JE. Myxedema coma. UpTo...»111.
- Tillståndet kan också utvecklas utan utlösande faktor om patienten länge har haft svår hypotyreos som inte diagnostiserats eller behandlats.
- Centrala symtom och fynd är bradykardi, förändringar i EKG (low voltage), lågt blodtryck,
hypotermi, hypoglykemi, hyponatremi och medvetandestörningar av olika grad, såsom
långsamhet, vanföreställningar samt i sällsynta fall djup medvetslöshet eller kramper.
- Ofta förekommer myxödem (omfattande svullnad i huden och andra vävnader) och andningssvikt.
- Även paralytisk ileus kan förekomma.
- Diagnosen grundar sig på avvikande sköldkörtelvärden (TSH och T4-V).
- Innan behandlingen inleds ska kortisolhalten i plasma undersökas för att säkerställa att patienten inte har obehandlad hypokortisolism «Ross DS, Cooper DS, Mulder JE. Myxedema coma. UpTo...»111.
- Behandlingen genomförs med 200–400 μg tyroxin i.v. som engångsdos, därefter 50–100 μg i.v. dagligen.
- Dessutom kan man ge 5–20 μg liotyronin i.v. som en engångsdos, därefter 2,5–10 μg i.v. med 8 timmars mellanrum, om liotyronin finns att tillgå.
- Bestäm sköldkörtelhormonerna i initialskedet med 1–2 dygns mellanrum.
- Undvik att höja T3-V-värdet över den övre gränsen för referensområdet, särskilt hos äldre patienter.
- Patienten bör ges hydrokortison 100 mg i.v. med 8 timmars mellanrum tills hypokortisolism har uteslutits, eftersom hypokortisolism som inte tidigare konstaterats kan förekomma samtidigt och ACTH-responsen på stressituationen vara nedsatt vid djup hypotyreos.
- Stöd för vitala livsfunktioner, korrigering av vätske-, elektrolyt- och glukosbalansen, passiv korrigering av temperaturen och eliminering av den utlösande faktorn hör också till behandlingen «Brent GA, Weetman AP. Hypothyroidism and Thyroidit...»112.
- Intravenöst tyroxin bör ingå i jourlagren vid de sjukhus som ansvarar för dygnetruntjour.
- Om man är tvungen att ge levotyroxin som tabletter oralt eller malet via näs-magsond ska man beakta att absorptionen av tyroxin i tarmen är försämrad vid djup hypotyreos.
- Vid kortvarig intensivvård och parenteral nutrition behövs inget intravenöst tyroxin för att förebygga myxödemkoma, eftersom tyroxin har en lång halveringstid.
Bemötande av patienten, patient-läkarrelationen
- En patient-läkarrelation som grundar sig på förtroende har en stor betydelse i vården av personer med hypotyreos, liksom också i vården av andra långtidssjuka.
- I samband med att vården inleds och följs upp är det väsentligt med konfidentialitet, ett empatiskt bemötande av patienten, att man lyssnar till patienten samt att man informerar patienten enligt evidensbaserad kunskap.
- I uppföljningen bör man förhålla sig allvarligt och empatiskt till patientens symtom, identifiera sambandet mellan psykofysiska symtom, lyssna till bekymmer och minska dem samt undvika överdiagnostik och -behandling. Under uppföljningsbesöken är det också bra att beakta sjukdomens eventuella inverkan på parförhållandet, familjelivet, fritidsintressen samt arbets- och funktionsförmågan.
- Människor upplever och tolkar symtom på olika sätt och förmågan att tåla symtom och ovisshet varierar.
- I patienthandledningen kan man utnyttja patientversionen av God medicinsk praxis-rekommendationen (under arbete).
- Den patientorienterade vården kan försvåras vid avsaknad av kontinuerliga och långvariga vårdrelationer «Raivio R. Väitöskirja. Hoidon jatkuvuus perusterve...»113, «Raivio R, Holmberg-Marttila D, Mattila KJ. Patient...»114, «Mitchell AL, Hegedüs L, Žarković M, ym. Patient sa...»115.
- Utbildad vårdpersonal kan hjälpa till med anpassningen och stärka patientens resiliens.
- Läkaren bör skydda patienterna från grundlösa undersökningar och medicineringar som kan leda till biverkningar.
- Kamratstöd via en patientorganisation (Sköldkörtelförbundet och dess medlemsorganisationer), internet och sociala medier kan vara en viktig hjälp vid hanteringen av de känslor sjukdomen orsakar och vid annan anpassning till sjukdomen.
- Ibland kan sociala medier även väcka rädsla och konflikter.
- Även om sociala medier erbjuder ett enkelt sätt att söka information och få kamratstöd, finns det också en risk för att en enskild patients upplevelse blandas med evidensbaserad forskningsdata.
Vårdtillfredsställelse och faktorer som påverkar den
- Enligt enkätundersökningar är upp till 20–60 procent av hypotyreospatienterna missnöjda med sitt tillstånd. Typiska symtom som försämrar tillståndet är trötthet, viktökning, depression och minnesstörningar «Peterson SJ, Cappola AR, Castro MR, ym. An Online ...»116, «Perros P, Hegedüs L, Nagy EV, ym. The Impact of Hy...»117.
- Bakgrunden till missnöjet med vården är mångfacetterad. Det kan bland annat vara fråga
om en suboptimal sköldkörtelhormonbehandling, autoimmun sjukdom, andra obehandlade
symtom och sjukdomar, patientens upplevelse av vården, personalens sakkunskap, problem
med vårdkontinuiteteten, det använda sköldkörtelhormonpreparatet eller patientens
orealistiska förväntningar på vården «Hegedüs L, Bianco AC, Jonklaas J, ym. Primary hypo...»35.
- I E-MPATHY-enkätundersökningen som utredde vårdtillfredsställelsen vid hypotyreos konstaterades att 48 procent av patienterna var missnöjda med behandlingen av hypotyreos och 69 procent hade symtom som störde vardagslivet (muskelsvaghet, brist på energi, långsamhet, bristande koncentrationsförmåga) «Perros P, Hegedüs L, Nagy EV, ym. The Impact of Hy...»117. Missnöjet med vården förklarades av att patienterna hade ett svagt förtroende för vårdpersonalen, upplevde att vårdpersonalen inte hade tillräckligt med tid, och att vårdpersonalen hade otillräcklig kunskap om behandlingen av hypotyreos, Man upplevde också att man inte fick delta i beslutsfattandet och inte fick tillräcklig eller begriplig information om behandlingen och medicineringen, eller att laboratorieproverna var belastande.
- Sköldkörtelmedicineringen (tyroxin eller T3-baserad behandling) påverkade inte vårdtillfredsställelsen.
- Symtom som störde vardagslivet förekom mindre hos patienter som fick tyroxinmonoterapi än hos patienter som fick T3-baserade preparat.
- Missnöjet med vården hade en svag men statistiskt signifikant association med symtom som stör vardagslivet.
- I studien som omfattade 68 länder deltog 3 915 patienter som använde sköldkörtelpreparat mot hypotyreos. 4,3 procent av patienterna kom från Finland.
- Somatiseringssyndromet är en möjlig förklaring till symtom som fortsätter trots behandling
«Perros P, Nagy EV, Papini E, ym. Hypothyroidism an...»118, «Taylor PN, Iqbal A, Minassian C, ym. Falling thres...»13, «Panicker V, Evans J, Bjøro T, ym. A paradoxical di...»119.
- I E-MPATHY-undersökningen uppfylldes kriterierna för somatisering (över 10 poäng i enkäten) hos 58,6 procent, när somatiseringsprevalensen hos befolkningen i allmänhet är 5–25 procent, och somatiseringssyndromet associerades med missnöje med vården samt symtom som stör vardagen.
- I E-MPATHY-enkätundersökningen användes enkätformuläret Patient Health Questionnaire-15 (PHQ-15) för bedömning av somatiseringssyndromet. Enkäten besvarades av 3 516 patienter (90 % av alla patienter).
Livskvalitet och arbetsförmåga
- Enligt observationsstudier förbättras livskvaliteten och TSH-värdet återgår till referensområdet eller dess närhet vid autoimmunbaserad klinisk hypotyreos hos största delen av patienterna inom 3–6 månader efter att behandlingen inletts «Borson-Chazot F, Terra JL, Goichot B, ym. What Is ...»120.
- Liksom vid flera andra kroniska sjukdomar har kännedom om diagnosen en negativ inverkan på hälsan också hos hypotyreospatienter jämfört med dem som uppfyller de diagnostiska kriterierna, men diagnosen ännu inte har ställts «Jørgensen P, Langhammer A, Krokstad S, ym. Diagnos...»121.
- Enligt en enkätundersökning i en brittisk patientorganisation korrelerar manligt kön och sjukdomstiden positivt med livskvaliteten. Livskvaliteten korrelerar däremot negativt med åldern, över 3 besök hos allmänläkare före diagnosen, självständig reglering av doser av animaliska preparat och T3-preparat samt förväntningar på att T4-behandlingen korrigerar alla symtom. Önskemålet om mer stöd från den behandlande allmänläkaren korrelerar också negativt med livskvaliteten «Mitchell AL, Hegedüs L, Žarković M, ym. Patient sa...»115, «Borson-Chazot F, Terra JL, Goichot B, ym. What Is ...»120.
- Finländska patienter med hypotyreos uppger att de har sämre livskvalitet än befolkningen i genomsnitt. I 15D-enkäten var det totala talet hos personer med hypotyreos (15D-score) 0,838, medan det bland den ålders- och könsstandardiserade befolkningen är 0,918 (skala 0–1). Se Sköldkörtelförbundet: Undersökning: Kilpirauhasen vajaatoiminta vaikuttaa elämänlaatuun «https://kilpirauhasliitto.fi/tutkimus-kilpirauhasen-vajaatoiminta-vaikuttaa-elamanlaatuun/»7.
- Hypotyreospatienternas livskvalitet kan också påverkas av vikten, TPO-antikroppshalter, motion, parrelations- och arbetsmarknadsstatus samt kosten.
- Hypotyreospatienter har längre sjukfrånvaro särskilt under de första fem åren efter diagnosen och de får sjukpension några år tidigare än den övriga befolkningen «Jørgensen P, Langhammer A, Krokstad S, ym. Diagnos...»121, «Sawicka-Gutaj N, Ruchala M, Feldt-Rasmussen U, ym....»122.
- Eftersom man har konstaterat en ökad risk för sjukfrånvaro och sjukpension hos hypotyreospatienter är det viktigt att följa upp och stödja arbetsförmågan. Det är skäl att hänvisa patienter i arbetslivet till företagshälsovården när hypotyreosdiagnosen ställs (se God medicinsk praxis-rekommendationen Bedömning av behovet av sjukfrånvaro «Bedömning av behovet av sjukfrånvaro»5, «Sairauspoissaolon tarpeen arviointi. Käypä hoito -...»123).
Symtomen fortsätter trots en TSH-halt inom målområdet
- Enligt populationsundersökningar har 5–15 procent av tyroxinbehandlade hypotyreospatienter symtom som tyder på hypotyreos trots att TSH-halten ligger inom referensområdet «Peterson SJ, Cappola AR, Castro MR, ym. An Online ...»116, «Panicker V, Evans J, Bjøro T, ym. A paradoxical di...»119, «Wekking EM, Appelhof BC, Fliers E, ym. Cognitive f...»124, «Saravanan P, Chau WF, Roberts N, ym. Psychological...»125.
- Det har inte konstaterats att ett varierande TSH-värde inom referensområdet skulle korrelera med patientens symtom eller tillfredsställelse «Saltevo J, Kautiainen H, Mäntyselkä P, ym. The Rel...»126.
- Om patienten är missnöjd med sitt tillstånd eller sin livskvalitet under tyroxinmonoterapin
«Jonklaas J. Optimal Thyroid Hormone Replacement. E...»95
- kontrollerar man om patienten har primär klinisk hypotyreos
- bedömer man om hypotyreosens etiologi är sådan att den leder till en bestående och
signifikant sköldkörtelhormonbrist
- sköldkörteloperation, radiojodbehandling, strålbehandling av halsen eller autoimmunityreoidit (TPOAb-värde)
- kontrollerar man att tyroxinbehandlingen genomförs korrekt
- man bedömer om behandlingsmålen för sköldkörtelvärdena har uppnåtts med tyroxinbehandling (TSH inom referensområdet).
- en för hög initialdos eller en snabbt förändrad dos kan vara orsaken till en dålig vårdrespons. Då kan behandlingens startdos ändras och doserna ökas stegvis.
- andra läkemedel och sjukdomar kan medföra att dosbehovet av tyroxin förändras eller att resultaten av sköldkörtelproverna varierar.
- dokumenterar man symtom som stör patienten
- typiska upplevda symtom är bland annat viktökning, trötthet, humör- och minnessvårigheter, förstoppning och smärta «Perros P, Nagy EV, Papini E, ym. Hypothyroidism an...»118.
- utreder man om symtomen beror på någon annan odiagnostiserad eller obehandlad sjukdom
eller orsak (se tabell «Symtom på klinisk hypotyreos, fynd och differentialdiagnostik enligt organsystem.
Översatt och bearbetat från källa ....»5).
- Man bör misstänka att symtomen orsakas av andra faktorer än hypotyreos när symtomen har förekommit redan i diagnosskedet, men inte har korrigerats trots att tyroxinbehandlingen genomförts på adekvat sätt.
- Man bör aktivt utreda och behandla andra orsaker till symtomen även i situationer där patienten tidigare har mått bra under tyroxinbehandlingen men har börjat må sämre trots adekvat behandling.
- Andra orsaker kan vara:
- sömnlöshet, sömnstörningar och sömnapné
- brist på motion
- belastande livssituation (kroniskt stresstillstånd, utbrändhet, missbruksproblem)
- klimakterium
- metaboliska störningar (hyperkalcemi, hypokalcemi, fetma, elektrolytstörningar)
- depression, ångest, fibromyalgi, somatisering «Perros P, Nagy EV, Papini E, ym. Hypothyroidism an...»118
- kroniskt trötthetssyndrom eller följdtillstånd av virussjukdom
- annan endokrin sjukdom (odiagnostiserad diabetes, binjurebarkssvikt)
- annan autoimmun sjukdom (celiaki, typ 1-diabetes, Addisons sjukdom)
- hematologisk sjukdom (anemi, myelom)
- annan somatisk sjukdom (njur-, lever- eller hjärtsjukdom, polymyalgia rheumatica eller en annan kronisk inflammatorisk sjukdom)
- nutritionell orsak (B12-vitaminbrist, D-vitaminbrist, folatbrist, järnbrist)
- läkemedelseffekt (läkemedel som påverkar det centrala nervsystemet, betablockerare med hög dos, glukokortikoidbehandling).
- Efter en helhetsbedömning kan man överväga en kombinationsbehandling med LT4 + LT3. Behandlingen planeras av en endokrinolog eller en specialist i inremedicin med utbildning i behandling av sköldkörtelsjukdomar. Se avsnittet Kombinationsbehandling med tyroxin och liotyronin «A10»13.
Hypotyreosens och tyroxinbehandlingens inverkan på vikten
- Sköldkörtelhormonbehandling som syftar till att normalisera sköldkörtelvärdena korrigerar uppenbarligen inte övervikt vid hypotyreos «Kilpirauhasarvojen normaalistamiseen tähtäävä kilpirauhashormonihoito ei ilmeisesti korjaa ylipainoa kilpirauhasen vajaatoiminnassa.»B.
- Mekanismerna som påverkar ämnesomsättningens aktivitet och regleringen av aptiten och vikten är talrika och sköldkörtelhormonet är endast en delfaktor i det komplicerade systemet.
- Eftersom största delen av viktökningen vid obehandlad hypotyreos beror på att salt och vatten samlas i kroppen minskar tyroxinbehandlingen vikten något. Vikten återgår i allmänhet till den nivå som den låg på innan hypotyreosen utvecklades, om inte andra orsaker ökar den «Karmisholt J, Andersen S, Laurberg P. Weight loss ...»127. Om andra symtom på hypotyreos korrigeras med undantag av vikten är det mycket osannolikt att ett kontinuerligt viktproblem trots hypotyreosbehandlingen enbart har att göra med sköldkörteln.
- När hypotyreosen är i terapeutisk balans och TSH-värdet är inom referensområdet har personen samma förmåga att öka eller minska vikten som en person som inte har en funktionsstörning i sköldkörteln.
- När viktutvecklingen bedöms ska man beakta vikthistorien på längre sikt och andra faktorer som påverkar viktökningen, såsom förändringar i motion, stress och sömn. Om viktökningen har föregåtts av viktminskning, strävar de fysiologiska regleringsmekanismerna som påverkar viktregleringen till att öka vikten till minst föregående nivå.
- En överstor tyroxindos stimulerar ämnesomsättningen, men samtidigt förlorar patienten också muskelvävnad. Å andra sidan kan tyroxinet också öka vikten om aptiten ökar mer än energiförbrukningen. Eftersom iatrogen tyreotoxikos också orsakar ben- och hjärtskador rekommenderas denna inte för viktkontroll.
Icke evidensbaserade behandlingsformer
Kombinationsbehandling med tyroxin (T4) och liotyronin (T3)
- Kombinationsbehandling med syntetiskt levotyroxin (T4) och liotyronin (T3) (T4 + T3-kombinationsbehandling) för patienter med klinisk hypotyreos påverkar uppenbarligen inte livskvalitet, trötthet, depression, ångest eller smärta i högre grad än tyroxinmonoterapi «Synteettisen levotyroksiinin (T4) ja liotyroniinin (T3) yhdistelmähoidolla ei ilmeisesti ole vaikutusta kliinistä kilpirauhasen vajaatoimintaa sairastavien potilaiden elämänlaatuun, väsymykseen, masennukseen, ahdistuneisuuteen tai kipuun.»B.
- Efter 1990 har 13 internationella behandlingsrekommendationer för hypotyreos utarbetats. Av dessa gäller 3 gravida patienter, 2 barnpatienter och 8 vuxna patienter. I Europeiska sköldkörtelföreningens rekommendation från 2017 «Wiersinga WM, Duntas L, Fadeyev V, ym. 2012 ETA Gu...»128 och Storbritanniens sköldkörtelförenings rekommendation från 2015 «Kraut E, Farahani P. A Systematic Review of Clinic...»129 föreslås försök med T4 + T3 för patienter med klinisk hypotyreos med symtom trots att TSH-halten ligger inom referensområdet och för vilkas symtom man inte kan hitta en annan förklaring. Kombinationsbehandling med T4 + T3 rekommenderas inte för gravida och barnpatienter.
- Även om objektiv evidens på fördelarna med kombinationsbehandling jämfört med behandling med levotyroxin inte har påvisats i kontrollerade studier, ansåg 48 procent av patienterna enligt en metaanalys att kombinationsbehandling var bättre, 25 procent upplevde att T4-monoterapi var bättre och 27 procent observerade ingen skillnad mellan behandlingarna «Lan H, Wen J, Mao Y, ym. Combined T4 + T3 therapy ...»130.
- Eventuella biverkningar i samband med kombinationsbehandling utvecklas långsamt och är sällsynta. Biverkningarna accentueras hos äldre personer. De kontrollerade studier som hittills publicerats är för kortvariga för att på ett tillförlitligt sätt påvisa biverkningar eller säkerhet vid T4 + T3-behandling «Kraut E, Farahani P. A Systematic Review of Clinic...»129. Studiernas statistiska styrka räcker inte heller till för att bedöma hjärt- och kärlsäkerheten i behandlingen, eftersom antalet patienter i endast 6 studier var större än 50 och antalet patienter i den största metaanalysen var bara 883 «Leese GP, Soto-Pedre E, Donnelly LA. Liothyronine ...»131, «Tariq A, Wert Y, Cheriyath P, ym. Effects of Long-...»132.
- Enligt observationsstudier har incidensen för hjärt- och kärlsjukdomar inte ökat om TSH-halten har hållits inom referensområdet under kombinationsbehandlingen.
- Under de senaste åren har användningen av sköldkörtelextrakt av animaliskt ursprung och syntetiska T4 + T3-kombinationspreparat ökat betydligt i västländerna. År 2021 beviljades 2 353 specialtillstånd för syntetiska T3-preparat och 741 specialtillstånd för specialpreparat av animaliskt ursprung i Finland.
- Det behövs mer information om patienter som lämpar sig för kombinationsbehandling och sannolikt har nytta av den «Tyroksiinin (LT4) ja liotyroniinin (LT3) yhdistelmähoitokokeilun tausta ja tarvittavat lisätutkimukset»11.
Kombinationsbehandlingens kostnader
- Syntetiska liotyronin-(T3)-preparat som är tillgängliga i Finland med specialtillstånd är cirka 20 gånger så dyra som syntetiska T4-preparat med försäljningstillstånd. Vid användning av preparat med specialtillstånd uppstår förutom läkemedelskostnader även andra tilläggskostnader, eftersom det behövs tätare laboratorieprovsuppföljning och man i uppföljningen utöver TSH-halten måste bestämma också T4-V- och T3-V-halterna.
- Dessutom medför förnyandet av specialtillståndet årligen merkostnader för både hälso- och sjukvården och patienten.
- Eftersom kombinationsbehandling blir dyrare än T4-behandling för patienten, bör man med patienten gå igenom kostnaderna och specialtillståndsförfarandet i anslutning till medicineringen innan kombinationsbehandlingen inleds.
Patienter som lämpar sig för kombinationsbehandling
- Om patienten har korrekt diagnostiserad klinisk hypotyreos och symtom trots att TSH-halten befinner sig inom referensområdet, kartläggs först eventuella andra problem, vars behandling kan påverka symtomen gynnsamt. Se tabell «Symtom på klinisk hypotyreos, fynd och differentialdiagnostik enligt organsystem. Översatt och bearbetat från källa ....»5 och avsnittet Symtomen fortsätter trots målenlig TSH-halt «A11»14.
- Innan patienten remitteras för bedömning av kombinationsbehandling
- kontrollerar man att patienten har primär klinisk hypotyreos och att etiologin för
hypotyreosen är sådan att den leder till bestående och betydande sköldkörtelhormonbrist
- Kombinationsbehandlingen är sannolikt inte till nytta om patienten har bibehållen egen produktion av sköldkörtelhormon «DiStefano J 3rd, Jonklaas J. Predicting Optimal Co...»133, «Jonklaas J, Bianco AC, Cappola AR, ym. Evidence-Ba...»134.
- kontrollerar man att tyroxinbehandlingen genomförs korrekt
- dokumenterar man de symtom som stör patienten
- utreder man om symtomen beror på någon annan odiagnostiserad eller obehandlad sjukdom, annan medicinering, en belastande livssituation eller klimakteriet
- säkerställer man att patienten inte har kontraindikationer för kombinationsbehandling (graviditet eller graviditetsönskemål, arytmibenägenhet, svår ångest, hjärt- och kärlsjukdom).
- kontrollerar man att patienten har primär klinisk hypotyreos och att etiologin för
hypotyreosen är sådan att den leder till bestående och betydande sköldkörtelhormonbrist
- Det finns inte tillräckligt med information om genetisk testning (DIO2-polymorfitest) i bedömningen av behovet för kombinationsbehandling, ytterligare studier är nödvändiga «Dijodinaasientsyymien polymorfismien käyttö kilpirauhasen vajaatoiminnan korvaushoidon ohjaamisessa»12.
- T3-V-halten eller T4-V/T3-V-förhållandet förutspår inte terapisvaret för kombinationsbehandling «DiStefano J 3rd, Jonklaas J. Predicting Optimal Co...»133.
- Särdragen i patientens symtom förutspår inte terapisvaret.
Genomförande av kombinationsbehandling
- Vi rekommenderar att en endokrinolog eller en specialist i inremedicin med utbildning i behandling av sköldkörtelsjukdomar planerar eller inleder kombinationsbehandling med LT4 + LT3 efter en individuell helhetsbedömning «Karmisholt J, Andersen S, Laurberg P. Weight loss ...»127. Se avsnittet Nivåstrukturerad behandling «A12»15.
- En läkare inom primärvården kan fortsätta en behandling som inletts inom specialsjukvården eller som inletts enligt konsultationsföreskrifter från specialsjukvården.
- Målsättningen med behandlingen är att hålla TSH-halten inom referensområdet. T3-V-halten får inte överskrida den övre gränsen för referensområdet «Synteettisen levotyroksiinin (T4) ja liotyroniinin (T3) yhdistelmähoidolla ei ilmeisesti ole vaikutusta kliinistä kilpirauhasen vajaatoimintaa sairastavien potilaiden elämänlaatuun, väsymykseen, masennukseen, ahdistuneisuuteen tai kipuun.»B.
- Innan behandlingen inleds bör man med patienten diskutera behandlingens målsättning och tidtabellen för bedömningen av responsen, adherens- och säkerhetssynpunkter, specialtillståndsförfarandet i anslutning till medicineringen samt behandlingskostnaderna.
- Kombinationsbehandlingen ska genomföras på ett säkert sätt och patienterna ska följas
upp omsorgsfullt med tanke på risk-nyttabalansen.
- Behandling med alltför stora doser har orsakat farliga biverkningar som har försämrat förtroendet för behandlingens säkerhet «Yi W, Kim BH, Kim M, ym. Heart Failure and Stroke ...»135, «Khan W, Van Der Gugten G, Holmes DT. Thyrotoxicosi...»136.
- Hjärt- och kärlbiverkningar har inte konstaterats i kortvariga kontrollerade studier där kombinationsbehandlingen i regel har genomförts med små dygnsdoser på 5–15 μg liotyronin och TSH-halten har hållits inom referensområdet «Lan H, Wen J, Mao Y, ym. Combined T4 + T3 therapy ...»130.
- I de längsta observationsstudierna där man undersökt kombinationsbehandling har TSH-halten hållits inom referensområdet och då har biverkningar inte förekommit «Lan H, Wen J, Mao Y, ym. Combined T4 + T3 therapy ...»130, «Tariq A, Wert Y, Cheriyath P, ym. Effects of Long-...»132.
Bedömning av inledningsdosen för kombinationsbehandling
- Vid behandlingen rekommenderas att man använder ett syntetiskt LT3-preparat, som är ett läkemedel med specialtillstånd.
- Enligt läkemedelslagen kan Fimea av särskilda sjukvårdsskäl bevilja tillstånd att överlåta ett sådant läkemedelspreparat som inte har försäljningstillstånd i Finland till förbrukning. Beviljandet av Fimeas specialtillstånd uttrycker inte att myndigheten skulle ha bedömt läkemedelsbehandlingen vara nödvändig, effektiv eller säker för en enskild patient, utan läkaren ansvarar för läkemedelsbehandlingen och ansvaret betonas när hen ordinerar preparat med specialtillstånd.
- Specialtillstånd för T3-preparatet söks med ett års mellanrum. Utöver ansökan om specialtillstånd skrivs ett skriftligt recept ut till patienten för samma T3-preparat och -dos. Patienten skickar tillsammans med apoteket ett skriftligt recept som bilaga till ansökan om specialtillstånd till Fimea.
- En behandlingsform som kräver specialtillstånd förutsätter kompetens och erfarenhet för att beräkna behandlingsdoserna.
- Förhållandet mellan tyroxin (T4) och liotyronin (T3) bör motsvara förhållandet i utsöndringen av tyroxin och liotyronin i människan sköldkörtel (13:1–16:1), och vid beräkningen av doserna bör man beakta att liotyroninets effekt per mikrogram är 3–4 gånger större än för tyroxin «Wiersinga WM, Duntas L, Fadeyev V, ym. 2012 ETA Gu...»128.
- Den lämpliga dosen bestäms utgående från den tidigare optimala tyroxindosen (med TSH-värdet inom referensområdet).
- Dygnsdoserna för T3 ska vara små (5–15 μg/dygn), och dygnsdosen ska indelas i 2–3 doser «Lan H, Wen J, Mao Y, ym. Combined T4 + T3 therapy ...»130, «Leese GP, Soto-Pedre E, Donnelly LA. Liothyronine ...»131.
- Doseringen av T4 och T3 i förhållandet 10:1–20:1 bedöms leda till en fysiologisk vävnadshalt.
- Farmakokinetiska studier ger vid handen att man med en T3-dos på 0,07 μg/kg två gånger
per dag i kombination med tyroxin uppnår en relativt jämn T3-halt «Khan W, Van Der Gugten G, Holmes DT. Thyrotoxicosi...»136.
- Utgående från detta är T3-dosen för en vuxen som väger 70 kg 5 μg x 2.
- I tabell «Kombinationsbehandlingsdoser som planerats enligt tyroxindosen....»10 finns exempel på T4- och T3-doser vid fysiologisk kombinationsbehandling i proportion till tyroxinbehandlingsdoserna «Wiersinga WM, Duntas L, Fadeyev V, ym. 2012 ETA Gu...»128.
- Liotyronin finns att tillgå med dosstyrkorna 5 μg och 20 μg.
| Nuvarande T4-dos μg/dygn | Fysiologisk kombinationsbehandling med LT4- och LT3-preparat (förhållande 13:1–16:1) |
|
| T4 µg | T3 µg | |
| 75–100 | 50–75 | 2,5 µg x 2 |
| 112–137 | 88–112 | 2,5 µg x 3 eller 5 µg + 2,5 µg |
| 150–175 | 112–137 | 5 µg x 2 |
| 200–250 | 150–200 | 7,5 µg + 5 |
Uppföljning av en kombinationsbehandling
- I början av behandlingen dokumenteras de störande symtom som patienten förknippar med hypotyreosen «Ross DS. Treatment of primary hypothyroidism in ad...»89.
- I uppföljningen av behandlingen bedöms behandlingens effekt särskilt på de symtom som man ville korrigera samt på eventuella biverkningar «Jonklaas J. Optimal Thyroid Hormone Replacement. E...»95.
- Den viktigaste uppföljningsparametern är TSH-halten, som man rekommenderar att ska ligga inom referensområdet.
- T4-V- och T3-halterna ger inte nödvändigtvis en riktig bild av hur substitutionsbehandlingen
lyckats.
- Med beaktande av den kliniska helhetssituationen kan T4-V- och T3-V-halterna bestämmas i synnerhet om TSH-halten sjunker under 0,1 mU/l.
- T4-V-halten kan vara låg om LT4/LT3-förhållandet är ofysiologiskt T3-dominerat.
- T3-V-halterna är också mycket varierande på grund av den snabba absorptionen av LT3 och den korta halveringstiden.
- T3-V-halten kan vara i referensområdets övre del 3–4 timmar efter tablettintaget och låg före nästa dos. T3-V-halten får inte överskrida den övre gränsen för referensområdet.
- Titrering av kombinationsbehandling
- TSH-halten kontrolleras 6–8 veckor efter att behandlingen inletts.
- Dosförändringar enligt TSH-halten:
- Om TSH-halten är något förhöjd, ökas mängden tyroxin 12,5–13 μg.
- Om TSH-halten överstiger 10 mU/l kan både T3- och T4-dosen ökas med bibehållande av förhållandet 13:1–16:1.
- Om TSH-halten är inom referensområdet, fortsätter man med samma dos
- Om TSH-halten ligger under den nedre gränsen för referensområdet men är mätbar och förhållandet är cirka 13:1, minskas T3-dosen med 2,5 μg. Hos yngre personer med förhållandet cirka 16:1 minskas T4-dosen 12,5–13 μg.
- Efter 6 månader bedöms behandlingens risk-nyttabalans. Om kombinationsbehandlingen inte korrigerar de symtom som antecknats innan behandlingen inleddes, återgår man till T4-behandlingen.
- Om diagnosen klinisk hypotyreos är säker, kontraindikationer saknas, kombinationsbehandlingen genomförs säkert utan biverkningar och TSH-värdet hålls inom referensområdet, kan behandlingen fortsätta med beaktande av att det är fråga om en behandlingsform som kräver specialtillstånd och där läkaren har ett särskilt ansvar för behandlingens säkerhet. För detta behövs i regel en intensivare klinisk uppföljning och laboratorieprovsuppföljning än vid T4-monoterapi.
- Vid uppföljningen ska man på nytt bedöma om behandlingsresultatet bibehållits och om man bör återgå till T4-behandlingen vid ett förlorat terapisvar.
- Det är viktigt att patienterna inte genomför T3-behandlingen på egen hand baserat på subjektiva upplevelser, utan att eventuella dosändringarna grundar sig på resultaten från laboratorieproverna.
- I uppföljningen beaktas också kontraindikationer och eventuella symtom på hjärt- och kärlsjukdomar som ökar risken för biverkningar samt humörförändringar och skelettproblem. I det etablerade skedet följs patienten upp på mottagningen med 12 månaders mellanrum: anamnes, klinisk undersökning, blodprov och vid behov EKG.
- Om patienten har önskemål om graviditet bör man övergå till tyroxinbehandling i tid «Metso S, Hakala T, Attanasio R ym. Kilpirauhashorm...»11.
Byte av kombinationsbehandling mot tyroxinbehandling
- Att byta ut kombinationsbehandlingen till en säkrare tyroxinmonoterapi rekommenderas särskilt om det förekommer problem med genomförandet av kombinationsbehandlingen, om nyttan av behandlingen är osäker eller om det finns kontraindikationer för behandlingen. Vid behov kan man konsultera en endokrinolog eller en specialist i inremedicin med utbildning i behandling av sköldkörtelsjukdomar.
- Om man rekommenderar att kombinationsbehandlingen fortsätter bör det finnas grunder för detta och säkerheten vid kombinationsbehandlingen ska kunna påvisas när specialtillståndet för T3-preparatet förnyas.
- Om behandlingen tidigare har genomförts inom den privata sektorn eller självständigt av patienten är en allmänläkare inom primärvården inte skyldig att förnya recept eller genomföra en behandling som allmänläkaren inte är insatt i och som är potentiellt skadlig, särskilt om diagnosen och de vårdindikationer som fastställts i denna rekommendation inte uppfylls.
- T3 är cirka 3–4 gånger starkare än tyroxin. Vid övergång t.ex. från kombinationen liotyronin 10 μg + tyroxin 50 μg till tyroxinmonoterapi är den lämpliga tyroxindosen 80–100 μg. Vid valet av dos bör man beakta TSH-halten, åldern, symtomen och målsättningen för behandlingen.
- Kombinationsbehandlingen kan också trappas ned stegvis genom att öka mängden tyroxin. TSH-halten följs samtidigt med 6–12 veckors mellanrum.
- Om liotyroninbehandlingen har medfört biverkningar kan behandlingen avslutas genast utan att dosen minskas stegvis.
- Om patienten använder endast en liten dos liotyronin en gång per dag kan detta tyda på placeboeffekt och tala för möjligheten att återgå till tyroxinmonoterapi.
Animaliska preparat (dessicated thyroid extract, DTE)
- Inledning av behandling med animaliska preparat rekommenderas inte, eftersom det är svårt att titrera och monitorera medicineringen. Preparatens effekt och säkerhet bör följas upp med kliniska undersökningar och laboratorieprov oftare än vid T4-monoterapibehandling.
- Problemet med preparaten är ett för människan ofysiologiskt T4/T3-hormonförhållande och att det är svårare att reglera doserna jämfört med syntetiska preparat.
- På grund av den högre T3-koncentrationen är det svårare att uppnå det fysiologiska förhållandet och behandlingen leder lätt till en situation där TSH-värdet är lågt, T4-V-värdet har minskat och T3-V-värdet varierar «Wiersinga WM, Duntas L, Fadeyev V, ym. 2012 ETA Gu...»128.
- Behandlingen kräver specialtillstånd.
- Absoluta kontraindikationer är
- graviditet eller önskan om graviditet
- arytmibenägenhet
- svår ångest
- hjärt- och kärlsjukdom.
- Om diagnosen klinisk hypotyreos är säker, kontraindikationer saknas, behandlingen har genomförts säkert utan biverkningar och TSH-värdet ligger inom referensområdet, kan behandlingen enligt noggrann individuell prövning fortsätta med beaktande av att det är fråga om en behandling som kräver specialtillstånd och där läkaren har ett särskilt ansvar för behandlingens säkerhet och för tillräcklig uppföljning.
- Utbyte av animaliskt preparat mot T4:
- Vid övergång från en dos på 60 mg dos animaliskt sköldkörtelextrakt till tyroxin är startdosen för tyroxin 100 μg.
- Vid övergång från en dos på 90 mg animaliskt preparat till tyroxin är startdosen för tyroxin 112–150 μg.
T3-monoterapi
- T3-monoterapi rekommenderas inte för behandling av hypotyreos, eftersom risken för tyreotoxikos är stor, läkemedels- och uppföljningskostnaderna är högre än vid normal tyroxinbehandling, behandlingen är ofysiologisk och behandlingsformen har undersökts bristfälligt.
- T4 är ett T3-prohormon som konverteras till T3. T3 binds till cellernas sköldkörtelhormonreceptorer, vilket leder till biologiska effekter i sköldkörtelhormonerna.
- Halveringstiden för T3 är enligt olika undersökningar 6–22 timmar «Saberi M, Utiger RD. Serum thyroid hormone and thy...»138, «Nicoloff JT, Low JC, Dussault JH, ym. Simultaneous...»139. Halveringstiden är således betydligt kortare än halveringstiden på cirka 7 dygn för T4.
- Den korta halveringstiden för T3 leder lätt till stora variationer i plasmahalten.
- För att uppnå en något jämnare T3-halt borde man i T3-monoterapi dosera preparatet flera gånger per dygn.
- Det finns endast begränsad information gällande monoterapi med T3-hormonpreparat för
hypotyreos.
- I en randomiserad och dubbelblind studie av 14 patienter var det svårt att uppnå eutyreos, och det tog i medeltal 180 dagar innan man uppnådde eutyreos.
- I en 6 veckors studie jämfördes monoterapibehandling med liotyronin och tyroxin «Celi FS, Zemskova M, Linderman JD, ym. Metabolic e...»140. Den genomsnittliga dosen liotyronin var 0,57 ± 0,08 μg/kg/dygn och tyroxindosen 1,68 ± 0,33 μg/kg/dygn (förhållande 1:3). Dygnsdosen av liotyronin fördelades i tre doser. TSH-värdet hölls inom referensområdet i båda grupperna. Ingen skillnad observerades mellan grupperna i fråga om livskvalitet, glukosomsättning eller biverkningar. Vikten hos dem som använde liotyronin minskade i genomsnitt med 2,1 kg och LDL-kolesterolet med 13,3 procent jämfört med dem som använde tyroxin.
- I anslutning till T3-monoterapi har allvarliga biverkningar som lett till sjukhusvård beskrivits «Yi W, Kim BH, Kim M, ym. Heart Failure and Stroke ...»135, «Khan W, Van Der Gugten G, Holmes DT. Thyrotoxicosi...»136.
- Absoluta kontraindikationer för T3-monoterapi är
- graviditet eller önskan om graviditet
- arytmibenägenhet
- svår ångest
- hjärt- och kärlsjukdom.
Nivåstrukturerad vård
- Diagnostiken och behandlingen av primär hypotyreos med tyroxin är i allmänhet rätlinjig
och genomförs i huvudsak inom primärvården, företagshälsovården eller den privata
sektorn.
- Beslutet om att inleda behandlingen ska grunda sig på adekvat laboratoriediagnostik. Grunden för behandlingen och målet för TSH ska dokumenteras.
- Behandlingen av hypotyreos hos barn inleds under handledning av en specialist i barnsjukdomar, se avsnittet Barn «A2»4.
- Patienter med sköldkörtelcancer vårdas i början inom specialsjukvården, se avsnittet Patienter med sköldkörtelcancer «A7»10.
- Diagnostik av central hypotyreos och inledande av behandling för patienter i alla åldrar genomförs inom specialsjukvården, se avsnittet Central hypotyreos «A1»3.
- Hypotyreos hos gravida kvinnor behandlas inom primärvården, vid behov genom konsultation av specialsjukvården, se avsnittet Graviditet «A4»7.
- Möjliga indikationer för konsultation av eller remiss till specialsjukvården är följande:
- Resultaten av sköldkörtelproverna är motstridiga, se avsnittet Utredning av atypiska sköldkörtelvärden «A6»9.
- Misstanke om central hypotyreos, se avsnittet Central hypotyreos «A1»3
- Svårigheter att genomföra sköldkörtelhormonbehandlingen
- Bedömning av behovet för kombinationsbehandling
- Patienter med sköldkörtelcancer som följs upp inom primärvården och vars TSH-halt
är under 0,1 enligt föråldrad vårdpraxis, se avsnittet Patienter med sköldkörtelcancer
«A7»10.
- Tyroxindosen hos sköldkörtelcancerpatienter som följs upp inom specialsjukvården ska inte ändras utan konsultation.
- Välfärdsområdena är skyldiga att säkerställa att de regionala vårdkedjorna och vårdpraxisen fungerar samt att sörja för utbildning, anvisningar och fungerande konsultationstjänster. Rekommendationerna om nivåstrukturering av vården är allmänna riktlinjer och de kan anpassas lokalt.
- Bedömningen av vårdbehovet och uppföljningen av vården kan genomföras på läkarens
eller sjukskötarens mottagning, på en videomottagning, per telefon eller elektroniskt
enligt patientens vårdbehov på ett patientorienterat sätt.
- Man rekommenderar att följa upp personer med symtom på läkarmottagningen.
- I sjukskötarens kontroller kan man följa upp patienter vars TSH-halt har uppnått den terapeutiska balansen och som inte har fått nya symtom.
- I det inledande skedet och vid övergången till sjukskötaruppföljning bör patienten informeras väl om behandlingen av hypotyreos, målsättningen och behandlingens inverkan på symtombilden samt behovet av utredning av differentialdiagnostiska alternativ och behandlingsbehovet, se avsnittet Symtomen fortsätter trots målenlig TSH-halt «A11»14, «Perros P, Hegedüs L, Nagy EV, ym. The Impact of Hy...»117.
- I samband med att distansuppföljning blir allt vanligare bör man vid uppföljningen av hypotyreos fästa särskild uppmärksamhet vid patienter som inte mår bra, även om TSH-värdet ligger inom referensområdet. För att utreda orsakerna till dessa patienters symtom och för att planera behandlingen behövs oftast besök på en läkarmottagning.
- Planen för behandlingen av hypotyreos kan dokumenteras i mellanbladet för specialitet
i patientjournalen eller i hälso- och vårdplanen. I planen dokumenteras vårdbehovet,
målsättningen, genomförandet och metoderna samt nödvändigt stöd, arbetsfördelning,
bedömning av vården, uppföljning och medicinering enligt vad som är väsentligt för
vården av respektive patient «Terveydenhuoltolaki 30.12.2010/1326. §24. https://...»141, «Laki potilaan asemasta ja oikeuksista 17.8.1992/78...»142.
- Vårdplanen kan också utarbetas och förverkligas på sjukskötarens eller hälsovårdarens mottagning, men läkaren ställer diagnosen, ordinerar läkemedelsbehandlingen samt besluter om uppföljningsfrekvensen.
- Eftersom man har konstaterat en ökad risk för sjukfrånvaro och sjukpension hos hypotyreospatienter är det viktigt att följa upp och stödja arbetsförmågan. Det är skäl att hänvisa en arbetande patient till företagshälsovården när hypotyreosdiagnosen ställs (se God medicinsk praxis-rekommendationen Bedömning av behovet av sjukfrånvaro «Bedömning av behovet av sjukfrånvaro»5, «Sairauspoissaolon tarpeen arviointi. Käypä hoito -...»123).
Nivåstrukturering av vården vid användningen av T3-preparat
- Alla gravida eller patienter som planerar en graviditet och som använder T3-monoterapi, animaliska sköldkörtelläkemedel eller kombinationsbehandling bör remitteras till specialsjukvärden (gravida som brådskande).
- Gällande T3-monoterapi, animaliska sköldkörtelläkemedel eller kombinationsbehandling
rekommenderas att en endokrinolog eller en specialist i inremedicin som fått utbildning
i behandling av sköldkörtelsjukdomar vid behov bedömer behandlingens säkerhet och
behov.
- Om behandlingen tidigare har genomförts inom den privata sektorn i överstora doser (TSH-halten låg), kan man vid behov utfärda en remiss till en endokrinologkonsultation, om patienten är villig att ändra behandlingen så att den blir säkrare och följer rekommendationerna.
- Om T3-monoterapi, sköldkörtelpreparat av animaliskt ursprung eller kombinationsbehandling har genomförts tidigare inom den privata sektorn eller på eget bevåg, är en läkare inom primärvården inte skyldig att förnya recept eller genomföra behandlingar utan att patienten förbinder sig till ett säkert genomförande av behandlingen.
- En läkare inom primärvården kan fortsätta en kombinationsbehandling som godkänts eller inletts på basis av konsultation eller bedömning inom specialissjukvården, under förutsättning att behandlingen har bedömts vara ändamålsenlig och säker, att uppföljningsanvisningarna är tillräckliga och att patienten förbinder sig till vårdplanen.
Graviditet
Sköldkörtelvärden under graviditet
- Hos friska personer anpassas sköldkörtelns funktion utan problem till de fysiologiska förändringar som graviditeten orsakar.
- Om modern har en latent eller uppenbar sköldkörtelsjukdom, kan avvikelser i sköldkörtelfunktionen uppkomma eller framhävas under graviditeten.
- Graviditeten påverkar sköldkörtelfunktionen på följande sätt:
- Halten av tyroxinbindande globulin (TBG) ökar.
- Produktionen av sköldkörtelhormoner ökar.
- Jodförlusten i urinen ökar, vilket ökar jodbehovet.
- Sköldkörtelns storlek växer med cirka 10 procent om jodintaget är tillräckligt och betydligt mer om jodintaget är för litet i proportion till graviditetsbehoven.
- På grund av koriongonadotropinets (hCG) inverkan minskar TSH-halten och T4-V-halten
ökar i början av graviditeten.
- Hos 15 procent sjunker TSH-värdet under den nedre gränsen för referensområdet i början av graviditeten.
- Den överfunktion som hCG orsakar är i allmänhet lindrig och ger få symtom och korrigeras eller lindras spontant under den andra och tredje trimestern.
- Efter den tidiga graviditeten ökar TSH-halten, men förblir lägre än före graviditeten.
- Under graviditeten skulle det vara optimalt att använda populations- och graviditetstrimesterspecifika referensvärden för TSH. Problemet är att de referensvärden för sköldkörtelhormoner som publicerats i litteraturen varierar kraftigt beroende på den undersökta graviditetspopulationen och vilken analysmetod som använts «Alexander EK, Pearce EN, Brent GA, ym. 2017 Guidel...»143, «Osinga JAJ, Derakhshan A, Feldt-Rasmussen U, ym. T...»144. I Finland har laboratorierna inte heller uppgett trimesterspecifika referensvärden för de laboratoriemetoder som används.
- T4-V-halten kontrolleras under graviditeten endast när TSH-värdet är avvikande (under 0,3 mU/l eller över 3,9 mU/l)
- Under graviditeten är många immunologiska analysmetoder som allmänt används i kliniska
laboratorier för fritt tyroxin opålitliga vid bedömning av T4-V-halten «De Groot L, Abalovich M, Alexander EK, ym. Managem...»145, «Lee RH, Spencer CA, Mestman JH, ym. Free T4 immuno...»146.
- Detta beror på den ökade halten av tyroxinets bärarprotein under graviditeten, en
större plasmavolym och hemodilution «Aguree S, Gernand AD. Plasma volume expansion acro...»147 samt en lägre albuminhalt. Förändringarna påverkar hur fritt tyroxin binds till transportproteiner
och stör immunologiska metoder för fria hormoner.
- Minskningen av T4-V-halten under graviditeten är metodspecifik.
- De analysmetoder som baserar sig på en balanserad dialys eller ultrafiltration och
känslig vätskekromatografi-masspektrometri är mer tillförlitliga än automatiserade
immunologiska bestämningar av fritt tyroxin, men de är dyra (dialyserad T4-V-bestämning,
T4-Vdi, KL 6160).
- T4-Vdi-halten minskar med cirka 10 procent under graviditeten.
- Detta beror på den ökade halten av tyroxinets bärarprotein under graviditeten, en
större plasmavolym och hemodilution «Aguree S, Gernand AD. Plasma volume expansion acro...»147 samt en lägre albuminhalt. Förändringarna påverkar hur fritt tyroxin binds till transportproteiner
och stör immunologiska metoder för fria hormoner.
- Särskilt under graviditetens sista trimester kan T4-V-värdet underskrida den nedre
gränsen för referensområdet för friska vuxna «De Groot L, Abalovich M, Alexander EK, ym. Managem...»145.
- Detta fysiologiska tillstånd i samband med graviditeten påminner om central hypotyreos och kan orsaka tolkningsproblem, eftersom man i Finland inte separat har fastställt referensintervall för gravida kvinnor.
- Tyroxinbehandling har inte visat sig vara till nytta vid isolerad hypotyroxinemi under graviditeten och tyroxinbehandling rekommenderas inte enbart på grund av ett lågt T4-V-värde.
- Fostret börjar producera sköldkörtelhormoner efter den första trimestern och är därför inte så beroende av mammans T4-V-halt efter mitten av graviditeten.
- Central hypotyreos är sällsynt.
- Isolerad hypotyroxinemi är oftast förknippad med graviditet och sköldkörtelvärdena normaliseras efter graviditeten.
Kontroll och uppföljning av sköldkörtelvärden under graviditeten
- TSH-screening rekommenderas inte för alla gravida kvinnor.
- TSH-screening under graviditeten riktas till riskgrupper (se tabell «Specialgrupper för vilka man bör överväga screening eller uteslutande av hypotyreos också hos symtomfria personer....»7) samt patienter som tidigare haft störningar i sköldkörtelfunktionen.
- TSH-halten kontrolleras också om man utgående från symtom eller det kliniska tillståndet misstänker hypotyreos eller hypertyreos.
- Under graviditeten rekommenderas uppföljning av enbart TSH-värdet på grund av tolkningsproblemen förknippade med T4-V-bestämningen.
- Om patienten tidigare har haft Basedows sjukdom, kontrolleras TSHRAb.
- Om tyroxin inte används före graviditeten «De Groot L, Abalovich M, Alexander EK, ym. Managem...»145 och TSH-värdet är
- < 0,3 nmol/l, kontrolleras TSH-, T4-V-, T3-V- och TSHRAb-halterna
- Om T4-V- och T3-V-halterna är inom referensområdet är det fråga om subklinisk hypertyreos.
- Om T4-V- eller T3-V-halterna överskrider den övre gränsen för referensområdet är det fråga om klinisk hypertyreos.
- Om TSHRAb-halten överskrider den övre gränsen för referensområdet är det sannolikt fråga om Basedows sjukdom.
- Om TSHRAb-halten inte överskrider den övre gränsen för referensområdet är det sannolikt fråga om hypertyreos i samband med den tidiga graviditeten, som ofta är förknippad med graviditetsillamående, eller hypertyreos som beror på någon annan orsak.
- ≥ 4,0 mU/l, kontrolleras TSH- och T4-V-halterna
- Om T4-V-halten är inom referensområdet är det fråga om subklinisk hypotyreos.
- Om T4-V-halten ligger under den nedre gränsen för referensområdet är det fråga om klinisk hypotyreos.
- 2,5–3,9 mU/l, kontrolleras TPOAb-halten en gång (se avsnittet Om TSH-halten är on 2,5–3,9 mU/l «A13»16).
- < 0,3 nmol/l, kontrolleras TSH-, T4-V-, T3-V- och TSHRAb-halterna
Subklinisk hypotyreos och sköldkörtelantikroppar under graviditeten
- Om TSH-halten är 4,0–9,9 mU/l och T4-V-värdet är inom referensområdet, inleds tyroxin
under graviditeten. Se bild «Tyroksiinihoidon tarpeen arviointi raskaana olevilla naisilla, joilla ei ole ollut tyroksiinia käytössä ennen raskautta»8, «hoi50133d.pdf»4 (PDF).
- Startdos 0,75–1,0 μg/kg x 1
- TSH-målet är < 2,5 mU/l under den första trimestern och därefter under graviditeten < 3,0 mU/l oberoende av TPOAb-halten
- TSH-värdet 4,0–9,9 mU/l under graviditeten innebär redan ökad risk för missfall och prematur förlossning och sämre neuropsykisk utveckling hos fostret «De Groot L, Abalovich M, Alexander EK, ym. Managem...»145.
- Om TSH-halten är 2,5–3,9 mU/l under den första trimestern eller 3,0–4,0 mU/l under
den andra och tredje trimestern rekommenderas att TPOAb-värdet kontrolleras en gång.
- Om TPOAb-halten är förhöjd rekommenderas att tyroxin inleds (startdos 25 μg x 1).
- Behandlingsmålet är TSH < 2,5 mU/l under den första trimestern och < 3,0 mU/l därefter.
- TPOAb-positivitet kan konstateras hos cirka 2–17 procent av gravida kvinnor.
- Om TPOAb-värdet är förhöjt är det mer sannolikt att en klinisk hypotyreos utvecklas, eftersom sköldkörtelns förmåga att öka produktionen av sköldkörtelhormoner under graviditeten är nedsatt.
- Evidensen är inte entydig, men tyroxinbehandling kan minska graviditetskomplikationerna och ha en positiv inverkan på fostrets neuropsykiska utveckling om TSH-halten är 2,5–3,9 mU och TPOAb-halten är förhöjd «De Groot L, Abalovich M, Alexander EK, ym. Managem...»145, «Osinga JAJ, Derakhshan A, Feldt-Rasmussen U, ym. T...»144.
- Om TPOAb-värdet ligger inom referensområdet behövs ingen tyroxinbehandling och inte heller någon rutinmässig uppföljning under graviditeten.
- Uppföljningen är selektivt nödvändig för vissa riskgrupper till exempel om sköldkörteln tidigare har opererats eller radiojodbehandlats eller patienten har exponerats för jod till exempel med kontrastmedel.
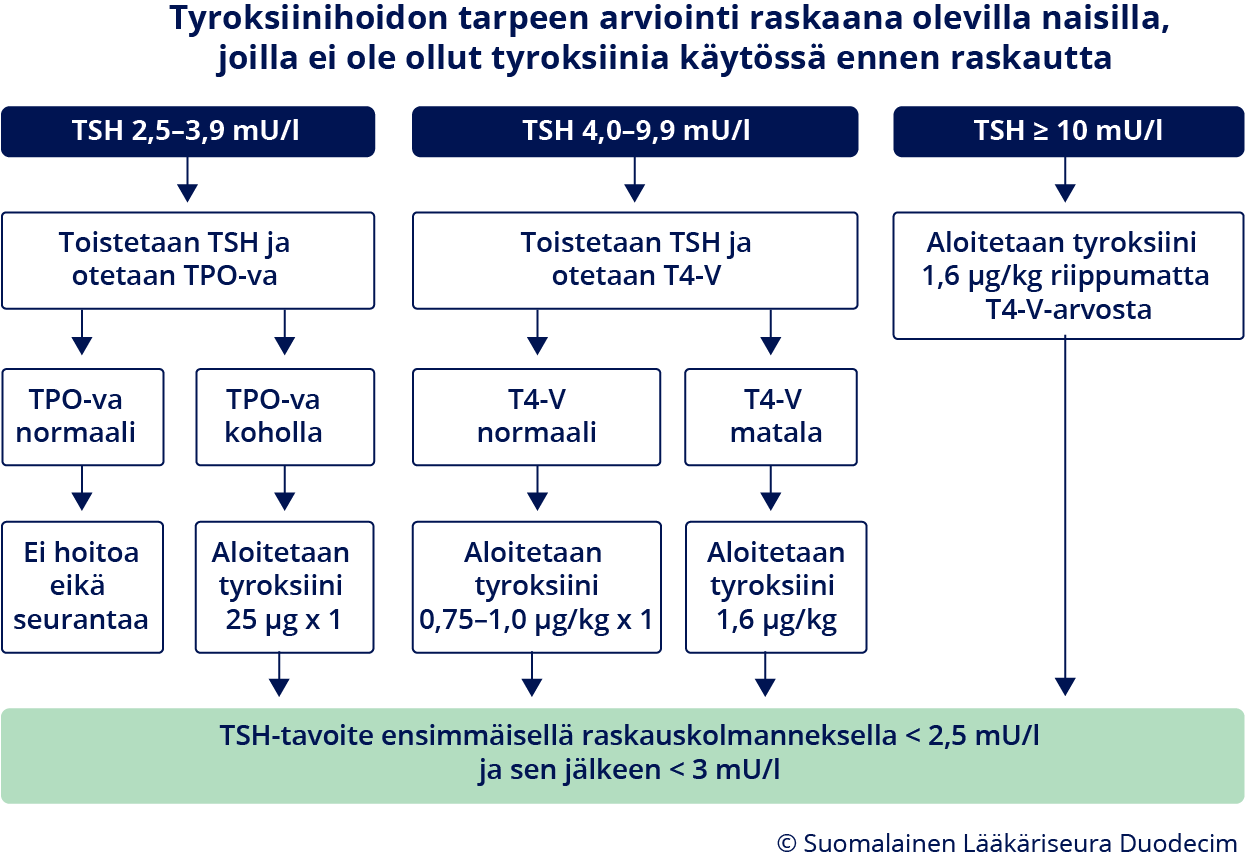
Tyroksiinihoidon tarpeen arviointi raskaana olevilla naisilla, joilla ei ole ollut tyroksiinia käytössä ennen raskautta. Avaa kaavion PDF-versio tästä linkistä «hoi50133d.pdf»4.
Klinisk hypotyreos som konstaterats under graviditeten
- Om TSH ≥ 10 mU/l oberoende av T4-V-halten eller TSH är 4,0–9,9 mU/l och T4-V-halten är under den nedre gränsen för referensområdet inleds tyroxin (startdos 1,6 µg/kg). Se bild «Tyroksiinihoidon tarpeen arviointi raskaana olevilla naisilla, joilla ei ole ollut tyroksiinia käytössä ennen raskautta»8, «hoi50133d.pdf»4 (PDF)
- TSH-målet är < 2,5 mU/l under den första trimestern och < 3,0 mU/l därefter oberoende
av TPOAb-halten.
- Obehandlad klinisk hypotyreos är förknippad med bland annat ökad risk för missfall, prematur förlossning och en sämre neuropsykisk utveckling hos fostret «De Groot L, Abalovich M, Alexander EK, ym. Managem...»145.
Hypotyreos som konstaterats före graviditeten
- Om patienten har hypotyreos och får tyroxinbehandling
- justerar man genom tyroxindoseringen TSH-värdet till målet för graviditeten (TSH < 2,5 mU/l) redan i planeringsskedet av graviditeten.
- instrueras patienten att öka tyroxindosen med cirka 30 procent genast när hon vet att hon är gravid.
- TSH-värdet kontrolleras i samband med det första rådgivningsbesöket och vid behov ändras tyroxindosen.
- Om tyroxin har använts redan före graviditeten eller om det inleds under graviditeten, kontrolleras TSH-halten med 4 veckors mellanrum fram till graviditetsvecka 20 och tyroxindosen justeras vid behov.
- När tyroxindosen är stabiliserad och TSH-värdet är inom målet (< 2,5 mmol/l under första trimestern och < 3,0 mmol/l därefter), räcker det med att bestämma TSH-halten och vid behov justera tyroxindosen nära graviditetsvecka 30.
Kontroll av sköldkörtelvärden efter förlossningen
- Om patientens hypotyreos behandlades med tyroxin redan före graviditeten, minskas tyroxindosen till nivån före graviditeten genast efter förlossningen.
- Om subklinisk hypotyreos eller klinisk hypotyreos konstaterades under graviditeten (TSH ≥ 10 mU/l oberoende av T4-V-värdet eller TSH 4,0–9,9 mmol/l och T4-V under referensområdets nedre gräns), minskas tyroxindosen med cirka 30 procent efter förlossningen.
- Om tyroxinet inleddes eftersom TSH-halten var 2,5–3,9 mU/l och TPOAb-halten var förhöjd eller TSH-halten var 4,0–9,9 mU/l och T4-V-halten inom referensområdet, avslutas tyroxinet genast efter förlossningen.
- Sköldkörtelvärdena kontrolleras 6 veckor efter förlossningen.
- Tyroxindosen justeras eller tyroxinbehandlingen inleds på nytt enligt samma vårdprinciper som för kvinnor som inte är gravida.
Tyreoidit efter förlossningen
- Tyreoidit efter förlossningen utvecklas hos cirka 1–16 procent av mödrarna inom ett år efter förlossningen. Vanligtvis utvecklas den 6 månader efter förlossningen.
- Riskfaktorerna för tyreoidit efter förlossningen är bland annat tidigare tyreoidit
efter förlossningen, förhöjd TPO-antikroppshalt och typ 1-diabetes.
- För mödrar med riskfaktorer rekommenderas screening (TSH och T4-V) 6–12 veckor efter förlossningen «De Groot L, Abalovich M, Alexander EK, ym. Managem...»145.
- I den klassiska formen (25 % av fallen) förekommer initialt en lindrig hypertyreos,
som följs av lindrig och övergående hypotyreos «Alexander EK, Pearce EN, Brent GA, ym. 2017 Guidel...»143.
- Hypertyreosen behandlas vid behov enligt symtomen med betablockerare och hypotyreosen vid behov med tyroxin.
- I 32 procent av fallen förekommer endast en övergående hypertyreosfas.
- I 43 procent av fallen förekommer endast en hypotyreosfas.
- Tyroxinet kan ofta avslutas senare.
- Om TPOAb är förhöjd är risken för utveckling av permanent hypotyreos större.
- Differentialdiagnosen är Basedows sjukdom, i samband med vilken
- hypertyreosens svårighetsgrad är ofta mer betydande
- det kan förekomma ögonsymtom
- TSHRAb nästan alltid är förstorad
- vårdlinjen avviker från tyreoidit efter förlossningen. Basedows hypertyreos behandlas initialt med tyreostatika.
Liotyronin och andra läkemedel som innehåller T3 under graviditeten
- Användning av kombinationsbehandling med T4 + T3 eller animaliska sköldkörtelpreparat rekommenderas inte under graviditeten «Alexander EK, Pearce EN, Brent GA, ym. 2017 Guidel...»143.
- Kombinationsbehandling med tyroxin och liotyronin, T3-monoterapi och animaliska sköldkörtelpreparat
bör bytas ut till tyroxinmonoterapi hos kvinnor som planerar en graviditet eller är
gravida.
- Remiss till den specialsjukvården rekommenderas.
- Remissen skrivs som brådskande om patienten redan är gravid.
- Det finns ingen evidens för att T3-baserade behandlingar är säkra för fostret. Enligt information som baserar sig på djurstudier är det möjligt att behandlingen medför risker för fostret «Alexander EK, Pearce EN, Brent GA, ym. 2017 Guidel...»143, «Patel J, Landers K, Li H, ym. Thyroid hormones and...»148.
- Risken med kombinationsbehandling med T4 + T3 eller behandling med animaliska sköldkörtelpreparat
är att fostret inte får tillräckligt med T4-hormon från modern, vilket äventyrar fostrets
hjärnutveckling.
- Att T4 sprids genom moderkakan till fostret och vidare genom fostrets blod-hjärnbarriär är centralt för utvecklingen av fostrets hjärna «Alexander EK, Pearce EN, Brent GA, ym. 2017 Guidel...»143.
- Vid kombinationsbehandling är T4-V-halten i allmänhet lägre och i synnerhet i början av graviditeten är fostret beroende av T4-halten hos modern.
- T3 transporteras dåligt till fostrets centrala nervsystem. Största delen av T3 i fostrets hjärna bildas till följd av dejodisering av mammans T4 särskilt fram till graviditetsveckorna 16–18 «Patel J, Landers K, Li H, ym. Thyroid hormones and...»148.
- Behandlingar baserade på T3-preparat medför risk för tyreotoxikos. Endogen hypertyreos är förknippad med risk för missfall och prematur förlossning «De Groot L, Abalovich M, Alexander EK, ym. Managem...»145.
Patienter med sköldkörtelcancer
- Oftast behandlas sköldkörtelcancer med totalresektion av sköldkörteln, varvid en livslång tyroxinmedicinering är nödvändig «Filetti S, Durante C, Hartl D, ym. Thyroid cancer:...»149, «Suomen Kilpirauhassyöpäryhmä. Papillaarinen ja fol...»150, «Haugen BR, Alexander EK, Bible KC, ym. 2015 Americ...»151.
- TSH-målen för patienter som haft sköldkörtelcancer varierar enligt återstoden av eventuell cancer och risken för återfall samt behandlings- och uppföljningsfasen av cancern.
- TSH-målet fastställs individuellt och kan ändras under behandlingen och uppföljningen.
- När sköldkörtelresektion räcker som behandling för cancern och ingen radiojodbehandling på grund av en bra prognos behövs som adjuvant behandling, genomförs tyroxinmedicineringen på samma sätt som för patienter med hypotyreos.
- När radiojodbehandling behövs utöver en operation är TSH-målet under 0,1 mU/l eller 0,1–0,5 mU/l åtminstone fram till undersökningarna för responsbedömning, som görs 8–12 månader efter behandlingen.
- Om det efter responsbedömningen inte finns tecken på cancer, är TSH-målet 0,5–2 mU/l.
- Om responsbedömningen inte ger säkerhet om tillfrisknandet från cancern utan kräver antingen tilläggsbehandlingar eller en längre uppföljningstid, hålls TSH-halten under den nedre gränsen för referensområdet 0,1–0,5 mU/l.
- Om cancern bilddiagnostiskt finns kvar är TSH-målet under 0,1 mU/l, eftersom TSH-halten kan stimulera cancercellernas tillväxt. Suppressionen av TSH förbättrar prognosen för dessa patienter.
- TSH-halten ska inte hållas låg när cancern är botad, eftersom lågt TSH ökar risken för hjärt- och kärlsjukdom och -dödlighet men inte påverkar prognosen för cancern.
- För behandling av sköldkörtelcancer med en mycket bra prognos kan det räcka med borttagning av den ena sköldkörtelloben, varvid det oftast inte utvecklas någon hypotyreos. Vid behov följs de normala principerna för diagnostik och behandling av hypotyreos.
Uppföljning av vården av patienter med sköldkörtelcancer
- Uppföljningen genomförs i början inom specialsjukvården inom onkologi eller endokrinologi, men överförs vanligtvis senare till primärvården.
- När specialsjukvården har uppföljningsansvaret regleras tyroxinmedicineringen inom specialsjukvården eller genom att konsultera den enhet som ansvarar för uppföljningen.
- När uppföljningen överförs till primärvården har cancern konstaterats vara botad, och då justeras tyroxinmedicineringen enligt samma principer som för patienter med hypotyreos (TSH-målet inom referensområdet).
- Överbehandling av botad sköldkörtelcancer hos äldre bör undvikas. TSH-målet för tyroxinsubstitutionsbehandling är högre hos äldre personer (över 65 år) «Waring AC, Arnold AM, Newman AB, ym. Longitudinal ...»64, «Leng O, Razvi S. Hypothyroidism in the older popul...»71, «Kilpirauhasen toimintakokeiden laboratoriokohtaisia viitearvoja Suomessa»5.
- TSH-värdena för personer som haft sköldkörtelcancer och som övergår till primärvården följs upp med 1–2 års mellanrum.
- Om klinisk misstanke om återfall av cancer uppkommer ska ultraljudsundersökning av halsen och tyreoglobulinmätning planeras in.
- Ibland kan man inom specialsjukvården ge anvisningar om mer individuell uppföljning, till exempel årlig tyreoglobulinmätning. Då ger specialsjukvården också anvisningar om tolkningen av värden.
- Sköldkörtelcancer påverkar i allmänhet inte TSH- eller T4-V-värdena i diagnos- eller relapsskedet.
- Under tidigare årtionden har det varit praxis att hålla alla patienter som haft sköldkörtelcancer i TSH-suppression. Dessa patienter som vårdats enligt föråldrad praxis följs fortfarande upp inom primärvården. När man träffar på dylika patienter kan man vid behov konsultera specialsjukvården för att uppdatera TSH-målet i enlighet med nuvarande praxis.
Personer som insjuknat i cancer som barn, unga eller unga vuxna
- Personer som har haft cancer i ungdomen kan beroende på behandlingarna ha en ökad risk för funktionsstörning i sköldkörteln eller för sköldkörtelcancer.
- Livslång, regelbunden (med 1-2 års mellanrum samt vid behov i samband med symtom) uppföljning av sköldkörtelhormonhalterna (TSH och T4-V) rekommenderas för patienter som har fått strålbehandling av huvud- eller halsregionen eller hela kroppen. Dessutom rekommenderas uppföljning av sköldkörtelvärden för patienter som har fått 131I-MIBG-behandling «Viikari L, Jahnukainen J, Lähteenmäki P. Endokriin...»39, «Welch JJG, Ames B, Cohen LE, ym. Management of chi...»152.
- Även små stråldoser medför en ökad risk för sköldkörteltumörer. Dessutom ökar större stråldoser risken för utveckling av hypo- eller hypertyreos. Även immunologiska behandlingar och tyrosinkinashämmare medför en risk för utveckling av funktionsstörningar i sköldkörteln.
- Central hypotyreos är sällsynt och utvecklas först när man använder stora stråldoser i huvudområdet. Oftast utgör den en del av panhypopituitarism, dvs. omfattande hypofyssvikt.
- Hos patienter som haft cancer ska tyroxinbehandling inledas med lägre tröskel även i samband med subklinisk hypotyreos, eftersom en förhöjd TSH-halt kan öka risken för sköldkörteltumörer. Med tyroxinbehandling strävar man efter att hålla TSH-halten hos dessa patienter i den nedre halvan av referensområdet «Waguespack SG. Thyroid Sequelae of Pediatric Cance...»78.
Äldre personer
- Hos äldre personer övervägs ofta TSH-bestämning bland annat vid utredning av nedsatt funktionsförmåga, försämrat minne och förstoppning.
- Särskilt hos äldre personer är det skäl att vara försiktig med överdiagnostik och
överbehandling.
- Befolkningsstudier visar att TSH-halten hos äldre personer allmänt är över den övre gränsen för referensområdet för friska vuxna.
- Inledningsgränsen för tyroxinsubstitutionsbehandling och TSH-målet vid substitutionsbehandling mot hypotyreos är högre hos äldre personer (över 65 år) och särskilt hos mycket äldre personer «Waring AC, Arnold AM, Newman AB, ym. Longitudinal ...»64, «Leng O, Razvi S. Hypothyroidism in the older popul...»71, «Kilpirauhasen toimintakokeiden laboratoriokohtaisia viitearvoja Suomessa»5.
- Eftersom man i flera undersökningar har observerat att TSH-halten ökar med åldern, har detta beaktats i referensvärdena för TSH referensvärden i flera laboratorier.
- Enligt nuvarande rekommendationer ska subklinisk hypotyreos (TSH < 10 mU/l, T4-V i referensområdet) hos mycket gamla personer inte behandlas. Det finns ingen evidens för risker med obehandlad subklinisk hypotyreos hos personer över 70 år.
- Inverkan av läkemedel och andra sjukdomar på sköldkörtelnfunktionen, resultaten av funktionstest och tyroxinbehandlingen ska beaktas, eftersom sannolikheten för andra sjukdomar och läkemedelsanvändning är större (se tabell «Läkemedel och kosttillskott som orsakar hypotyreos....»3 och «Läkemedel och kosttillskott som orsakar avvikande fynd i sköldkörtelns funktionstest och som kan påverka tyroxindosen, men som inte nödvändigtvis påverkar sköldkörtelns funktion....»4).
- Startdosen för levotyroxin är 25 μg/dygn. Dosen ökas småningom med 4–6 veckors mellanrum. Biverkningarna av en för stor tyroxindos framhävs hos personer över 70 år.
- Viktminskning på grund av en allvarlig sjukdom eller dess behandling kan vara snabb, varvid det är bra att följa upp TSH-halten oftare med tanke på behovet av att ändra tyroxindosen. I synnerhet hos mycket gamla personer är en gradvis viktminskning ganska vanlig, och även detta bör beaktas i uppföljningsfrekvensen för TSH.
- Det första tecknet på en begynnande minnessjukdom kan vara ett överraskande TSH-värde i uppföljningen av hypotyreos. Medicineringen kan ha genomförts oregelbundet eller inte alls. Särskilt bland äldre personer bör man se till att TSH-halten mäts regelbundet årligen samt därtill vid behov om det sker förändringar i tillståndet, i annan medicinering eller i vikten.
Barn
- Hypotyreos hos barn kan vara medfödd eller förvärvad (juvenil).
Medfödd hypotyreos
- Förekomsten av medfödd hypotyreos i Finland är 1:2 783 «Danner E, Niuro L, Huopio H, ym. Incidence of prim...»153.
- Den vanligaste orsaken till medfödd hypotyreos är en utvecklingsstörning i sköldkörteln. Utvecklingsstörningen kan yttra sig som total avsaknad av sköldkörteln (aplasi), liten storlek (hypoplasi) eller en avvikande lokalisation. Sköldkörtelns utvecklingsstörning är vanligtvis sporadisk.
- I cirka 35 procent av fallen konstateras en normalstor eller förstorad sköldkörtel på normal plats och i cirka hälften av dessa fall är orsaken ett ärftligt fel i syntesen av sköldkörtelhormoner (dyshormonogenes) «Danner E, Niuro L, Huopio H, ym. Incidence of prim...»153.
- Central hypotyreos, som är sällsynt, hittas inte vid TSH-screening av nyfödda «Wassner AJ. Congenital Hypothyroidism. Clin Perina...»154.
- Diagnosen medfödd primär hypotyreos grundar sig i Finland på bestämningen av TSH-halten
i navelserum.
- Om TSH-koncentrationen i navelserum överskrider screeninggränsen (beroende på laboratoriemetod 35 eller 40 mU/l) tas vid minst 72 timmars ålder ett kontrollprov med bestämning av TSH- och TV-4-halterna i plasma.
- Om kontrollprovets TSH-halt överskrider screeninggränsen (vanligen P-TSH 20 mU/l), inleds behandling med levotyroxin omedelbart «Linko-Parvinen A, Kouki A, Uitto J. Synnynnäisen h...»155.
- T4-V-halten berättar om hypotyreosens svårighetsgrad, men medicineringen inleds också när T4-V-värdet är inom referensområdet.
- Om det är fråga om en tvillinggraviditet och fostret har haft en gemensam moderkaka, eller om man inte känner till detta med säkerhet och de födda barnen är av samma kön, rekommenderas kontroll av TSH- och T4-V-halterna vid två veckors ålder, eftersom sköldkörtelhormonhalterna hos en sjuk nyfödd kan härstamma från det friska fostret och hos ett hypotyreotiskt barn tar det över en vecka innan TSH-halten ökar. Likaså rekommenderas kontroll av TSH- och T4-V-halterna i plasma vid två veckors ålder om barnets födelsevikt är mindre än 1 500 g eller graviditeten vid födelsetidpunkten har varat i mindre än 32 veckor, eller om den nyfödda har varit eller är allvarligt sjuk, även om de tidigare screeningresultaten skulle ha varit inom referensområdet «Rose SR, Wassner AJ, Wintergerst KA, ym. Congenita...»156.
- Om Downs syndrom har konstaterats hos barnet rekommenderas kontroll av värdena vid 4 veckors ålder «van Trotsenburg P, Stoupa A, Léger J, ym. Congenit...»157.
- T4-V- och TSH-halterna hos den nyfödda ska kontrolleras för att utesluta central hypotyreos
om barnet är exceptionellt hypotoniskt, har långvarig gulhet eller om man misstänker
eller har konstaterat andra hypofyshormonbrister «van Trotsenburg P, Stoupa A, Léger J, ym. Congenit...»157.
- Om den nyfödda också har binjurebarkssvikt ska kortisolsubstitutionsbehandling inledas före tyroxinbehandlingen.
- Den rekommenderade startdosen för behandling med levotyroxin är 10–15 μg/kg «van Trotsenburg P, Stoupa A, Léger J, ym. Congenit...»157, «Niuro L, Danner E, Viikari L, ym. Treatment of Con...»158.
- En startdos i övre delen av detta variationsintervall kan vara lämplig i en situation där T4-V-halten är mycket liten i kontrollscreeningprovet.
- Dosen kan krossas och ges med sked blandad med vatten eller mjölk en gång dagligen.
- Dosen kan också ges i samband med matningen, men vid samma tidpunkt på dygnet «van Trotsenburg P, Stoupa A, Léger J, ym. Congenit...»157.
- Innan behandlingen inleds behövs inga etiologiska undersökningar, men sköldkörtelns
lokalisation, storlek och struktur kan utredas med ultraljudsundersökning.
- Genetiska undersökningar är inte etablerad praxis, men kan vara till nytta om sjukdomsbilden är avvikande.
- Den första laboratoriekontrollen rekommenderas före två veckors ålder efter att behandlingen inletts och i fortsättningen med två veckors mellanrum tills TSH- och T4-V-värdena är inom det åldersenliga referensområdet.
- Om TSH-värdet är inom det åldersenliga referensområdet rekommenderas att T4-V-halten
ska ligga i övre hälften av det åldersenliga referensområdet «van Trotsenburg P, Stoupa A, Léger J, ym. Congenit...»157, «Kilpirauhasen toimintakokeiden laboratoriokohtaisia viitearvoja Suomessa»5.
- Tyroxindosen minskas endast om T4-V-halten är klart högre än den övre gränsen för det åldersenliga referensområdet och TSH-halten är exceptionellt låg eller barnet har symtom som tyder på hypertyreos.
- Det rekommenderade uppföljningsintervallet under det första året är högst 3 månader, fram till 3 år högst 4 månader och senare högst 6 månader ända till tillväxtperiodens slut. Om läkemedelsdosen ändras rekommenderas kontroll av sköldkörtelvärdena efter 4–6 veckor.
- Medfödd hypotyreos kan vara övergående.
- Sannolikheten för övergående hypotyreos är större när en normalstor sköldkörtel kan hittas på rätt plats och TSH inte har ökat till över 10 mU/l efter det första levnadsåret.
- Då kan man vid 2–3 års ålder avbryta tyroxinbehandlingen och kontrollera sköldkörtelvärdena senast efter 4 veckor.
Förvärvad (juvenil) hypotyreos hos barn
- Den vanligaste orsaken (70 % av fallen) till juvenil hypotyreos är Hashimotos autoimmuna
tyreoidit «Hunter I, Greene SA, MacDonald TM, ym. Prevalence ...»159.
- Förekomsten av autoimmun tyreoidit hos barn och unga i USA är cirka 3 procent «Crisafulli G, Gallizzi R, Aversa T, ym. Thyroid fu...»160. Det finns ingen motsvarande statistik för Finland.
- Autoimmun tyreoidit ökar avsevärt risken för att insjukna i hypotyreos, men under 5 års uppföljning förblir över hälften eutyreotiska, en tredjedel utvecklar subklinisk hypotyreos och endast 12 procent klinisk hypotyreos «Crisafulli G, Gallizzi R, Aversa T, ym. Thyroid fu...»160.
- I en finländsk retrospektiv registerstudie var cirka hälften av barnen i diagnosskedet
av hypotyreos symtomfria.
- De vanligaste (men ospecifika) symtomen var trötthet eller yrsel (31 %), avvikande torr hud (26 %) och buksmärta (19 %).
- Längdtillväxten hade avtagit hos 12 procent och sjukdomen hittades ofta redan innan man konstaterat störningar i tillväxten «Saari A, Pokka J, Mäkitie O, ym. Early Detection o...»161.
- Grunderna för diagnostik och inledning av behandling är desamma som för unga vuxna,
och vid subklinisk hypotyreos rekommenderas tyroxinbehandling om TSH-halten är över
10 mU/l «Kilpirauhasarvojen normaalistamiseen tähtäävä kilpirauhashormonihoito ei ilmeisesti korjaa ylipainoa kilpirauhasen vajaatoiminnassa.»B.
- Särskilt fetma kan öka TSH-halten hos barn när T4-V-halten hålls inom referensområdet också utan tyreoidit. Behandling med sköldkörtelläkemedel är inte till nytta i denna situation och TSH-värdet normaliseras om vikten normaliseras.
- Om ett barns sköldkörtel inte fungerar alls, är det genomsnittliga levotyroxinbehovet
hos små barn 4–6 μg/kg/dygn och hos ungdomar i puberteten 2–4 μg/kg/dygn «Jonklaas J. Sex and age differences in levothyroxi...»162. Vanligtvis fungerar dock den egna sköldkörteln delvis i diagnosskedet, varvid man
bör inleda behandlingen med en mindre dos, ofta ungefär en halv dos.
- Det rekommenderas att behandlingen inleds av eller under handledning av en specialist i barnsjukdomar.
- I uppföljningen är det också viktigt att följa upp barnets tillväxt och utveckling.
- I behandlingen strävar man efter att hålla TSH-halten inom det åldersenliga referensområdet eller inom den nedre hälften av referensområdet.
- TSH- och T4-V-värdena följs upp med ett halvt års mellanrum, hos barn under 3 år dock oftare (med 3–4 månaders mellanrum). När tillväxten har upphört kan uppföljningen överföras till primärvården.
- Om behovet av permanent behandling med sköldkörtelhormon inte är uppenbart och dosen inte har behövt höjas enligt TSH-halten, ska man efter att tillväxten upphört överväga att göra ett uppehåll i behandlingen innan uppföljningen överförs till primärvården.
- Det finns mycket lite evidens om kombinationsbehandling med T4- och T3-hormon hos
barn och det finns inget belägg för att kombinationsbehandling skulle förbättra tillståndet
hos barn. Därför ska kombinationsbehandling inte användas hos barn.
- Tillägg av en liten dos liotyronin vid sidan om tyroxinet har dock normaliserat sköldkörtelvärdena (TSH och T4-V) utan avvikande ökning av T3-V-halten hos barn med medfödd aplasi av sköldkörteln, perifer resistens mot sköldkörtelhormon eller vars sköldkörtel har opererats bort i sin helhet «Biondi B, Wartofsky L. Treatment with thyroid horm...»84, «Paone L, Fleisch AF, Feldman HA, ym. Liothyronine ...»163, «Torlontano M, Durante C, Torrente I, ym. Type 2 de...»164.
Central hypotyreos
- Central hypotyreos beror på en störning i hypofysens eller hypotalamus funktion «Persani L, Brabant G, Dattani M, ym. 2018 European...»7.
- Mindre än 1 procent av hypotyreosfallen är centrala. Diagnostiken och inledandet av behandlingen genomförs inom specialsjukvården.
- Prevalensen uppskattas till 1:20 000–80 000.
- Symtomen och fynden är likadana som vid primär hypotyreos, men i allmänhet lindrigare.
- Orsaker till central hypotyreos är adenom i hypofysen, andra hjärntumörer, operation av hypofysen, strålbehandling av huvudet, infiltrativa och inflammatoriska sjukdomar samt blödning i hypofysen (pituitär apoplexi) (se tabell «Orsaker till hypotyreos ....»2).
- Vissa läkemedel kan också inhibera TSH-utsöndringen i hypofysen (se tabell «Läkemedel och kosttillskott som orsakar hypotyreos....»3 och «Läkemedel och kosttillskott som orsakar avvikande fynd i sköldkörtelns funktionstest och som kan påverka tyroxindosen, men som inte nödvändigtvis påverkar sköldkörtelns funktion....»4).
- I laboratorieprover är TSH-värdet i allmänhet inom referensområdet eller under den
nedre gränsen för referensområdet, dvs. lågt i proportion till T4-V-värdet, T4-V-värdet
är under den nedre gränsen för referensområdet och T3-V-värdet är inom referensområdet
eller under den nedre gränsen för referensområdet «Ross DS. Central hypothyroidism. UpToDate. April 2...»165.
- Den vanligaste orsaken till låg TSH-halt är subklinisk hypertyreos.
- Även T3-preparat kan orsaka laboratoriefynd som påminner om central hypotyreos (TSH- och T4-V-värden under referensområdets nedre gräns).
- Vid akuta sjukdomstillstånd kan låga TSH- och T4-V-värden förekomma.
- I differentialdiagnostiken ska man också komma ihåg funktionella orsaker till underfunktion av sköldkörteln, såsom systemsjukdom och undernäring.
- Laboratoriediagnostikens stegvisa förlopp:
- T4-V-värdet ligger under den nedre gränsen för referensområdet och TSH-värdet inom referensområdet eller under dess nedre gräns.
- TSH- och T4-V-värden kontrolleras, den kliniska bilden utvärderas och vanliga orsaker till låg TSH- och T4-V-halt utreds, se avsnittet Utredning av atypiska sköldkörtelvärden «A6»9.
- En endokrinolog konsulteras om det fortfarande finns misstanke om central hypotyreos. Ofta är det skäl att mäta kortisol- och prolaktinhalten i plasma.
- Inom specialsjukvården görs hypofysfunktionsprov och vid behov mäts T4-Vdi- och T3-V-halterna och hypofysen undersöks med magnetundersökning.
- Vid misstanke om central hypotyreos ska tyroxin inte inledas inom primärvården, eftersom hypokortisolism kan förekomma samtidigt vid hypofyssvikt, varvid inledning av tyroxin före hydrokortison kan orsaka en krissituation.
Patientreferensgruppens synpunkter på God medicinsk praxis-rekommendationen om hypotyreos
Patientreferensgruppens synpunkter presenteras i tilläggsmaterialet «Potilasviiteryhmän näkemyksiä Kilpirauhasen vajaatoiminta Käypä hoito -suosituksesta»13.
Arbetsgrupp tillsatt av Finska Läkarföreningen Duodecim, Finlands Endokrinologförening, Finlands barnendokrinologiförening och Allmänmedicinska föreningen i Finland
För mer information om arbetsgruppsmedlemmar samt anmälan om intressekonflikter, se «Kilpirauhasen vajaatoiminta»1 (på finska)
Översättare: Lingsoft Language Services Oy
Granskning av översättningen: Peter Nyberg
Litteratur
Hypotyreos. God medicinsk praxis-rekommendation. Arbetsgrupp tillsatt av Finska Läkarföreningen Duodecim, Finlands Endokrinologförening, Finlands barnendokrinologiförening och Allmänmedicinska föreningen i Finland. Helsingfors: Finska Läkarföreningen Duodecim, 2024 (hänvisning dd.mm.åååå). Tillgänglig på internet: www.kaypahoito.fi
Närmare anvisningar: «https://www.kaypahoito.fi/sv/god-medicinsk-praxis/nyttjanderattigheter/citering»8
Ansvarsbegränsning
God medicinsk praxis- och Avstå klokt-rekommendationerna är sammandrag gjorda av experter gällande diagnostik och behandling av bestämda sjukdomar. Rekommendationerna fungerar som stöd när läkare eller andra yrkesutbildade personer inom hälso- och sjukvården ska fatta behandlingsbeslut. De ersätter inte läkarens eller annan hälsovårdspersonals egen bedömning av vilken diagnostik, behandling och rehabilitering som är bäst för den enskilda patienten då behandlingsbeslut fattas.
Litteratur
- Chaker L, Bianco AC, Jonklaas J, ym. Hypothyroidism. Lancet 2017;390(10101):1550-1562 «PMID: 28336049»PubMed
- Rao RH, McCready VR, Spathis GS. Iodine kinetic studies during amiodarone treatment. J Clin Endocrinol Metab 1986;62(3):563-8 «PMID: 3944239»PubMed
- Franklyn JA, Davis JR, Gammage MD, ym. Amiodarone and thyroid hormone action. Clin Endocrinol (Oxf) 1985;22(3):257-64 «PMID: 3978832»PubMed
- van Beeren HC, Bakker O, Wiersinga WM. Structure-function relationship of the inhibition of the 3,5,3'-triiodothyronine binding to the alpha1- and beta1-thyroid hormone receptor by amiodarone analogs. Endocrinology 1996;137(7):2807-14 «PMID: 8770901»PubMed
- Stanbury JB, Ermans AE, Bourdoux P, ym. Iodine-induced hyperthyroidism: occurrence and epidemiology. Thyroid 1998;8(1):83-100 «PMID: 9492158»PubMed
- Roti E, Minelli R, Gardini E, ym. Thyrotoxicosis followed by hypothyroidism in patients treated with amiodarone. A possible consequence of a destructive process in the thyroid. Arch Intern Med 1993;153(7):886-92 «PMID: 8466380»PubMed
- Persani L, Brabant G, Dattani M, ym. 2018 European Thyroid Association (ETA) Guidelines on the Diagnosis and Management of Central Hypothyroidism. Eur Thyroid J 2018;7(5):225-237 «PMID: 30374425»PubMed
- Virta LJ, Eskelinen SI. Prevalence of hypothyroidism in Finland--a nationwide prescription study. Eur J Clin Pharmacol 2011;67(1):73-7 «PMID: 20809083»PubMed
- Garmendia Madariaga A, Santos Palacios S, Guillén-Grima F, ym. The incidence and prevalence of thyroid dysfunction in Europe: a meta-analysis. J Clin Endocrinol Metab 2014;99(3):923-31 «PMID: 24423323»PubMed
- Kela. Sairausvakuutuksesta korvattavat lääketoimitukset. https://tietotarjotin.kela.fi/tilasto/2857522/tilasto-sairausvakuutuksesta-korvattavista-laaketoimituksista «https://tietotarjotin.kela.fi/tilasto/2857522/tilasto-sairausvakuutuksesta-korvattavista-laaketoimituksista»9
- Metso S, Hakala T, Attanasio R ym. Kilpirauhashormonien käyttö kilpirauhasen vajaatoiminnan hoidossa: THESIS-kyselytutkimus suomalaisille erikoislääkäreille. THESIS: Treatment of Hypothyroidism in Europe by Specialists: an International Survey. Suomen Lääkärilehti 2021:48:2885-2889
- Asvold BO, Vatten LJ, Bjøro T. Changes in the prevalence of hypothyroidism: the HUNT Study in Norway. Eur J Endocrinol 2013;169(5):613-20 «PMID: 23975540»PubMed
- Taylor PN, Iqbal A, Minassian C, ym. Falling threshold for treatment of borderline elevated thyrotropin levels-balancing benefits and risks: evidence from a large community-based study. JAMA Intern Med 2014;174(1):32-9 «PMID: 24100714»PubMed
- Mendes D, Alves C, Silverio N, ym. Prevalence of Undiagnosed Hypothyroidism in Europe: A Systematic Review and Meta-Analysis. Eur Thyroid J 2019;8(3):130-143 «PMID: 31259155»PubMed
- Bothra N, Shah N, Goroshi M, ym. Hashimoto's thyroiditis: relative recurrence risk ratio and implications for screening of first-degree relatives. Clin Endocrinol (Oxf) 2017;87(2):201-206 «PMID: 28273382»PubMed
- Karlsson B, Gustafsson J, Hedov G, ym. Thyroid dysfunction in Down's syndrome: relation to age and thyroid autoimmunity. Arch Dis Child 1998;79(3):242-5 «PMID: 9875020»PubMed
- Gravholt CH, Andersen NH, Conway GS, ym. Clinical practice guidelines for the care of girls and women with Turner syndrome: proceedings from the 2016 Cincinnati International Turner Syndrome Meeting. Eur J Endocrinol 2017;177(3):G1-G70 «PMID: 28705803»PubMed
- Surks M. Iodine-induced thyroid dysfunction. UpToDate. https://www.uptodate.com/contents/iodine-induced-thyroid-dysfunction «https://www.uptodate.com/contents/iodine-induced-thyroid-dysfunction»10
- Ong KK, Kuh D, Pierce M, ym. Childhood weight gain and thyroid autoimmunity at age 60-64 years: the 1946 British birth cohort study. J Clin Endocrinol Metab 2013;98(4):1435-42 «PMID: 23436917»PubMed
- Gore AC, Chappell VA, Fenton SE, ym. EDC-2: The Endocrine Society's Second Scientific Statement on Endocrine-Disrupting Chemicals. Endocr Rev 2015;36(6):E1-E150 «PMID: 26544531»PubMed
- Szczuko M, Syrenicz A, Szymkowiak K, ym. Doubtful Justification of the Gluten-Free Diet in the Course of Hashimoto's Disease. Nutrients 2022;14(9): «PMID: 35565695»PubMed
- Rayman MP. Multiple nutritional factors and thyroid disease, with particular reference to autoimmune thyroid disease. Proc Nutr Soc 2019;78(1):34-44 «PMID: 30208979»PubMed
- Valsta L, Kaartinen N, Tapanainen H ym. (toim). Ravitsemus Suomessa - FinRavinto 2017 -tutkimus. THL Raportti 12/2018, https://urn.fi/URN:ISBN:978-952-343-238-3 «https://urn.fi/URN:ISBN:978-952-343-238-3»11
- Zimmermann MB, Boelaert K. Iodine deficiency and thyroid disorders. Lancet Diabetes Endocrinol 2015;3(4):286-95 «PMID: 25591468»PubMed
- Zimmermann MB. Methods to assess iron and iodine status. Br J Nutr 2008;99 Suppl 3():S2-9 «PMID: 18598585»PubMed
- Ma ZF, Venn BJ, Manning PJ, ym. Iodine Supplementation of Mildly Iodine-Deficient Adults Lowers Thyroglobulin: A Randomized Controlled Trial. J Clin Endocrinol Metab 2016;101(4):1737-44 «PMID: 26891118»PubMed
- Wu Q, Rayman MP, Lv H, ym. Low Population Selenium Status Is Associated With Increased Prevalence of Thyroid Disease. J Clin Endocrinol Metab 2015;100(11):4037-47 «PMID: 26305620»PubMed
- Carlé A, Pedersen IB, Knudsen N, ym. Hypothyroid symptoms and the likelihood of overt thyroid failure: a population-based case-control study. Eur J Endocrinol 2014;171(5):593-602 «PMID: 25305308»PubMed
- Ojala A, Strandberg T, Schalin-Jäntti C. Iäkkään poikkeava tyreotropiinipitoisuus. Duodecim 2019;135(23):2277-82 https://www.duodecimlehti.fi/duo15275 «https://www.duodecimlehti.fi/duo15275»12
- Biondi B, Cappola AR, Cooper DS. Subclinical Hypothyroidism: A Review. JAMA 2019;322(2):153-160 «PMID: 31287527»PubMed
- Canaris GJ, Manowitz NR, Mayor G, ym. The Colorado thyroid disease prevalence study. Arch Intern Med 2000;160(4):526-34 «PMID: 10695693»PubMed
- LeFevre ML, U.S. Preventive Services Task Force. Screening for thyroid dysfunction: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med 2015;162(9):641-50 «PMID: 25798805»PubMed
- Vanderpump MP, Ahlquist JA, Franklyn JA, ym. Consensus statement for good practice and audit measures in the management of hypothyroidism and hyperthyroidism. The Research Unit of the Royal College of Physicians of London, the Endocrinology and Diabetes Committee of the Royal College of Physicians of London, and the Society for Endocrinology. BMJ 1996;313(7056):539-44 «PMID: 8789985»PubMed
- Birtwhistle R, Morissette K, Dickinson JA, ym. Recommendation on screening adults for asymptomatic thyroid dysfunction in primary care. CMAJ 2019;191(46):E1274-E1280 «PMID: 31740537»PubMed
- Hegedüs L, Bianco AC, Jonklaas J, ym. Primary hypothyroidism and quality of life. Nat Rev Endocrinol 2022;18(4):230-242 «PMID: 35042968»PubMed
- Wilson SA, Stem LA, Bruehlman RD. Hypothyroidism: Diagnosis and Treatment. Am Fam Physician 2021;103(10):605-613 «PMID: 33983002»PubMed
- Garber JR, Cobin RH, Gharib H, ym. Clinical practice guidelines for hypothyroidism in adults: cosponsored by the American Association of Clinical Endocrinologists and the American Thyroid Association. Endocr Pract 2012;18(6):988-1028 «PMID: 23246686»PubMed
- NICE guideline [NG145]. Thyroid disease: assessment and management. Published: 20 November 2019, https://www.nice.org.uk/guidance/ng145 «https://www.nice.org.uk/guidance/ng145»13
- Viikari L, Jahnukainen J, Lähteenmäki P. Endokriiniset ja metaboliset ongelmat lapsuus- ja nuoruusiän syöpähoitojen jälkeen. Duodecim 2022;138(1):21-30
- Mäkimattila S, Harjutsalo V, Forsblom C, ym. Response to Comment on Mäkimattila et al. Every Fifth Individual With Type 1 Diabetes Suffers From an Additional Autoimmune Disease: A Finnish Nationwide Study. Diabetes Care 2020;43:1041-1047. Diabetes Care 2020;43(8):e106-e107 «PMID: 32669417»PubMed
- Taylor PN, Albrecht D, Scholz A, ym. Global epidemiology of hyperthyroidism and hypothyroidism. Nat Rev Endocrinol 2018;14(5):301-316 «PMID: 29569622»PubMed
- Demers LM, Spencer CA. Laboratory medicine practice guidelines: laboratory support for the diagnosis and monitoring of thyroid disease. Clin Endocrinol (Oxf) 2003;58(2):138-40 «PMID: 12580927»PubMed
- Russell W, Harrison RF, Smith N, ym. Free triiodothyronine has a distinct circadian rhythm that is delayed but parallels thyrotropin levels. J Clin Endocrinol Metab 2008;93(6):2300-6 «PMID: 18364382»PubMed
- Roelfsema F, Pereira AM, Veldhuis JD, ym. Thyrotropin secretion profiles are not different in men and women. J Clin Endocrinol Metab 2009;94(10):3964-7 «PMID: 19773394»PubMed
- Kuzmenko NV, Tsyrlin VA, Pliss MG, ym. Seasonal variations in levels of human thyroid-stimulating hormone and thyroid hormones: a meta-analysis. Chronobiol Int 2021;38(3):301-317 «PMID: 33535823»PubMed
- Wang D, Cheng X, Yu S, ym. Data mining: Seasonal and temperature fluctuations in thyroid-stimulating hormone. Clin Biochem 2018;60():59-63 «PMID: 30130522»PubMed
- Konno N, Morikawa K. Seasonal variation of serum thyrotropin concentration and thyrotropin response to thyrotropin-releasing hormone in patients with primary hypothyroidism on constant replacement dosage of thyroxine. J Clin Endocrinol Metab 1982;54(6):1118-24 «PMID: 6804476»PubMed
- Thienpont LM, Faix JD, Beastall G. Standardization of FT4 and harmonization of TSH measurements - a request for input from endocrinologists and other physicians. Endocr J 2015;62(10):855-6 «PMID: 26211473»PubMed
- Thienpont LM, Van Uytfanghe K, Beastall G, ym. Report of the IFCC Working Group for Standardization of Thyroid Function Tests; part 1: thyroid-stimulating hormone. Clin Chem 2010;56(6):902-11 «PMID: 20395624»PubMed
- Ain KB, Pucino F, Shiver TM, ym. Thyroid hormone levels affected by time of blood sampling in thyroxine-treated patients. Thyroid 1993;3(2):81-5 «PMID: 8369656»PubMed
- Dora JM, Biscolla RPM, Caldas G, ym. Choosing Wisely for Thyroid Conditions: Recommendations of the Thyroid Department of the Brazilian Society of Endocrinology and Metabolism. Arch Endocrinol Metab 2021;65(2):248-252 «PMID: 33587833»PubMed
- Halsall DJ, Oddy S. Clinical and laboratory aspects of 3,3',5'-triiodothyronine (reverse T3). Ann Clin Biochem 2021;58(1):29-37 «PMID: 33040575»PubMed
- Gomes-Lima C, Wartofsky L, Burman K. Can Reverse T3 Assay Be Employed to Guide T4 vs. T4/T3 Therapy in Hypothyroidism? Front Endocrinol (Lausanne) 2019;10():856 «PMID: 31920970»PubMed
- Vanderpump MP, Tunbridge WM, French JM, ym. The incidence of thyroid disorders in the community: a twenty-year follow-up of the Whickham Survey. Clin Endocrinol (Oxf) 1995;43(1):55-68 «PMID: 7641412»PubMed
- Khoodoruth MAS, Abdo AKA, Ouanes S. Quetiapine-Induced Thyroid Dysfunction: A Systematic Review. J Clin Pharmacol 2022;62(1):20-35 «PMID: 34467533»PubMed
- Vinayak Patki, Aniket Kumbhojkar, Praveen Khilnani. Sick Euthyroid Syndrome: A Myth or Reality. Journal of Pediatric Critical Care 2017. Vol 4 : 4. DOI-10.21304/2017.0403.00213
- DeGroo L. The Non-Thyroidal Illness Syndrome. [Updated 2015 Feb 1]. Teoksessa Feingold KR, Anawalt B, Blackman MR ym. toim. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK285570/ «https://www.ncbi.nlm.nih.gov/books/NBK285570/»14
- Gurnell M, Halsall DJ, Chatterjee VK. What should be done when thyroid function tests do not make sense? Clin Endocrinol (Oxf) 2011;74(6):673-8 «PMID: 21521292»PubMed
- Favresse J, Burlacu MC, Maiter D, ym. Interferences With Thyroid Function Immunoassays: Clinical Implications and Detection Algorithm. Endocr Rev 2018;39(5):830-850 «PMID: 29982406»PubMed
- Persani L. Clinical review: Central hypothyroidism: pathogenic, diagnostic, and therapeutic challenges. J Clin Endocrinol Metab 2012;97(9):3068-78 «PMID: 22851492»PubMed
- Somwaru LL, Rariy CM, Arnold AM, ym. The natural history of subclinical hypothyroidism in the elderly: the cardiovascular health study. J Clin Endocrinol Metab 2012;97(6):1962-9 «PMID: 22438233»PubMed
- Surks MI, Hollowell JG. Age-specific distribution of serum thyrotropin and antithyroid antibodies in the US population: implications for the prevalence of subclinical hypothyroidism. J Clin Endocrinol Metab 2007;92(12):4575-82 «PMID: 17911171»PubMed
- Bremner AP, Feddema P, Leedman PJ, ym. Age-related changes in thyroid function: a longitudinal study of a community-based cohort. J Clin Endocrinol Metab 2012;97(5):1554-62 «PMID: 22344200»PubMed
- Waring AC, Arnold AM, Newman AB, ym. Longitudinal changes in thyroid function in the oldest old and survival: the cardiovascular health study all-stars study. J Clin Endocrinol Metab 2012;97(11):3944-50 «PMID: 22879629»PubMed
- Meyerovitch J, Rotman-Pikielny P, Sherf M, ym. Serum thyrotropin measurements in the community: five-year follow-up in a large network of primary care physicians. Arch Intern Med 2007;167(14):1533-8 «PMID: 17646608»PubMed
- Biondi B, Cooper DS. The clinical significance of subclinical thyroid dysfunction. Endocr Rev 2008;29(1):76-131 «PMID: 17991805»PubMed
- Díez JJ, Iglesias P. Spontaneous subclinical hypothyroidism in patients older than 55 years: an analysis of natural course and risk factors for the development of overt thyroid failure. J Clin Endocrinol Metab 2004;89(10):4890-7 «PMID: 15472181»PubMed
- Klaver EI, van Loon HC, Stienstra R, ym. Thyroid hormone status and health-related quality of life in the LifeLines Cohort Study. Thyroid 2013;23(9):1066-73 «PMID: 23530992»PubMed
- Correia N, Mullally S, Cooke G, ym. Evidence for a specific defect in hippocampal memory in overt and subclinical hypothyroidism. J Clin Endocrinol Metab 2009;94(10):3789-97 «PMID: 19584178»PubMed
- Valdés S, Maldonado-Araque C, Lago-Sampedro A, ym. Reference values for TSH may be inadequate to define hypothyroidism in persons with morbid obesity: Di@bet.es study. Obesity (Silver Spring) 2017;25(4):788-793 «PMID: 28276648»PubMed
- Leng O, Razvi S. Hypothyroidism in the older population. Thyroid Res 2019;12():2 «PMID: 30774717»PubMed
- Treister-Goltzman Y, Yarza S, Peleg R. Lipid profile in mild subclinical hypothyroidism: systematic review and meta-analysis. Minerva Endocrinol (Torino) 2021;46(4):428-440 «PMID: 35078310»PubMed
- Biondi B, Palmieri EA, Lombardi G, ym. Effects of subclinical thyroid dysfunction on the heart. Ann Intern Med 2002;137(11):904-14 «PMID: 12458990»PubMed
- Pearce SH, Brabant G, Duntas LH, ym. 2013 ETA Guideline: Management of Subclinical Hypothyroidism. Eur Thyroid J 2013;2(4):215-28 «PMID: 24783053»PubMed
- Bekkering GE, Agoritsas T, Lytvyn L, ym. Thyroid hormones treatment for subclinical hypothyroidism: a clinical practice guideline. BMJ 2019;365():l2006 «PMID: 31088853»PubMed
- Stott DJ, Rodondi N, Kearney PM, ym. Thyroid Hormone Therapy for Older Adults with Subclinical Hypothyroidism. N Engl J Med 2017;376(26):2534-2544 «PMID: 28402245»PubMed
- Feller M, Snel M, Moutzouri E, ym. Association of Thyroid Hormone Therapy With Quality of Life and Thyroid-Related Symptoms in Patients With Subclinical Hypothyroidism: A Systematic Review and Meta-analysis. JAMA 2018;320(13):1349-1359 «PMID: 30285179»PubMed
- Waguespack SG. Thyroid Sequelae of Pediatric Cancer Therapy. Horm Res Paediatr 2019;91(2):104-117 «PMID: 30541010»PubMed
- Pasqualetti G, Pagano G, Rengo G, ym. Subclinical Hypothyroidism and Cognitive Impairment: Systematic Review and Meta-Analysis. J Clin Endocrinol Metab 2015;100(11):4240-8 «PMID: 26305618»PubMed
- Pollock MA, Sturrock A, Marshall K, ym. Thyroxine treatment in patients with symptoms of hypothyroidism but thyroid function tests within the reference range: randomised double blind placebo controlled crossover trial. BMJ 2001;323(7318):891-5 «PMID: 11668132»PubMed
- Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines for the treatment of hypothyroidism: prepared by the american thyroid association task force on thyroid hormone replacement. Thyroid 2014;24(12):1670-751 «PMID: 25266247»PubMed
- Kaptein EM, Beale E, Chan LS. Thyroid hormone therapy for obesity and nonthyroidal illnesses: a systematic review. J Clin Endocrinol Metab 2009;94(10):3663-75 «PMID: 19737920»PubMed
- Salmela P, Metso S, Moilanen L, ym. [Treatment of primary hypothyroidism in adult patients]. Duodecim 2016;132(1):33-42 «PMID: 27044179»PubMed
- Biondi B, Wartofsky L. Treatment with thyroid hormone. Endocr Rev 2014;35(3):433-512 «PMID: 24433025»PubMed
- Roos A, Linn-Rasker SP, van Domburg RT, ym. The starting dose of levothyroxine in primary hypothyroidism treatment: a prospective, randomized, double-blind trial. Arch Intern Med 2005;165(15):1714-20 «PMID: 16087818»PubMed
- Vasileiou M, Gilbert J, Fishburn S, ym. Thyroid disease assessment and management: summary of NICE guidance. BMJ 2020;368():m41 «PMID: 31996347»PubMed
- Bach-Huynh TG, Nayak B, Loh J, ym. Timing of levothyroxine administration affects serum thyrotropin concentration. J Clin Endocrinol Metab 2009;94(10):3905-12 «PMID: 19584184»PubMed
- Pang X, Pu T, Xu L, ym. Effect of l-thyroxine administration before breakfast vs at bedtime on hypothyroidism: A meta-analysis. Clin Endocrinol (Oxf) 2020;92(5):475-481 «PMID: 32022947»PubMed
- Ross DS. Treatment of primary hypothyroidism in adults. UpToDate. April 2023. https://www.uptodate.com/contents/treatment-of-primary-hypothyroidism-in-adults «https://www.uptodate.com/contents/treatment-of-primary-hypothyroidism-in-adults»15
- Wartofsky L, Dickey RA. The evidence for a narrower thyrotropin reference range is compelling. J Clin Endocrinol Metab 2005;90(9):5483-8 «PMID: 16148345»PubMed
- Walsh JP, Ward LC, Burke V, ym. Small changes in thyroxine dosage do not produce measurable changes in hypothyroid symptoms, well-being, or quality of life: results of a double-blind, randomized clinical trial. J Clin Endocrinol Metab 2006;91(7):2624-30 «PMID: 16670161»PubMed
- Surks MI, Goswami G, Daniels GH. The thyrotropin reference range should remain unchanged. J Clin Endocrinol Metab 2005;90(9):5489-96 «PMID: 16148346»PubMed
- Okosieme O, Gilbert J, Abraham P, ym. Management of primary hypothyroidism: statement by the British Thyroid Association Executive Committee. Clin Endocrinol (Oxf) 2016;84(6):799-808 «PMID: 26010808»PubMed
- Burgos N, Toloza FJK, Singh Ospina NM, ym. Clinical Outcomes After Discontinuation of Thyroid Hormone Replacement: A Systematic Review and Meta-Analysis. Thyroid 2021;31(5):740-751 «PMID: 33161885»PubMed
- Jonklaas J. Optimal Thyroid Hormone Replacement. Endocr Rev 2022;43(2):366-404 «PMID: 34543420»PubMed
- Briesacher BA, Andrade SE, Fouayzi H, ym. Comparison of drug adherence rates among patients with seven different medical conditions. Pharmacotherapy 2008;28(4):437-43 «PMID: 18363527»PubMed
- Briesacher BA, Andrade SE, Fouayzi H, ym. Medication adherence and use of generic drug therapies. Am J Manag Care 2009;15(7):450-6 «PMID: 19589012»PubMed
- Caron P, Declèves X. The Use of Levothyroxine Absorption Tests in Clinical Practice. J Clin Endocrinol Metab 2023;108(8):1875-1888 «PMID: 36916146»PubMed
- Walker JN, Shillo P, Ibbotson V, ym. A thyroxine absorption test followed by weekly thyroxine administration: a method to assess non-adherence to treatment. Eur J Endocrinol 2013;168(6):913-7 «PMID: 23554450»PubMed
- McMillan M, Rotenberg KS, Vora K, ym. Comorbidities, Concomitant Medications, and Diet as Factors Affecting Levothyroxine Therapy: Results of the CONTROL Surveillance Project. Drugs R D 2016;16(1):53-68 «PMID: 26689565»PubMed
- Thayakaran R, Adderley NJ, Sainsbury C, ym. Thyroid replacement therapy, thyroid stimulating hormone concentrations, and long term health outcomes in patients with hypothyroidism: longitudinal study. BMJ 2019;366():l4892 «PMID: 31481394»PubMed
- Lillevang-Johansen M, Abrahamsen B, Jørgensen HL, ym. Duration of over- and under-treatment of hypothyroidism is associated with increased cardiovascular risk. Eur J Endocrinol 2019;180(6):407-416 «PMID: 31035256»PubMed
- Perros P, Nirantharakumar K, Hegedüs L. Recent evidence sets therapeutic targets for levothyroxine-treated patients with primary hypothyroidism based on risk of death. Eur J Endocrinol 2021;184(2):C1-C3 «PMID: 33306038»PubMed
- Flynn RW, Bonellie SR, Jung RT, ym. Serum thyroid-stimulating hormone concentration and morbidity from cardiovascular disease and fractures in patients on long-term thyroxine therapy. J Clin Endocrinol Metab 2010;95(1):186-93 «PMID: 19906785»PubMed
- Flinterman LE, Kuiper JG, Korevaar JC, ym. Impact of a Forced Dose-Equivalent Levothyroxine Brand Switch on Plasma Thyrotropin: A Cohort Study. Thyroid 2020;30(6):821-828 «PMID: 32188356»PubMed
- Okosieme OE, Belludi G, Spittle K, ym. Adequacy of thyroid hormone replacement in a general population. QJM 2011;104(5):395-401 «PMID: 21109503»PubMed
- Rodondi N, den Elzen WP, Bauer DC, ym. Subclinical hypothyroidism and the risk of coronary heart disease and mortality. JAMA 2010;304(12):1365-74 «PMID: 20858880»PubMed
- Razvi S, Weaver JU, Butler TJ, ym. Levothyroxine treatment of subclinical hypothyroidism, fatal and nonfatal cardiovascular events, and mortality. Arch Intern Med 2012;172(10):811-7 «PMID: 22529180»PubMed
- Somwaru LL, Arnold AM, Joshi N, ym. High frequency of and factors associated with thyroid hormone over-replacement and under-replacement in men and women aged 65 and over. J Clin Endocrinol Metab 2009;94(4):1342-5 «PMID: 19126628»PubMed
- Olkkola K,Kiviluoma K, Saari T ym. (toim.). Anestesiologia, teho-, ensi- ja kivunhoito. 2021. 4., uudistettu painos. Kustannus Oy Duodecim
- Ross DS, Cooper DS, Mulder JE. Myxedema coma. UpToDate. UpToDate Inc. https://www.uptodate.com/contents/myxedema-coma (Accessed on Jan, 2023) «https://www.uptodate.com/contents/myxedema-coma»16
- Brent GA, Weetman AP. Hypothyroidism and Thyroiditis teoksessa Williams Textbook of Endocrinology (Toim. Melmed, Shlomo ym.) (14th Edition). Elsevier - OHCE, 2020.
- Raivio R. Väitöskirja. Hoidon jatkuvuus perusterveydenhuollossa. 2016. Tampere University Press https://urn.fi/URN:ISBN:978-952-03-0178-1 «https://urn.fi/URN:ISBN:978-952-03-0178-1»17
- Raivio R, Holmberg-Marttila D, Mattila KJ. Patients' assessments of the continuity of primary care in Finland: a 15-year follow-up questionnaire survey. Br J Gen Pract 2014;64(627):e657-63 «PMID: 25267052»PubMed
- Mitchell AL, Hegedüs L, Žarković M, ym. Patient satisfaction and quality of life in hypothyroidism: An online survey by the british thyroid foundation. Clin Endocrinol (Oxf) 2021;94(3):513-520 «PMID: 32978985»PubMed
- Peterson SJ, Cappola AR, Castro MR, ym. An Online Survey of Hypothyroid Patients Demonstrates Prominent Dissatisfaction. Thyroid 2018;28(6):707-721 «PMID: 29620972»PubMed
- Perros P, Hegedüs L, Nagy EV, ym. The Impact of Hypothyroidism on Satisfaction with Care and Treatment and Everyday Living: Results from E-Mode Patient Self-Assessment of Thyroid Therapy, a Cross-Sectional, International Online Patient Survey. Thyroid 2022;32(10):1158-1168 «PMID: 35959734»PubMed
- Perros P, Nagy EV, Papini E, ym. Hypothyroidism and Somatization: Results from E-Mode Patient Self-Assessment of Thyroid Therapy, a Cross-Sectional, International Online Patient Survey. Thyroid 2023;33(8):927-939 «PMID: 37134204»PubMed
- Panicker V, Evans J, Bjøro T, ym. A paradoxical difference in relationship between anxiety, depression and thyroid function in subjects on and not on T4: findings from the HUNT study. Clin Endocrinol (Oxf) 2009;71(4):574-80 «PMID: 19751298»PubMed
- Borson-Chazot F, Terra JL, Goichot B, ym. What Is the Quality of Life in Patients Treated with Levothyroxine for Hypothyroidism and How Are We Measuring It? A Critical, Narrative Review. J Clin Med 2021;10(7): «PMID: 33808358»PubMed
- Jørgensen P, Langhammer A, Krokstad S, ym. Diagnostic labelling influences self-rated health. A prospective cohort study: the HUNT Study, Norway. Fam Pract 2015;32(5):492-9 «PMID: 26240089»PubMed
- Sawicka-Gutaj N, Ruchala M, Feldt-Rasmussen U, ym. Patients with Benign Thyroid Diseases Experience an Impaired Sex Life. Thyroid 2018;28(10):1261-1269 «PMID: 30039748»PubMed
- Sairauspoissaolon tarpeen arviointi. Käypä hoito -suositus. Suomalaisen Lääkäriseuran Duodecimin Verkostovaliokunnan asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim, 2019 (viitattu 12.9.2023). Saatavilla internetissä: www.kaypahoito.fi «»6
- Wekking EM, Appelhof BC, Fliers E, ym. Cognitive functioning and well-being in euthyroid patients on thyroxine replacement therapy for primary hypothyroidism. Eur J Endocrinol 2005;153(6):747-53 «PMID: 16322379»PubMed
- Saravanan P, Chau WF, Roberts N, ym. Psychological well-being in patients on 'adequate' doses of l-thyroxine: results of a large, controlled community-based questionnaire study. Clin Endocrinol (Oxf) 2002;57(5):577-85 «PMID: 12390330»PubMed
- Saltevo J, Kautiainen H, Mäntyselkä P, ym. The Relationship between Thyroid Function and Depressive Symptoms-the FIN-D2D Population-Based Study. Clin Med Insights Endocrinol Diabetes 2015;8():29-33 «PMID: 25987853»PubMed
- Karmisholt J, Andersen S, Laurberg P. Weight loss after therapy of hypothyroidism is mainly caused by excretion of excess body water associated with myxoedema. J Clin Endocrinol Metab 2011;96(1):E99-103 «PMID: 20926526»PubMed
- Wiersinga WM, Duntas L, Fadeyev V, ym. 2012 ETA Guidelines: The Use of L-T4 + L-T3 in the Treatment of Hypothyroidism. Eur Thyroid J 2012;1(2):55-71 «PMID: 24782999»PubMed
- Kraut E, Farahani P. A Systematic Review of Clinical Practice Guidelines' Recommendations on Levothyroxine Therapy Alone versus Combination Therapy (LT4 plus LT3) for Hypothyroidism. Clin Invest Med 2015;38(6):E305-13 «PMID: 26654514»PubMed
- Lan H, Wen J, Mao Y, ym. Combined T4 + T3 therapy versus T4 monotherapy effect on psychological health in hypothyroidism: A systematic review and meta-analysis. Clin Endocrinol (Oxf) 2022;97(1):13-25 «PMID: 35445422»PubMed
- Leese GP, Soto-Pedre E, Donnelly LA. Liothyronine use in a 17 year observational population-based study - the tears study. Clin Endocrinol (Oxf) 2016;85(6):918-925 «PMID: 26940864»PubMed
- Tariq A, Wert Y, Cheriyath P, ym. Effects of Long-Term Combination LT4 and LT3 Therapy for Improving Hypothyroidism and Overall Quality of Life. South Med J 2018;111(6):363-369 «PMID: 29863229»PubMed
- DiStefano J 3rd, Jonklaas J. Predicting Optimal Combination LT4 + LT3 Therapy for Hypothyroidism Based on Residual Thyroid Function. Front Endocrinol (Lausanne) 2019;10():746 «PMID: 31803137»PubMed
- Jonklaas J, Bianco AC, Cappola AR, ym. Evidence-Based Use of Levothyroxine/Liothyronine Combinations in Treating Hypothyroidism: A Consensus Document. Thyroid 2021;31(2):156-182 «PMID: 33276704»PubMed
- Yi W, Kim BH, Kim M, ym. Heart Failure and Stroke Risks in Users of Liothyronine With or Without Levothyroxine Compared with Levothyroxine Alone: A Propensity Score-Matched Analysis. Thyroid 2022;32(7):764-771 «PMID: 35570696»PubMed
- Khan W, Van Der Gugten G, Holmes DT. Thyrotoxicosis due to 1000-fold error in compounded liothyronine: A case elucidated by mass spectrometry. Clin Mass Spectrom 2019;11():8-11 «PMID: 34841067»PubMed
- Van Tassell B, Wohlford GF 4th, Linderman JD, ym. Pharmacokinetics of L-Triiodothyronine in Patients Undergoing Thyroid Hormone Therapy Withdrawal. Thyroid 2019;29(10):1371-1379 «PMID: 31364488»PubMed
- Saberi M, Utiger RD. Serum thyroid hormone and thyrotropin concentrations during thyroxine and triiodothyronine therapy. J Clin Endocrinol Metab 1974;39(5):923-7 «PMID: 4422006»PubMed
- Nicoloff JT, Low JC, Dussault JH, ym. Simultaneous measurement of thyroxine and triiodothyronine peripheral turnover kinetics in man. J Clin Invest 1972;51(3):473-83 «PMID: 4110897»PubMed
- Celi FS, Zemskova M, Linderman JD, ym. Metabolic effects of liothyronine therapy in hypothyroidism: a randomized, double-blind, crossover trial of liothyronine versus levothyroxine. J Clin Endocrinol Metab 2011;96(11):3466-74 «PMID: 21865366»PubMed
- Terveydenhuoltolaki 30.12.2010/1326. §24. https://www.finlex.fi/fi/laki/ajantasa/2010/20101326 «https://www.finlex.fi/fi/laki/ajantasa/2010/20101326»18
- Laki potilaan asemasta ja oikeuksista 17.8.1992/785. 4a§. https://www.finlex.fi/fi/laki/ajantasa/1992/19920785 «https://www.finlex.fi/fi/laki/ajantasa/1992/19920785»19
- Alexander EK, Pearce EN, Brent GA, ym. 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. Thyroid 2017;27(3):315-389 «PMID: 28056690»PubMed
- Osinga JAJ, Derakhshan A, Feldt-Rasmussen U, ym. TSH and FT4 Reference Interval Recommendations and Prevalence of Gestational Thyroid Dysfunction: Quantification of Current Diagnostic Approaches. J Clin Endocrinol Metab 2024;109(3):868-878 «PMID: 37740543»PubMed
- De Groot L, Abalovich M, Alexander EK, ym. Management of thyroid dysfunction during pregnancy and postpartum: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2012;97(8):2543-65 «PMID: 22869843»PubMed
- Lee RH, Spencer CA, Mestman JH, ym. Free T4 immunoassays are flawed during pregnancy. Am J Obstet Gynecol 2009;200(3):260.e1-6 «PMID: 19114271»PubMed
- Aguree S, Gernand AD. Plasma volume expansion across healthy pregnancy: a systematic review and meta-analysis of longitudinal studies. BMC Pregnancy Childbirth 2019;19(1):508 «PMID: 31856759»PubMed
- Patel J, Landers K, Li H, ym. Thyroid hormones and fetal neurological development. J Endocrinol 2011;209(1):1-8 «PMID: 21212091»PubMed
- Filetti S, Durante C, Hartl D, ym. Thyroid cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Ann Oncol 2019;30(12):1856-1883 «PMID: 31549998»PubMed
- Suomen Kilpirauhassyöpäryhmä. Papillaarinen ja follikulaarinen kilpirauhasen syöpä. https://ammattilaiset.terveyskyla.fi/tietoa/papillaarinen-ja-follikulaarinen-kilpirauhasen-syöpä «https://ammattilaiset.terveyskyla.fi/tietoa/papillaarinen-ja-follikulaarinen-kilpirauhasen-syöpä»20
- Haugen BR, Alexander EK, Bible KC, ym. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid 2016;26(1):1-133 «PMID: 26462967»PubMed
- Welch JJG, Ames B, Cohen LE, ym. Management of childhood cancer survivors at risk for thyroid function abnormalities: A Delphi study. Pediatr Blood Cancer 2022;69(12):e29942 «PMID: 36069601»PubMed
- Danner E, Niuro L, Huopio H, ym. Incidence of primary congenital hypothyroidism over 24 years in Finland. Pediatr Res 2023;93(3):649-653 «PMID: 35661828»PubMed
- Wassner AJ. Congenital Hypothyroidism. Clin Perinatol 2018;45(1):1-18 «PMID: 29405999»PubMed
- Linko-Parvinen A, Kouki A, Uitto J. Synnynnäisen hypotyreoosin seulonta vastasyntyneiltä kuiva- ja napaverinäytteistä. Lääkäril 2018;73:512-7
- Rose SR, Wassner AJ, Wintergerst KA, ym. Congenital Hypothyroidism: Screening and Management. Pediatrics 2023;151(1): «PMID: 36827523»PubMed
- van Trotsenburg P, Stoupa A, Léger J, ym. Congenital Hypothyroidism: A 2020-2021 Consensus Guidelines Update-An ENDO-European Reference Network Initiative Endorsed by the European Society for Pediatric Endocrinology and the European Society for Endocrinology. Thyroid 2021;31(3):387-419 «PMID: 33272083»PubMed
- Niuro L, Danner E, Viikari L, ym. Treatment of Congenital Hypothyroidism: Impact of Secular Changes in Levothyroxine Initial Dose on Early Growth. Horm Res Paediatr 2023;96(4):376-384 «PMID: 36476603»PubMed
- Hunter I, Greene SA, MacDonald TM, ym. Prevalence and aetiology of hypothyroidism in the young. Arch Dis Child 2000;83(3):207-10 «PMID: 10952634»PubMed
- Crisafulli G, Gallizzi R, Aversa T, ym. Thyroid function test evolution in children with Hashimoto's thyroiditis is closely conditioned by the biochemical picture at diagnosis. Ital J Pediatr 2018;44(1):22 «PMID: 29415743»PubMed
- Saari A, Pokka J, Mäkitie O, ym. Early Detection of Abnormal Growth Associated with Juvenile Acquired Hypothyroidism. J Clin Endocrinol Metab 2021;106(2):e739-e748 «PMID: 33245341»PubMed
- Jonklaas J. Sex and age differences in levothyroxine dosage requirement. Endocr Pract 2010;16(1):71-9 «PMID: 19833578»PubMed
- Paone L, Fleisch AF, Feldman HA, ym. Liothyronine Improves Biochemical Control of Congenital Hypothyroidism in Patients with Central Resistance to Thyroid Hormone. J Pediatr 2016;175():167-172.e1 «PMID: 27178621»PubMed
- Torlontano M, Durante C, Torrente I, ym. Type 2 deiodinase polymorphism (threonine 92 alanine) predicts L-thyroxine dose to achieve target thyrotropin levels in thyroidectomized patients. J Clin Endocrinol Metab 2008;93(3):910-3 «PMID: 18073314»PubMed
- Ross DS. Central hypothyroidism. UpToDate. April 2022. https://www.uptodate.com/contents/central-hypothyroidism «https://www.uptodate.com/contents/central-hypothyroidism»21

