Kilpirauhasen vajaatoiminta
Ota käyttöön
- Luentomateriaali: «https://www.kaypahoito.fi/khl00143»1
- Kaavio: Hypotyreoosin diagnostiikkakaavio «Hypotyreoosin diagnostiikkakaavio»1
- Taulukko: Kilpirauhashormonien tulkinta hypotyreoosissa «Kilpirauhashormonien tulkinta hypotyreoosissa....»1
- Taulukko: Kliinisen kilpirauhasen vajaatoiminnan oireet, löydökset ja erotusdiagnostiikka elinjärjestelmittäin «Kliinisen kilpirauhasen vajaatoiminnan oireet, löydökset ja erotusdiagnostiikka elinjärjestelmittäin. Suomennettu ja muokattu lähteestä ....»5
- Taulukko: Epätyypillisesti käyttäytyvien kilpirauhasarvojen syyt ja niiden selvittely «Epätyypillisesti käyttäytyvien kilpirauhasarvojen syyt ja niiden selvittely , , ....»9
- Kuva: Tyroksiinihoidon aloitusannos ja annoksen muutokset aikuisilla «Tyroksiinihoidon aloitusannos ja annoksen muutokset aikuisilla»2
- Kuva: Tyroksiinihoidon tarpeen arviointi raskaana olevilla naisilla, joilla ei ole ollut tyroksiinia käytössä ennen raskautta «hoi50133d.pdf»3
Miten viitata Käypä hoito -suositukseen? «K1»1
Vastuun rajaus
- Käypä hoito -suositukset ja Vältä viisaasti -suositukset ovat asiantuntijoiden laatimia yhteenvetoja yksittäisten sairauksien diagnostiikan ja hoidon vaikuttavuudesta. Suositukset toimivat lääkärin tai muun terveydenhuollon ammattilaisen päätöksenteon tukena hoitopäätöksiä tehtäessä. Ne eivät korvaa lääkärin tai muun terveydenhuollon ammattilaisen omaa arviota yksittäisen potilaan parhaasta mahdollisesta diagnostiikasta, hoidosta ja kuntoutuksesta.
- Ks. lisätietoa Mitä Käypä hoito -suositukset ovat ja miten niitä käytetään «Mitä Käypä hoito -suositukset ovat ja miten niitä käytetään?»1.
Keskeinen sanoma
- Primaarisen kilpirauhasen vajaatoiminnan (hypotyreoosin) toteaminen ja hoito tyroksiinilla on yleensä selväpiirteistä ja toteutetaan pääosin avoterveydenhuollossa (perusterveydenhuollossa, työterveyshuollossa tai yksityissektorilla). Lapsen hypotyreoosin hoitoa ohjaa lastenlääkäri.
- Epäily kilpirauhasen vajaatoiminnasta voi syntyä oireiden perusteella, mutta diagnoosin tulee perustua laboratoriomäärityksiin.
- Kilpirauhasen vajaatoiminnan oireet ovat usein epäspesifisiä, ja samanlaisia oireita ilmenee lukuisissa muissakin somaattisissa ja psyykkisissä sairauksissa.
- Kliinisen hypotyreoosin tavallisia oireita ja löydöksiä ovat väsymys, kuiva iho, turvotus, palelu, muistihäiriöt, kuukautishäiriöt, infertiliteetti, suuri kolesterolipitoisuus ja anemia. Lapsella pituuskasvu voi hidastua ja pituuteen suhteutettu paino voi samanaikaisesti nousta.
- Tyypillisten oireiden tai löydösten yhteydessä hypotyreoosi tulisi sulkea pois tyreotropiini (TSH) -pitoisuuden määrityksellä. Lapsille suositellaan myös vapaan tyroksiinin (T4-V) pitoisuuden määritystä.
- Kliinisessä primaarisessa hypotyreoosissa TSH-arvo on yli viitealueen ylärajan ja T4-V-arvo alle viitealueen alarajan.
- Kliinistä hypotyreoosia hoidetaan aina.
- Subkliinisessä hypotyreoosissa TSH-arvo on toistetusti yli viitealueen ylärajan ja T4-V-arvo viitealueella.
- Subkliininen hypotyreoosi hoidetaan tietyissä erityistilanteissa, kuten oireisilla ja raskautta suunnittelevilla potilailla, sekä useimmiten, kun TSH-pitoisuus on toistetusti vähintään 10 mU/l.
- Tyroksiinihoitoa ei tule aloittaa, jos kilpirauhasarvot ovat viitealueella, vaikka henkilöllä olisi kilpirauhasen vajaatoimintaan sopivia oireita, kuten ylipainoa ja väsymystä.
- Jos kilpirauhashormonihoito on aloitettu ilman diagnostisia perusteita, voidaan tyroksiinihoito kokeilla lopettaa.
- Hypotyreoosin hoidon tavoite on korjata hypotyreoosin oireet ja löydökset sekä normalisoida TSH-arvo viitealueelle. Hypotyreoosin hoito toteutetaan synteettisellä tyroksiinilla.
- Yleensä seurannassa riittää laboratoriokokeeksi TSH-mittaus. T4-V-määritys kannattaa tehdä hoidon alkuvaiheessa, jos potilas on oireinen siitä huolimatta, että TSH-arvo on viitealueella, jos epäillään adherenssiongelmaa, jos seurataan sentraalista hypotyreoosia tai potilas on lapsi.
- Hypotyreoosi vaatii säännöllistä seurantaa, koska tyroksiinin annostarve voi muuttua.
- Vakaassa tilanteessa seurantaväli voi olla 1–2 vuotta. Tiheämpää seurantaa (6–12 viikon välein) tarvitaan, jos kilpirauhashormonilääkityksen annosta muutetaan tai jos paino, vointi tai muu lääkitys olennaisesti muuttuu.
- Liian suuri tai pieni tyroksiiniannos lisää sairastavuutta ja kuolleisuutta, minkä vuoksi TSH-arvo pyritään pitämään viitealueella. Liian suuri tyroksiiniannos (TSH-arvo alle 0,1 mU/l) lisää etenkin eteisvärinän ja osteoporoosin riskiä.
- Iäkkäillä potilailla liian suuren tyroksiiniannoksen riskit korostuvat.
- Potilasohjauksessa on olennaista lääkkeen oton sekä laboratoriokoeseurannan ohjeistus.
- Työikäinen potilas saattaa tarvita tukea työkyvyn ylläpitämisessä, koska hypotyreoosipotilailla on suurentunut sairauspoissaolojen ja työkyvyttömyyseläkkeelle joutumisen riski.
- Mikäli potilaalla esiintyy oireita tavoitellusta TSH-arvosta huolimatta ja muiden sairauksien, lääkkeiden, elämäntilanteen ja elintapojen vaikutukset oireisiin on tutkittu ja hoidettu ensin, voi endokrinologian erikoislääkäri tai kilpirauhassairauksien hoitoon perehtynyt sisätautilääkäri suunnitella hoitokokeilun synteettisen levotyroksiinin (T4) ja liotyroniinin (T3) yhdistelmähoidolla. TSH-arvon tulee pysyä viitealueella yhdistelmähoidon aikana.
- T4 + T3 -yhdistelmähoito ei ilmeisesti paranna potilaan elämänlaatua, väsymystä masennusta, ahdistuneisuutta tai kipua tyroksiinimonoterapiaan verrattuna kliinistä kilpirauhasen vajaatoimintaa sairastavilla potilailla.
- T3-monoterapiaa tai eläinperäisiä valmisteita ei suositella.
- Lasten, raskaana olevien ja kilpirauhassyöpäpotilaiden hoitoon liittyy erityispiirteitä.
Tiivistelmä ja potilasversio
- Suosituksen tiivistelmä «Kilpirauhasen vajaatoiminta»1
- Suosituksen yleiskielinen potilasversio suomeksi «Kilpirauhasen vajaatoiminta (hypotyreoosi)»2 ja potilasversio ruotsiksi «Underfunktion av sköldkörteln (hypotyreos)»3
Aiheen rajaus
- Kilpirauhasen vajaatoimintaan sopivien oireiden ja löydösten erotusdiagnostiikkaa ei käsitellä yksityiskohtaisesti tässä suosituksessa, vaan suositukseen on lisätty linkit muihin näitä oireita ja löydöksiä käsitteleviin ohjeisiin ja suosituksiin.
Tavoitteet
- Suosituksen tavoitteena on
- selkeyttää ja yhdenmukaistaa hypotyreoosin diagnostiikkaa ja hoitoa
- vähentää liian suureen tai liian pieneen kilpirauhashormoniannokseen liittyviä terveyshaittoja
- parantaa potilaiden informointia kilpirauhasen vajaatoiminnan diagnostiikan ja hoidon perusteista, hoidon tavoitteista ja seurantasuunnitelmasta
- edistää tyroksiinihoidosta huolimatta jatkuvien oireiden syiden tunnistamista, selvittelyä ja hoitoa
- parantaa potilaiden elämänlaatua, työ- ja toimintakykyä.
Kohderyhmä
- Hypotyreoosin diagnostiikasta ja hoidosta vastaavat lääkärit, hoidon seurantaa toteuttavat terveydenhuollon ammattihenkilöt, lääketieteen ja terveysalan opiskelijat ja apteekkien farmaseuttinen henkilöstö.
Määritelmät
- Hypotyreoosi tarkoittaa kilpirauhasen vajaatoimintaa eli sitä, että elimistössä on tarpeeseen nähden liian vähän kilpirauhashormoneita.
- Hypotyreoosin määritelmä perustuu laboratoriotutkimuksiin, koska hypotyreoosin oirekuva ei ole spesifinen (ks. kuva «Hypotyreoosin oireiden ja löydösten esiintyminen terveillä ja hypotyreoosia sairastavilla»1).
- Kliinisessä hypotyreoosissa TSH-arvo (tyreotropiini) on yli viitealueen ylärajan ja T4-V-arvo (vapaa tyroksiini) on alle viitealueen alarajan (ks. kuva «Hypotyreoosin diagnostiikkakaavio»2, «hoi50133a.pdf»1 (PDF) ja taulukko «Kilpirauhashormonien tulkinta hypotyreoosissa....»1).
- Subkliinisessä hypotyreoosissa TSH-arvo on toistuvasti yli viitealueen ylärajan, mutta
T4-V-arvo on viitealueella (ks. kuva «Hypotyreoosin diagnostiikkakaavio»2, «hoi50133a.pdf»1 (PDF) ja taulukko «Kilpirauhashormonien tulkinta hypotyreoosissa....»1).
- Lievässä subkliinisessä hypotyreoosissa TSH-pitoisuus on alle 10 mU/l (ks. taulukko «Kilpirauhashormonien tulkinta hypotyreoosissa....»1).
- Merkittävässä subkliinisessä hypotyreoosissa TSH-pitoisuus on vähintään 10 mU/l (ks. taulukko «Kilpirauhashormonien tulkinta hypotyreoosissa....»1).
- Primaarisessa hypotyreoosissa kilpirauhanen ei tuota elimistön tarpeisiin nähden riittävästi kilpirauhashormoneja.
- Sentraalisessa hypotyreoosissa kilpirauhanen ei tuota riittävästi kilpirauhashormoneita aivolisäke-kilpirauhasakselin toiminnan häiriön vuoksi (ks. kuva «Hypotyreoosin diagnostiikkakaavio»2, «hoi50133a.pdf»1 (PDF) ja taulukko «Kilpirauhashormonien tulkinta hypotyreoosissa....»1).
- Erittäin harvinainen perifeerinen hypotyreoosi johtuu kilpirauhashormonien lisääntyneestä kulutuksesta tai kilpirauhashormoniresistenssistä.
| * T3-V-määrityksestä ei ole hyötyä hypotyreoosin diagnostiikassa. N = normaali eli viitealueella ↑= yli viitealueen ylärajan ↓ = alle viitealueen alarajan |
||||
| Hypotyreoosin luokittelu | Lievä subkliininen hypotyreoosi TSH ≤ 10 mU/l |
Subkliininen hypotyreoosi TSH > 10 mU/l |
Primaarinen kliininen hypotyreoosi |
Sentraalinen hypotyreoosi |
| Oirekuva | oireeton tai vähäoireinen |
oireeton tai vähäoireinen |
oireinen | oireinen |
| TSH | ↑ | ↑ | ↑ | N tai ↓ |
| T4-V | N | N | ↓ | ↓ |
| T3-V* | N | N | N tai ↓ | N tai ↓ |
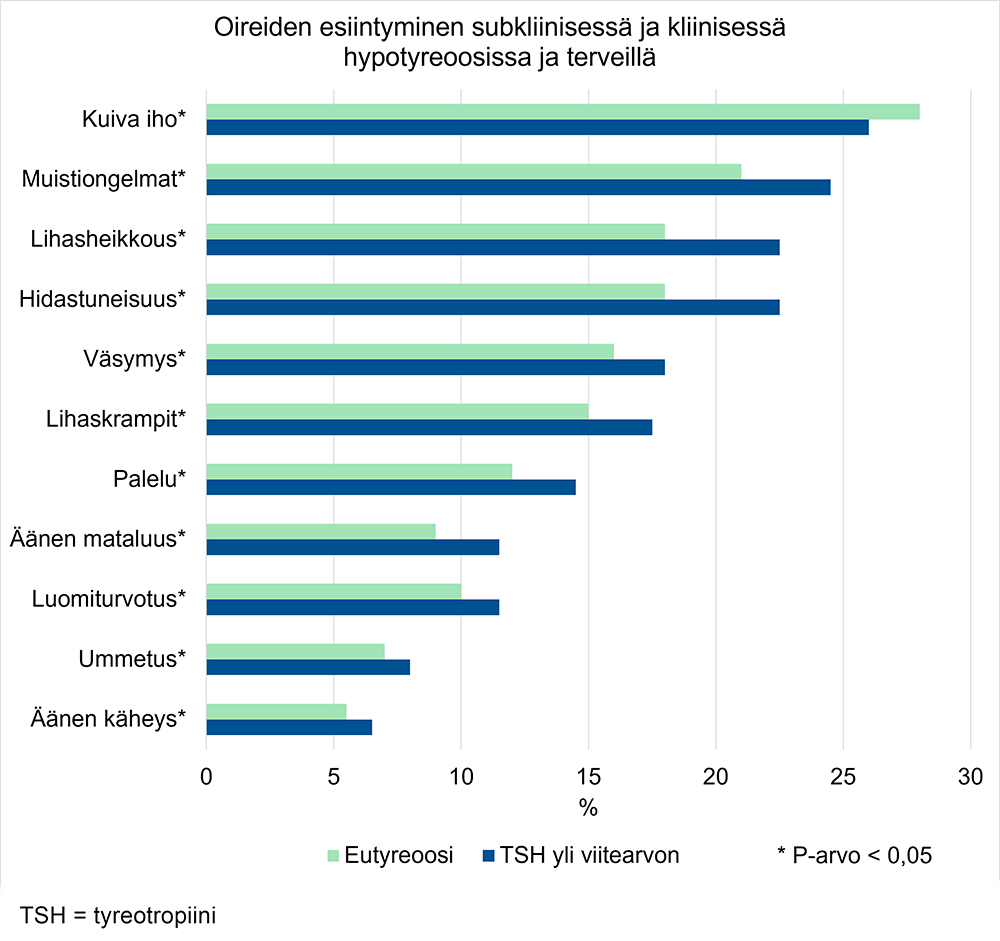
Hypotyreoosin oireiden ja löydösten esiintyminen terveillä ja hypotyreoosia sairastavilla
Mukailtu lähteestä: Canaris GJ, Manowitz NR, Mayor G ym. The Colorado Thyroid Disease Prevalence Study. Arch Intern Med 2000;160:526-34
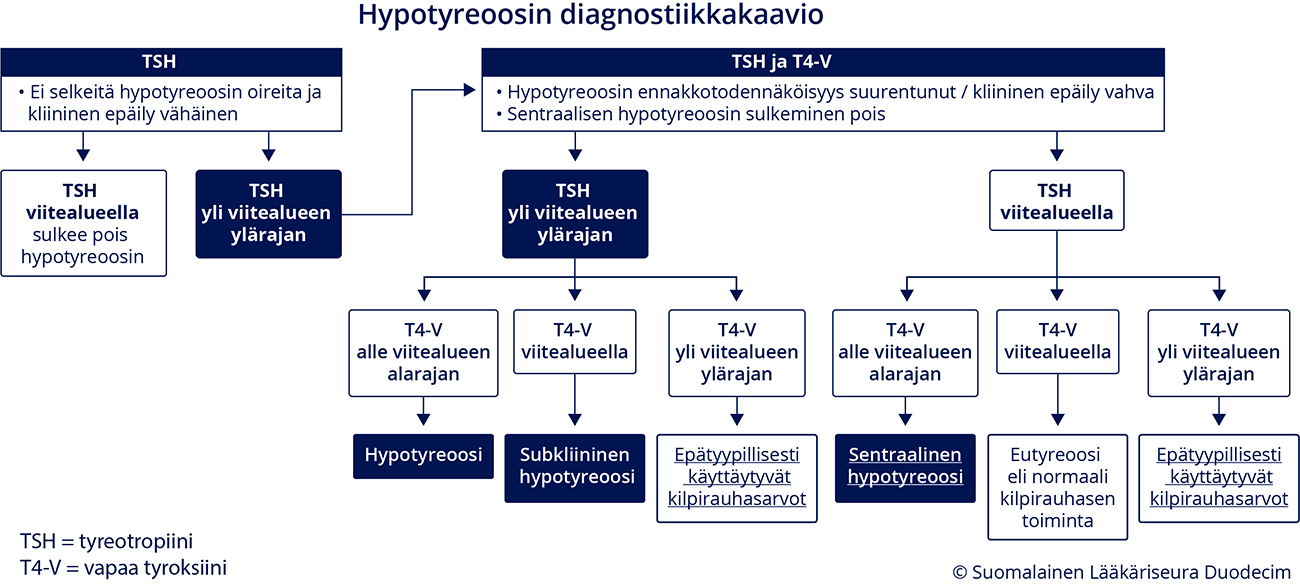
Hypotyreoosin diagnostiikkakaavio. Avaa kaavion PDF-versio tästä linkistä «hoi50133a.pdf»1.
Mukailtu lähteestä: Chaker L, Bianco AC, Jonklaas J ym. Hypothyroidism. Lancet 2017;390:1550-62
Patogeneesi
Primaarinen kilpirauhasen vajaatoiminta
- Valtaosassa hypotyreoositapauksista kyse on primaarisesta eli kilpirauhasperäisestä hypotyreoosista (ks. kuva «Hypotyreoosin diagnostiikkakaavio»2, «hoi50133a.pdf»1 (PDF) ja taulukko «Kilpirauhashormonien tulkinta hypotyreoosissa....»1).
- Yleisin primaarisen hypotyreoosin syy on krooninen autoimmuunityreoidiitti (ks. taulukko «Kilpirauhasen vajaatoiminnan syyt ....»2), «Chaker L, Bianco AC, Jonklaas J, ym. Hypothyroidis...»1.
- Jodin puutteesta johtuva hypotyreoosi on Suomessa harvinainen, ks. kohta Jodi, seleeni ja rauta «A14»2.
- Kilpirauhasen vajaatoiminta voi myös olla seurausta kilpirauhasen osittaisesta tai täydellisestä poistosta, liikatoimintaan annetusta radiojodihoidosta, kaulan alueelle annetusta sädehoidosta, kilpirauhasen kehityshäiriöstä tai kilpirauhashormonien synteesin perinnöllisestä virheestä.
- Useat lääkkeet voivat aiheuttaa kliinistä hypotyreoosia: yleisimpiä ovat litium ja amiodaroni (ks. taulukot «Kilpirauhasen vajaatoimintaa aiheuttavia lääkkeitä ja ravintolisiä....»3 ja «Lääkkeitä ja ravintolisiä, jotka aiheuttavat poikkeavia löydöksiä kilpirauhasen toimintakokeissa ja voivat vaikuttaa tyroksiinin annokseen, mutta eivät välttämättä vaikuta kilpirauhasen toimintaan....»4).
- Amiodaroni voi aiheuttaa kliinisen hypo- tai hypertyreoosin. Hypertyreoosi syntyy joko tulehduksellisen kudostuhon tai jodikuorman vuoksi. Hypertyreoosin riski on suurentunut potilailla, joilla on monikyhmystruuma, autonominen adenooma tai Basedowin tauti. Kliinisen hypotyreoosin riski on suurentunut potilailla, joilla on krooninen autoimmuunityreoidiitti tai jotka ovat aikaisemmin saaneet radiojodihoidon (ks. taulukko «Kilpirauhasen vajaatoimintaa aiheuttavia lääkkeitä ja ravintolisiä....»3).
- Lisäksi amiodaroni vaikuttaa laboratoriokokeisiin siten, että T4-V-pitoisuus suurenee ja T3-V-pitoisuus pienenee amiodaronin dejodinaasi 2:n toimintaa estävän vaikutuksen takia (ks. taulukko «Lääkkeitä ja ravintolisiä, jotka aiheuttavat poikkeavia löydöksiä kilpirauhasen toimintakokeissa ja voivat vaikuttaa tyroksiinin annokseen, mutta eivät välttämättä vaikuta kilpirauhasen toimintaan....»4), «Rao RH, McCready VR, Spathis GS. Iodine kinetic st...»2, «Franklyn JA, Davis JR, Gammage MD, ym. Amiodarone ...»3, «van Beeren HC, Bakker O, Wiersinga WM. Structure-f...»4, «Stanbury JB, Ermans AE, Bourdoux P, ym. Iodine-ind...»5, «Roti E, Minelli R, Gardini E, ym. Thyrotoxicosis f...»6.
Sentraalinen kilpirauhasen vajaatoiminta
- Sentraalinen hypotyreoosi johtuu aivolisäkkeen tai hypotalamuksen toiminnan häiriöstä «Persani L, Brabant G, Dattani M, ym. 2018 European...»7.
- T4-V-arvo on alle viitealueen alarajan ja TSH-arvo viitealueella tai alle viitealueen alarajan (ks. kohta Sentraalinen hypotyreoosi «A1»3, kuva «Hypotyreoosin diagnostiikkakaavio»2, «hoi50133a.pdf»1 (PDF) ja taulukko «Kilpirauhashormonien tulkinta hypotyreoosissa....»1).
- Alle 1 % hypotyreoositapauksista on sentraalisia.
- Sentraalisen hypotyreoosin erotusdiagnostiikassa keskeisiä ovat toiminnalliset kilpirauhasen vajaatoiminnan syyt, kuten yleissairaus, aliravitsemus tai lääkkeet (ks. taulukot «Kilpirauhasen vajaatoiminnan syyt ....»2 ja «Kilpirauhasen vajaatoimintaa aiheuttavia lääkkeitä ja ravintolisiä....»3).
| Primaarinen hypotyreoosi |
|
| Sentraalinen, aivolisäke- ja hypotalamusperäinen hypotyreoosi |
|
| Perifeerinen hypotyreoosi |
|
| Vaikutusmekanismi | Lääke | Hoidossa ja diagnostiikassa huomioitavaa |
|---|---|---|
| Kilpirauhasen hormonieritys vähenee | Aminoglutetimidi Etionamidi Guaifenesiiniä sisältävät yskänlääkkeet Jodi, sitä sisältävät lääkkeet (amiodaroni, kaliumjodidi, merilevätabletit ja röntgenvarjoaineet*) Karbimatsoli Ketiapiini Litium Perkloraatti Propyylitiourasiili Sulfonamidit Talidomidi, lenalidomidi |
* Voi aiheuttaa myös kilpirauhasen liikatoiminnan |
| T4:n imeytymistä suolistosta vähentävät | Alumiinihydroksidi* Ferrosulfaatti (rautavalmisteet)* Magnesium Protonipumpun estäjät** Kalsiumvalmisteet* Orlistaatti Sappihapon sitojat* (kolesevelaami, kolestipoli kolestyramiini) Sevelameeri Sukralfaatti* |
Jos T4-imeytymistä estävä valmiste ei ole korvattavissa toisella lääkkeellä, on huolehdittava
riittävästä annosteluvälistä tyroksiinin ja ko. lääkkeen välillä * Lääke tulee ottaa vähintään 4 tuntia tyroksiinin oton jälkeen ** Lääkkeen pitkän vaikutusajan takia tyroksiiniannosta voidaan joutua lisäämään |
| Kiihdyttää T4:n metaboliaa maksassa (maksan kautta poistuminen lisääntyy) | Amiodaroni Fenobarbitaali* Fenytoiini* Karbamatsepiini* Mitotaani Rifampisiini Sertraliini Valproaatti* |
* Erityisesti kilpirauhasleikatuilla potilailla tyroksiiniannosta voidaan joutua suurentamaan |
| T4:n dejodittuminen T3:ksi vähenee (dejodinaasi 2:n esto) | Amiodaroni Beetasalpaajat Glukokortikoidit (suprafysiologiset annokset) Jodia sisältävät röntgenvarjoaineet Propyylitiourasiili |
|
| Lisääntynynyt dejodinaasi 3:n aktiivisuus (T4:n ja T3:n dejodittuminen inaktiiviseen muotoon) | Tyrosiinikinaasin estäjät** (erit. sunitinibi, aksitinibi, imatinibi, kabotsantinibi, lenvatinibi, sorafenibi, vandetanibi) |
** Hypotyreoosi kehittyy tyypillisesti sekundaarisena destruktiivisen tyreoidiitin ja siihen liittyvän hypertyreoosin jälkeen |
| TSH:n eritys vähenee tai estyy (sentraalinen hypotyreoosi) | Dopamiini Dopamiiniagonistit (kabergoliini, bromokriptiini) Levodopa Dobutamiini Glukortikoidit Immuunivasteen vapauttajat
Interleukiini 1b ja 6 Mitotaani Neuroleptit (ketiapiini ja olantsapiini suurilla annoksilla) Oktreotidi, lanreotidi |
TSH-määritys ei riitä yksistään tyroksiinihoidon seurannassa (lisäksi T4-V-määritys) * Sentraalinen hypotyreoosi kehittyy hypofysiitin seurauksena |
| Lisääntynyt T4:n poistuma ja TSH-erityksen estyminen | Beksaroteeni |
|
| Kilpirauhastulehdus (immunologinen, destruktiivinen) | Alemtutsumabi* Interferoni beeta Amiodaroni Granulosyyttimakrofagikasvutekijä Interferoni alfa** Interleukiini 2* Immuunivasteen vapauttajat
Litium Tyrosiinikinaasin estäjät** (erit. sunitinibi, aksitinibi, imatinibi, kabotsantinibi, sorafenibi, vandetanibi) |
Kilpirauhasen toimintakokeita seurattava ja tyroksiini aloitettava, mikäli todetaan
hypotyreoosi * Voi aiheuttaa Basedowin taudin kilpirauhasen liikatoiminnan (hypertyreoosi) ** Hypotyreoosi kehittyy tyypillisesti sekundaarisena destruktiivisen tyreoidiitin ja siihen liittyvän hypertyreoosin jälkeen *** Voivat aiheuttaa subkliinisen tai kliinisen hypotyreoosin immunologisella mekanismilla tai sentraalisen hypotyreoosin hypofysiitin seurauksena |
| Vaikutusmekanismi | Lääke | Hoidossa ja diagnostiikassa huomioitavaa |
|---|---|---|
| T4:n kantajavalkuaisen (TBG:n) pitoisuus pienenee T4-V-pitoisuus suurenee |
Anaboliset steroidit Androgeenit Danatsoli Glukokortikoidit Nikotiinihappo L-asparaginaasi |
Tyroksiinia käyttävällä henkilöllä lääkeannosta voidaan joutua pienentämään |
| TBG-pitoisuus suurenee T4-V-pitoisuus pienenee |
Estrogeeni (etenkin p.o.) 5-fluorourasiili Morfiini Kapesitabiini Klofibraatti Metadoni Mitotaani SERM (raloksifeeni) Tamoksifeeni |
Tyroksiinia käyttävällä henkilöllä lääkeannosta voidaan joutua suurentamaan |
| T4:n sitoutuminen kantajavalkuaiseen vähenee T4-V-pitoisuus suurenee |
Salisylaatit, ASA Diklofenaakki Fenytoiini Furosemidi (isommilla annoksilla) Hepariini Mitotaani Pienimolekylaarinen hepariini |
Tyroksiinia käyttävällä henkilöllä lääkeannosta voidaan joutua pienentämään |
| Kiihdyttää T4:n maksametaboliaa (maksan kautta poistuminen lisääntyy) T4-V-pitoisuus pienenee |
Fenobarbitaali Fenytoiini Karbamatsepiini Mitotaani Rifampisiini Sertraliini Jotkin tyrosiinikinaasin estäjät (imatinibi) |
Tyroksiinia käyttävällä henkilöllä lääkeannosta voidaan joutua suurentamaan |
| T4:n dejodittuminen T3:ksi vähenee (dejodinaasi 2:n esto) T4-V-pitoisuus suurenee ja T3-V-pitoisuus pienenee |
Amiodaroni Beetasalpaajat (propranololi) Glukokortikoidit (suprafysiologiset annokset) Jodia sisältävät röntgenvarjoaineet Nadololi Propyylitiourasiili |
Tyroksiiniannosta säädetään pääsääntöisesti TSH-pitoisuuden perusteella |
Esiintyvyys
- Luotettavaa tietoa kliinisen hypotyreoosin esiintyvyydestä on vaikea saada. Suomessa tyroksiinin lääkemääräystietoihin perustuva arvio hypotyreoosin esiintyvyydestä oli 3,6 % vuonna 2007 «Virta LJ, Eskelinen SI. Prevalence of hypothyroidi...»8.
- Vuonna 2014 julkaistun meta-analyysin mukaan hypotyreoosin esiintyvyys Euroopassa on 3,05 %, josta valtaosa 85 % on subkliinistä hypotyreoosia «Garmendia Madariaga A, Santos Palacios S, Guillén-...»9.
- Kliinisen hypotyreoosin esiintyvyys on naisilla 0,48 % ja miehillä 0,18 %. Subkliinisen hypotyreoosin esiintyvyys on naisilla 4,61 % ja miehillä 2,83 %
- Vuoden 2022 lopussa 343 496 suomalaista käytti kilpirauhashormonivalmisteita «Kela. Sairausvakuutuksesta korvattavat lääketoimit...»10, «https://tilastot.kela.fi/»2. Kilpirauhasvalmisteita käyttävien määrä on yli kaksinkertaistunut viimeisten 15 vuoden aikana «Metso S, Hakala T, Attanasio R ym. Kilpirauhashorm...»11.
- Erityisluvallisia kilpirauhashormoneja käytti noin 1 % kaikista kilpirauhasvalmisteita käyttävistä potilaista «Metso S, Hakala T, Attanasio R ym. Kilpirauhashorm...»11.
- Valtaosa kilpirauhasvalmisteita käyttävien potilaiden määrän lisääntymisestä selittyy subkliinisen hypotyreoosin hoidon yleistymisellä «Asvold BO, Vatten LJ, Bjøro T. Changes in the prev...»12, «Taylor PN, Iqbal A, Minassian C, ym. Falling thres...»13, «Mendes D, Alves C, Silverio N, ym. Prevalence of U...»14.
- Hypotyreoosi on selvästi yleisempi naisilla kuin miehillä «Virta LJ, Eskelinen SI. Prevalence of hypothyroidi...»8, «Asvold BO, Vatten LJ, Bjøro T. Changes in the prev...»12.
Riskitekijät
- Hypotyreoosin riskiä suurentavia tekijöitä ovat:
- Naissukupuoli. Krooninen autoimmuunityreoidiitti on tavallisempi naisilla.
- Ikä. Yli 60-vuotiailla todetaan enemmän hypotyreoosia kuin nuoremmilla.
- Muu autoimmuunisairaus, kuten keliakia, tyypin 1 diabetes tai Addisonin tauti «Bothra N, Shah N, Goroshi M, ym. Hashimoto's thyro...»15
- Downin tai Turnerin oireyhtymä «Karlsson B, Gustafsson J, Hedov G, ym. Thyroid dys...»16, «Gravholt CH, Andersen NH, Conway GS, ym. Clinical ...»17
- Suvussa esiintyvät kilpirauhasen toimintahäiriöt ja autoimmuunisairaudet. Ensimmäisen asteen sukulaisen Hashimoton tyreoidiitti yhdeksänkertaistaa hypotyreoosin riskin «Bothra N, Shah N, Goroshi M, ym. Hashimoto's thyro...»15.
- Kilpirauhasen leikkaus
- Kilpirauhasen seutuun tai pään alueelle kohdistunut sädehoito
- Jodin liian vähäinen tai liian runsas saanti «Surks M. Iodine-induced thyroid dysfunction. UpToD...»18
- Lapsuusiän painon nousu ja ylipaino nuoruudessa «Ong KK, Kuh D, Pierce M, ym. Childhood weight gain...»19
- Monet hormonitoimintaa häiritsevät ympäristö- ja teollisuuskemikaalit (endocrine disrupting chemicals, EDCs) «Hormonitoimintaa häiritsevät ympäristökemikaalit»2, «Gore AC, Chappell VA, Fenton SE, ym. EDC-2: The En...»20. Vaikutuksia on todettu hormonien biosynteesissä, kuljetuksessa, metaboliassa ja kilpirauhashormonireseptorin aktiivisuudessa.
- Tavallisessa suomalaisessa ruokavaliossa ei ole kilpirauhaseen vaikuttavia ruoka-aineita (kassava, hirssi) merkittävässä määrin.
- Vaikka gluteeniton ruokavalio assosioituu TPOAb-arvon pienenemiseen, ei ole näyttöä siitä, että gluteeniton ruokavalio vaikuttaisi autoimmuunityreoidiitin kehittymiseen tai etenemiseen «Szczuko M, Syrenicz A, Szymkowiak K, ym. Doubtful ...»21. Nykytiedon perusteella ei voi suositella gluteenitonta ruokavaliota autoimmuunityreoidiitin ehkäisyssä «Szczuko M, Syrenicz A, Szymkowiak K, ym. Doubtful ...»21.
Jodi, seleeni ja rauta
- Jodia tarvitaan kilpirauhashormonien synteesissä.
- Tyroksiini sisältää 4 jodiatomia, ja dejodinaation jälkeen aktiivinen hormoni trijodityroniini sisältää 3 jodiatomia «Rayman MP. Multiple nutritional factors and thyroi...»22.
- Valtaosalla suomalaisista jodin saanti on riittävä «Valsta L, Kaartinen N, Tapanainen H ym. (toim). Ra...»23, (ks. Ruokavirasto – Jodi «https://www.ruokavirasto.fi/elintarvikkeet/terveytta-edistava-ruokavalio/ravintoaineet/jodi/»3)
- Suomalaisessa ruokavaliossa noin kolmannes jodista saadaan maidosta ja maitovalmisteista. Toinen merkittävä jodin lähde ovat viljavalmisteet (leipä), joiden valmistuksessa on käytetty jodioitua suolaa (ks. Ruokavirasto – Jodi «https://www.ruokavirasto.fi/elintarvikkeet/terveytta-edistava-ruokavalio/ravintoaineet/jodi/»3).
- Jodin puute lisää struuman ja hypotyreoosin riskiä «Surks M. Iodine-induced thyroid dysfunction. UpToD...»18, «Zimmermann MB, Boelaert K. Iodine deficiency and t...»24.
- Jodin liiallinen saanti on haitallista «Jodin merkitys kilpirauhassairauksissa»3.
- Jodin puute raskauden aikana voi johtaa vastasyntyneen hypotyreoosiin.
- Jodin tarve on aikuisella 150 µg vuorokaudessa. Tämä tarve täyttyy, jos syö ravitsemussuositusten mukaisesti. Mikäli ruokavalio ei sisällä maitovalmisteita tai jodioituja kasvijuomia, kalaa, kananmunaa ja jodioitua suolaa, jodin saanti on todennäköisesti tarvetta pienempää.
- Vegaaniruokavaliota ja muita esimerkiksi allergioiden vuoksi noudatettuja vähän jodia sisältäviä välttämisruokavalioita suositellaan täydennettäväksi 100–175 µg/vrk jodia sisältävillä monivitamiini-kivennäisainevalmisteilla (ks. Ruokavirasto – Vegaaninen ruokavalio «https://www.ruokavirasto.fi/elintarvikkeet/terveytta-edistava-ruokavalio/ravitsemus--ja-ruokasuositukset/vegaaninen-ruokavalio/»4).
- Lisääntyneen tarpeen vuoksi jodin puutteen riskiryhmiin kuuluvat raskaana olevat ja imettävät äidit, joille suositellaan jodia sisältäviä monivitamiini-kivennäisainevalmisteita, jos jodin vuorokausitarve ei täyty ruokavaliolla (raskaana olevilla 175 µg/vrk ja imettävillä 200 µg/vrk).
- Väestötasolla jodin saantia voidaan tutkia määrittämällä virtsan jodin pitoisuutta ja struuman esiintyvyyttä sekä tutkimalla verenkierron tyreoglobuliinin (S-Tygl) ja TSH:n pitoisuuksia.
- Yksilön riittävää jodin saantia ei ole tarkoituksenmukaista arvioida jodidimäärityksellä kilpirauhassairauksien diagnostiikassa, koska virtsan ja veren jodidimääritys kuvastaa vain viimeisten 24–48 tunnin aikaista jodin saantia ja jodin puutteen seuraukset syntyvät yksilötasolla hitaasti «Zimmermann MB, Boelaert K. Iodine deficiency and t...»24, «Zimmermann MB. Methods to assess iron and iodine s...»25, «Ma ZF, Venn BJ, Manning PJ, ym. Iodine Supplementa...»26.
- Seleenin ja raudan merkitys kilpirauhassairauksien patogeneesissa on epäselvä «Seleenin ja raudan merkitys kilpirauhassairauksissa»4, «Wu Q, Rayman MP, Lv H, ym. Low Population Selenium...»27. Suomessa ei esiinny seleenin puutetta (ks. Ruokavirasto – Seleenilannoitus «https://www.ruokavirasto.fi/kasvit/lannoitevalmisteet/laatuvaatimukset/seleeni/»5).
Oireet ja löydökset
Oireet
- Kilpirauhashormonit vaikuttavat lähes kaikissa kudoksissa, minkä vuoksi kilpirauhashormonivaje voi johtaa hyvin moninaisiin ja laaja-alaisiin oireisiin (ks. taulukko «Kliinisen kilpirauhasen vajaatoiminnan oireet, löydökset ja erotusdiagnostiikka elinjärjestelmittäin. Suomennettu ja muokattu lähteestä ....»5). Tarkemmin hypotyreoosin oireet ja löydökset on kuvattu lisätietoaineistossa «Hoitamattoman kliinisen hypotyreoosin oireet ja löydökset»5.
- Kilpirauhasen vajaatoiminnan oireet ovat yksilöllisiä, ja niiden vaikeusaste vaihtelee kilpirauhasen toimintahäiriön asteen mukaan.
- Tunnusomaista vaikealle hypotyreoosille on yleinen aineenvaihdunnan hidastuminen ja lapsella pituuskasvun hidastuminen ja samanaikainen pituuteen suhteutetun painon nousu.
- Kliinisen hypotyreoosin tavallisia oireita ja löydöksiä ovat väsymys, kuiva iho, silmäluomien turvotus, palelu, muistihäiriöt ja ummetus (ks. taulukko «Hoitamattoman kliinisen kilpirauhasen vajaatoiminnan oireiden ja löydösten esiintyvyys....»6).
- Nuorilla naisilla ensioireena voivat olla kuukautishäiriöt tai infertiliteetti.
- Hypotyreoosi on syytä muistaa mahdollisena suuren kolesterolipitoisuuden ja normosytaarisen anemian syynä.
- Yksittäisen hypotyreoosille tyypillisen oireen taustalta löytyy vain harvoin hypotyreoosi.
- Joskus potilas voi syvässäkin hypotyreoosissa olla oireeton tai hyvin vähäoireinen «Carlé A, Pedersen IB, Knudsen N, ym. Hypothyroid s...»28.
- Noin puolet lapsista on diagnoosivaiheessa oireettomia, ks. kohta Lapset «A2»4.
- Iäkkäämmillä hypotyreoosi voi olla vähäoireinen tai oireeton sivulöydös «Ojala A, Strandberg T, Schalin-Jäntti C. Iäkkään p...»29. Vanhuksilla taudinkuva on usein epätyypillinen ja oireet voivat muistuttaa sydämen vajaatoiminnan oireita tai simuloida dementiaa «Biondi B, Cappola AR, Cooper DS. Subclinical Hypot...»30. Joskus iäkkään oireina ovat kaatuilu ja kömpelöityminen, ks. kohta Iäkkäät «A3»5.
- Subkliininen hypotyreoosi ei yleensä selitä hypotyreoosin tavalliseen oirekirjoon kuuluvia oireita. Jopa 70 %:lla «Carlé A, Pedersen IB, Knudsen N, ym. Hypothyroid s...»28 henkilöistä, joilla on normaali kilpirauhasen toiminta (eutyreoosi), voidaan todeta vähintään yksi hypotyreoosin tyyppioire (ks. kuva «Hypotyreoosin oireiden ja löydösten esiintyminen terveillä ja hypotyreoosia sairastavilla»1), «Canaris GJ, Manowitz NR, Mayor G, ym. The Colorado...»31. Tällaisessa tilanteessa on syytä pohtia erotusdiagnostisia vaihtoehtoja (ks. taulukko «Kliinisen kilpirauhasen vajaatoiminnan oireet, löydökset ja erotusdiagnostiikka elinjärjestelmittäin. Suomennettu ja muokattu lähteestä ....»5).
- Kilpirauhasen vajaatoiminta tulee sulkea pois (ks. kuva «Hypotyreoosin diagnostiikkakaavio»2, «hoi50133a.pdf»1 (PDF)), kun potilaalla on hypotyreoosin tyypillisiä oireita tai löydöksiä. Lisäksi tulee huomioida muut erotusdiagnostiset vaihtoehdot (ks. taulukko «Kliinisen kilpirauhasen vajaatoiminnan oireet, löydökset ja erotusdiagnostiikka elinjärjestelmittäin. Suomennettu ja muokattu lähteestä ....»5).
| Elinjärjestelmä | Ilmentymä/oire | Löydökset | Erotusdiagnostiikka (Lääkärin tietokantojen artikkelit vaativat kirjautumisen) |
|---|---|---|---|
| * harvinainen ilmentymä | |||
| Aineenvaihdunta | Painon nousu Palelu Väsymys Heikotus |
Suurentunut painoindeksi, hidastunut aineenvaihdunta, turvotukset, myksödeema*, alentunut kehonlämpö* | Väsymys «Väsymysoire»1 Painon nousu «Lihavuuden puheeksiotto ja arviointi»2 Uniapnea «Uniapnea aikuisilla»3 Unen häiriöt «Unettomuus»4 |
| Sydän- ja verenkiertoelimistö ja keuhkot | Heikentynyt suorituskyky Hengenahdistus |
Bradykardia ja johtumishäiriöt, hypertensio, diastolinen vajaatoiminta*, perikardium- ja pleuranesteily*, homokysteinemia* | Hengenahdistus «Hengenahdistus»4 Kohonnut verenpaine «Kohonnut verenpaine»5 |
| Neurosensoriset | Äänen käheys Makuaistin menetys Heikentynyt näkö tai kuulo |
Neuropatia, sisäkorvan toimintahäiriö, heikentynyt haju- tai makuaisti | Polyneuropatia «Polyneuropatiat»5 Käheys ja äänihäiriöt «Käheys ja äänihäiriöt»6 Makuaistin häiriöt «Makuaistin häiriöt»7 Heikentynyt kuulo «Kuulokäyrän tulkinta ja heikentynyt kuulo»8 |
| Neurologiset ja psyykkiset | Muistiongelmat Parestesiat Mielialamuutokset |
Kognitiivisten toimintojen heikentyminen, hidastuneet jänneheijasteet, masennus, dementia, ataksia*, hermopinneoireet*, kooma* | Masennus «Depressio»9 Väsymys «Väsymysoire»1 Muistipotilaan tutkimukset «Muistipotilaan tutkimukset»10 |
| Suolisto | Ummetus Ruokahaluttomuus |
Vaimentunut ruokatorven motiliteetti, NASH*, askites* | Aikuisen ummetus «Aikuisen ummetus»11 |
| Muut endokriiniset vaikutukset | Infertiliteetti Kuukautishäiriöt Galaktorrea |
Infertiliteetti, seksuaalitoimintojen ongelmat, suurentunut prolaktiini, aivolisäkkeen
hyperplasia*, glukoosiaineenvaihdunnan häiriöt, hyperkolesterolemia ja hypertriglyseridemia, struuma |
Lapsettomuus «Lapsettomuus»12 Kuukautiskierron häiriöt «Gynekologiset vuotohäiriöt»13 Galaktorrea «Erittävä rinta ja imettämättömän rintatulehdus»14 Vaihdevuodet «Vaihdevuosioireet ja hormonihoito»15 Metabolinen oireyhtymä «Metabolinen oireyhtymä»16 |
| Muskuloskeletaaliset | Lihasheikkous Lihaskrampit Nivelsäryt |
Suurentunut kreatiinikinaasi tai suurentuneet transaminaasit | Kipu «Kipu»6 |
| Verenkuva ja hyytymisjärjestelmä | Väsymys Heikotus Verenvuototaipumus |
Lievä normosytaarinen anemia, hankinnainen von Willebrandin tauti*, pienentynyt proteiini C ja S*, suurentunut MCV*, suurentunut trombosyyttikoko* | Aikuisen anemian selvittely «Aikuisten anemian selvittely»17 Verenvuotopotilaan tutkiminen «Verenvuotopotilaan tutkiminen ja hoito»18 |
| Iho ja hiukset | Kuiva iho Hiustenlähtö |
Karhea iho, kulmakarvojen irtoaminen*, kellertävät kämmenet*, pälvikalju * | Hiustenlähtö ja kaljuuntuminen «Hiustenlähtö ja kaljuuntuminen»19 |
| Elektrolyytit ja munuaisfunktio | Heikentyvä munuaisfunktio | Pienentynyt GFR, hyponatremia* | Hyponatremia «Hyponatremia»20 |
| Lapsen kasvu | Hidastunut pituuskasvu ja painon nousu | Suhteellisen pituuden väheneminen ja pituuteen suhteutetun painon (BMI SDS tai pituuspaino) nousu | Lapsen normaali ja poikkeava kasvu «Lapsen normaali ja poikkeava kasvu»21 |
| Oire | Esiintyvyys hypotyreoosissa (%) |
|---|---|
| Heikkous, väsymys | 99 |
| Kuiva iho | 76–97 |
| Silmäluomien tai kasvojen turvotus | 79–90 |
| Palelu, ihon kylmyys | 64–89 |
| Vähentynyt hikoilu | 89 |
| Muistihäiriöt | 66 |
| Keskittymisvaikeus, unohtelu | 46 |
| Ummetus | 48–61 |
| Painon nousu | 54–59 |
| Hiusten lähtö | 57 |
| Perifeerinen turvotus | 55–60 |
| Käheys | 34–52 |
| Kuukautishäiriöt | 32 |
| Palpitaatio, bradykardia | 31 |
Seulonta
- Suomessa primaarinen synnynnäinen hypotyreoosi seulotaan kaikilta vastasyntyneiltä.
- Muutoin kilpirauhasen vajaatoiminnan suuntaamatonta (alla lueteltuihin erityisryhmiin tai oireisiin rajoittumatonta) seulontaa ei suositella, koska se lisää ylidiagnostiikan ja turhien tyroksiinihoitojen riskiä eikä sen terveyshyödystä ole näyttöä «LeFevre ML, U.S. Preventive Services Task Force. S...»32, «Vanderpump MP, Ahlquist JA, Franklyn JA, ym. Conse...»33, «Birtwhistle R, Morissette K, Dickinson JA, ym. Rec...»34, «Taylor PN, Iqbal A, Minassian C, ym. Falling thres...»13, «Hegedüs L, Bianco AC, Jonklaas J, ym. Primary hypo...»35.
- Seulonnan suhteen eri maiden suosituksissa on eroja. Osa kehottaa seulomaan kilpirauhasen vajaatoimintaa iäkkäiltä potilailta (AAFP «Wilson SA, Stem LA, Bruehlman RD. Hypothyroidism: ...»36, ATA/AACE «Garber JR, Cobin RH, Gharib H, ym. Clinical practi...»37), kun taas toiset (U.S. Preventive Services Task Force «LeFevre ML, U.S. Preventive Services Task Force. S...»32, Royal College of Physicians of London «Vanderpump MP, Ahlquist JA, Franklyn JA, ym. Conse...»33, kanadalainen Task Force «Birtwhistle R, Morissette K, Dickinson JA, ym. Rec...»34) suosittelevat välttämään seulontaa oireettomilta potilailta, jotka eivät ole raskaana. Brittiläinen NICE «NICE guideline [NG145]. Thyroid disease: assessmen...»38 suosittaa seulomaan kilpirauhasen vajaatoimintaa oireisilta sekä tietyiltä potilasryhmiltä (muun muassa tyypin 1 diabetes tai muu autoimmuunisairaus, masennus tai ahdistus), mutta muistuttaa, ettei diagnoosi voi perustua pelkkiin oireisiin.
- Taulukossa «Erityisryhmät, joilla hypotyreoosin seulontaa tai sulkemista pois kannattaa harkita
myös oireettomilta henkilöiltä....»7 on lueteltu ne erityisryhmät, joilla hypotyreoosin seulontaa tai sulkemista pois
kannattaa harkita myös oireettomilta henkilöiltä.
- Tyypin 1 diabetesta sairastavista noin 10 %:lle kehittyy hypotyreoosi, ja siksi seulontaa suositellaan diagnoosivaiheessa ja 3–5 vuoden välein (ks. Käypä hoito -suositus Insuliininpuutosdiabetes, taulukko 3: Aikuisen diabeetikon arviokäynnin sisältö «https://www.kaypahoito.fi/hoi50116#T3»6) tai kilpirauhasen vajaatoiminnan oireiden perusteella.
- Downin oireyhtymää sairastavista aikuisista noin 8 %:lla on todettavissa kliininen hypotyreoosi. Hypotyreoosi seulotaan vastasyntyneiltä, 1 kuukauden ikäisiltä ja 12 kuukauden ikäisiltä, minkä jälkeen seulonta tehdään 2 vuoden välein «Karlsson B, Gustafsson J, Hedov G, ym. Thyroid dys...»16.
- Turnerin oireyhtymää sairastavista noin 10–30 %:lle kehittyy hypotyreoosi, ja siksi seulontaa suositellaan vuosittain «Gravholt CH, Andersen NH, Conway GS, ym. Clinical ...»17.
- Lapsuusiässä hoidetun syövän jälkeen esiintyy sekä primaarista että sentraalista hypotyreoosia, mikä tulee huomioida seulonnassa «Viikari L, Jahnukainen J, Lähteenmäki P. Endokriin...»39.
| Raskautta suunnittelevat, joilla on aikaisempia keskenmenoja, ennenaikaisia synnytyksiä tai infertiliteetti |
| Henkilöt, joilla on todettu autoimmuunisairaus (tyypin 1 diabetes, vitiligo, alopecia areata, Addisonin tauti, keliakia, pernisiöösi anemia, APECED) «Garber JR, Cobin RH, Gharib H, ym. Clinical practi...»37, «Mäkimattila S, Harjutsalo V, Forsblom C, ym. Respo...»40 |
| Henkilöt, joilla on hoidettu lapsuusiässä syöpä «Viikari L, Jahnukainen J, Lähteenmäki P. Endokriin...»39 |
| Henkilöt, joilla on Turnerin tai Downin oireyhtymä «Karlsson B, Gustafsson J, Hedov G, ym. Thyroid dys...»16, «Gravholt CH, Andersen NH, Conway GS, ym. Clinical ...»17 |
| Henkilöt, joilla on kilpirauhasen toimintaan mahdollisesti vaikuttava lääkitys: amiodaroni, litium, interferoni alfa, interferoni gamma, immuunivasteen muuntajat (immune check point inhibitors), tyrosiinikinaasin estäjät (ks. taulukot «Kilpirauhasen vajaatoimintaa aiheuttavia lääkkeitä ja ravintolisiä....»3 ja «Lääkkeitä ja ravintolisiä, jotka aiheuttavat poikkeavia löydöksiä kilpirauhasen toimintakokeissa ja voivat vaikuttaa tyroksiinin annokseen, mutta eivät välttämättä vaikuta kilpirauhasen toimintaan....»4), «Garber JR, Cobin RH, Gharib H, ym. Clinical practi...»37, «Taylor PN, Albrecht D, Scholz A, ym. Global epidem...»41 |
Laboratoriodiagnostiikka
- Hypotyreoosin diagnostiikka perustuu kilpirauhashormonien laboratoriotutkimuksiin, joista tärkeimmät ovat tyreoideaa stimuloiva hormoni eli tyreotropiini (TSH) ja vapaa tyroksiini (T4-V) (ks. taulukko «Kilpirauhashormonien tulkinta hypotyreoosissa....»1 ja kuva «Hypotyreoosin diagnostiikkakaavio»2, «hoi50133a.pdf»1 (PDF)), «Demers LM, Spencer CA. Laboratory medicine practic...»42.
- Suuret biotiiniravintolisäannokset aiheuttavat virheitä immunologisissa laboratoriotutkimuksissa, joten ne pitää tauottaa 24 tuntia ennen laboratoriomäärityksiä.
- T3-V-määrityksestä ei ole hyötyä hypotyreoosin diagnostiikassa lukuun ottamatta joitakin poikkeustilanteita, joissa selvitellään epätyypillisesti käyttäytyviä kilpirauhasarvoja (ks. taulukko «Epätyypillisesti käyttäytyvien kilpirauhasarvojen syyt ja niiden selvittely , , ....»9).
- Kilpirauhasen toimintakokeet otetaan ennen tyroksiinilääkkeen annostelua.
Tyreotropiini (TSH)
- Plasman tyreotropiinin (TSH) pitoisuuden määritys on ensisijainen laboratoriomääritys seulottaessa kilpirauhasen hormonitoimintaa, mukaan lukien kliininen tai subkliininen hypotyreoosi.
- Sitä käytetään myös, kun seurataan primaarisen hypotyreoosin tyroksiinikorvaushoidon tehoa.
- TSH-näyte voidaan ottaa kello 7–16, koska TSH-pitoisuuden vuorokausivaihtelu on vähäinen tällä aikavälillä «Russell W, Harrison RF, Smith N, ym. Free triiodot...»43, «Roelfsema F, Pereira AM, Veldhuis JD, ym. Thyrotro...»44.
- TSH-pitoisuudella on vuodenaikavaihtelu. TSH:n pitoisuus on keskimäärin suurempi talvella kuin kesällä. Pitoisuusvaihtelu on kuitenkin keskimäärin vähäistä, joten sillä ei ole merkitystä TSH-pitoisuuden arvioinnissa «Kuzmenko NV, Tsyrlin VA, Pliss MG, ym. Seasonal va...»45, «Wang D, Cheng X, Yu S, ym. Data mining: Seasonal a...»46, «Konno N, Morikawa K. Seasonal variation of serum t...»47.
- Tyroksiinihoidon seurannassa TSH-näyte otetaan ennen tyroksiinin ottoa. Tyroksiini pienentää tulosta noin 0,5 mU/l. Koska vaikutus on rajallinen, epähuomiossa otettu tyroksiini ei estä TSH-näytteen ottoa, mutta tyroksiinin ottaminen tulee merkitä laboratoriotuloksen lisätietoihin.
- Eri laboratoriossa määritetyt TSH-arvot eivät ole suoraan vertailukelpoisia, koska niissä on menetelmäkohtaisia tasoeroja «Thienpont LM, Faix JD, Beastall G. Standardization...»48, «Thienpont LM, Van Uytfanghe K, Beastall G, ym. Rep...»49, «Kilpirauhasen toimintakokeiden laboratoriokohtaisia viitearvoja Suomessa»6.
- Koska useissa tutkimuksissa on havaittu TSH-pitoisuuden suurenevan iän myötä, se on otettu huomioon TSH:n viitearvoissa joissakin laboratorioissa «Kilpirauhasen toimintakokeiden laboratoriokohtaisia viitearvoja Suomessa»6.
- Ks. lisätietoa «Tyreotropiini (TSH)»7.
Vapaa tyroksiini (T4-V)
- Viitealueen alarajan alittava plasman vapaan tyroksiinin (T4-V) pitoisuus viittaa hypotyreoosiin, mutta lievästi alle viitealueen alarajan olevia arvoja todetaan myös terveillä henkilöillä.
- Primaarisessa kilpirauhasperäisessä hypotyreoosissa T4-V-pitoisuus on pieni ja TSH-pitoisuus on suurentunut.
- Sentraalisessa, hypofyysi- tai hypotalamusperäisessä hypotyreoosissa T4-V-pitoisuus on pieni ja TSH-pitoisuus on pieni tai viitealueella.
- Vapaalla tyroksiinilla ei ole merkittävää vuorokausivaihtelua, joten sillä ei ole merkitystä näytteenoton ajoituksessa «Russell W, Harrison RF, Smith N, ym. Free triiodot...»43.
- Tyroksiinihoitoa hypotyreoosiin saavilta potilailta T4-V-näyte tulisi ottaa aamulla ennen seuraavaa lääkeannosta, koska tyroksiinilääkitys suurentaa T4-V-pitoisuutta jopa 20 %. T4-V-pitoisuuden huippu saavutetaan noin 3,5 tuntia lääkkeen otosta, ja pitoisuus saattaa olla suurentunut jopa 9 tuntia lääkkeen otosta «Ain KB, Pucino F, Shiver TM, ym. Thyroid hormone l...»50.
- Ks. lisätietoa «Vapaa tyroksiini (T4-V)»8.
Vapaa trijodityroniini (T3-V)
- Vapaan trijodityroniinin (T3-V) pitoisuuden määritystä käytetään hypotyreoosin diagnostiikassa vain erityistapauksissa, ja sen hyöty on rajallinen (ks. taulukko «Epätyypillisesti käyttäytyvien kilpirauhasarvojen syyt ja niiden selvittely , , ....»9) «Dora JM, Biscolla RPM, Caldas G, ym. Choosing Wise...»51.
- T3-V-pitoisuus on epäherkkä kilpirauhasen vajaatoiminnan diagnostiikassa. T3-V-pitoisuus pienenee viimeisenä, sillä TSH-pitoisuuden suureneminen stimuloi kilpirauhasen T4- ja T3-synteesiä ja T3:n muodostumista kudostasolla tyypin 2 jodityroniinidejodinaasin lisääntyneen aktiivisuuden kautta (ks. kuva «Hormonimuutokset primaarisen hypotyreoosin vaikeusasteen mukaan»3).
- Vakavissa yleissairauksissa T3-V-pitoisuus on pieni, koska T3:n perifeerinen konversio T4:stä vähenee ja T3 muuttuu inaktiiviseksi rT3:ksi.
- Ks. kuva Hormonimuutokset primaarisen hypotyreoosin vaikeusasteen mukaan «Hormonimuutokset primaarisen hypotyreoosin vaikeusasteen mukaan»3.
- Ks. lisätietoa «Vapaa trijodityroniini (T3-V)»9 ja taulukko «Kilpirauhashormonien tulkinta hypotyreoosissa....»1.
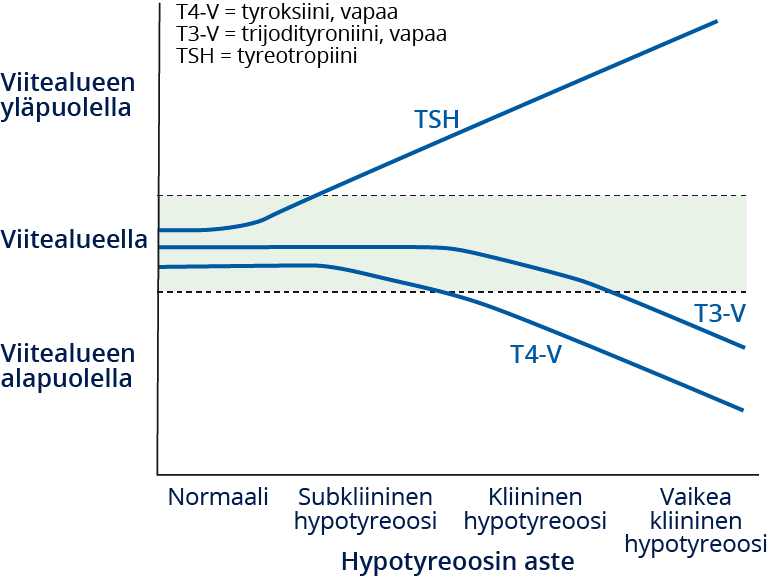
Hormonimuutokset primaarisen hypotyreoosin vaikeusasteen mukaan.
Mukailtu lähteestä: McDermott MT. In the clinic. Hypothyroidism. Ann Intern Med 2009;151:ITC61, PMID: 19949140
Käänteistrijodityroniini (rT3)
- Käänteistrijodityroniinin (rT3) -määrityksiä ei tule tehdä «Dora JM, Biscolla RPM, Caldas G, ym. Choosing Wise...»51.
- rT3:n määrittämisestä ei ole hyötyä hypotyreoosin diagnostiikassa eikä hoitoannosten suunnittelussa.
- Määritys ei myöskään ole käyttökelpoinen yleissairauteen liittyvissä hormonimuutoksissa (NTI, non-thyroidal illness) erottelemaan sitä, onko potilaalla todellinen hypotyreoosi vai liittyvätkö kilpirauhashormonimuutokset yleissairauteen.
- rT3-määritystä voidaan poikkeustapauksissa käyttää erikoissairaanhoidossa erittäin harvinaisten kilpirauhasen geneettisten häiriöiden tai tiettyihin kasvaimiin liittyvän kulutushypotyreoosin (consumptive hypothyroidism) diagnostiikassa.
- rT3-molekyyli (reverse T3) muodostuu T4- ja T3-hormoneista dejodinaation kautta. Inaktivaation tarkoitus on todennäköisimmin kudosten suojelu liialliselta kilpirauhashormonivaikutukselta «Halsall DJ, Oddy S. Clinical and laboratory aspect...»52, «Gomes-Lima C, Wartofsky L, Burman K. Can Reverse T...»53.
- rT3 on biologisesti inaktiivinen. rT3:n affiniteetti tumareseptoriin on varsin pieni, eikä rT3 käytännössä syrjäytä aktiivista T3-hormonia eikä estä sen toimintaa.
Kilpirauhasperoksidaasin (TPO) vasta-aineet
- Kilpirauhasperoksidaasin (TPO) vasta-aineita todetaan autoimmuunityreoidiitissa (Hashimoto), joka on yleisin primaarisen hypotyreoosin syy.
- TPO-vasta-aineita käytetään todetun subkliinisen tai kliinisen hypotyreoosin etiologian selvittämisessä ja seurannan suunnittelussa.
- Kertamittaus riittää. TPO-vasta-aineita ei voi eikä pidä hoitaa, eikä niitä siitä syystä pidä seurata «Dora JM, Biscolla RPM, Caldas G, ym. Choosing Wise...»51.
- TPO-vasta-aineita esiintyy 5–20 %:lla naisista, mutta useimmille ei kehity kilpirauhasen vajaatoimintaa.
- TPO-vasta-aineita ei tutkita, ellei potilaalla ole subkliinistä tai kliinistä hypotyreoosia, paitsi riskipotilailta erikoissairaanhoidossa (esimerkiksi APECED-potilaat). Jos TPO-vasta-aineet on kuitenkin määritetty, niiden perusteella ei tarvitse rutiinimaisesti seurata kilpirauhaskokeita.
- Suurentuneet TPO-vasta-aineet assosioituvat subkliinisen hypotyreoosin ennusteeseen «Vanderpump MP, Tunbridge WM, French JM, ym. The in...»54.
- Potilailla, joilla TPO-vasta-aineet ovat suurentuneet ja joilla on subkliininen hypotyreoosi, on lisääntynyt taipumus kliinisen hypotyreoosin kehittymiseen verrattuna niihin, joilla TPO-vasta-aineita ei esiinny. Ks. kohta Subkliinisen hypotyreoosin hoitokokeilun toteuttaminen «A15»6.
Epätyypillisesti käyttäytyvien kilpirauhasarvojen selvittely
- Epätyypillisesti käyttäytyvillä kilpirauhasarvoilla tarkoitetaan, että oireet ja kilpirauhasen toimintakokeiden tulokset ovat ristiriidassa tai että TSH- ja T4-V-arvojen tulkinta on keskenään ristiriidassa.
- Tällaisissa tilanteissa kannattaa tarkistaa, onko vertailuun käytettävissä aiempia kilpirauhasarvoja.
- Seuraavaksi toistetaan TSH- ja T4-V-määritykset.
Tavalliset syyt ja niiden selvittely
- Akuutti tai krooninen sairaus (ei-kilpirauhasperäinen sairaus, non-thyroidal illness,
NTI) (ks. taulukko «Ei-kilpirauhasperäinen sairaus (NTI) ja kilpirauhasen toimintakokeiden tulkinta ,
....»8 ja kuva «Kilpirauhasarvot akuutin sairauden yhteydessä»4)
- Kontrolloidaan arvot myöhemmin, kun potilas on toipunut.
- Koska kilpirauhashormonien pitoisuudet vaihtelevat akuutin sairauden yhteydessä, niitä ei pidä määrittää akuutin sairauden yhteydessä, ellei erityisesti epäillä vakavaa kilpirauhasen toimintahäiriötä akuutin sairauden taustalla.
- Huomioidaan kroonisen sairauden vaikutus laboratoriotutkimuksiin (ks. taulukko «Ei-kilpirauhasperäinen sairaus (NTI) ja kilpirauhasen toimintakokeiden tulkinta , ....»8 ).
- Raskaus
- Lääkitys, esimerkiksi ketiapiini «Khoodoruth MAS, Abdo AKA, Ouanes S. Quetiapine-Ind...»55, karbamatsepiini tai amiodaroni «Franklyn JA, Davis JR, Gammage MD, ym. Amiodarone ...»3 (ks. taulukot «Kilpirauhasen vajaatoimintaa aiheuttavia lääkkeitä ja ravintolisiä....»3 ja «Lääkkeitä ja ravintolisiä, jotka aiheuttavat poikkeavia löydöksiä kilpirauhasen toimintakokeissa ja voivat vaikuttaa tyroksiinin annokseen, mutta eivät välttämättä vaikuta kilpirauhasen toimintaan....»4)
- Ravintolisät ja luontaistuotteet, esimerkiksi biotiini
- Muutokset tyroksiinihoidon toteutumisessa
- Epäsäännöllinen tyroksiinin käyttö
- Äskettäin muutettu tyroksiiniannos
- Tyroksiinin imeytymisongelma
- Rauta-, kalkki- tai magnesiumlääkitys
- Suolistosairaus, kuten keliakia
- Laboratoriovirhe
- Harkitaan lisätutkimuksia, jotka minimoivat häiriötekijän laboratoriomäärityksissä (ks. taulukko «Epätyypillisesti käyttäytyvien kilpirauhasarvojen syyt ja niiden selvittely , , ....»9).
- Epätyypillisesti käyttäytyvien kilpirauhasarvojen selvittely on kuvattu tarkemmin taulukossa «Epätyypillisesti käyttäytyvien kilpirauhasarvojen syyt ja niiden selvittely , , ....»9.
- Ks. kuva «Epätyypillisesti käyttäytyvien kilpirauhasen toimintakokeiden syyt ja niiden selvittely»5.
| TSH | T4-V | T3-V | |
|---|---|---|---|
| N = normaali eli viitealueella ↑ = yli viitealueen ylärajan ↓ = alle viitealueen alarajan |
|||
| Akuuttivaihe | N | ↓ tai N tai ↑ |
↓ |
| Krooninen vaihe | ↓ | ↓ | ↓ |
| Toipumisvaihe | N tai ↑ | ↓ tai N | ↓ tai N |
| T4-V-arvo on alle viitealueen alarajan, mutta TSH-arvo on pieni suhteessa T4-V-arvoon |
|
| T4-V-arvo on yli viitealueen ylärajan, mutta TSH- ja T3-V-arvot ovat viitealueella |
|
| T4-V-arvo on yli viitealueen ylärajan, mutta TSH-arvo on viitealueella tai yli viitealueen ylärajan ja T3-V-arvo on yli viitealueen ylärajan |
|
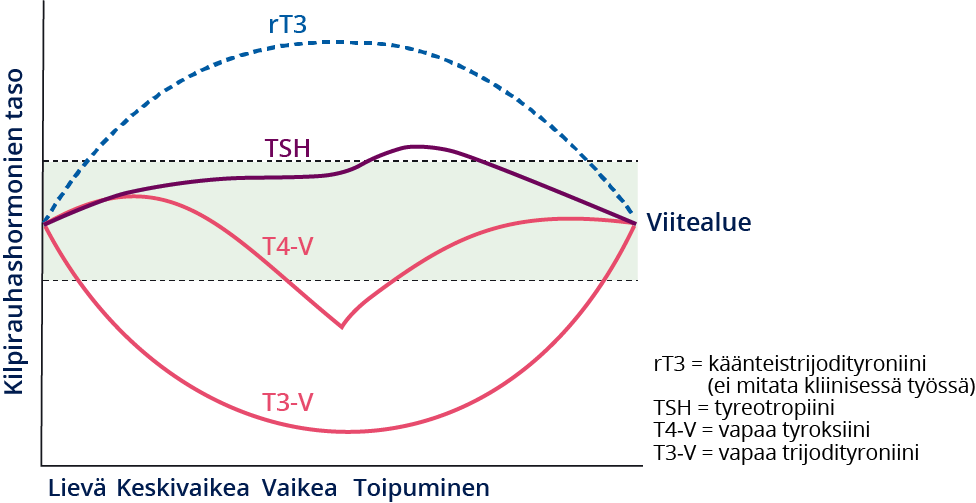
Kilpirauhasarvot akuutin sairauden yhteydessä.
Mukailtu lähteestä: Patki V, Kumbhojkar A, Khilnani P. Sick Euthyroid Syndrome: A Myth or Reality. Journal of Pediatric Critical Care 2017;4:4, DOI-10.21304/2017.0403.00213

Epätyypillisesti käyttäytyvien kilpirauhasen toimintakokeiden syyt ja niiden selvittely.
Hoidon aloituksen indikaatiot
Kliininen hypotyreoosi
- Kliinistä hypotyreoosia (TSH-arvo yli viitealueen ylärajan ja T4-V-arvo alle viitealueen alarajan) hoidetaan aina.
- Erityiskorvausoikeuden myöntäminen edellyttää kliinisen kilpirauhasen vajaatoiminnan osoittamista. Vajaatoiminnan kliinisen kuvan, alkamisajan ja mahdollisen etiologian tulee käydä lausunnosta ilmi. Lisäksi on ilmoitettava kilpirauhasen toimintaa kuvaavien laboratoriokokeiden (esimerkiksi TSH ja T4-V) tulokset ennen kilpirauhashormonihoidon aloittamista. Ks. Kela «https://www.kela.fi/laake104»7.
- Subkliinistä hypotyreoosia ei pidetä erityiskorvattavuuteen oikeuttavana vaikeana sairautena.
Subkliininen hypotyreoosi
- Subkliinisessä hypotyreoosissa TSH-pitoisuuden suureneminen on elimistön kompensaatiomekanismi, jonka seurauksena kilpirauhashormonipitoisuudet saadaan pysymään riittävinä.
- Suurentunut TSH-pitoisuus ei välttämättä ole osoitus kilpirauhassairaudesta «Biondi B, Cappola AR, Cooper DS. Subclinical Hypot...»30, «Somwaru LL, Rariy CM, Arnold AM, ym. The natural h...»61, «Surks MI, Hollowell JG. Age-specific distribution ...»62, «Bremner AP, Feddema P, Leedman PJ, ym. Age-related...»63, «Waring AC, Arnold AM, Newman AB, ym. Longitudinal ...»64.
- Noin 90 %:lla henkilöistä, joilla on todettu subkliininen hypotyreoosi, TSH-pitoisuus on alle 10 mU/l «Biondi B, Cappola AR, Cooper DS. Subclinical Hypot...»30.
- Noin 60 %:lla TSH-arvo palautuu viitealueelle itsestään 5 vuoden seurannassa, mikäli TSH-pitoisuus on alkuvaiheessa alle 10 mU/l. Vain 2–4 %:lla tila etenee vuosittain kliiniseen hypotyreoosiin. Positiiviset TPO-vasta-aineet ja naissukupuoli suurentavat tätä riskiä «Meyerovitch J, Rotman-Pikielny P, Sherf M, ym. Ser...»65, «Biondi B, Cooper DS. The clinical significance of ...»66.
- Kolmen vuoden seurannassa kliiniseen hypotyreoosiin etenee 40 % niistä, joilla TSH-pitoisuus on 10–14,9 mU/l, ja 85 % niistä, joilla TSH-pitoisuus on 15–19,9 mU/l «Díez JJ, Iglesias P. Spontaneous subclinical hypot...»67.
- Henkilöillä, joilla on lievä subkliininen hypotyreoosi (TSH-pitoisuus alle 10 mU/l),
on keskimäärin saman verran oireita kuin henkilöillä, joiden kilpirauhasen toimintakokeiden
arvot ovat viitealueella.
- Henkilöillä, joilla on lievä subkliininen hypotyreoosi, esiintyy neuropsykiatrisia oireita sekä kognition ja koetun henkisen hyvinvoinnin heikentymistä saman verran kuin normaaliväestöllä «Biondi B, Cappola AR, Cooper DS. Subclinical Hypot...»30.
- Keski-ikäisillä henkilöillä, joilla on merkittävä subkliininen hypotyreoosi (TSH-pitoisuus vähintään 10 mU/l) on havaittu lievää heikentymää tietyissä kognitiivisissa toiminnoissa (asiamuisti, työmuisti, mieliala) verrokkeihin nähden. Elämänlaadussa ei ole havaittu eroa normaaliväestöön verrattuna «Klaver EI, van Loon HC, Stienstra R, ym. Thyroid h...»68, «Correia N, Mullally S, Cooke G, ym. Evidence for a...»69.
- TSH-pitoisuus on yleisesti suurempi ylipainoisilla ja lihavilla henkilöillä «Valdés S, Maldonado-Araque C, Lago-Sampedro A, ym....»70.
- Painon väheneminen pienentää TSH-pitoisuutta.
- Väestötutkimuksen (n = 3 928) mukaan kilpirauhasen suhteen terveillä henkilöillä TSH:n viitealue on 0,6–5,5 mU/l BMI:n ollessa 25–29,9 kg/m2, 0,5–5,9 mU/l BMI:n ollessa 30–39,9 kg/m2 ja 0,7–7,5 mU/l BMI:n ollessa vähintään 40 kg/m2 «Valdés S, Maldonado-Araque C, Lago-Sampedro A, ym....»70.
- Etenkin iäkkäillä ylidiagnostiikkaa ja ylihoitoa on syytä varoa.
- Väestötutkimuksissa nähdään vanhuksilla TSH-pitoisuuden suurenemista yli terveiden aikuisten viitealueen ylärajan.
- Tyroksiinikorvaushoidon aloitusraja ja TSH-tavoite hoidossa on suurempi iäkkäillä (yli 70-vuotiailla) ja erityisesti hyvin iäkkäillä henkilöillä «Waring AC, Arnold AM, Newman AB, ym. Longitudinal ...»64, «Leng O, Razvi S. Hypothyroidism in the older popul...»71.
- Koska useissa tutkimuksissa on havaittu TSH-pitoisuuden suurenevan iän myötä, se on otettu huomioon TSH:n viitearvoissa joissakin laboratorioissa «Kilpirauhasen toimintakokeiden laboratoriokohtaisia viitearvoja Suomessa»6.
- Subkliininen hypotyreoosi on yhteydessä suurentuneisiin kokonaiskolesteroli-, LDL-kolesteroli- ja triglyseridipitoisuuksiin «Treister-Goltzman Y, Yarza S, Peleg R. Lipid profi...»72.
- Merkittävä subkliininen hypotyreoosi on yhteydessä lieviin sydän- ja verisuonipoikkeavuuksiin, kuten heikentyneeseen vasemman kammion systoliseen ja diastoliseen toimintaan ja heikentyneeseen verisuonten relaksaatioon «Biondi B, Palmieri EA, Lombardi G, ym. Effects of ...»73. Kontrolloiduissa tutkimuksissa ei ole osoitettu, että subkliinisen hypotyreoosin hoito vähentäisi sydäntapahtumia «Subkliininen hypotyreoosi sydän- ja verisuonisairauksien riskitekijänä»11.
Subkliinisen hypotyreoosin hoidon indikaatiot
- Tyroksiinihoito ei ilmeisesti vaikuta oireisiin, mielialaan, elämänlaatuun tai kognitioon henkilöillä, joilla on subkliininen hypotyreoosi «Tyroksiinihoito ei ilmeisesti vaikuta oireisiin, mielialaan, elämänlaatuun tai kognitioon henkilöillä, joilla on subkliininen hypotyreoosi.»B.
- Tyroksiinihoito voidaan aloittaa tilanteissa, joissa TSH-pitoisuus on toistuvasti
vähintään 10 mU/l «Biondi B, Cappola AR, Cooper DS. Subclinical Hypot...»30, «Pearce SH, Brabant G, Duntas LH, ym. 2013 ETA Guid...»74, (ks. kuva «Subkliinisen hypotyreoosin hoito aikuisella»6, «hoi50133b.pdf»4 (PDF)).
- Toisaalta kansainvälinen asiantuntijaryhmä on ehdottanut tyroksiinihoidon aloitusrajaksi vähintään 20 mU:n/l TSH-pitoisuutta, jos potilas on oireeton ja yli 30-vuotias «Bekkering GE, Agoritsas T, Lytvyn L, ym. Thyroid h...»75.
- Raskautta suunnitteleville ja raskaana oleville suositellaan aloitettavaksi tyroksiini subkliinisessä hypotyreoosissa, ks. kohta Raskaus «A4»7 ja kuva «Subkliinisen hypotyreoosin hoito aikuisella»6, «hoi50133b.pdf»4 (PDF))
- Lievässä subkliinisessä hypotyreoosissa (TSH < 10 mU/l) voidaan harkita 6 kuukauden
tyroksiinihoitokokeilua oireisilla henkilöillä. On kuitenkin huomioitava, että tutkimusnäyttö
lievän subkliinisen hypotyreoosin hoidon vaikuttavuudesta on niukkaa (ks. kuva «Subkliinisen hypotyreoosin hoito aikuisella»6, «hoi50133b.pdf»4 (PDF)).
- Etenevässä ja satunnaistetussa TRUST-tutkimuksessa (n = 737) ei havaittu eroa tyroksiini- ja lumeryhmän välillä, kun tutkittiin elämänlaatua, käsien puristusvoimaa, hypotyreoosioireita ja väsymystä. Henkilöt olivat vähintään 65-vuotiaita, ja keskimääräinen TSH-arvo oli tutkimuksen alussa 6,4 mU/l «Stott DJ, Rodondi N, Kearney PM, ym. Thyroid Hormo...»76.
- Meta-analyysissä (21 subkliinistä hypotyreoosia selvittänyttä tutkimusta) ei havaittu eroa tyroksiinin ja lumeen välillä elämänlaatumittareissa, kognitiivisessa suoriutumisessa, väsymyksessä, lihasvoimassa, systolisessa verenpaineessa tai BMI:ssä. Iso TRUST-tutkimus oli mukana meta-analyysissä, mikä vaikutti huomattavasti tulokseen «Feller M, Snel M, Moutzouri E, ym. Association of ...»77.
- Alle 70-vuotiailla, joilla on lievä subkliininen hypotyreoosi (TSH < 10 mU/l), voidaan harkita tyroksiinihoitoa myös, jos TPO-vasta-aineet ovat yli viitealueen ylärajan, TSH-pitoisuus suurenee jatkuvasti seurannassa tai henkilöllä on struuma (ks. kuva «Subkliinisen hypotyreoosin hoito aikuisella»6, «hoi50133b.pdf»4 (PDF)).
- Tyroksiinihoitoa voidaan harkita lievässä subkliinisessä hypotyreoosissa myös henkilöllä,
joilla on suurentunut sydän- ja verisuonisairauksien riski, kuten hyperkolesterolemia.
- Perinteisten riskitekijöiden hoidon tehosta sydän- ja verisuonisairauksien ehkäisyssä on vahva tutkimusnäyttö. Tyroksiinihoidon tehosta sydän- ja verisuonisairauksien ehkäisyssä ei ole riittävää näyttöä.
- Lapsuudessa syövän sairastaneille suositellaan harkittavaksi tyroksiinihoidon aloitusta subkliinisessä hypotyreoosissa, koska lapsuudessa saadut syöpähoidot voivat altistaa kilpirauhassyövälle «Waguespack SG. Thyroid Sequelae of Pediatric Cance...»78, ks. kohta Lapsena, nuorena tai nuorena aikuisena syövän sairastaneet «A5»8.
- Subkliinisen hypotyreoosin ja dementian välillä on havaittu yhteys alle 75-vuotiailla, mutta ei yli 75-vuotiailla «Pasqualetti G, Pagano G, Rengo G, ym. Subclinical ...»79. Ei ole kuitenkaan tutkimusnäyttöä siitä, että subkliinisen hypotyreoosin hoito pienentäisi dementiariskiä.
- Yli 70-vuotiailla suositellaan harkitsemaan tyroksiinihoitoa vain TSH-arvon ollessa vähintään 10 mU/l «Pearce SH, Brabant G, Duntas LH, ym. 2013 ETA Guid...»74.
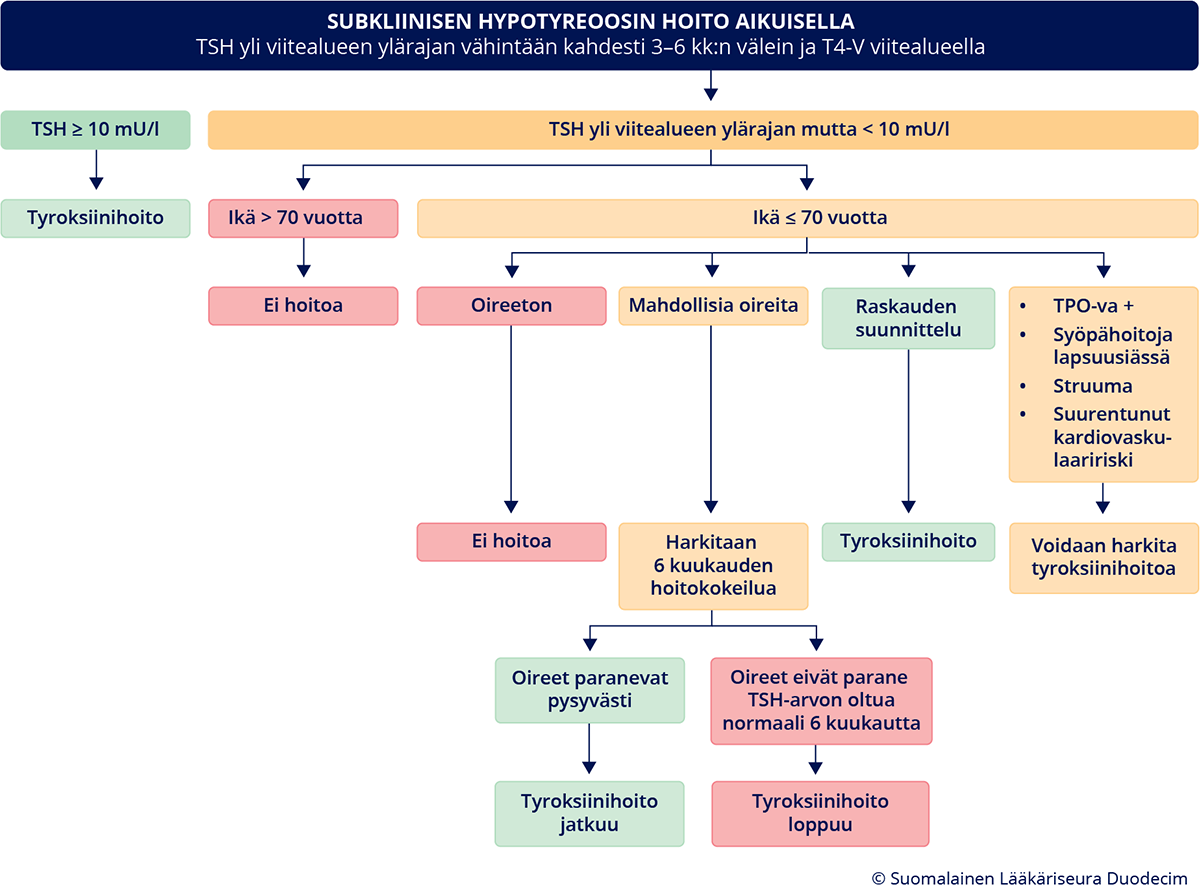
Subkliinisen hypotyreoosin hoito aikuisella. Avaa kaavion PDF-versio tästä linkistä «hoi50133b.pdf»4.
Subkliinisen hypotyreoosin hoitokokeilun toteuttaminen
- Ennen hoitokokeilun aloittamista
- Varmistetaan, että on kyse pysyvästä subkliinisestä hypotyreoosista. Tällöin TSH-arvo on vähintään kahdessa 3–6 kuukauden välein tehdyssä tutkimuksessa yli viitealueen ylärajan ja T4-V-arvo on viitealueella. (ks. kuva «Subkliinisen hypotyreoosin hoito aikuisella»6, «hoi50133b.pdf»4 (PDF))
- Kirjataan hoidon tavoite eli ne oireet, joiden helpottumista tavoitellaan.
- Selitetään potilaalle, että hoidon vaikutus oireisiin on epävarma ja hoito lopetetaan «Biondi B, Cappola AR, Cooper DS. Subclinical Hypot...»30, jollei 6 kuukauden hoidon aikana havaita vaikutusta oireisiin, vaikka TSH-arvo saadaan viitealueelle.
- On myös syytä huomioida lääkehoidon aloittamiseen liittyvä mahdollinen lume- tai hoitosuhdevaikutus, jonka kesto on epäselvä ja riippuu muun muassa hoitosuhteen jatkuvuudesta.
- Subkliinisessä hypotyreoosissa tyroksiinin tarve on yleensä pienempi kuin kliinisessä
hypotyreoosissa.
- Yleensä tyroksiini suositellaan aloitettavaksi annoksella 25–50 µg vuorokaudessa.
- Tyroksiinin annosta säädetään 6–8 viikon välein, kunnes TSH-arvo on asettunut viitealueelle. Tämän jälkeen jatketaan samalla annoksella.
- Tuloksettoman hoitokokeilun jälkeen tutkitaan TSH- ja T4-V-pitoisuus uudestaan vuoden kuluttua, jotta havaitaan mahdollinen eteneminen kliiniseksi hypotyreoosiksi.
Jos TSH-arvo on vuoden seurannan jälkeen alle 10 mU/l, ei säännöllistä seurantaa ole välttämätöntä järjestää, koska vain 2–4 % tapauksista etenee vuosittain kliiniseen hypotyreoosiin «Meyerovitch J, Rotman-Pikielny P, Sherf M, ym. Ser...»65.
- Potilaat, joilla TSH-arvo on vähintään 10 mU/l tai joilla tyroksiinin hoitokokeilu
on tuloksellinen, hoidetaan yleensä pysyvästi tyroksiinilla.
- Mikäli silti päädytään seurantalinjalle, suositellaan TSH- ja T4-V-pitoisuutta seuraamaan vuosittain, jotta havaitaan mahdollinen kliininen hypotyreoosi. Seuranta lopetetaan, jos TSH-arvo palautuu viitealueelle ilman tyroksiinihoitoa.
Hypotyreoosiin sopivia oireita, mutta TSH- ja T4-V-arvot ovat viitealueella
- Tyroksiinihoito lievittää hypotyreoosiin sopivia oireita saman verran kuin lumelääke henkilöillä, joiden kilpirauhasen toimintakokeiden arvot (TSH ja T4-V) ovat viitealueella «Pollock MA, Sturrock A, Marshall K, ym. Thyroxine ...»80, «Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines fo...»81.
- Tyroksiinihoitoa ei tule aloittaa, jos kilpirauhaskokeiden arvot ovat viitealueella, vaikka henkilöllä olisi kilpirauhasen vajaatoimintaan sopivia oireita, kuten ylipainoa ja väsymystä «Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines fo...»81, «Kaptein EM, Beale E, Chan LS. Thyroid hormone ther...»82.
Kliinisen hypotyreoosin hoidon toteutus
- Hoidon tavoitteena on potilaan hypotyreoosiin liittyvien oireiden, löydösten sekä TSH-pitoisuuden normalisoiminen «Salmela P, Metso S, Moilanen L, ym. [Treatment of ...»83, «Biondi B, Wartofsky L. Treatment with thyroid horm...»84.
- Hoidossa käytetään ensisijaisesti synteettistä tyroksiinia (T4-hormonia) (ks. kuva «Tyroksiinihoidon aloitusannos ja annoksen muutokset aikuisilla»7, «hoi50133c.pdf»2 (PDF))
- Tyroksiinin suurimpia etuja ovat pitkän puoliintumisajan (6–7 vrk) ansiosta ennakoitavissa
oleva ja vakaa teho, pitkä käyttökokemus sekä vahva näyttö tehosta ja turvallisuudesta.
- T4-hormoni muuttuu tasaisesti T3-hormoniksi kudosten dejodinaasientsyymien vaikutuksesta. T3-hormoni sitoutuu solujen kilpirauhashormonireseptoreihin, mikä johtaa biologiseen vaikutukseen.
- Kliinisessä hypotyreoosissa voidaan sydämen suhteen terveillä alle 65-vuotiailla aloittaa tyroksiinihoito suoraan annoksella noin 1,6 µg/kg/vrk «Biondi B, Wartofsky L. Treatment with thyroid horm...»84, «Roos A, Linn-Rasker SP, van Domburg RT, ym. The st...»85, «Vasileiou M, Gilbert J, Fishburn S, ym. Thyroid di...»86, (ks. kuva «Tyroksiinihoidon aloitusannos ja annoksen muutokset aikuisilla»7, «hoi50133c.pdf»2 (PDF))
- Aloitus pienemmällä annoksella on myös mahdollinen. Silloin biokemiallisen eutyreoosin saavuttaminen kestää yleensä hieman kauemmin, mutta oireet lievittyvät kuitenkin yhtä nopeasti «Roos A, Linn-Rasker SP, van Domburg RT, ym. The st...»85.
- Sydänsairailla sekä yli 65-vuotiailla suositellaan aloittamaan tyroksiinihoito pienemmällä annoksella (25–50 µg/vrk) ja suurentamaan annosta vähitellen.
- Hoidon aloituksen jälkeen lääkeannoksien tarvittavat lisämuutokset ovat yleensä kerrallaan 12,5–25 µg/vrk «Salmela P, Metso S, Moilanen L, ym. [Treatment of ...»83.
- Tyroksiini otetaan ensisijaisesti aamulla tyhjään vatsaan vähintään 30 minuuttia ennen
aamiaista. Tyroksiini voidaan myös ottaa tyhjään vatsaan 2 tunnin paaston jälkeen
ennen nukkumaan menoa «Bach-Huynh TG, Nayak B, Loh J, ym. Timing of levot...»87. Näin otettu tyroksiini on mahdollinen vaihtoehto, mikäli se parantaa adherenssia.
- Kilpirauhashormonipitoisuuksissa ei ole havaittu merkitsevää eroa ennen aamupalaa ja ennen iltapalaa otetun kilpirauhaslääkityksen osalta «Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines fo...»81, «Pang X, Pu T, Xu L, ym. Effect of l-thyroxine admi...»88.
- Samanaikainen ruokailu heikentää tyroksiinin imeytymistä 40–80 %. Aterian yhteydessä otettu tyroksiini voi johtaa vaihtelevaan TSH-pitoisuuteen.
- Muun muassa mahalaukun hapon eritystä vähentävät lääkkeet, rauta ja kalsiumvalmisteet sekä mahalaukun ohitusleikkaus heikentävät tyroksiinin imeytymistä.
- Tyroksiinin pitkän puoliintumisajan takia päiväannokset voivat olla erisuuruisia, mutta tasasuuruiset päiväannokset helpottavat hoidon toteuttamista.
- Lyhytaikaisen tehohoidon tai parenteraalisen ravitsemuksen aikana ei tarvita suonensisäistä tyroksiinia, koska tyroksiinilla on pitkä puoliintumisaika.

Tyroksiinihoidon aloitusannos ja annoksen muutokset aikuisilla. Avaa kaavion PDF-versio tästä linkistä «hoi50133c.pdf»2
Tyroksiiniannoksen säätö aikuisella
- Annoslisäyksen suuruus riippuu potilaan tyroksiiniannoksesta ja TSH-arvosta. Kuvassa «Tyroksiinihoidon aloitusannos ja annoksen muutokset aikuisilla»7, «hoi50133c.pdf»2 (PDF) esitetään tyroksiinin annossäätö.
- Jos TSH-arvo on hieman viitealueen ulkopuolella, tyroksiiniannos on ollut pitkään stabiili ja potilas on oireeton, annosta ei ole välttämätöntä muuttaa, vaan TSH-arvon voi ensin kontrolloida 6–12 viikon kuluttua «Ross DS. Treatment of primary hypothyroidism in ad...»89.
- Jos TSH-pitoisuus on suurentunut, varmistetaan ensin, että potilas ottaa tyroksiinin
säännöllisesti ohjeen mukaan tyhjään vatsaan eikä käytössä ole tyroksiinin imeytymistä
estäviä lääkkeitä.
- Annosmuutos voidaan arvioida myös prosentteina viikkoannoksesta, jolloin annosmuutos on 10–20 %. Esimerkiksi potilaalla, jonka päiväannos on 100 µg päivässä, annosta voi suurentaa lisäämällä 100 µg:n tabletin yhdelle päivälle tai puolikkaan kahdelle päivälle viikossa, jolloin 100 µg:n viikkoannoksen muuttaminen vastaa noin 14 %:n ja 14 µg:n vuorokausiannoksen muuttamista «Ross DS. Treatment of primary hypothyroidism in ad...»89.
- Annosten hienosäädössä voi käyttää apuna 25 µg:n tai 13 µg:n vahvuista tyroksiinia varoen kuitenkin titrausvaiheessa useiden eri annosvahvuuksien aiheuttamaa sekaannusta.
- Jos TSH-pitoisuus on ollut pitkään pieni liian suuren tyroksiiniannoksen vuoksi, voi pienempi annos olla paremmin siedetty, kun annosta pienennetään hitaammin. Jos TSH-pitoisuus on alle 0,05, saattaa kestää pitempään (jopa 6 kuukautta) ennen kuin se on viitealueella.
- TSH-pitoisuuden normalisoituminen voi kestää jopa 6 kuukautta, mikäli pitoisuus on lähtötilanteessa hyvin suuri tai kliininen hypotyreoosi on kestänyt kauan ennen hoidon aloitusta «Vasileiou M, Gilbert J, Fishburn S, ym. Thyroid di...»86. Tämän vuoksi hoidon alkuvaiheessa voi T4-V-määritystä käyttää annostitrauksessa apuna, jos TSH-arvo ei normalisoidu säätämällä annosta kuvan «Tyroksiinihoidon aloitusannos ja annoksen muutokset aikuisilla»7, «hoi50133c.pdf»2 (PDF) mukaisesti.
- Annoksen vakiinnuttua kannattaa pyrkiä mahdollisimman samansuuruisiin päiväannoksiin ja helposti toteutettavaan annosteluun «Ross DS. Treatment of primary hypothyroidism in ad...»89.
Hoidon seuranta
Seurannassa käytettävät verikokeet
- On tärkeää löytää kullekin potilaalle yksilöllisesti sopiva kilpirauhashormonikorvaushoidon annos.
- Primaarisessa hypotyreoosissa luotettavin laboratoriokoe tyroksiiniannoksen sopivuuden arvioinnissa on TSH, jonka tulisi olla viitealueella (noin 0,3–4 mU/l) «NICE guideline [NG145]. Thyroid disease: assessmen...»38, «Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines fo...»81, «Kilpirauhasen toimintakokeiden laboratoriokohtaisia viitearvoja Suomessa»6.
- Etenkin yli 70-vuotiailla TSH-tavoite voi olla viitealueen ylärajaa suurempi «Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines fo...»81.
- Nuorilla aikuisilla TSH-pitoisuus 1–2,5 mU/l saattaa olla suositeltavin «Wartofsky L, Dickey RA. The evidence for a narrowe...»90, mutta näyttö ei ole yksiselitteistä «Walsh JP, Ward LC, Burke V, ym. Small changes in t...»91, «Surks MI, Goswami G, Daniels GH. The thyrotropin r...»92.
- TSH-pitoisuuden viitealueen sisällä voidaan yksilöllisesti hakea sitä pitoisuutta,
jolla potilas voi parhaiten.
- Jos potilas on edelleen oireinen, vaikka TSH-arvo on viitealueella, kilpirauhashormonivalmisteen annosta voi säätää, koska osa potilaista kokee voivansa paremmin TSH-arvon ollessa viitealueen alaosassa ja osa yläosassa.
- Iatrogeenista TSH:n suppressiota ja tyreotoksikoosia tulee aina välttää «NICE guideline [NG145]. Thyroid disease: assessmen...»38, «Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines fo...»81.
- Mikäli potilaalla on viitealueella olevasta TSH-arvosta huolimatta oireita, tulee selvitellä ja hoitaa muut oireita aiheuttavat sairaudet ja tilat taulukon «Kliinisen kilpirauhasen vajaatoiminnan oireet, löydökset ja erotusdiagnostiikka elinjärjestelmittäin. Suomennettu ja muokattu lähteestä ....»5 mukaisesti.
- TSH-arvon palautuminen viitealueelle voi kestää jopa 6 kuukautta potilailla, joilla TSH-arvo on ollut hyvin suuri tai pieni ennen hoidon aloitusta tai tehostusta «Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines fo...»81.
- TSH-pitoisuus tutkitaan 6–12 viikkoa tyroksiinihoidon aloituksesta ja annosmuutosten jälkeen.
- Kun TSH-arvo on tavoitteessa, se tutkitaan 4–6 kuukauden kuluttua ja sen jälkeen vuosittain «NICE guideline [NG145]. Thyroid disease: assessmen...»38, «Okosieme O, Gilbert J, Abraham P, ym. Management o...»93.
- Jatkossa seurantavälit voidaan pidentää 2 vuoteen, mikäli vointi on ennallaan eikä muu lääkitys tai paino merkittävästi muutu.
- Jos TSH-arvo on oireettoman potilaan seurannassa viitealueella, riittää seurannassa pelkkä TSH-arvo. Vaikka oireiden seuraaminen ja selvittely on tärkeää hypotyreoosin seurannassa, oireita arvioidaan aina suhteessa TSH-arvoon eikä lääkitystä koskaan säädetä pelkästään oireiden perusteella «Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines fo...»81.
- T4-V-määritys kannattaa tehdä, jos potilas on oireinen siitä huolimatta, että TSH-arvo on viitealueella, tai jos epäillään adherenssiongelmaa «NICE guideline [NG145]. Thyroid disease: assessmen...»38. Primaarisessa hypotyreoosissa tyroksiinikorvaushoito voi joskus johtaa viitealueen ylärajan ylittävään T4-V-pitoisuuteen. Sillä ei ole kliinistä merkitystä, jos TSH-arvo on tavoitealueella «Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines fo...»81.
- T3-V-määritystä ei tarvita kilpirauhasen vajaatoiminnan seurannassa, ellei ole epäilyä epätyypillisesti käyttäytyvistä kilpirauhasarvoista, ks. kohta Epätyypillisesti käyttäytyvien kilpirauhasarvojen selvittely «A6»9.
- Kilpirauhasen vajaatoiminnan seurannassa ei ole näyttöä muiden verikokeiden (esim. TPO-vasta-aineet, SHBG, kolesteroli, myoglobiini, kreatiniinikinaasi tai ferritiini) seurannan hyödyistä «Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines fo...»81.
- Raskautta suunnittelevien ja lasten osalta hoidon tavoitteet kuvataan omassa luvussaan, ks. kohdat Raskaus ja Lapset «A2»4.
- Kilpirauhassyöpäpotilaiden seurannan osalta tyroksiinihoidon annostelu ja hoitotavoitteet esitetään kilpirauhassyöpäpotilaiden kilpirauhashormonikorvaushoitoa kuvaavassa kappaleessa, ks. kohta Kilpirauhassyöpäpotilaat «A7»10.
Pitkäaikaisen tyroksiinihoidon lopettaminen
- Jos hoidon aloituksen indikaatio ei ole selvä tai tyroksiiniannos on pieni eikä annosta
ole tarvinnut suurentaa ja hoidon teho on epävarma, voidaan tyroksiinihoito kokeilla
lopettaa.
- Kolmasosa potilaista pysyy eutyreoosissa tyroksiinin lopettamisen jälkeen, ja tämä on erityisen todennäköistä niillä, joilla hoito on aloitettu subkliiniseen hypotyreoosiin «Burgos N, Toloza FJK, Singh Ospina NM, ym. Clinica...»94.
- Kilpirauhasen vajaatoiminta voi olla ohimenevä (transientti hypotyreoosi), jolloin tyroksiinikorvaushoidon tarve on tilapäistä.
- Kilpirauhastulehduksen eli tyreoidiitin alkuvaiheen liikatoiminta- eli hypertyreoosivaihetta seuraa vajaatoimintavaihe, joka suurimmalla osalla on ohimenevä.
- Tyroksiinihoidon lopettaminen:
- Jos tyroksiiniannos on enintään 50 µg/vrk, tyroksiini voidaan lopettaa ilman annoksen pienentämistä. TSH- ja T4-V-pitoisuudet tutkitaan 6–12 viikon kuluttua «Burgos N, Toloza FJK, Singh Ospina NM, ym. Clinica...»94.
- Jos tyroksiiniannos on tätä suurempi, hoitoannos puolitetaan ja TSH- ja T4-V-pitoisuus tutkitaan 6 viikon kuluttua. Mikäli TSH-arvo ei ylitä viitealueen ylärajaa, hoito voidaan lopettaa ja TSH- ja T4-V-pitoisuudet kontrolloida jälleen 6–12 viikon kuluttua.
- Mikäli TSH-arvo pysyy viitealueella 3–6 kuukautta tyroksiinin lopettamisesta, ei tyroksiinihoitoa tarvitse jatkaa. Mikäli TSH-pitoisuus on alle 10 mU/l 12 kuukautta tyroksiinin lopettamisesta eikä potilaan vointi olennaisesti muutu, ei jatkossa tarvitse järjestää säännöllistä TSH-seurantaa, koska vain 2–4 % lievistä subkliinisistä hypotyreoositapauksista etenee vuosittain kliiniseen hypotyreoosiin «Meyerovitch J, Rotman-Pikielny P, Sherf M, ym. Ser...»65.
- 1 103 potilaan seurantatutkimuksessa kolmanneksella (37 %) «Burgos N, Toloza FJK, Singh Ospina NM, ym. Clinica...»94 kilpirauhasen toiminta pysyi normaalina tyroksiinin lopettamisen jälkeen. Näistä suurimmalla osalla oli alun perin ollut subkliininen hypotyreoosi. Kilpirauhasen toiminnan pysyminen normaalina oli epätodennäköisempää (11 %), jos hoito oli aloitettu kliiniseen hypotyreoosin. Näissä tapauksissa todennäköinen syy hypotyreoosiin on ollut ohimenevä hypotyreoosi kilpirauhastulehduksen jälkeen.
Tyroksiinin annokseen vaikuttavat lääkkeet ja kliiniset tilanteet
- Tyroksiini imeytyy ileumista ja jejunumista. Paastoon liittyvä pieni mahan pH-arvo edistää imeytymistä. Optimaalisissa olosuhteissa tyroksiinista imeytyy 70–80 %.
- Mikäli tyroksiinikorvaushoidon aikana potilaan vointi ja TSH-pitoisuus muuttuvat, tulee selvittää tyroksiinin annostelussa tapahtuneet muutokset (lääkkeen ottamisajankohta, valmiste ja annosvahvuus), annostarpeeseen vaikuttavat lääkkeet (ks. taulukot «Kilpirauhasen vajaatoimintaa aiheuttavia lääkkeitä ja ravintolisiä....»3 ja «Lääkkeitä ja ravintolisiä, jotka aiheuttavat poikkeavia löydöksiä kilpirauhasen toimintakokeissa ja voivat vaikuttaa tyroksiinin annokseen, mutta eivät välttämättä vaikuta kilpirauhasen toimintaan....»4) ja muut sairaudet ja mahdollinen painonmuutos (10 %:n muutos vaikuttaa tyroksiiniannokseen) sekä titrata tyroksiiniannos tilanteeseen sopivaksi «Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines fo...»81, (ks. taulukot «Kilpirauhasen vajaatoimintaa aiheuttavia lääkkeitä ja ravintolisiä....»3 ja «Lääkkeitä ja ravintolisiä, jotka aiheuttavat poikkeavia löydöksiä kilpirauhasen toimintakokeissa ja voivat vaikuttaa tyroksiinin annokseen, mutta eivät välttämättä vaikuta kilpirauhasen toimintaan....»4).
- Jos aloitetaan tai lopetetaan kilpirauhashormonien imeytymiseen, metaboliaan tai sitojaproteiinipitoisuuteen
vaikuttava lääkitys, kilpirauhaskokeet tutkitaan noin 6–12 viikon kuluttua lääkemuutoksesta
(ks. taulukot «Kilpirauhasen vajaatoimintaa aiheuttavia lääkkeitä ja ravintolisiä....»3 ja «Lääkkeitä ja ravintolisiä, jotka aiheuttavat poikkeavia löydöksiä kilpirauhasen toimintakokeissa
ja voivat vaikuttaa tyroksiinin annokseen, mutta eivät välttämättä vaikuta kilpirauhasen
toimintaan....»4).
- Kalsium- ja rautavalmisteet heikentävät tyroksiinin imeytymistä. Ne suositellaan otettavaksi vasta 4 tuntia tyroksiinin ottamisen jälkeen, mutta näyttöä tämän hyödystä tyroksiinin imeytymiseen ei ole «Jonklaas J. Optimal Thyroid Hormone Replacement. E...»95.
- Potilailla esiintyy paljon kalsium- ja rautavalmisteiden käyttöä relatiivisissa indikaatioissa ja itsehoidossa. Silloin, kun sopivan tyroksiiniannoksen löytämisessä on vaikeuksia, kannattaa kriittisesti tarkastella, tarvitseeko potilas lainkaan rauta- ja kalsiumvalmisteita.
- Protonipumpun estäjät suurentavat mahan pH-arvoa ja heikentävät siksi tyroksiinin imeytymistä, minkä vuoksi tyroksiinin tarve suurenee. Vaihteleva PPI-lääkkeiden käyttö voi aiheuttaa heilahtelua kilpirauhaskokeiden tuloksiin «Jonklaas J. Optimal Thyroid Hormone Replacement. E...»95.
- Suun kautta otettava estrogeenivalmiste lisää tyroksiinia sitovan proteiinin määrää ja tyroksiinin tarvetta, kun taas estrogeenipitoisuuden pieneneminen vaihdevuosissa tai lopetettaessa estrogeenikorvaushoito vähentää tyroksiinin tarvetta.
- Keliakia, atrofinen gastriitti, helikobakteerin aiheuttama gastriitti sekä gastric bypass -leikkaus saattavat heikentää tyroksiinin imeytymistä «Jonklaas J. Optimal Thyroid Hormone Replacement. E...»95, ks. kohta Hoitoon sitoutuminen (adherenssi) «A8»11.
- Myös ikä (annostarve pienenee) ja lihavuus (annostarve suurenee) ja laihtuminen (annostarve pienenee) saattavat vaikuttaa tyroksiinin annostarpeeseen.
Hoitoon sitoutuminen (adherenssi)
- Kilpirauhasen vajaatoiminnan hoidossa vain 66–68 % potilaista saavuttaa riittävän eli 80 % hoitoon sitoutumisen eli adherenssin T4-hoidon toteutuksessa, mikä on samaa luokkaa kuin muissa pitkäaikaissairauksissa «Briesacher BA, Andrade SE, Fouayzi H, ym. Comparis...»96, «Briesacher BA, Andrade SE, Fouayzi H, ym. Medicati...»97, «Caron P, Declèves X. The Use of Levothyroxine Abso...»98.
- Adherenssia voi parantaa hyvällä alkuinformaatiolla ja kertauksella tyroksiinihoidon indikaatioista ja hoidon tavoitteista sekä lääkkeen imeytymiseen vaikuttavista seikoista.
- Samansuuruinen päivittäinen annos tyroksiinia saattaa parantaa adherenssia kuten myös dosetin käyttö ja puhelimeen asetetut muistutukset.
- Viitealueen ylärajan ylittävä TSH-arvo ja samanaikainen viitealueella oleva T4-V-arvo voivat viitata riittämättömään adherenssiin.
- Hyvästä adherenssista kertovat säännölliset sähköisten reseptien toimitustiedot, joita voi hyödyntää, jos potilas on hoitosuhteessa.
- Jos tyroksiiniannos ylittää 1,9 µg/kg/vrk ja TSH-pitoisuus pysyy suurena huolimatta
tyroksiiniannoksen suurentamisesta, tulee epäillä ongelmaa tyroksiinin imeytymisessä.
Ellei selittävää syytä löydy, voidaan erikoissairaanhoidossa tehdä absorptiotesti,
joka erottelee malabsorption lääkitykseen sitoutumisen ongelmasta «Walker JN, Shillo P, Ibbotson V, ym. A thyroxine a...»99, «Caron P, Declèves X. The Use of Levothyroxine Abso...»98. Ks. kohta Tyroksiinin annokseen vaikuttavat lääkkeet ja kliiniset tilanteet «A9»12.
- Kokeessa potilaille annetaan valvotusti painonmukainen viikkoannos tyroksiinia kerta-annoksena (n. 1,6 µg/kg x 7, usein 1 000 µg) tyhjään vatsaan yöpaaston jälkeen ja TSH- ja T4-V-pitoisuudet mitataan ennen tyroksiinin ottoa ja T4-V-pitoisuus 1 tunnin välein 4 tunnin ajan. Tyroksiinin imeytymisen katsotaan olevan normaalia, jos T4-V-pitoisuus suurenee vähintään 60 %. Tätä pienempi lukema viittaa malabsorptioon ja suurempi lukema sitoutumisen ongelmaan «Walker JN, Shillo P, Ibbotson V, ym. A thyroxine a...»99, «Caron P, Declèves X. The Use of Levothyroxine Abso...»98.
Tarpeeseen nähden liian pienen tai liian suuren tyroksiiniannoksen riskit
- Liian suuri tyroksiiniannos johtaa viitealueen alarajan alittavaan TSH-pitoisuuteen ja liian pieni tyroksiiniannos viitealueen ylärajan ylittävään TSH-pitoisuuteen.
- Tutkimusten mukaan 35 % potilaista luulee tyroksiiniannoksen pysyvän samana läpi elämän, vaikka todellisuudessa potilaista kolmasosan annosta pitää muuttaa jo 12 kuukauden seurannan aikana «McMillan M, Rotenberg KS, Vora K, ym. Comorbiditie...»100.
- Yli puolella hypotyreoosipotilaista TSH-pitoisuus ei ole tavoitteessa: 12–20 %:lla hypotyreoosipotilaista se on alle viitealueen alarajan ja 17–32 %:lla yli viitealueen ylärajan «Thayakaran R, Adderley NJ, Sainsbury C, ym. Thyroi...»101, «Lillevang-Johansen M, Abrahamsen B, Jørgensen HL, ...»102, «Perros P, Nirantharakumar K, Hegedüs L. Recent evi...»103, «Flynn RW, Bonellie SR, Jung RT, ym. Serum thyroid-...»104, «Flinterman LE, Kuiper JG, Korevaar JC, ym. Impact ...»105, «Okosieme OE, Belludi G, Spittle K, ym. Adequacy of...»106.
- Potilaita tuleekin informoida siitä, että tyroksiiniannos ei pysy samana läpi elämän ja siksi kokeissa tulee käydä säännöllisesti 1–2 vuoden välein sekä tarvittaessa, mikäli voinnissa, painossa tai muussa lääkityksessä tulee olennaisia muutoksia «NICE guideline [NG145]. Thyroid disease: assessmen...»38.
- Liian suureen tyroksiiniannokseen liittyy haittavaikutuksia, kuten eteisvärinä, palpitaatiot, rintakivut, hermostuneisuus, huono keskittymiskyky, kognition heikkeneminen, osteoporoosi ja luunmurtumat «Biondi B, Wartofsky L. Treatment with thyroid horm...»84, «Thayakaran R, Adderley NJ, Sainsbury C, ym. Thyroi...»101, «Lillevang-Johansen M, Abrahamsen B, Jørgensen HL, ...»102, «Flynn RW, Bonellie SR, Jung RT, ym. Serum thyroid-...»104. Liian suuren annoksen haitat korostuvat yli 65-vuotiailla ja postmenopausaalisilla naisilla.
- Alle 70-vuotiailla liian pienen tyroksiiniannoksen haittoja ovat hypotyreoosin oireet, hyperkolesterolemia, ateroskleroosi ja sydämen vajaatoiminta «Rodondi N, den Elzen WP, Bauer DC, ym. Subclinical...»107, «Razvi S, Weaver JU, Butler TJ, ym. Levothyroxine t...»108.
- Yli 70-vuotiailla ei ole näyttöä hypotyreoosin alihoidon riskeistä.
- Yhden tutkimuksen perusteella 41 %:lla yli 65-vuotiaista hypotyreoosipotilaista TSH-pitoisuus oli alle viitealueen alarajan, mihin assosioitui suurentunut eteisvärinän ja osteoporoosin riski «Somwaru LL, Arnold AM, Joshi N, ym. High frequency...»109.
- Mitä pitempään TSH-pitoisuus on alle viitealueen alarajan tai yli viitealueen ylärajan kilpirauhasen vajaatoimintaa sairastavalla potilaalla, sitä suurempi kuolleisuusriski on. Riski lisääntyy 18 % jokaista 6:tta kuukautta kohti, kun TSH-pitoisuus on alle 0,1 mU/l, ja 5 % jokaista 6:tta kuukautta kohti, kun TSH-pitoisuus on yli 4 mU/l «Lillevang-Johansen M, Abrahamsen B, Jørgensen HL, ...»102, «Perros P, Nirantharakumar K, Hegedüs L. Recent evi...»103.
Myksödeemisen kooman hoito
- Myksödeeminen kooma on henkeä uhkaava ja välitöntä hoitoa vaativa tilanne «Olkkola K,Kiviluoma K, Saari T ym. (toim.). Aneste...»110.
- Leikkaus, infektio tai muu stressi voi laukaista myksödeemisen kooman hoitamatonta kilpirauhasen vajaatoimintaa sairastavalla potilaalla «Ross DS, Cooper DS, Mulder JE. Myxedema coma. UpTo...»111.
- Tila voi myös kehittyä ilman laukaisevaa tekijää, jos potilaalla on ollut pitkään toteamaton tai hoitamaton vaikea hypotyreoosi.
- Keskeisiä oireita ja löydöksiä ovat sydämen harvalyöntisyys, EKG:n muutokset (low
voltage), alhainen verenpaine, alilämpöisyys, hypoglykemia, hyponatremia ja eriasteiset
tajunnan häiriöt, kuten hidastuneisuus, harhaisuus ja harvoin syvä tajuttomuus tai
kouristelu.
- Usein esiintyy myksödeema (ihon ja muiden kudosten laaja-alainen turvotus) ja hengitysvajaus.
- Voi myös esiintyä paralyyttinen ileus.
- Diagnoosi perustuu poikkeaviin kilpirauhaskokeiden arvoihin (TSH ja T4-V).
- Ennen hoidon aloitusta on tutkittava plasman kortisolipitoisuus, jotta varmistetaan, ettei potilaalla ole hoitamatonta hypokortisolismia «Ross DS, Cooper DS, Mulder JE. Myxedema coma. UpTo...»111.
- Hoitona on tyroksiinia 200–400 µg i.v. kerta-annoksena, sitten 50–100 µg i.v. päivittäin.
- Lisäksi voidaan antaa liotyroniinia 5–20 µg i.v. kerta-annoksena, sitten 2,5–10 µg i.v. 8 tunnin välein, mikäli sitä on saatavilla.
- Määritä alkuvaiheessa kilpirauhashormonit 1–2:n vuorokauden välein.
- Vältä T3-V-arvon suurentamista yli viitealueen ylärajan, erityisesti iäkkäillä potilailla.
- Potilaille tulisi antaa hydrokortisonia 100 mg i.v. 8 tunnin välein, kunnes hypokortisolismi on suljettu pois, koska aiemmin toteamaton hypokortisolismi voi esiintyä samanaikaisesti ja syvässä hypotyreoosissa ACTH:n vaste stressitilanteeseen voi olla heikentynyt.
- Vitaalien elintoimintojen tukeminen, neste-, elektrolyytti- ja glukoositasapainon korjaaminen, lämpötilan passiivinen korjaaminen ja laukaisevan tekijän poistaminen kuuluvat myös hoitoon «Brent GA, Weetman AP. Hypothyroidism and Thyroidit...»112.
- Suonensisäisen tyroksiinin olisi syytä kuulua ympärivuorokautisesta päivystyksestä
vastaavien sairaaloiden päivystysvarastoihin.
- Jos levotyroksiini joudutaan antamaan tabletteina suun kautta tai jauhettuna nenä-mahaletkun kautta, on huomioitava, että syvässä hypotyreoosissa tyroksiinin imeytyminen suolistosta on heikentynyt.
- Lyhytaikaisessa tehohoidossa ja parenteraalisessa ravitsemuksessa ei tarvita suonensisäistä tyroksiinia myksödeemisen kooman ehkäisemiseen, koska tyroksiinilla on pitkä puoliintumisaika.
Potilaan kohtaaminen ja potilas-lääkärisuhde
- Luottamukseen perustuva potilas-lääkärisuhde on tärkeässä asemassa myös hypotyreoosia sairastavien kuten muidenkin pitkäaikaissairaiden hoidossa.
- Hoidon aloituksen ja seurannan yhteydessä on olennaista luottamuksellisuus, potilaan kohtaaminen empaattisesti, potilaan kuuleminen sekä potilaan informointi näyttöön perustuvaan tietoon pohjautuen.
- Seurannassa potilaan oireisiin vakavasti ja empaattisesti suhtautuminen, psykofyysisten oireiden yhteyden tunnistaminen, huolien kuuleminen ja niiden hälventäminen sekä ylidiagnostiikan ja -hoidon välttäminen korostuvat. Seurantakäynneillä on hyvä huomioida myös sairauden mahdollinen vaikutus parisuhteeseen, perhe-elämään, harrastuksiin sekä työ- ja toimintakykyyn.
- Ihmiset kokevat ja tulkitsevat oireita eri tavoin, ja kyky sietää oireita ja epätietoisuutta vaihtelee.
- Potilaan ohjauksessa voidaan hyödyntää Käypä hoito -suosituksen potilasversiota (tekeillä).
- Potilaslähtöisen hoidon toteutumisen esteenä voivat olla vaihtuvat ammattihenkilöt ja pitkien hoitosuhteiden puuttuminen «Raivio R. Väitöskirja. Hoidon jatkuvuus perusterve...»113, «Raivio R, Holmberg-Marttila D, Mattila KJ. Patient...»114, «Mitchell AL, Hegedüs L, Žarković M, ym. Patient sa...»115.
- Terveydenhuollon ammattilainen voi auttaa sopeutumisessa ja vahvistaa potilaan resilienssiä.
- Lääkärin tulee suojella potilaita aiheettomilta tutkimuksilta ja lääkityksiltä, joista heille voi seurata haittoja.
- Vertaistuki potilasjärjestön (Kilpirauhasliitto ja sen jäsenjärjestöt), internetin ja sosiaalisen median kautta voi olla tärkeä apu sairauteen liittyvien tunteiden käsittelyssä ja muussa sopeutumisessa sairauteen.
- Joskus sosiaalinen media herättää myös pelkoa ja ristiriitoja.
- Vaikka sosiaalisen median kanavat tarjoavat vaivattoman tavan tiedonhakuun ja vertaistukeen, liittyy niiden käyttöön myös riski siihen, että yksittäisen potilaan kokemus sekoittuu näyttöön perustuvaan tutkimustietoon.
Hoitotyytyväisyys ja siihen vaikuttavat tekijät
- Kyselytutkimusten mukaan hypotyreoosipotilaista jopa 20–60 % on tyytymättömiä vointiinsa. Tyypillisiä vointia huonontavia oireita ovat väsymys, painon nousu, masennus ja muistihäiriöt «Peterson SJ, Cappola AR, Castro MR, ym. An Online ...»116, «Perros P, Hegedüs L, Nagy EV, ym. The Impact of Hy...»117.
- Hoitotyytymättömyyden taustat ovat monitekijäiset. Taustalla voivat olla muun muassa
epäoptimaalinen kilpirauhashormonihoito, autoimmuunisairaus, muut hoitamattomat oireet
ja sairaudet, potilaan kokemus hoidosta, henkilökunnan asiantuntemus, ongelmat hoidon
jatkuvuudessa, käytetty kilpirauhasvalmiste tai potilaan epärealistiset odotukset
hoidosta «Hegedüs L, Bianco AC, Jonklaas J, ym. Primary hypo...»35.
- Hypotyreoosin hoitotyytyväisyyttä selvittäneessä E-MPATHY-kyselytutkimuksessa todettiin, että 48 % potilaista oli tyytymättömiä hypotyreoosin hoitoon ja 69 %:lla oli arkipäivän elämää haittaavia oireita (lihasheikkoutta, energisyyden puutetta, hitautta, keskittymiskyvyn puutetta) «Perros P, Hegedüs L, Nagy EV, ym. The Impact of Hy...»117. Hoitoon tyytymättömyyttä selittivät potilaan heikko luottamus terveydenhuollon henkilökuntaan, kokemus siitä, että terveydenhuollon ammattilaisilla ei ollut riittävästi aikaa ja tietämystä kilpirauhasen vajaatoiminnan hoidosta, potilas ei saanut osallistua päätöksentekoon ja saanut riittävästi tai ymmärrettävää informaatiota kilpirauhasen vajaatoiminnan hoidosta ja lääkityksestä, tai kokemus laboratoriokokeiden rasittavuudesta.
- Kilpirauhaslääkityksellä (tyroksiini tai T3-pohjainen hoito) ei ollut vaikutusta hoitotyytyväisyyteen.
- Arkipäivän elämää haittaavia oireita oli vähemmän tyroksiinimonoterapiaa saavilla potilailla kuin T3-pohjaisia valmisteita saavilla.
- Hoitoon tyytymättömyydellä oli heikko mutta tilastollisesti merkitsevä assosiaatio arkipäivän elämää haittaaviin oireisiin.
- Tutkimukseen osallistui 3 915 kilpirauhasvalmisteita hypotyreoosiin käyttävää potilaista 68 maasta, ja 4,3 % potilaista oli Suomesta.
- Somatisaatiohäiriö on yksi mahdollinen selitys hypotyreoosipotilaiden oireille, jotka
jatkuvat hoidosta huolimatta «Perros P, Nagy EV, Papini E, ym. Hypothyroidism an...»118, «Taylor PN, Iqbal A, Minassian C, ym. Falling thres...»13, «Panicker V, Evans J, Bjøro T, ym. A paradoxical di...»119.
- E-MPATHY-tutkimuksessa 58,6 %:lla täyttyivät somatisaation kriteerit (yli 10 pistettä kyselyssä), kun somatisaation esiintyvyys väestössä on yleensä 5–25 %, ja somatisaatiohäiriö assosioitui hoitoon tyytymättömyyteen sekä arkipäivää haittaaviin oireisiin.
- E-MPATHY kyselytutkimuksessa käytettiin somatisaatiohäiriön arvioimiseen Patient Health Questionnaire-15 (PHQ-15) -kyselykaavaketta, johon vastasi 3 516 potilasta (90 % kaikista potilaista).
Elämänlaatu ja työkyky
- Havainnoivien tutkimusten mukaan elämänlaatu paranee ja TSH-arvo palautuu viitealueelle tai lähelle sitä autoimmuunipohjaisessa kliinisessä hypotyreoosissa suurimmalla osalla 3–6 kuukauden kuluttua hoidon aloittamisesta «Borson-Chazot F, Terra JL, Goichot B, ym. What Is ...»120.
- Kuten useissa muissakin pitkäaikaissairauksissa, myös hypotyreoosipotilailla tietoisuus diagnoosista vaikuttaa terveyttä heikentävästi verrattuna niihin, joilla diagnostiset kriteerit täyttyvät, mutta diagnoosia ei ole vielä tehty «Jørgensen P, Langhammer A, Krokstad S, ym. Diagnos...»121.
- Brittiläisen potilasjärjestön jäsenille lähetetyn kyselytutkimuksen perusteella elämänlaatuun korreloivat positiivisesti miessukupuoli ja hypotyreoosin sairastamisaika. Elämänlaatuun korreloivat puolestaan negatiivisesti ikä, yli 3 käyntiä yleislääkärillä ennen diagnoosia, eläinperäisten ja T3-valmisteiden annosten säätö itsenäisesti sekä odotukset siitä, että T4-hoito korjaa kaikki oireet. Toive saada enemmän tukea hoitavalta yleislääkäriltä korreloi myös negatiivisesti elämänlaatuun «Mitchell AL, Hegedüs L, Žarković M, ym. Patient sa...»115, «Borson-Chazot F, Terra JL, Goichot B, ym. What Is ...»120.
- Suomalaiset kilpirauhasen vajaatoimintaa sairastavat potilaat ilmoittavat elämänlaatunsa huonommaksi kuin väestö keskimäärin. 15D-kyselyssä kilpirauhasen vajaatoimintaa sairastavien kokonaislukema (15D-score) oli 0,838, kun se ikä- ja sukupuolivakioidulla väestöllä on 0,918 (asteikko 0–1). Ks. Kilpirauhasliitto: Tutkimus: Kilpirauhasen vajaatoiminta vaikuttaa elämänlaatuun «https://kilpirauhasliitto.fi/tutkimus-kilpirauhasen-vajaatoiminta-vaikuttaa-elamanlaatuun/»8.
- Hypotyreoosipotilaiden elämänlaatuun saattavat osaltaan vaikuttaa myös paino, TPO-vasta-ainepitoisuudet, liikunta, parisuhde- ja työmarkkinastatus sekä ruokavalio.
- Hypotyreoosipotilailla on pitemmät sairauspoissaolot etenkin ensimmäisten viiden vuoden aikana diagnoosista, ja he jäävät työkyvyttömyyseläkkeelle muutama vuosi muuta väestöä aikaisemmin «Jørgensen P, Langhammer A, Krokstad S, ym. Diagnos...»121, «Sawicka-Gutaj N, Ruchala M, Feldt-Rasmussen U, ym....»122.
- Koska hypotyreoosipotilailla on todettu lisääntynyt sairauspoissaolojen ja työkyvyttömyyseläkkeen riski, on tärkeää seurata ja tukea työkykyä. Parhaiten tämä hoituu työterveydenhuollossa, jonne työssä käyvä potilas on hyvä ohjata, kun hypotyreoosidiagnoosi tehdään (ks. Käypä hoito -suositus Sairauspoissaolon tarpeen arviointi «Sairauspoissaolon tarpeen arviointi»7, «Sairauspoissaolon tarpeen arviointi. Käypä hoito -...»123).
Oireet jatkuvat tavoitellusta TSH-pitoisuudesta huolimatta
- Populaatiotutkimusten mukaan 5–15 %:lla tyroksiinihoidetuista hypotyreoosipotilaista on hypotyreoosiin sopivia oireita viitealueelle hoidetusta TSH-pitoisuudesta huolimatta «Peterson SJ, Cappola AR, Castro MR, ym. An Online ...»116, «Panicker V, Evans J, Bjøro T, ym. A paradoxical di...»119, «Wekking EM, Appelhof BC, Fliers E, ym. Cognitive f...»124, «Saravanan P, Chau WF, Roberts N, ym. Psychological...»125.
- Viitevälin sisällä vaihtelevan TSH-arvon ei ole todettu korreloivan potilaan oireisiin tai tyytyväisyyteen «Saltevo J, Kautiainen H, Mäntyselkä P, ym. The Rel...»126.
- Jos potilas ei ole tyytyväinen vointiinsa tai elämänlaatuunsa tyroksiinimonoterapian
aikana «Jonklaas J. Optimal Thyroid Hormone Replacement. E...»95
- tarkistetaan, onko potilaalla primaarinen kliininen hypotyreoosi
- arvioidaan, onko hypotyreoosin etiologia sellainen, että se johtaa pysyvään ja merkittävään
kilpirauhashormonivajaukseen
- kilpirauhasleikkaus, radiojodihoito, kaulan sädehoito tai autoimmuunityreoidiitti (TPOAb-arvo)
- tarkistetaan tyroksiinihoidon asianmukainen toteutuminen
- Arvioidaan, onko kilpirauhasarvojen hoitotavoitteet saavutettu tyroksiinihoidolla (TSH-viitealueella).
- Liian suuri tai nopeasti muuttuva annos voi olla syy huonoon hoitovasteeseen. Tällöin voidaan muuttaa hoidon aloitusannosta ja suurentaa annoksia asteittain.
- Muut lääkkeet ja sairaudet voivat aiheuttaa tyroksiinin annostarpeen muuttumisen tai kilpirauhasen toimintakokeiden tulosten vaihtelun.
- kirjataan potilasta häiritsevät oireet
- Tyypillisiä koettuja oireita ovat muun muassa painon nousu, väsymys, mieliala- ja muistivaikeudet, ummetus ja kipu «Perros P, Nagy EV, Papini E, ym. Hypothyroidism an...»118.
- selvitetään, onko oireiden taustalla jokin muu diagnosoimaton tai hoitamaton sairaus
tai syy (ks. taulukko «Kliinisen kilpirauhasen vajaatoiminnan oireet, löydökset ja erotusdiagnostiikka elinjärjestelmittäin.
Suomennettu ja muokattu lähteestä ....»5).
- Muiden syiden aiheuttamiin oireisiin viittaa tilanne, jossa oireet ovat esiintyneet jo diagnoosivaiheessa, mutta eivät ole korjaantuneet asianmukaisesti toteutetusta tyroksiinihoidosta huolimatta.
- Oireiden muita syitä tulee aktiivisesti selvitellä ja hoitaa myös tilanteissa, joissa potilas on aiemmin voinut hyvin tyroksiinihoidon aikana, mutta alkanut voida huonosti sen aikana asianmukaisesti toteutetusta hoidosta huolimatta.
- Muita syitä voivat olla:
- unettomuus, unihäiriöt ja uniapnea
- liikunnan puute
- kuormittava elämäntilanne (krooninen stressitila, työuupumus, päihdeongelma)
- vaihdevuodet
- metabolinen syy (hyperkalsemia, hypokalsemia, lihavuus, elektrolyyttihäiriö)
- masennus, ahdistus, fibromyalgia, somatisaatio «Perros P, Nagy EV, Papini E, ym. Hypothyroidism an...»118
- krooninen väsymysoireisto tai virussairauden jälkitila
- muu endokriininen sairaus (diagnosoimaton diabetes, lisämunuaiskuoren vajaatoiminta)
- muu autoimmuunisairaus (keliakia, tyypin 1 diabetes, Addisonin tauti)
- hematologinen sairaus (anemia, myelooma)
- muu somaattinen sairaus (munuais-, maksa- ja sydänsairaus, polymyalgia rheumatica tai muu krooninen tulehduksellinen sairaus)
- ravitsemuksellinen syy (B12-vitamiinin puutos, D-vitamiinin puutos, folaatin puutos, raudan puutos)
- lääkevaikutus (keskushermostoon vaikuttavat lääkkeet, suuriannoksinen beetasalpaaja, glukokortikoidihoito).
- Kokonaisarvion jälkeen potilaalle voidaan harkita endokrinologin tai kilpirauhassairauksien hoitoon koulutuksen saaneen sisätautilääkärin suunnittelemaa LT4 + LT3 -yhdistelmähoitoa. Ks. kohta Tyroksiinin ja liotyroniinin yhdistelmähoito «A10»13.
Hypotyreoosin ja tyroksiinihoidon vaikutus painoon
- Kilpirauhasarvojen normaalistamiseen tähtäävä kilpirauhashormonihoito ei ilmeisesti korjaa ylipainoa kilpirauhasen vajaatoiminnassa «Kilpirauhasarvojen normaalistamiseen tähtäävä kilpirauhashormonihoito ei ilmeisesti korjaa ylipainoa kilpirauhasen vajaatoiminnassa.»B.
- Aineenvaihdunnan vilkkauteen ja ruokahalun ja painon säätelyyn vaikuttavat mekanismit ovat moninaisia, ja kilpirauhashormoni on vain yksi osatekijä monimutkaisessa systeemissä.
- Koska suurin osa painon noususta hoitamattomassa hypotyreoosissa johtuu suolan ja veden kertymisestä elimistöön, tyroksiinihoito pudottaa painoa hiukan. Paino palaa yleensä tasolle, jolla se oli ennen hypotyreoosin kehittymistä, elleivät muut syyt nosta sitä «Karmisholt J, Andersen S, Laurberg P. Weight loss ...»127. Mikäli muut hypotyreoosin oireet korjaantuvat painoa lukuun ottamatta, on hyvin epätodennäköistä, että hypotyreoosin hoidosta huolimatta jatkuva paino-ongelma liittyy yksin kilpirauhaseen.
- Kun hypotyreoosi on hoidossa ja TSH-arvo viitealueella, on henkilön kyky nostaa tai pudottaa painoa yhtä suuri kuin henkilöllä, jolla ei ole kilpirauhasen toimintahäiriötä.
- Painon kehitystä arvioitaessa on huomioitava pitemmän aikavälin painohistoria ja muut painon nousuun vaikuttavat tekijät, kuten muutokset liikunnan määrässä, stressissä ja nukkumisessa. Mikäli painon nousua on edeltänyt painon väheneminen, painonsäätelyyn vaikuttavat fysiologiset säätelymekanismit pyrkivät nostamaan painon vähintään edeltävälle tasolle.
- Ylisuuri tyroksiiniannos vilkastuttaa aineenvaihduntaa, mutta samalla menetetään myös lihaskudosta. Toisaalta se voi myös lisätä painoa, jos ruokahalu lisääntyykin energiankulutusta enemmän. Koska iatrogeeninen tyreotoksikoosi aiheuttaa myös luu- ja sydänhaittoja, sitä ei suositella painonhallintaan.
Näyttöön perustumattomat hoitomuodot
Tyroksiinin (T4) ja liotyroniinin (T3) yhdistelmähoito
- Synteettisen levotyroksiinin (T4) ja liotyroniinin (T3) yhdistelmähoito (T4 + T3 -yhdistelmähoito) ei ilmeisesti paranna potilaan elämänlaatua, väsymystä, masennusta, ahdistuneisuutta tai kipua tyroksiinimonoterapiaan verrattuna kliinistä kilpirauhasen vajaatoimintaa sairastavilla potilailla «Synteettisen levotyroksiinin (T4) ja liotyroniinin (T3) yhdistelmähoidolla ei ilmeisesti ole vaikutusta kliinistä kilpirauhasen vajaatoimintaa sairastavien potilaiden elämänlaatuun, väsymykseen, masennukseen, ahdistuneisuuteen tai kipuun.»B.
- Hypotyreoosista on tehty 13 kansainvälistä hoitosuositusta vuoden 1990 jälkeen. Näistä 3 koskee raskaana olevia potilaita, 2 lapsipotilaita ja 8 aikuispotilaita. Euroopan kilpirauhasyhdistyksen vuoden 2017 suosituksessa «Wiersinga WM, Duntas L, Fadeyev V, ym. 2012 ETA Gu...»128 ja Britannian kilpirauhasyhdistyksen vuoden 2015 suosituksessa «Kraut E, Farahani P. A Systematic Review of Clinic...»129 ehdotetaan T4 + T3 -kokeilua potilaille, joilla on kliininen kilpirauhasen vajaatoiminta, oireita viitealueella olevasta TSH-pitoisuudesta huolimatta ja joiden oireille ei löydy muuta selitystä. Raskaana oleville ja lapsipotilaille T4 + T3 -yhdistelmähoitoa ei suositella.
- Vaikka objektiivista näyttöä yhdistelmähoidon eduista suhteessa levotyroksiinihoitoon ei ole osoitettu kontrolloiduissa tutkimuksissa, niistä tehdyn meta-analyysin mukaan 48 % potilaista piti yhdistelmähoitoa parempana, 25 % koki T4-monoterapian paremmaksi ja 27 % ei havainnut hoitojen välillä eroa «Lan H, Wen J, Mao Y, ym. Combined T4 + T3 therapy ...»130.
- Yhdistelmähoitoon liittyvät mahdolliset haitat kehittyvät hitaasti ja ovat harvinaisia. Haitat korostuvat iäkkäillä. Tähän mennessä julkaistut kontrolloidut tutkimukset ovat kestoltaan liian lyhyitä osoittamaan luotettavasti T4 + T3 -hoidon haittoja tai turvallisuutta «Kraut E, Farahani P. A Systematic Review of Clinic...»129. Tutkimusten tilastollinen voima ei myöskään riitä arvioimaan hoidon sydän- ja verisuoniturvallisuutta, koska vain 6 tutkimuksessa potilasmäärä oli suurempi kuin 50 ja suurimman meta-analyysin potilasmäärä oli 883 «Leese GP, Soto-Pedre E, Donnelly LA. Liothyronine ...»131, «Tariq A, Wert Y, Cheriyath P, ym. Effects of Long-...»132.
- Havainnoivien tutkimusten perusteella sydän- ja verisuonisairastavuus ei ole lisääntynyt, jos TSH-pitoisuus on yhdistelmähoidon aikana pysynyt viitealueella.
- Viime vuosina eläinperäisten kilpirauhasuutteiden ja synteettisten T4 + T3 -yhdistelmävalmisteiden käyttö on lisääntynyt huomattavasti länsimaissa. Suomessa myönnettiin vuonna 2021 2 353 erityislupaa synteettisiin T3-valmisteisiin ja 741 erityislupaa eläinperäisiin erityisvalmisteisiin.
- Lisätietoa yhdistelmähoitoon soveltuvista ja siitä todennäköisesti hyötyvistä potilaista tarvitaan «Tyroksiinin (LT4) ja liotyroniinin (LT3) yhdistelmähoitokokeilun tausta ja tarvittavat lisätutkimukset»12.
Yhdistelmähoidon kustannukset
- Suomessa saatavilla olevat erityisluvalliset synteettiset liotyroniini (T3) -valmisteet ovat noin 20 kertaa niin kalliita kuin myyntiluvalliset synteettiset T4-valmisteet. Erityisluvallisia valmisteita käytettäessä syntyy lääkekustannusten lisäksi myös muita lisäkustannuksia, koska laboratoriokoeseurantaa tarvitaan enemmän ja seurannassa joudutaan määrittämään TSH-pitoisuuden lisäksi T4-V- ja T3-V-pitoisuudet.
- Lisäksi erityisluvan uusimisesta tulee vuosittain lisäkustannuksia sekä terveydenhuollolle että potilaalle.
- Koska yhdistelmähoito tulee potilaalle kalliimmaksi kuin T4-hoito, tulee kustannukset ja lääkitykseen liittyvä erityislupamenettely käydä potilaan kanssa läpi ennen yhdistelmähoidon aloitusta.
Yhdistelmähoitoon soveltuvat potilaat
- Jos potilaalla on asianmukaisesti diagnosoitu kliininen kilpirauhasen vajaatoiminta ja oireita viitealueella olevasta TSH-pitoisuudesta huolimatta, kartoitetaan ensin mahdolliset muut ongelmat, joiden hoidolla voidaan vaikuttaa oireisiin suotuisasti. Ks. taulukko «Kliinisen kilpirauhasen vajaatoiminnan oireet, löydökset ja erotusdiagnostiikka elinjärjestelmittäin. Suomennettu ja muokattu lähteestä ....»5 ja kohta Oireet jatkuvat tavoitellusta TSH-pitoisuudesta huolimatta «A11»14.
- Ennen yhdistelmähoidon arvioon lähettämistä
- tarkistetaan, että potilaalla on primaarinen kliininen hypotyreoosi ja että hypotyreoosin
etiologia sellainen, että se johtaa pysyvään ja merkittävään kilpirauhashormonivajaukseen
- Yhdistelmähoidosta ei ole todennäköisesti hyötyä, jos potilaalla on jäljellä omaa kilpirauhashormonituotantoa «DiStefano J 3rd, Jonklaas J. Predicting Optimal Co...»133, «Jonklaas J, Bianco AC, Cappola AR, ym. Evidence-Ba...»134.
- tarkistetaan tyroksiinihoidon asianmukainen toteutuminen
- kirjataan potilasta häiritsevät oireet
- selvitetään, onko oireiden taustalla jokin muu diagnosoimaton tai hoitamaton sairaus, lääkitys, kuormittava elämäntilanne tai vaihdevuodet
- varmistetaan, että potilaalla ei ole yhdistelmähoidon vasta-aiheita (raskaus tai raskaustoive, arytmiataipumus, vaikea ahdistus, sydän- ja verisuonitauti).
- tarkistetaan, että potilaalla on primaarinen kliininen hypotyreoosi ja että hypotyreoosin
etiologia sellainen, että se johtaa pysyvään ja merkittävään kilpirauhashormonivajaukseen
- Geneettisestä testauksesta (DIO2-polymorfiatutkimus) ei ole riittävästi tietoa yhdistelmähoidon aloituksen arvioinnissa, mutta lisätutkimuksia tarvitaan «Dijodinaasientsyymien polymorfismien käyttö kilpirauhasen vajaatoiminnan korvaushoidon ohjaamisessa»13.
- T3-V-pitoisuus tai T4-V/T3-V-suhde eivät ennusta yhdistelmähoidon hoitovastetta «DiStefano J 3rd, Jonklaas J. Predicting Optimal Co...»133.
- Potilaan oireiston piirteet eivät ennakoi hoitovastetta.
Yhdistelmähoidon toteutus
- Suosittelemme, että endokrinologi tai kilpirauhassairauksien hoitoon koulutuksen saanut sisätautilääkäri suunnittelee tai aloittaa LT4 + LT3 -yhdistelmähoidon yksilöllisen kokonaisarvion jälkeen «Karmisholt J, Andersen S, Laurberg P. Weight loss ...»127. Ks. kohta Hoidon porrastus «A12»15.
- Perusterveydenhuollon lääkäri voi jatkaa erikoissairaanhoidossa aloitettua tai erikoissairaanhoidon konsultaation perusteella aloitettua hoitoa ohjeiden mukaan.
- Hoidon tavoitteena on pitää TSH-pitoisuus viitealueella. T3-V-pitoisuus ei saa ylittää viitealueen ylärajaa «Synteettisen levotyroksiinin (T4) ja liotyroniinin (T3) yhdistelmähoidolla ei ilmeisesti ole vaikutusta kliinistä kilpirauhasen vajaatoimintaa sairastavien potilaiden elämänlaatuun, väsymykseen, masennukseen, ahdistuneisuuteen tai kipuun.»B.
- Potilaiden kanssa tulee keskustella hoidon tavoitteista ja vasteen arvioinnin aikataulusta, hoitoon sitoutumisesta, turvallisuudesta, lääkitykseen liittyvästä erityislupamenettelystä ja hinnasta ennen hoidon aloitusta.
- Yhdistelmähoito tulee toteuttaa turvallisesti ja seurata potilaita huolellisesti sekä
hyötyjen että haittojen osalta.
- Hoidosta ylisuurilla annoksilla on aiheutunut vaarallisia haittavaikutuksia, joka on heikentänyt luottamusta hoidon turvallisuuteen «Yi W, Kim BH, Kim M, ym. Heart Failure and Stroke ...»135, «Khan W, Van Der Gugten G, Holmes DT. Thyrotoxicosi...»136.
- Sydän- ja verisuonihaittoja ei ole todettu lyhytkestoisissa kontrolloiduissa tutkimuksissa, joissa yhdistelmähoito on pääsääntöisesti toteutettu käyttämällä pieniä 5–15 µg liotyroniinin vuorokausiannoksia ja TSH-pitoisuus on pysynyt viitealueella «Lan H, Wen J, Mao Y, ym. Combined T4 + T3 therapy ...»130.
- Pisimmissä yhdistelmähoitoa tutkineissa havainnoivissa tutkimuksissa yhdistelmähoitopotilaiden TSH-pitoisuus on pidetty viitealueella eikä tällöin haittavaikutuksia ole ilmennyt «Lan H, Wen J, Mao Y, ym. Combined T4 + T3 therapy ...»130, «Tariq A, Wert Y, Cheriyath P, ym. Effects of Long-...»132.
Yhdistelmähoidon aloitusannoksen arvioiminen
- Hoidossa suositellaan käytettäväksi synteettistä LT3-valmistetta, joka on erityisluvallinen lääke.
- Lääkelain mukaan Fimea voi erityisistä sairaanhoidollisista syistä myöntää luvan luovuttaa kulutukseen sellaisen lääkevalmisteen, jolla ei Suomessa ole myyntilupaa. Fimean erityisluvan myöntäminen ei ole osoitus siitä, että viranomainen olisi arvioinut lääkehoidon tarpeelliseksi, vaikuttavaksi tai turvalliseksi yksittäisen potilaan kohdalla, vaan lääkäri vastaa lääkehoidosta, ja vastuu korostuu, kun hän määrää erityisluvallisia valmisteita.
- T3-valmisteelle haetaan erityislupa vuoden välein. Erityislupahakemuksen lisäksi potilaalle tulostetaan kirjallinen lääkemääräys samalle T3-valmisteelle ja -annokselle. Potilas toimittaa apteekin kanssa yhteistyössä kirjallisen lääkemääräyksen erityislupahakemuksen liitteenä Fimealle.
- Erityislupaa vaativa hoitomuoto edellyttää osaamista ja kokemusta hoitoannoksien laskemiseksi.
- Tyroksiinin (T4) ja liotyroniinin (T3) suhteen tulisi vastata ihmisen kilpirauhasen tyroksiinin ja liotyroniinin erityksen suhdetta (13:1–16:1), ja annoksien laskemisessa tulisi huomioida liotyroniinin 3–4 kertaa tyroksiinia suurempi teho mikrogrammaa kohden laskettuna «Wiersinga WM, Duntas L, Fadeyev V, ym. 2012 ETA Gu...»128.
- Sopiva annos määräytyy aiemman optimaalisen (TSH-arvo viitealueella) tyroksiiniannoksen perusteella.
- T3:n vuorokausiannoksien tulee olla pieniä (5–15 µg/vrk) ja vuorokausiannos tulee jakaa 2–3 annokseen «Lan H, Wen J, Mao Y, ym. Combined T4 + T3 therapy ...»130, «Leese GP, Soto-Pedre E, Donnelly LA. Liothyronine ...»131.
- T4:n ja T3:n annostelun suhteessa 10:1–20:1 arvioidaan johtavan fysiologiseen kudospitoisuuteen.
- Farmakokineettisten tutkimusten mukaan näyttää siltä, että tyroksiiniin yhdistetyllä
T3-annoksella 0,07 µg/kg kahdesti päivässä saavutetaan kohtalaisen tasainen T3-pitoisuus
«Khan W, Van Der Gugten G, Holmes DT. Thyrotoxicosi...»136.
- Tästä 70 kg painavalle aikuiselle laskettu T3-annos on 5 µg x 2.
- Taulukossa «Tyroksiiniannoksen perusteella suunnitellut yhdistelmähoidon annokset....»10 on esimerkkejä fysiologisen yhdistelmähoidon T4- ja T3-annoksista suhteutettuna tyroksiinihoitoannoksiin «Wiersinga WM, Duntas L, Fadeyev V, ym. 2012 ETA Gu...»128.
- Liotyroniinista on saatavana 5 µg:n ja 20 µg:n annosvahvuudet.
| Nykyinen T4-annos µg/vrk | Fysiologinen yhdistelmähoito LT4- ja LT3-valmisteilla (suhde 13:1–16:1) |
|
| T4 µg | T3 µg | |
| 75–100 | 50–75 | 2,5 µg x 2 |
| 112–137 | 88–112 | 2,5 µg x 3 tai 5 µg + 2,5 µg |
| 150–175 | 112–137 | 5 µg x 2 |
| 200–250 | 150–200 | 7,5 µg + 5 |
Yhdistelmähoidon seuranta
- Hoidon alussa kirjataan ne potilasta häiritsevät oireet, jotka hän liittää hypotyreoosiin «Ross DS. Treatment of primary hypothyroidism in ad...»89.
- Hoidon seurannassa arvioidaan hoidon vaikutusta erityisesti niihin oireisiin, joita haluttiin korjata, sekä mahdollisiin haittavaikutuksiin «Jonklaas J. Optimal Thyroid Hormone Replacement. E...»95.
- Tärkein seurantaparametri on TSH-pitoisuus, jonka suositellaan asettuvan viitealueelle.
- T4-V- ja T3-pitoisuudet eivät välttämättä anna oikeaa kuvaa korvaushoidon onnistumisesta.
- T4-V- ja T3-V-pitoisuuksia voidaan kliininen kokonaistilanne huomioiden määrittää etenkin, jos TSH-pitoisuus pienenee alle 0,1 mU/l.
- T4-V-pitoisuus voi olla pieni, jos LT4/LT3-suhde on epäfysiologisesti T3-painotteinen.
- T3-V-pitoisuudet ovat myös varsin vaihtelevia LT3:n nopean imeytymisen ja lyhyen puoliintumisajan vuoksi.
- T3-V-pitoisuus saattaa olla viitealueen yläosassa 3–4 tuntia tabletin oton jälkeen ja pieni ennen seuraavaa annosta. T3-V-pitoisuus ei saa ylittää viitealueen ylärajaa.
- Yhdistelmähoidon titraus
- 6–8 viikon kuluttua hoidon aloituksesta tarkistetaan TSH-pitoisuus.
- Annosmuutokset TSH-pitoisuuden perusteella:
- Jos TSH-pitoisuus on hieman suurentunut, lisätään tyroksiinin määrää 12,5–13 µg.
- Jos TSH-pitoisuus on yli 10 mU/l, voidaan sekä T3- että T4-annosta suurentaa säilyttäen suhde 13:1–16:1.
- Jos TSH-pitoisuus on viitealueella, jatketaan samaa annosta
- Jos TSH-pitoisuus on alle viitealueen alarajan mutta mitattavissa ja suhde noin 13:1, pienennetään T3-annosta 2,5 µg. Nuoremmilla, joilla suhde on noin 16:1, pienennetään T4-annosta 12,5–13 µg.
- 6 kuukauden kuluttua arvioidaan hoidon hyödyt ja haitat. Mikäli yhdistelmähoito ei korjaa ennen hoidon aloitusta kirjattuja oireita, palataan takaisin T4-hoitoon.
- Jos kliinisen hypotyreoosin diagnoosi on varma, vasta-aiheita ei ole, yhdistelmähoito toteutuu turvallisesti ilman haittavaikutuksia ja TSH-arvo pysyy viitealueella, hoitoa voidaan jatkaa huomioiden, että kyseessä on erityislupaa vaativa hoitomuoto, jossa lääkäri on erityisessä vastuussa hoidon turvallisuudesta. Pääsääntöisesti tähän tarvitaan T4-monoterapiaa tiiviimpää kliinistä ja laboratoriokoeseurantaa.
- Seurannassa on arvioitava uudelleen hoitotuloksen säilyminen ja siirtyminen takaisin T4-hoitoon, jos hoitovaste menetetään.
- On tärkeää, että potilaat eivät toteuta T3-hoitoa omatoimisesti subjektiivisten tuntemustensa perusteella, vaan annosmuutokset perustuvat laboratoriokokeiden tuloksiin.
- Seurannassa huomioidaan myös vasta-aiheet ja haittavaikutuksille altistavat mahdolliset sydän- ja verisuonitautien oireet sekä mielialan muutokset ja luusto-ongelmat. Vakiintuneessa vaiheessa potilasta seurataan vastaanotolla 12 kuukauden välein: anamneesi, kliininen tutkimus, verikokeet ja tarvittaessa EKG.
- Jos potilaalla on raskaustoive, tyroksiinihoitoon tulee siirtyä ajoissa «Metso S, Hakala T, Attanasio R ym. Kilpirauhashorm...»11.
Yhdistelmähoidon vaihtaminen tyroksiinihoitoon
- Yhdistelmähoidon muuttamista turvallisemmaksi tyroksiinimonoterapiaksi suositellaan erityisesti, mikäli yhdistelmähoidon toteuttamiseen liittyy ongelmia, hoidon hyöty on jäänyt epävarmaksi tai hoidolle on vasta-aiheita. Tarvittaessa tyroksiinihoitoon siirtymisestä voi konsultoida endokrinologia tai kilpirauhassairauksien hoitoon koulutuksen saanutta sisätautilääkäriä.
- Jos yhdistelmähoitoa suositellaan jatkettavaksi, pitäisi tälle olla perusteet ja yhdistelmähoidon turvallisuuden tulisi olla osoitettavissa T3-valmisteen erityislupaa uusittaessa.
- Mikäli hoitoa on toteutettu aiemmin yksityissektorilla tai omatoimisesti, perusterveydenhuollon yleislääkäri ei ole velvollinen uusimaan lääkemääräystä eikä toteuttamaan hoitoa, jota ei tunne ja joka on potentiaalisesti haitallinen etenkään, elleivät diagnoosi ja tässä suosituksessa asetetut hoitoindikaatiot toteudu.
- T3 on noin 3–4 kertaa voimakkaampaa verrattuna tyroksiiniin. Esimerkiksi siirryttäessä yhdistelmästä liotyroniini 10 µg + tyroksiini 50 µg tyroksiinimonoterapiaan sopiva annos tyroksiinia on 80–100 µg. Annoksen valinnassa kannattaa huomioida TSH-pitoisuus, ikä, oireet ja hoidon tavoitteet.
- Yhdistelmähoitoa voidaan myös keventää asteittain tyroksiinin määrää lisäämällä. TSH-pitoisuutta seurataan samalla 6–12 viikon välein.
- Jos liotyroniinihoitoon on liittynyt haittoja, voi hoidon lopettaa heti ilman annoksen asteittaista vähentämistä.
- Se, että potilaalla on käytössä vain pieni annos liotyroniinia kerran päivässä, saattaa viitata lumevaikutukseen ja ennakoida mahdollisuutta siirtyä takaisin tyroksiinimonoterapiaan.
Eläinperäiset valmisteet (dessicated thyroid extract, DTE)
- Eläinperäisten valmisteiden aloittamista ei suositella, koska lääkityksen titraus ja monitorointi on haasteellista. Valmisteiden vaikuttavuutta ja turvallisuutta tulee seurata kliinisin tutkimuksin ja laboratoriokokein tiheämmin kuin T4-monoterapiahoidossa.
- Valmisteiden ongelma on ihmiselle epäfysiologinen T4/T3-hormonisuhde ja vaikeampi annosten säätelymahdollisuus verrattuna synteettisiin valmisteisiin.
- Suuremman T3-pitoisuuden vuoksi fysiologista suhdetta on vaikeampi saavuttaa, ja hoidossa ajaudutaan herkästi tilanteeseen, jossa TSH-arvo on pieni, T4-V-arvo pienentynyt ja T3-V-arvo vaihteleva «Wiersinga WM, Duntas L, Fadeyev V, ym. 2012 ETA Gu...»128.
- Hoito vaatii erityislupaa.
- Ehdottomat vasta-aiheet ovat
- raskaus tai raskaustoive
- arytmiataipumus
- vaikea ahdistus
- sydän- ja verisuonitauti.
- Jos kliinisen hypotyreoosin diagnoosi on varma, vasta-aiheita ei ole, hoito toteutuu turvallisesti ilman haittavaikutuksia ja TSH-arvo on viitealueella, hoitoa voidaan huolellisen yksilöllisen harkinnan mukaan jatkaa huomioiden, että kyseessä on erityislupaa vaativa hoito, jossa lääkäri on erityisessä vastuussa hoidon turvallisuudesta ja riittävästä seurannasta.
- Eläinperäisen valmisteen vaihtaminen T4-hoitoon:
- Siirryttäessä 60 mg:n annoksesta eläinperäistä kilpirauhasuutetta tyroksiinohoitoon, tyroksiinin aloitusannos on 100 µg tyroksiinia.
- Siirryttäessä 90 mg:n annoksesta eläinperäistä valmistetta tyroksiinihoitoon, tyroksiinin aloitusannos on 112–150 µg.
T3-monoterapia
- T3-monoterapiaa ei suositella hypotyreoosin hoidoksi, koska tyreotoksikoosin riski on suuri, lääke- ja seurantakustannukset ovat suuremmat kuin tavanomaisessa tyroksiinihoidossa, hoito on epäfysiologista ja hoitomuoto on puutteellisesti tutkittu.
- T4 on T3:n prohormoni, joka konvertoituu T3-hormoniksi. T3 sitoutuu solujen kilpirauhashormonireseptoreihin, mikä johtaa kilpirauhashormonien biologisiin vaikutuksiin.
- T3:n puoliintumisaika on eri tutkimusten mukaan 6–22 tuntia «Saberi M, Utiger RD. Serum thyroid hormone and thy...»138, «Nicoloff JT, Low JC, Dussault JH, ym. Simultaneous...»139. Puoliintumisaika on näin ollen huomattavasti lyhyempi kuin T4:n noin 7 vuorokauden puoliintumisaika.
- T3:n lyhyt puoliintumisaika johtaa helposti plasmapitoisuuden suureen vaihteluun.
- Jokseenkin tasaisen T3-pitoisuuden saavuttamiseksi jouduttaisiin T3-monoterapiassa annostelemaan hormonivalmiste useita kertoja vuorokaudessa.
- Hypotyreoosin monoterapiasta T3-hormonilääkevalmisteilla on vain rajallisesti tietoa.
- 14 potilaan satunnaistetussa ja kaksoissokkoutetussa tutkimuksessa eutyreoosin saavuttaminen oli hankalaa ja sen saavuttaminen kesti keskimäärin 180 päivää.
- 6 viikon tutkimuksessa verrattiin liotyroniinin ja tyroksiinin monoterapiahoitoa «Celi FS, Zemskova M, Linderman JD, ym. Metabolic e...»140. Keskimääräinen liotyroniiniannos oli 0,57 ± 0,08 µg/kg/vrk ja tyroksiiniannos 1,68 ± 0,33 µg/kg/vrk (suhde 1:3). Liotyroniinin vuorokausiannos jaettiin kolmeen osaan. TSH-arvo pysyi molemmissa ryhmissä viitealueella. Ryhmien välillä ei havaittu eroa elämänlaadussa, glukoosiaineenvaihdunnassa tai haittavaikutuksissa. Liotyroniinia käyttäneiden paino väheni keskimäärin 2,1 kg ja LDL-kolesteroli 13,3 % verrattuna tyroksiinia käyttäneisiin.
- T3-monoterapiaan liittyen on kuvattu vakavia sairaalahoitoon johtaneita haittoja «Yi W, Kim BH, Kim M, ym. Heart Failure and Stroke ...»135, «Khan W, Van Der Gugten G, Holmes DT. Thyrotoxicosi...»136.
- T3-monoterapian ehdottomat vasta-aiheet ovat
- raskaus tai raskaustoive
- arytmiataipumus
- vaikea ahdistus
- sydän- ja verisuonitauti.
Hoidon porrastus
- Primaarisen hypotyreoosin toteaminen ja hoito tyroksiinilla on yleensä selväpiirteistä
ja toteutetaan pääosin perusterveydenhuollossa, työterveyshuollossa tai yksityissektorilla.
- Päätöksen hoidon aloittamisesta tulee perustua asianmukaiseen laboratoriodiagnostiikkaan. Hoidon peruste ja TSH-tavoite tulee kirjata.
- Lasten hypotyreoosin hoito aloitetaan lastentautien erikoislääkärin ohjauksessa, ks. kohta Lapset «A2»4.
- Kilpirauhassyöpäpotilaat hoidetaan alkuvaiheessa erikoissairaanhoidossa, ks. kohta Kilpirauhassyöpäpotilaat «A7»10.
- Sentraalisen hypotyreoosin diagnostiikka ja hoidon aloitus toteutetaan kaikenikäisillä erikoissairaanhoidossa, ks. kohta Sentraalinen hypotyreoosi «A1»3.
- Raskaana olevien hypotyreoosi hoidetaan perusterveydenhuollossa tarvittaessa erikoissairaanhoitoa konsultoiden, ks. kohta Raskaus «A4»7.
- Mahdollisia konsultaatio- tai läheteaiheita erikoissairaanhoitoon ovat seuraavat:
- Kilpirauhaskokeiden tulokset ovat ristiriitaisia, ks. kohta Epätyypillisesti käyttäytyvien kilpirauhasarvojen selvittely «A6»9
- Epäily sentraalisesta hypotyreoosista, ks. kohta Sentraalinen hypotyreoosi «A1»3
- Vaikeudet kilpirauhasen hormonihoidon toteuttamisessa
- Yhdistelmähoidon tarpeen arviointi
- Perusterveydenhuollossa seurattavat kilpirauhassyöpäpotilaat, joiden TSH-pitoisuus
on alle 0,1 vanhentuneen hoitokäytännön mukaisesti, ks. kohta Kilpirauhassyöpäpotilaat
«A7»10
- Erikoissairaanhoidon seurannassa olevien kilpirauhassyöpäpotilaiden tyroksiiniannosta ei tule muuttaa ilman konsultaatiota.
- Hyvinvointialueiden velvollisuus on varmistaa alueellisten hoitoketjujen ja hoitokäytäntöjen toimivuus ja huolehtia koulutuksesta, ohjeistuksesta ja toimivista konsultaatiopalveluista. Hoidon porrastusta koskevat suositukset ovat yleislinjauksia, ja niitä voidaan muokata paikallisesti.
- Hoidon tarpeen arviointi ja hoidon seuranta voidaan toteuttaa lääkärin tai hoitajan
vastaanotolla, videovastaanotolla, puhelimessa tai sähköisesti potilaan hoidon tarpeen
mukaan potilaslähtöisesti.
- Oireisten seuranta suositellaan toteutettavaksi lääkärin vastaanotolla.
- Hoitajan kontrolleissa voidaan seurata potilaita, joiden TSH-pitoisuus on hoitotavoitteessa ja joille ei ole ilmaantunut uusia oireita.
- Alkuvaiheessa ja hoitajaseurantaan siirryttäessä on huomioitava potilaan hyvä informointi kilpirauhasen vajaatoiminnan hoidosta, tavoitteista ja hoidon vaikutuksesta oirekuvaan sekä erotusdiagnostisten vaihtoehtojen selvittelyn ja hoidon tarve, ks. kohta Oireet jatkuvat tavoitellusta TSH-pitoisuudesta huolimatta «A11»14, «Perros P, Hegedüs L, Nagy EV, ym. The Impact of Hy...»117.
- Etäseurannan lisääntyessä on hypotyreoosin hoidossa kiinnitettävä erityistä huomiota potilaisiin, jotka eivät voi hyvin, vaikka TSH-arvo on viitealueella. Näiden potilaiden oireiden syiden selvittelyyn ja hoitoon tarvitaan useimmiten lääkärin vastaanotto.
- Hypotyreoosin hoidon suunnitelma voidaan kirjata sairauskertomuksen erikoisalalehdelle
tai terveys- ja hoitosuunnitelmaan (THS). Suunnitelmaan kirjataan hoidon tarve, tavoitteet,
toteutus ja keinot sekä tarvittava tuki, työnjako, hoidon arviointi, seuranta ja lääkitys
sen mukaisesti, mikä on kunkin potilaan hoidon kannalta olennaista «Terveydenhuoltolaki 30.12.2010/1326. §24. https://...»141, «Laki potilaan asemasta ja oikeuksista 17.8.1992/78...»142.
- Hoitosuunnitelma voidaan laatia ja toteuttaa myös sairaanhoitajan tai terveydenhoitajan vastaanotolla, mutta lääkäri määrittää diagnoosin, lääkehoidon ja seurannan tiheyden.
- Koska hypotyreoosipotilailla on todettu lisääntynyt sairauspoissaolojen ja työkyvyttömyyseläkkeen riski, on tärkeää seurata ja tukea työkykyä. Parhaiten tämä hoituu työterveydenhuollossa, jonne työssä käyvä potilas on hyvä ohjata, kun hypotyreoosidiagnoosi tehdään (ks. Käypä hoito -suositus Sairauspoissaolon tarpeen arviointi «Sairauspoissaolon tarpeen arviointi»7, «Sairauspoissaolon tarpeen arviointi. Käypä hoito -...»123).
Hoidon porrastus T3-valmisteiden käytön osalta
- Erikoissairaanhoitoon tehdään lähete kaikista raskaana olevista (kiireellinen) tai raskautta suunnittelevista T3-monoterapiaa, eläinperäisiä kilpirauhaslääkkeitä tai yhdistelmähoitoa käyttävistä potilaista.
- Käytössä olevan T3-monoterapian, eläinperäisen kilpirauhaslääkkeen tai yhdistelmähoidon
suhteen suositellaan tarvittaessa endokrinologin tai kilpirauhassairauksien hoitoon
koulutuksen saaneen sisätautilääkärin arviota hoidon turvallisuudesta ja tarpeesta.
- Mikäli hoitoa on toteutettu aiemmin yksityissektorilla ylisuurin annoksin (TSH-pitoisuus pieni), voi potilaasta tehdä tarvittaessa lähetteen endokrinologin konsultaation, mikäli potilas on halukas muuttamaan hoidon turvallisemmaksi ja suositusten mukaiseksi.
- Mikäli T3-monoterapiaa, eläinperäistä kilpirauhasvalmistetta tai yhdistelmähoitoa on toteutettu aiemmin yksityissektorilla tai omatoimisesti, perusterveydenhuollon lääkäri ei ole velvollinen uusimaan lääkemääräystä eikä toteuttamaan hoitoa ilman, että potilas sitoutuu turvalliseen hoidon toteutukseen.
- Perusterveydenhuollon lääkäri voi jatkaa erikoissairaanhoidon konsultaation tai arvion pohjalta hyväksyttyä tai aloitettua yhdistelmähoitoa edellyttäen, että hoito on arvioitu asianmukaiseksi ja turvalliseksi, seurantaohjeet ovat riittävät ja potilas sitoutuu hoitosuunnitelmaan.
Raskaus
Kilpirauhasarvot raskauden aikana
- Terveillä kilpirauhasen toiminta muokkautuu raskauden aiheuttamiin fysiologisiin muutoksiin ongelmitta.
- Jos äidillä on piilevä tai ilmeinen kilpirauhassairaus, kilpirauhastoiminnan poikkeavuudet voivat ilmaantua tai korostua raskauden aikana.
- Raskaus vaikuttaa kilpirauhasen toimintaan seuraavilla tavoilla:
- Tyroksiinin kantajaproteiinin (TBG) pitoisuus suurenee.
- Kilpirauhashormonien tuotanto lisääntyy.
- Jodin menetys virtsaan lisääntyy, mikä lisää jodin tarvetta.
- Kilpirauhasen koko kasvaa noin 10 %, jos jodin saanti on riittävä, ja reilusti enemmän, jos jodin saanti on liian vähäistä raskauden tarpeisiin nähden.
- Istukkahormonin (hCG) vaikutuksesta TSH-pitoisuus pienenee ja T4-V-pitoisuus suurenee
alkuraskaudessa.
- 15 %:lla TSH-arvo pienenee alle viitealueen alarajan alkuraskauden aikana.
- hCG:n aiheuttama liikatoiminta on yleensä lievä ja vähäoireinen ja korjaantuu tai lievenee spontaanisti toisen ja viimeisen kolmanneksen aikana.
- Alkuraskauden jälkeen TSH-pitoisuus suurenee, mutta pysyy pienempänä kuin ennen raskautta.
- Raskauden aikana kilpirauhasen toiminnan häiriön diagnosoinnissa olisi optimaalisinta käyttää populaatio- ja raskauskolmanneskohtaisia TSH:n viitearvoja. Ongelmana on se, että kirjallisuudessa julkaistut raskaudenaikaiset kilpirauhashormonien viitearvot vaihtelevat huomattavasti riippuen tutkitusta raskauspopulaatiosta ja käytetystä määritysmenetelmästä «Alexander EK, Pearce EN, Brent GA, ym. 2017 Guidel...»143, «Osinga JAJ, Derakhshan A, Feldt-Rasmussen U, ym. T...»144. Suomessa kliiniset laboratoriot eivät myöskään ole ilmoittaneet raskauskolmanneskohtaisia viitearvoja käytössään oleville laboratoriomenetelmille.
- T4-V-pitoisuus tarkistetaan raskauden aikana vain, kun TSH-arvo on poikkeava (alle 0,3 mU/l tai yli 3,9 mU/l)
- Raskauden aikana monet vapaan tyroksiinin immunologiset määritysmenetelmät, joita
käytetään yleisesti kliinisissä laboratorioissa, ovat epäluotettavia T4-V-pitoisuuden
arvioinnissa «De Groot L, Abalovich M, Alexander EK, ym. Managem...»145, «Lee RH, Spencer CA, Mestman JH, ym. Free T4 immuno...»146.
- Tämä johtuu raskaudenaikaisesta tyroksiinin kantajaproteiinin pitoisuuden suurenemisesta,
plasmavolyymin lisääntymisestä ja hemodiluutiosta «Aguree S, Gernand AD. Plasma volume expansion acro...»147 sekä albumiinipitoisuuden pienenemisestä. Muutokset vaikuttavat vapaan tyroksiinin
sitoutumiseen kuljetusproteiineihin ja häiritsevät immunologisia vapaiden hormonien
menetelmiä.
- Raskaudenaikainen T4-V-pitoisuuden pieneneminen on menetelmäkohtainen.
- Tasapainodialyysiin tai ultrafiltraatioon ja herkkään nestekromatografia-massaspektrometriaan
perustuvat määritysmenetelmät ovat automatisoituja immunologisia vapaan tyroksiinin
määrityksiä luotettavampia, mutta ne ovat kalliita (dialysoitu T4-V-määritys, T4-Vdi,
KL 6160).
- T4-Vdi-pitoisuus pienenenee raskauden aikana noin 10 %.
- Tämä johtuu raskaudenaikaisesta tyroksiinin kantajaproteiinin pitoisuuden suurenemisesta,
plasmavolyymin lisääntymisestä ja hemodiluutiosta «Aguree S, Gernand AD. Plasma volume expansion acro...»147 sekä albumiinipitoisuuden pienenemisestä. Muutokset vaikuttavat vapaan tyroksiinin
sitoutumiseen kuljetusproteiineihin ja häiritsevät immunologisia vapaiden hormonien
menetelmiä.
- Erityisesti raskauden viimeisen kolmanneksen aikana T4-V-arvo voi alittaa terveiden
aikuisten viitealueen alarajan «De Groot L, Abalovich M, Alexander EK, ym. Managem...»145.
- Tämä raskauteen liittyvä fysiologinen tila muistuttaa sentraalista hypotyreoosia ja voi aiheuttaa tulkintaongelmia, koska Suomessa ei ole erikseen määritelty viitealueita raskaana oleville naisille.
- Tyroksiinihoidosta ei ole osoitettu olevan hyötyä isoloidussa hypotyroksinemiassa raskauden aikana, eikä tyroksiiinihoitoa suositella pelkästään pienen T4-V-arvon takia.
- Sikiö alkaa tuottaa kilpirauhashormoneja ensimmäisen raskauskolmanneksen jälkeen eikä siksi ole niin riippuvainen äidin T4-V-pitoisuudesta raskauden puolivälin jälkeen.
- Sentraalinen hypotyreoosi on harvinainen.
- Isoloitu hypotyroksinemia on useimmiten raskauteen liittyvä ja kilpirauhasarvot normaalistuvat raskauden jälkeen.
Kilpirauhasarvojen tarkistus ja seuranta raskauden aikana
- TSH-seulontaa kaikille raskaana oleville naisille ei suositella.
- TSH-seulonta raskauden aikana kohdistetaan riskiryhmiin (ks. taulukko «Erityisryhmät, joilla hypotyreoosin seulontaa tai sulkemista pois kannattaa harkita myös oireettomilta henkilöiltä....»7) sekä potilaisiin, joilla on ollut aikaisemmin kilpirauhasen toiminnan häiriöitä.
- TSH-pitoisuus tarkistetaan myös, jos oireiden tai kliinisen tilan perusteella epäillään hypotyreoosia tai hypertyreoosia.
- Raskauden aikana suositellaan pelkän TSH-arvon seurantaa T4-V-määritykseen liittyvien tulkintaongelmien vuoksi.
- Mikäli potilaalla on ollut aikaisemmin Basedowin tauti, tarkistetaan TSHRAb.
- Jos tyroksiini ei ole käytössä ennen raskautta «De Groot L, Abalovich M, Alexander EK, ym. Managem...»145, (kuva «Tyroksiinihoidon tarpeen arviointi raskaana olevilla naisilla, joilla ei ole ollut tyroksiinia käytössä ennen raskautta»8, «hoi50133d.pdf»3 (PDF)) ja TSH-arvo on
- < 0,3 nmol/l, tarkistetaan TSH-, T4-V-, T3-V- ja TSHRAb-pitoisuudet
- Jos T4-V- ja T3-V-pitoisuudet ovat viitealueella, kyseessä on subkliininen hypertyreoosi.
- Jos T4-V- tai T3-V-pitoisudet ylittävät viitealueen ylärajan, kyseessä on kliininen hypertyreoosi.
- Jos TSHRAb-pitoisuus ylittää viitealueen ylärajan, kyseessä on todennäköisesti Basedowin tauti.
- Jos TSHRAb-pitoisuus ei ylitä viitealueen ylärajaa, kyseessä on todennäköisesti alkuraskauteen liittyvä hypertyreoosi, joka usein liittyy raskauspahoinvointiin, tai muusta syystä johtuva hypertyreoosi.
- ≥ 4,0 mU/l, tarkistetaan TSH- ja T4-V-pitoisuudet
- Jos T4-V-pitoisuus on viitealueella, kyseessä on subkliininen hypotyreoosi.
- Jos T4-V-pitoisuus on alle viitealueen alarajan, kyseessä on kliininen hypotyreoosi.
- 2,5–3,9 mU/l, tarkistetaan TPOAb-pitoisuus kertaalleen (ks. kohta Jos TSH-pitoisuus on 2,5–3,9 mU/l «A13»16).
- < 0,3 nmol/l, tarkistetaan TSH-, T4-V-, T3-V- ja TSHRAb-pitoisuudet
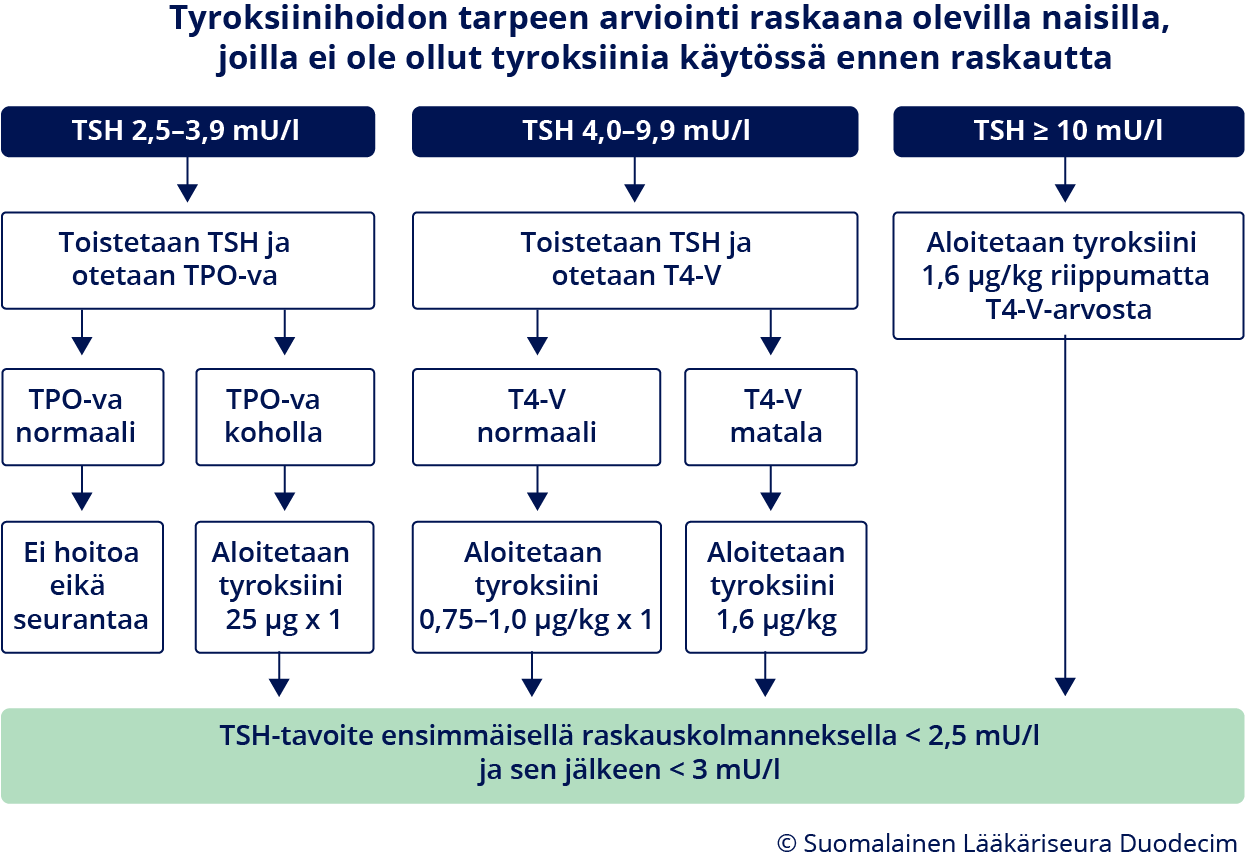
Tyroksiinihoidon tarpeen arviointi raskaana olevilla naisilla, joilla ei ole ollut tyroksiinia käytössä ennen raskautta. Avaa kaavion PDF-versio tästä linkistä «hoi50133d.pdf»3.
Subkliininen kilpirauhasen vajaatoiminta ja kilpirauhasen vasta-aineet raskauden aikana
- «»Jos TSH-pitoisuus on 4,0–9,9 mU/l ja T4-V-arvo on viitealueella, aloitetaan tyroksiini
raskauden ajaksi. Ks. kuva «Tyroksiinihoidon tarpeen arviointi raskaana olevilla naisilla, joilla ei ole ollut tyroksiinia käytössä ennen raskautta»8, «hoi50133d.pdf»3 (PDF).
- Alkuannos 0,75–1,0 µg/kg x 1
- TSH-tavoite < 2,5 mU/l ensimmäisellä kolmanneksella ja < 3,0 mU/l sen jälkeen raskauden aikana riippumatta TPOAb-pitoisuudesta
- TSH-arvo 4,0–9,9 mU/l raskauden aikana merkitsee jo suurentunutta keskenmenon ja ennenaikaisen synnytyksen ja sikiön huonomman neuropsyykkisen kehityksen riskiä «De Groot L, Abalovich M, Alexander EK, ym. Managem...»145.
- Jos TSH-pitoisuus on 2,5–3,9 mU/l ensimmäisessä raskauskolmanneksessa tai 3,0–4,0
mU/l toisessa ja kolmannessa raskauskolmanneksessa, suositellaan TPOAb-arvon tarkistamista
kertaalleen.
- Jos TPOAb-pitoisuus on suurentunut, suositellaan, että tyroksiini aloitetaan (alkuannos 25 µg x 1).
- Hoitotavoitteena on TSH < 2,5 mU/l ensimmäisellä kolmanneksella ja < 3,0 mU/l sen jälkeen.
- TPOAb-positiivisuus on todettavissa noin 2–17 %:lla raskaana olevista naisista.
- Jos TPOAb-arvo on suurentunut, kilpirauhasen kliinisen vajaatoiminnan kehittyminen on todennäköisempää, koska kilpirauhasen kyky lisätä kilpirauhashormonien tuotantoa raskauden aikana on heikentynyt.
- Näyttö ei ole yksiselitteistä, mutta tyroksiinihoito saattaa vähentää raskaudenaikaisia komplikaatioita ja vaikuttaa myönteisesti sikiön neuropsyykkiseen kehitykseen, jos TSH-pitoisuus on 2,5–3,9 mU ja TPOAb-pitoisuus on suurentunut «De Groot L, Abalovich M, Alexander EK, ym. Managem...»145, «Osinga JAJ, Derakhshan A, Feldt-Rasmussen U, ym. T...»144.
- Jos TPOAb-arvo on viitealueella, tyroksiinihoitoa ei tarvita eikä myöskään rutiinimaista seurantaa raskauden aikana.
- Seuranta on valikoidusti tarpeen tietyillä riskiryhmillä esimerkiksi, jos kilpirauhasta on aiemmin leikattu tai radiojodihoidettu tai potilaalla on ollut jodialtistus esimerkiksi varjoaineella.
Raskauden aikana todettu kliininen kilpirauhasen vajaatoiminta
- Jos TSH ≥ 10 mU/l T4-V-pitoisuudesta riippumatta tai TSH-pitoisuus on 4,0–9,9 mU/l ja T4-V-pitoisuus on alle viitealueen alarajan, aloitetaan tyroksiini (alkuannos 1,6 µg/kg). Ks. kuva «Tyroksiinihoidon tarpeen arviointi raskaana olevilla naisilla, joilla ei ole ollut tyroksiinia käytössä ennen raskautta»8, «hoi50133d.pdf»3 (PDF).
- TSH-tavoite on < 2,5 mU/l ensimmäisellä kolmanneksella ja < 3,0 mU/l sen jälkeen riippumatta
TPOAb-pitoisuudesta.
- Hoitamattomaan kliiniseen hypotyreoosiin liittyy muun muassa suurentunut keskenmenon, ennenaikaisen synnytyksen ja sikiön huonomman neuropsyykkisen kehityksen riski «De Groot L, Abalovich M, Alexander EK, ym. Managem...»145.
Ennen raskautta todettu kilpirauhasen vajaatoiminta
- Jos potilaalla on hypotyreoosi, johon hän saa tyroksiinihoitoa
- tyroksiinin annostelulla säädetään TSH-arvo raskaudenaikaiseen tavoitteeseen (TSH < 2,5 mU/l) jo raskauden suunnitteluvaiheessa.
- potilasta ohjeistetaan suurentamaan tyroksiiniannosta noin 30 % heti, kun hän tietää olevansa raskaana.
- TSH-arvo tarkistetaan ensimmäisen neuvolakäynnin yhteydessä ja tarvittaessa tyroksiiniannosta muutetaan.
- Jos tyroksiini on ollut käytössä jo ennen raskautta tai tyroksiini aloitetaan raskauden aikana, TSH-pitoisuus tarkistetaan 4 viikon välein raskausviikkoon 20 asti ja tyroksiiniannosta säädetään tarpeen mukaan.
- Kun tyroksiiniannos on vakiintunut ja TSH-arvo on tavoitteessa (< 2,5 mmol/l ensimmäisellä kolmanneksella ja < 3,0 mmol/l sen jälkeen), riittää TSH-pitoisuuden määrittäminen ja tarvittaessa tyroksiiniannoksen säätäminen lähellä raskausviikkoa 30.
Kilpirauhasarvojen tarkistus synnytyksen jälkeen
- Jos potilaan hypotyreoosia hoidettiin tyroksiinilla jo ennen raskautta, tyroksiiniannos pienennetään raskautta edeltävälle tasolle heti synnytyksen jälkeen.
- Jos raskauden aikana todettiin subkliininen hypotyreoosi tai kliininen hypotyreoosi (TSH ≥ 10 mU/l T4-V-arvosta riippumatta tai TSH 4,0–9,9 mmol/l ja T4-V alle viitealueen alarajan), tyroksiiniannosta pienennetään noin 30 % synnytyksen jälkeen.
- Jos tyroksiini aloitettiin, koska TSH-pitoisuus oli 2,5–3,9mU/l ja TPOAb-pitoisuus oli suurentunut tai TSH-pitoisuus oli 4,0–9,9 mU/l ja T4-V-pitoisuus viitealueella, tyroksiini lopetetaan heti synnytyksen jälkeen.
- Kilpirauhasarvot tarkistetaan 6 viikkoa synnytyksen jälkeen.
- Tyroksiiniannosta säädetään tai tyroksiinilääkitys aloitetaan uudelleen samoilla hoitoperiaatteilla kuin naisilla, jotka eivät ole raskaana.
Synnytyksen jälkeinen tyreoidiitti
- Synnytyksen jälkeinen tyreoidiitti kehittyy noin 1–16 %:lla äideistä vuoden sisällä synnytyksestä. Yleensä se kehittyy 6 kuukauden kuluttua synnytyksestä.
- Synnytyksen jälkeisen tyreoidiitin riskitekijät ovat muun muassa aiempi synnytyksen
jälkeinen tyreoidiitti, suurentunut TPO-vasta-ainepitoisuus ja tyypin 1 diabetes.
- Äideille, joilla on riskitekijöitä, suositellaan seulontaa (TSH ja T4-V) 6–12 viikkoa synnytyksen jälkeen «De Groot L, Abalovich M, Alexander EK, ym. Managem...»145.
- Klassisessa muodossa (25 % tapauksista) alkuvaiheessa on lievä hypertyreoosi, jota
seuraa lievä ja ohimenevä hypotyreoosi «Alexander EK, Pearce EN, Brent GA, ym. 2017 Guidel...»143.
- Hypertyreoosi hoidetaan oireenmukaisesti tarvittaessa beetasalpaajalla ja hypotyreoosi tarvittaessa tyroksiinilla.
- 32 %:ssa tapauksista esiintyy vain ohimenevä hypertyreoosivaihe.
- 43 %:ssa tapauksista esiintyy vain hypotyreoosivaihe.
- Tyroksiinin voi usein purkaa pois myöhemmin.
- Jos TPOAb on suurentunut, riski pysyvän hypotyreoosin kehittymiseen on lisääntynyt.
- Erotusdiagnoosina on Basedowin tauti, jonka yhteydessä
- hypertyreoosin vaikeusaste on usein merkittävämpi
- Basedowin taudin silmäoireita voi esiintyä
- TSHRAb on lähes aina suurentunut
- hoitolinja poikkeaa synnytyksen jälkeisestä tyreoidiitista. Basedowin hypertyreoosin alkuvaiheen hoito on tyreostaatti.
Liotyroniini ja muut T3:a sisältävät lääkkeet raskauden aikana
- T4 + T3 -yhdistelmähoidon tai eläinperäisten kilpirauhasvalmisteiden käyttöä ei suositella raskauden aikana «Alexander EK, Pearce EN, Brent GA, ym. 2017 Guidel...»143.
- Tyroksiinin ja liotyroniinin yhdistelmähoito, T3-monoterapia ja eläinperäiset kilpirauhasvalmisteet
tulee vaihtaa tyroksiinimonoterapiaan raskautta suunnittelevilla tai raskaana olevilla
naisilla.
- Suositellaan lähetettä erikoissairaanhoitoon.
- Lähete tehdään kiireellisenä, jos potilas on jo raskaana.
- Näyttöä T3-pohjaisten hoitojen turvallisuudesta sikiölle ei ole. Eläintutkimuksiin perustuvan tiedon pohjalta on mahdollista, että hoitoon sisältyy riskejä sikiölle «Alexander EK, Pearce EN, Brent GA, ym. 2017 Guidel...»143, «Patel J, Landers K, Li H, ym. Thyroid hormones and...»148.
- T4 + T3 -yhdistelmähoidon tai eläinperäisillä kilpirauhasvalmisteilla toteutetun hoidon
riski on, että sikiö ei saa riittävästi äidin T4-hormonia, mikä vaarantaa sikiön aivojen
kehityksen.
- T4:n kulkeutuminen istukan läpi sikiöön ja sikiön veri-aivoesteen läpi on keskeistä sikiön aivojen kehittymiselle «Alexander EK, Pearce EN, Brent GA, ym. 2017 Guidel...»143.
- Yhdistelmähoidossa T4-V-pitoisuus on yleensä pienempi, ja etenkin alkuraskaudessa sikiö on riippuvainen äidin T4-pitoisuudesta.
- T3 siirtyy huonosti sikiön keskushermostoon. Suurin osa sikiön aivojen T3:sta muodostuu äidin T4:stä dejodinaation seurauksena erityisesti raskausviikkoihin 16–18 asti «Patel J, Landers K, Li H, ym. Thyroid hormones and...»148.
- T3-valmisteisiin perustuviin hoitoihin liittyy tyreotoksikoosin vaara. Endogeeniseen hypertyreoosin liittyy keskenmenon ja ennenaikaisen synnytyksen riski «De Groot L, Abalovich M, Alexander EK, ym. Managem...»145.
Kilpirauhassyöpäpotilaat
- Useimmiten kilpirauhassyövän hoitona on koko kilpirauhasen poisto, jolloin elinikäinen tyroksiinilääkitys on tarpeen «Filetti S, Durante C, Hartl D, ym. Thyroid cancer:...»149, «Suomen Kilpirauhassyöpäryhmä. Papillaarinen ja fol...»150, «Haugen BR, Alexander EK, Bible KC, ym. 2015 Americ...»151.
- TSH-tavoitteet kilpirauhassyövän sairastaneilla potilailla vaihtelevat mahdollisen syövän jäljellä olon ja uusimisriskin sekä kilpirauhassyövän hoidon ja seurannan vaiheen mukaan.
- TSH-tavoite asetetaan yksilöllisesti, ja se voi muuttua hoidon ja seurannan myötä.
- Kun syövän hoidoksi riittää kilpirauhasen poisto eikä tarvita radiojodihoitoa liitännäishoitona hyvän ennusteen vuoksi, tyroksiinilääkitys toteutetaan kuten kilpirauhasen vajaatoimintaa sairastavilla potilailla.
- Silloin, kun leikkauksen lisäksi radiojodihoito on tarpeen, TSH-tavoite on alle 0,1 mU/l tai 0,1–0,5 mU/l ainakin 8–12 kuukauden kuluttua hoidon jälkeen tehtäviin vastearviotutkimuksiin saakka.
- Jos vastearviotutkimusten jälkeen ei syövän jäljellä olosta ole viitteitä, TSH-tavoitteeksi asetetaan 0,5–2 mU/l.
- Jos vastearviotutkimusten perusteella ei saada varmuutta syövän parantumisesta vaan vaaditaan joko lisähoitoja tai pidempää seuranta-aikaa, pidetään TSH-pitoisuus alle viitealueen alarajan 0,1–0,5 mU/l.
- Jos syöpää on kuvantamisen perusteella jäljellä, TSH-tavoite on alle 0,1 mU/l, koska TSH-pitoisuus voi stimuloida syöpäsolujen kasvua. TSH:n suppressio parantaa näiden potilaiden ennustetta.
- TSH-pitoisuutta ei tule pitää parantuneessa syövässä pienenä, koska se lisää sydän- ja verisuonisairastavuuden ja -kuolleisuuden riskiä mutta ei vaikuta syövän ennusteeseen.
- Erittäin hyväennusteisen kilpirauhassyövän hoidoksi saattaa riittää toisen kilpirauhaslohkon poisto, jolloin useimmiten ei kehity kilpirauhasen vajaatoimintaa. Tarvittaessa noudatetaan tavanomaisia kilpirauhasen vajaatoiminnan diagnostiikan ja hoidon periaatteita.
Kilpirauhassyöpäpotilaiden hoidon seuranta
- Seuranta toteutetaan alkuun erikoissairaanhoidossa onkologialla tai endokrinologialla, mutta siirretään yleensä myöhemmin perusterveydenhuoltoon.
- Erikoissairaanhoidon ollessa seurantavastuussa tyroksiinilääkityksen säätely toteutetaan erikoissairaanhoidossa tai seurannasta vastuussa olevaa yksikköä konsultoiden.
- Seurannan siirtyessä perusterveydenhuoltoon on syöpä todettu parantuneeksi, ja tällöin tyroksiinilääkitystä säädellään samoin periaattein kuin kilpirauhasen vajaatoimintaa sairastavilla potilailla (TSH-tavoite viitealueella).
- Iäkkäillä parantuneen kilpirauhassyövän ylihoitoa on syytä varoa. Tyroksiinikorvaushoidon TSH-tavoite on suurempi iäkkäillä (yli 65-vuotiailla) «Waring AC, Arnold AM, Newman AB, ym. Longitudinal ...»64, «Leng O, Razvi S. Hypothyroidism in the older popul...»71, «Kilpirauhasen toimintakokeiden laboratoriokohtaisia viitearvoja Suomessa»6.
- Perusterveydenhuoltoon siirtyvien kilpirauhassyövän sairastaneiden TSH-arvoja seurataan 1–2 vuoden välein.
- Mikäli kliinisesti herää epäily syövän uusimisesta, tulee ohjelmoida kaulan kaikukuvaustutkimus ja tyreoglobuliinimittaus.
- Joskus erikoissairaanhoidosta saatetaan ohjeistaa yksilöllisempi seuranta, esimerkiksi vuosittainen tyreoglobuliinimittaus. Tällöin erikoissairaanhoito ohjeistaa myös arvojen tulkinnan.
- Kilpirauhassyöpä ei yleensä diagnoosivaiheessa tai uusiessaan vaikuta TSH- tai T4-V-arvoihin.
- Aiempina vuosikymmeninä on ollut käytäntönä pitää kaikkien kilpirauhassyövän sairastaneiden potilaiden TSH suppressiossa. Näitä vanhentuneen käytännön mukaan hoidettuja potilaita on vielä perusterveydenhuollon seurannassa. Tällaisessa tilanteessa voi tarvittaessa konsultoida erikoissairaanhoitoa TSH-tavoitteen päivittämiseksi nykykäytännön mukaiseksi.
Lapsena, nuorena tai nuorena aikuisena syövän sairastaneet
- Nuorena syövän sairastaneilla voi annetuista hoidoista riippuen olla lisääntynyt kilpirauhasen toimintahäiriön tai kilpirauhassyövän riski.
- Elinikäistä, säännöllistä (1–2 vuoden välein sekä tarvittaessa oireiden yhteydessä tehtävää) kilpirauhashormonipitoisuuksien seurantaa (TSH ja T4-V) suositellaan potilaille, jotka ovat saaneet pään tai kaulan alueen tai koko kehon sädehoitoa. Lisäksi kilpirauhasarvojen seurantaa suositellaan niille potilaille, jotka ovat saaneet 131I-MIBG-hoitoa «Viikari L, Jahnukainen J, Lähteenmäki P. Endokriin...»39, «Welch JJG, Ames B, Cohen LE, ym. Management of chi...»152.
- Pieniinkin sädeannoksiin liittyy suurentunut kilpirauhaskasvainten riski. Lisäksi suuremmat sädeannokset lisäävät hypo- tai hypertyreoosin kehittymisen riskiä. Myös immunologisiin hoitoihin ja tyrosiinikinaasin estäjiin liittyy kilpirauhasen toimintahäiriöiden kehittymisen riski.
- Sentraalinen hypotyreoosi on harvinainen ja kehittyy vasta käytettäessä suuria pään alueen sädeannoksia. Useimmiten se on osa panhypopituitarismia eli laaja-alaista aivolisäkkeen vajaatoimintaa.
- Syövän sairastaneille potilaille tulee herkemmin aloittaa tyroksiinihoito myös subkliinisen hypotyreoosin yhteydessä, koska suurentunut TSH-pitoisuus voi lisätä kilpirauhaskasvainten riskiä. Tyroksiinihoidolla pyritään näillä potilailla pitämään TSH-pitoisuus viitealueen alapuoliskossa «Waguespack SG. Thyroid Sequelae of Pediatric Cance...»78.
Iäkkäät
- TSH-määritys tulee harkittavaksi iäkkäillä usein muun muassa toimintakyvyn heikkenemisen, muistin huononemisen ja ummetuksen selvittelyssä.
- Etenkin iäkkäillä ylidiagnostiikkaa ja ylihoitoa on syytä varoa.
- Väestötutkimuksissa nähdään vanhuksilla yleisesti TSH-pitoisuuden suurenemista yli terveiden aikuisten viitearvojen ylärajan.
- Tyroksiinikorvaushoidon aloitusraja ja hypotyreoosin korvaushoidon TSH-tavoite ovat suurempia iäkkäillä (yli 65-vuotiailla) ja erityisesti hyvin iäkkäillä «Waring AC, Arnold AM, Newman AB, ym. Longitudinal ...»64, «Leng O, Razvi S. Hypothyroidism in the older popul...»71, «Kilpirauhasen toimintakokeiden laboratoriokohtaisia viitearvoja Suomessa»6.
- Koska useissa tutkimuksissa on havaittu TSH-pitoisuuden suurenevan iän myötä, se on otettu huomioon TSH-pitoisuuden viitearvoissa useissa laboratorioissa.
- Nykysuositusten mukaan hyvin iäkkäiden subkliinistä hypotyreoosia (TSH < 10 mU/l, T4-V viitealueella) ei pidä hoitaa. Yli 70-vuotiailla ei ole näyttöä subkliinisen vajaatoiminnan hoitamatta jättämisen riskeistä.
- Lääkkeiden ja muiden sairauksien vaikutus kilpirauhasen toimintaan, toimintakokeiden tuloksiin ja tyroksiinihoitoon on otettava huomioon, koska muiden sairauksien ja lääkitysten todennäköisyys on suurempi (ks. taulukot «Kilpirauhasen vajaatoimintaa aiheuttavia lääkkeitä ja ravintolisiä....»3 ja «Lääkkeitä ja ravintolisiä, jotka aiheuttavat poikkeavia löydöksiä kilpirauhasen toimintakokeissa ja voivat vaikuttaa tyroksiinin annokseen, mutta eivät välttämättä vaikuta kilpirauhasen toimintaan....»4).
- Levotyroksiinin aloitusannos on 25 µg/vrk. Annosta lisätään vähitellen 4–6 viikon välein. Liian suuren tyroksiiniannoksen haitat korostuvat yli 70-vuotialla.
- Vakavan sairauden tai sen hoidon aiheuttama painon väheneminen voi olla nopeaa, jolloin TSH-pitoisuutta on hyvä seurata tiheämmin tyroksiinin annosmuutostarpeen varalta. Hyvin iäkkäillä etenkin painon vähittäinen väheneminen on melko yleistä ja myös tämä tulisi ottaa huomioon TSH-pitoisuuden seurantafrekvenssissä.
- Alkavan muistisairauden ensimmäinen merkki voi olla yllättävä TSH-arvo hypotyreoosin seurannassa. Lääkitys on voinut toteutua epäsäännöllisesti tai jäädä kokonaan pois käytöstä. Etenkin iäkkäillä olisikin huolehdittava siitä, että TSH-pitoisuus määritettäisiin säännöllisesti vuosittain sekä tarvittaessa, mikäli voinnissa, muussa lääkityksessä tai painossa tulee muutoksia.
Lapset
- Lapsen hypotyreoosi voi olla synnynnäinen tai hankittu (juveniili).
Synnynnäinen hypotyreoosi
- Synnynnäisen hypotyreoosin yleisyys Suomessa on 1:2 783 «Danner E, Niuro L, Huopio H, ym. Incidence of prim...»153.
- Synnynnäisen hypotyreoosin tavallisin aiheuttaja on kilpirauhasen kehityshäiriö. Kehityshäiriö voi ilmetä kilpirauhasen puuttumisena kokonaan (aplasia), pienikokoisuutena (hypoplasia) tai poikkeavana sijaintina. Kilpirauhasen kehityshäiriö on tavallisimmin sporadinen.
- Noin 35 %:ssa tapauksista todetaan normaalikokoinen tai suurentunut kilpirauhanen tavanomaisella paikalla, ja näistä noin puolessa syynä on kilpirauhashormonien synteesin perinnöllinen virhe (dyshormonogeneesi) «Danner E, Niuro L, Huopio H, ym. Incidence of prim...»153.
- Harvinainen sentraalinen hypotyreoosi ei löydy TSH-pitoisuuteen perustuvassa vastasyntyneiden seulonnassa «Wassner AJ. Congenital Hypothyroidism. Clin Perina...»154.
- Synnynnäisen primaarisen hypotyreoosin diagnoosi perustuu Suomessa napaseerumin TSH-pitoisuuden
määritykseen.
- Jos napaseerumin TSH-pitoisuus ylittää seulontarajan (laboratoriomenetelmästä riippuen 35 tai 40 mU/l), otetaan vähintään 72 tunnin iässä kontrollinäyte, josta määritetään plasman TSH- ja T4-V-pitoisuudet.
- Jos kontrollinäytteen TSH-pitoisuus ylittää seulontarajan (yleensä P-TSH 20 mU/l), aloitetaan heti levotyroksiinihoito «Linko-Parvinen A, Kouki A, Uitto J. Synnynnäisen h...»155.
- T4-V-pitoisuus kertoo hypotyreoosin vaikeusasteesta, mutta lääkitys aloitetaan myös T4-V-arvon ollessa viitealueella.
- Jos kyseessä on kaksosraskaus ja sikiöillä on ollut yhteinen istukka tai tästä ei ole varmuutta ja syntyneet lapset ovat samaa sukupuolta, suositellaan TSH- ja T4-V- pitoisuuksien kontrollointia kahden viikon iässä, koska sairaan vastasyntyneen kilpirauhashormonipitoisuudet voivat olla terveeltä sikiöltä saatuja ja TSH-pitoisuuden suureneminen hypotyreoottisella lapsella kestää yli viikon. Samoin, jos lapsen syntymäpaino on alle 1 500 g tai raskauden kesto syntymähetkellä on ollut alle 32 viikkoa tai vastasyntynyt on ollut tai on vakavasti sairas, suositellaan plasman TSH- ja T4-V-pitoisuuksien kontrolloimista kahden viikon iässä, vaikka aiemmat seulontatulokset olisivat olleet viitealueella «Rose SR, Wassner AJ, Wintergerst KA, ym. Congenita...»156.
- Jos lapsella on todettu Downin oireyhtymä, suositellaan arvojen kontrolloimista 4 viikon iässä «van Trotsenburg P, Stoupa A, Léger J, ym. Congenit...»157.
- Vastasyntyneen T4-V- ja TSH-pitoisuudet tulee tarkastaa sentraalisen hypotyreoosin
sulkemiseksi pois, jos lapsi on poikkeavan hypotoninen, hänellä on pitkittyvä keltaisuus
tai hänellä epäillään tai on todettu muita aivolisäkehormonien vajeita «van Trotsenburg P, Stoupa A, Léger J, ym. Congenit...»157.
- Jos vastasyntyneellä on myös lisämunuaiskuoren vajaatoiminta, tulee kortisolikorvaushoito aloittaa ennen tyroksiinihoitoa.
- Levotyroksiinihoidon suositeltu aloitusannos on 10–15 µg/kg «van Trotsenburg P, Stoupa A, Léger J, ym. Congenit...»157, «Niuro L, Danner E, Viikari L, ym. Treatment of Con...»158.
- Tämän vaihteluvälin yläosaan painottuvasta aloitusannoksesta voi olla hyötyä tilanteessa, jossa T4-V-pitoisuus on kontrolliseulontanäytteessä hyvin pieni.
- Sopiva annos voidaan murskata ja antaa lusikalla veteen tai maitoon sekoitettuna kerran päivässä.
- Lääkeannos voidaan antaa myös ruokinnan yhteydessä, mutta samaan vuorokauden aikaan «van Trotsenburg P, Stoupa A, Léger J, ym. Congenit...»157.
- Ennen hoidon aloitusta ei tarvita etiologiaa selvittäviä tutkimuksia, mutta kilpirauhasen
sijainti, koko ja rakenne voidaan selvittää kaikukuvaustutkimuksella.
- Geenitutkimusten asema on vakiintumaton, mutta tutkiminen voi olla hyödyllistä, jos taudinkuva on poikkeava.
- Ensimmäinen laboratoriokontrolli suositellaan tehtäväksi kahden viikon ikään mennessä hoidon aloituksesta ja jatkossa kahden viikon välein siihen asti, kunnes TSH- ja T4-V-arvot ovat iänmukaisella viitealueella.
- Jos TSH-arvo on iänmukaisella viitealueella, suositellaan T4-V-pitoisuuden sijoittuvan
iänmukaisen viitealueen yläpuoliskoon «van Trotsenburg P, Stoupa A, Léger J, ym. Congenit...»157, «Kilpirauhasen toimintakokeiden laboratoriokohtaisia viitearvoja Suomessa»6.
- Tyroksiiniannosta pienennetään vain, jos T4-V-pitoisuus on selvästi yli iänmukaisen viitealueen ylärajan ja TSH-pitoisuus on poikkeavan pieni tai lapsella on hypertyreoosiin sopivia oireita.
- Suositeltu seurantaväli ensimmäisen vuoden aikana on enintään 3 kuukautta, 3 vuoteen saakka enintään 4 kuukautta ja myöhemmin enintään 6 kuukautta aina kasvukauden loppuun saakka. Jos lääkeannosta muutetaan, suositellaan kilpirauhasarvojen kontrollointia 4–6 viikon kuluttua.
- Synnynnäinen hypotyreoosi voi olla ohimenevä.
- Hypotyreoosin ohimenevyyden todennäköisyys on suurempi, kun normaalikokoinen kilpirauhanen on löydettävissä oikealta paikaltaan eikä TSH ole suurentunut yli 10 mU/l -pitoisuuteen ensimmäisen elinvuoden jälkeen.
- Tällöin voidaan 2–3 vuoden iässä keskeyttää tyroksiinihoito ja kontrolloida kilpirauhasarvot viimeistään 4 viikon kuluttua.
Lapsen hankittu (juveniili) hypotyreoosi
- Myös lasten juveniilin hypotyreoosin tavallisin (70 % tapauksista) aiheuttaja on Hashimoton
autoimmuunityreoidiitti «Hunter I, Greene SA, MacDonald TM, ym. Prevalence ...»159.
- Lasten ja nuorten autoimmuunityreoidiitin yleisyys Yhdysvalloissa on noin 3 % «Crisafulli G, Gallizzi R, Aversa T, ym. Thyroid fu...»160, Suomesta ei ole vastaavaa tilastotietoa.
- Autoimmuunityreoidiitti lisää merkittävästi riskiä sairastua kilpirauhasen vajaatoimintaan, mutta 5 vuoden seurannassa yli puolet pysyy eutyreoottisina, kolmasosalle kehittyy subkliininen hypotyreoosi ja kliininen hypotyreoosi vain 12 %:lle «Crisafulli G, Gallizzi R, Aversa T, ym. Thyroid fu...»160.
- Suomalaisessa takautuvassa rekisteritutkimuksessa hypotyreoosin diagnoosivaiheessa
noin puolet lapsista oli oireettomia.
- Tavallisimpia (mutta ei spesifejä) oireita olivat väsymys tai huimaus (31 %), ihon poikkeava kuivuus (26 %) ja vatsakipu (19 %).
- Pituuskasvu oli hidastunut 12 %:lla, ja sairaus löytyi usein jo ennen kasvun häiriintymistä «Saari A, Pokka J, Mäkitie O, ym. Early Detection o...»161.
- Diagnostiikan ja hoidon aloituksen perusteet ovat samat kuin nuorilla aikuisilla,
ja subkliinisessä hypotyreoosissa tyroksiinihoitoa suositellaan, jos TSH-pitoisuus
on yli 10 mU/l «Kilpirauhasarvojen normaalistamiseen tähtäävä kilpirauhashormonihoito ei ilmeisesti korjaa ylipainoa kilpirauhasen vajaatoiminnassa.»B.
- Erityisesti lihavuus voi suurentaa lapsella TSH-pitoisuutta T4-V-pitoisuuden pysyessä viitealueella myös ilman tyreoidiittia. Kilpirauhaslääkehoidosta ei ole tässä tilanteessa hyötyä ja TSH-arvo normaalistuu, jos paino normaalistuu.
- Jos lapsen kilpirauhanen on täysin toimimaton, on levotyroksiinin keskimääräinen annostarve
pienillä lapsilla 4–6 µg/kg/vrk ja murrosikäisillä nuorilla 2–4 µg/kg/vrk «Jonklaas J. Sex and age differences in levothyroxi...»162. Yleensä diagnoosivaiheessa oma kilpirauhanen kuitenkin osittain toimii, jolloin
hoito kannattaa aloittaa pienemmällä, usein noin puolella annoksella.
- Hoito suositellaan aloitettavaksi lastentautien erikoislääkärin toimesta tai ohjauksessa.
- Seurannassa on tärkeää seurata myös lapsen kasvua ja kehitystä.
- Hoidossa pyritään pitämään TSH-pitoisuus iänmukaisella viitealueella tai sen alapuoliskossa.
- TSH- ja T4-V-arvoja seurataan puolen vuoden välein, alle 3-vuotiailla lapsilla kuitenkin tiheämmin (3–4 kuukauden välein). Kun kasvu on päättynyt, seuranta voidaan siirtää perusterveydenhuoltoon.
- Jos pysyvän kilpirauhashormonihoidon tarve ei ole ilmeinen eikä annosta ole tarvinnut TSH-pitoisuuden perusteella suurentaa, tulee kasvun päätyttyä harkita hoidon tauottamista ennen seurannan siirtämistä perusterveydenhuoltoon.
- T4- ja T3-hormonien yhdistelmähoidosta on lapsilla hyvin vähän näyttöä, eikä lapsen
voinnin paranemisesta yhdistelmähoidolla ole näyttöä, joten hoitoa ei tule käyttää.
- Pienen liotyroniiniannoksen lisäys tyroksiinin oheen on kuitenkin normaalistanut kilpirauhasarvot (TSH:n ja T4-V:n) ilman T3-V-pitoisuuden poikkeavaa suurenemista lapsilla, joilla on synnynnäinen kilpirauhasen aplasia, perifeerinen kilpirauhashormoniresistenssi tai joiden kilpirauhanen on kokonaan poistettu «Biondi B, Wartofsky L. Treatment with thyroid horm...»84, «Paone L, Fleisch AF, Feldman HA, ym. Liothyronine ...»163, «Torlontano M, Durante C, Torrente I, ym. Type 2 de...»164.
Sentraalinen hypotyreoosi
- Sentraalinen hypotyreoosi johtuu aivolisäkkeen tai hypotalamuksen toiminnan häiriöstä «Persani L, Brabant G, Dattani M, ym. 2018 European...»7.
- Alle 1 % hypotyreoositapauksista on sentraalisia. Diagnostiikka ja hoidon aloitus toteutetaan erikoissairaanhoidossa.
- Esiintyvyydeksi arvioidaan 1:20 000–80 000.
- Oireet ja löydökset ovat samanlaisia kuin primaarisessa hypotyreoosissa, mutta yleensä lievempiä.
- Sentraalisen hypotyreoosin syitä ovat aivolisäkkeen adenooma, muut aivokasvaimet, aivolisäkkeen leikkaus, pään alueen sädehoito, infiltratiiviset ja tulehdukselliset sairaudet sekä aivolisäkkeen verenvuoto (pituitaarinen apopleksia) (ks. taulukko «Kilpirauhasen vajaatoiminnan syyt ....»2).
- Myös jotkin lääkkeet voivat estää aivolisäkkeen TSH-eritystä (ks. taulukot «Kilpirauhasen vajaatoimintaa aiheuttavia lääkkeitä ja ravintolisiä....»3 ja «Lääkkeitä ja ravintolisiä, jotka aiheuttavat poikkeavia löydöksiä kilpirauhasen toimintakokeissa ja voivat vaikuttaa tyroksiinin annokseen, mutta eivät välttämättä vaikuta kilpirauhasen toimintaan....»4).
- Laboratoriokokeissa TSH-arvo on yleensä viitealueella tai alle viitealueen alarajan
eli pieni T4-V-arvoon nähden, T4-V-arvo on alle viitealueen alarajan ja T3-V-arvo
on viitealueella tai alle viitealueen alarajan «Ross DS. Central hypothyroidism. UpToDate. April 2...»165.
- Yleisin syy pieneen TSH-pitoisuuteen on subkliininen hypertyreoosi.
- Myös T3-valmisteet voivat aiheuttaa sentraalista hypotyreoosia muistuttavan laboratoriolöydöksen (TSH- ja T4-V-arvot alle viitealueen alarajan).
- Akuutin sairauden yhteydessä voi esiintyä pieniä TSH- ja T4-V-arvoja.
- Erotusdiagnostiikassa tulee muistaa myös toiminnalliset kilpirauhasen vajaatoiminnan syyt, kuten yleissairaus ja vajaaravitsemus.
- Laboratoriodiagnostiikan vaiheittainen eteneminen:
- T4-V-arvo on alle viitealueen alarajan ja TSH-arvo on viitealueella tai alle sen alarajan.
- Kontrolloidaan TSH- ja T4-V-arvot, arvioidaan kliininen kuva ja pohditaan tavalliset syyt pieneen TSH- ja T4-V-pitoisuuteen, ks. kohta Epätyypillisesti käyttäytyvien kilpirauhasarvojen selvittely «A6»9.
- Konsultoidaan endokrinologia, jos on edelleen sentraalisen hypotyreoosin epäily. Usein on syytä määrittää plasman kortisoli- ja prolaktiinipitoisuus.
- Erikoisairaanhoidossa määritetään aivolisäkkeen toimintakokeet ja tarvittaessa T4-Vdi- ja T3-V-pitoisuudet sekä kuvannetaan aivolisäke magneettikuvauksella.
- Sentraalista hypotyreoosia epäiltäessä tyroksiinia ei tule aloittaa perusterveydenhuollossa, koska aivolisäkkeen vajaatoiminnassa voi esiintyä samanaikaista hypokortisolismia, jolloin tyroksiinin aloitus ennen hydrokortisonia voi aiheuttaa kriisitilanteen.
Potilasviiteryhmän näkemykset Kilpirauhasen vajaatoiminta Käypä hoito -suosituksesta
Potilasviiteryhmän näkemykset on esitetty lisätietoaineistossa «Potilasviiteryhmän näkemyksiä Kilpirauhasen vajaatoiminta Käypä hoito -suosituksesta»14.
Suomalaisen Lääkäriseuran Duodecimin, Suomen Endokrinologiyhdistyksen, Suomen lastenendokrinologiyhdistyksen ja Suomen yleislääketieteen yhdistyksen asettama työryhmä
Kilpirauhasen vajaatoiminta -suosituksen historiatiedot «Kilpirauhasen vajaatoiminta, Käypä hoito -suosituksen historiatiedot»15
Puheenjohtaja:
Saara Metso, LT, sisätautiopin dosentti, sisätautien ja endokrinologian erikoislääkäri, diabeteksen hoidon ja haavanhoidon erityispätevyys; Tays, sisätautien vastuualue, endokrinologia, Pirkanmaan hyvinvointialue
Jäsenet:
Hanna Aula, LT, syöpätautien erikoislääkäri; Tays, syövänhoidon vastuualue, Pirkanmaan hyvinvointialue
Tapani Ebeling, LT, sisätautiopin dosentti, sisätautien ja endokrinologian erikoislääkäri, diabeteksen hoidon, haavanhoidon ja terveydenhuollon tietotekniikan erityispätevyys, osastonylilääkäri; OYS Sisätautikeskus, endokrinologia, Pohjois-Pohjanmaan hyvinvointialue Pohde
Seija Eskelinen, LT, yleislääketieteen erikoislääkäri, lääkärikouluttajan erityispätevyys, asiantuntijalääkäri; Kela Asiantuntijalääkärikeskus 2
Esa Hämäläinen, LKT, kliinisen kemian professori, emeritus; Itä-Suomen yliopisto, kliinisen lääketieteen yksikkö
Jarmo Jääskeläinen, LT, lastentautien professori ja ylilääkäri, lastentautien ja -endokrinologian erikoislääkäri; KYS, lasten ja nuorten osaamiskeskus ja Itä-Suomen yliopisto, kliinisen lääketieteen yksikkö
Otto Knutar, LL, sisätautien ja endokrinologian erikoislääkäri, diabeteksen hoidon erityispätevyys, ylilääkäri; Vaasan keskussairaala
Virpi Kröger,LL, yleislääketieteen erikoislääkäri, tulosaluejohtaja, kuntoutus; Kanta-Hämeen hyvinvointialue
David Laaksonen, LL, FT, sisätautiopin dosentti, sisätautien ja endokrinologian erikoislääkäri; KYS, endokrinologian ja ravitsemustieteen poliklinikka
Eero Mervaala, LT, professori; Helsingin yliopiston lääketieteellinen tiedekunta, farmakologian osasto ja Suomalainen Lääkäriseura Duodecim (Käypä hoito -toimittaja)
Lassi Nelimarkka, LT, sisätautien ja endokrinologian erikoislääkäri, kliininen opettaja, sisätautioppi; Turun yliopisto
Leena Norvio, LL, sisätautien ja endokrinologian erikoislääkäri, osastonylilääkäri; HUS Hyvinkään sairaala
Milla Rosengård-Bärlund, LT, sisätautien ja endokrinologian erikoislääkäri; HUS, Vatsakeskus, Endokrinologia, Meilahden sairaala
Liisa Viikari, LT, lastentautien erikoislääkäri, lastenendokrinologi, diabeteksen hoidon erityispätevyys; Tyks lasten ja nuorten klinikka
Asiantuntijat:
Asiantuntijat eivät ole osallistuneet päätöksentekoon hoitosuosituksen sisällöstä ja muotoiluista.
Potilasviiteryhmän jäsenet:
Raili Bergqvist, Kristiinankaupunki; viiteryhmän jäsen
Johanna Erkkilä, Tampere; viiteryhmän jäsen
Leena Kallionsivu, Pori; viiteryhmän jäsen
Tuula Karhila, Kannonkoski; viiteryhmän jäsen
Raili Kuusela, Rovaniemi; viiteryhmän jäsen
Satu Tommola, Helsinki; viiteryhmän jäsen
Jorma Komulainen; Suomalainen Lääkäriseura Duodecim, Käypä hoito -päätoimittaja (viiteryhmän puheenjohtaja)
Kirsi Tarnanen; Suomalainen Lääkäriseura Duodecim, potilaiden osallisuutta tukeva toimittaja (viiteryhmän sihteeri)
Lisäksi viiteryhmässä oli mukana 4 viiteryhmän jäsentä, jotka eivät antaneet lupaa julkaista nimeään.
Sidonnaisuudet
Sidonnaisuusilmoitukset on kerätty 1.11.2023 julkaistun suosituksen laatimisen yhteydessä.
Hanna Aula: Korvaukset kongressi- ja seminaarikuluista: Roche, MSD.
Tapani Ebeling: Sivutoimet: yksityisvastaanotto; Lääkärikeskus Mehiläinen Oulu, Satucon Oy:n työntekijä ja pienosakas. Ohjaushankkeet: Virtuaalisairaalan Diabetestalo-hanke 2016–, ohjausryhmä 2017–, Diabetes Käypä hoito -neuvottelukunta 2017–.
Seija Eskelinen: Ei aiheeseen liittyviä sidonnaisuuksia.
Esa Hämäläinen: Sivutoimet: laboratoriolääketieteen asiantuntija; Vita Laboratoriot Oy, Helsinki (lokakuusta 2022 lähtien). Tutkimusrahoitus: Laboratoriolääketieteen Edistämissäätiö ja Koulab Oy. Koulutus-, konsultointi- ja asiantuntijatoimintaa: Labquality Oy, Thermo Fisher Scientific Oy, Suomi, Vita Laboratoriot Oy, Roche Diagnostics Ldt. Korvaukset kongressi- ja seminaarikuluista: Vita Laboratoriot Oy, Roche Diagnostics Ldt. Luottamustoimet terveydenhuollon alalla: Suomen Kliinisen Kemian erikoislääkäriyhdistys, hallituksen jäsen, Suomen Lääkäriliitto, kliinisen kemian alaosasto, hallituksen jäsen. Muut sidonnaisuudet: Orion Oyj, pienosakas.
Jarmo Jääskeläinen: Sivutoimet: ylilääkäri; lastentaudit, Kuopion yliopistollinen sairaala, Pohjois-Savon hyvinvointialue, Kuopio. Luottamustoimet terveydenhuollon alalla: Itä-Suomen yliopisto, Kliinisen lääketieteen yksikön johtaja.
Otto Knutar: Koulutus-, konsultointi- ja asiantuntijatoimintaa: Amgen Oy, Boehringer Ingelheim Oy, Astra Zeneca Oy. Korvaukset kongressi- ja seminaarikuluista: Amgen Oy, Astra Zeneca Oy. Luottamustoimet terveydenhuollon alalla: hallituksen jäsen, rahastonhoitaja; Suomen Endokrinologiyhdistys, valtuuskunnan jäsen; Suomen Lääkäriliito, valtuuskunnan jäsen; Suomen Erikoislääkäriyhdistys.
Virpi Kröger: Ei aiheeseen liittyviä sidonnaisuuksia.
David Laaksonen: Korvaukset kongressi- ja seminaarikuluista: NovoNordisk, Sanofi, Pfizer.
Eero Mervaala: Sivutoimet: Käypä hoito -toimittaja; lääketieteellinen asiantuntija (farmakologia). Luottamustoimet terveydenhuollon alalla: jäsen; Suomen Verenpaineyhdistyksen hallitus, jäsen; Lääketietoverkosto, FIMEA.
Saara Metso: Sivutoimet: Diabetesrekisterin vastuuhenkilö; THL, endokrinologian vastuukouluttaja; Tampereen yliopisto, asiantuntija; Potilasvakuutuskeskus. Luottamustoimet terveydenhuollon alalla: Suomen Endokrinologiyhdistyksen hallitus 2012–2022, Kilpirauhasliiton hallitus 2021–2022, UEMS Board of Endocrinology jäsen 2016 alkaen.
Lassi Nelimarkka: Sivutoimet: erikoislääkäri; TYKS, Medisiininen toimialue, endokrinologia. Koulutus-, konsultointi- ja asiantuntijatoimintaa: Amgen, Astra-Zeneca, Lilly, MSD, Novo Nordisk, Sanofi. Korvaukset kongressi- ja seminaarikuluista: Amgen, Astra Zeneca, Novo Nordisk, Sanofi.
Leena Norvio: Koulutus-, konsultointi ja asiantuntijatoimintaa: Novo Nordisk Farma Oy, Medtronic Finland Oy, Astra Zeneca Oy. Muut sidonnaisuudet: Orion osakeomistus.
Milla Rosengård-Bärlund: Sivutoimet: Prakticonova (erikoislääkäri, vastaanottotoiminta Aavassa, etävastaanotto Pihlajalinnassa). Koulutus-, konsultointi- ja asiantuntijatoimintaa: Sanofi-Aventis, Eli Lilly, Novo Nordisk, Boehringer Ingelheim, Sandoz, Astra, Orion, Terveystalo, Ipsen, GSK. Korvaukset kongressi- ja seminaarikuluista: Eli Lilly, Novo Nordisk, Sanofi-Aventis, Novartis, Amgen, Ipsen. Luottamustoimet terveydenhuollon alalla: Diabetesliiton lääkärineuvosto 2017–2023, Endokrinologiyhdistyksen hallituksen jäsen 2020–, Suomen lihavuuslääkärit ry hallituksen varapj 2020–.
Liisa Viikari: Sivutoimet: lastentautien erikoislääkäri (lastenendokrinologian lisäkoulutusohjelman aikana); HUS Lasten ja nuorten klinikka yhteensä 5 kuukautta 2017–2018. Tutkimusrahoitus: Medtronic. Koulutus-, konsultointi ja asiantuntijatoimintaa: Mannerheimin lastensuojeluliitto, Diabetesliitto, Merck, Pfizer, Novo Nordisk. Korvaukset kongressi- ja seminaarikuluista: Novo Nordisk, Merck, Pfizer. Luottamustoimet terveydenhuollon alalla: Suomen lastenendokrinologiyhdistys ry:n puheenjohtaja 2019– (hallituksessa 2012–, sihteeri 2015–2018), Diabetesliiton lääkärineuvoston jäsen 2019–.
Kirjallisuusviite
Kilpirauhasen vajaatoiminta. Käypä hoito -suositus. Suomalaisen Lääkäriseuran Duodecimin, Suomen Endokrinologiyhdistyksen, Suomen lastenendokrinologiyhdistyksen ja Suomen yleislääketieteen yhdistyksen asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim, 2024 (viitattu pp.kk.vvvv). Saatavilla internetissä: www.kaypahoito.fi
Tarkemmat viittausohjeet: «http://www.kaypahoito.fi/web/kh/viittaaminen»9
Vastuun rajaus
Käypä hoito -suositukset ja Vältä viisaasti -suositukset ovat asiantuntijoiden laatimia yhteenvetoja yksittäisten sairauksien diagnostiikan ja hoidon vaikuttavuudesta. Suositukset toimivat lääkärin tai muun terveydenhuollon ammattilaisen päätöksenteon tukena hoitopäätöksiä tehtäessä. Ne eivät korvaa lääkärin tai muun terveydenhuollon ammattilaisen omaa arviota yksittäisen potilaan parhaasta mahdollisesta diagnostiikasta, hoidosta ja kuntoutuksesta hoitopäätöksiä tehtäessä.
Tiedonhakukäytäntö
Systemaattinen kirjallisuushaku on hoitosuosituksen perusta. Lue lisää artikkelista khk00007
Kirjallisuutta
- Chaker L, Bianco AC, Jonklaas J, ym. Hypothyroidism. Lancet 2017;390(10101):1550-1562 «PMID: 28336049»PubMed
- Rao RH, McCready VR, Spathis GS. Iodine kinetic studies during amiodarone treatment. J Clin Endocrinol Metab 1986;62(3):563-8 «PMID: 3944239»PubMed
- Franklyn JA, Davis JR, Gammage MD, ym. Amiodarone and thyroid hormone action. Clin Endocrinol (Oxf) 1985;22(3):257-64 «PMID: 3978832»PubMed
- van Beeren HC, Bakker O, Wiersinga WM. Structure-function relationship of the inhibition of the 3,5,3'-triiodothyronine binding to the alpha1- and beta1-thyroid hormone receptor by amiodarone analogs. Endocrinology 1996;137(7):2807-14 «PMID: 8770901»PubMed
- Stanbury JB, Ermans AE, Bourdoux P, ym. Iodine-induced hyperthyroidism: occurrence and epidemiology. Thyroid 1998;8(1):83-100 «PMID: 9492158»PubMed
- Roti E, Minelli R, Gardini E, ym. Thyrotoxicosis followed by hypothyroidism in patients treated with amiodarone. A possible consequence of a destructive process in the thyroid. Arch Intern Med 1993;153(7):886-92 «PMID: 8466380»PubMed
- Persani L, Brabant G, Dattani M, ym. 2018 European Thyroid Association (ETA) Guidelines on the Diagnosis and Management of Central Hypothyroidism. Eur Thyroid J 2018;7(5):225-237 «PMID: 30374425»PubMed
- Virta LJ, Eskelinen SI. Prevalence of hypothyroidism in Finland--a nationwide prescription study. Eur J Clin Pharmacol 2011;67(1):73-7 «PMID: 20809083»PubMed
- Garmendia Madariaga A, Santos Palacios S, Guillén-Grima F, ym. The incidence and prevalence of thyroid dysfunction in Europe: a meta-analysis. J Clin Endocrinol Metab 2014;99(3):923-31 «PMID: 24423323»PubMed
- Kela. Sairausvakuutuksesta korvattavat lääketoimitukset. https://tietotarjotin.kela.fi/tilasto/2857522/tilasto-sairausvakuutuksesta-korvattavista-laaketoimituksista «https://tietotarjotin.kela.fi/tilasto/2857522/tilasto-sairausvakuutuksesta-korvattavista-laaketoimituksista»10
- Metso S, Hakala T, Attanasio R ym. Kilpirauhashormonien käyttö kilpirauhasen vajaatoiminnan hoidossa: THESIS-kyselytutkimus suomalaisille erikoislääkäreille. THESIS: Treatment of Hypothyroidism in Europe by Specialists: an International Survey. Suomen Lääkärilehti 2021:48:2885-2889
- Asvold BO, Vatten LJ, Bjøro T. Changes in the prevalence of hypothyroidism: the HUNT Study in Norway. Eur J Endocrinol 2013;169(5):613-20 «PMID: 23975540»PubMed
- Taylor PN, Iqbal A, Minassian C, ym. Falling threshold for treatment of borderline elevated thyrotropin levels-balancing benefits and risks: evidence from a large community-based study. JAMA Intern Med 2014;174(1):32-9 «PMID: 24100714»PubMed
- Mendes D, Alves C, Silverio N, ym. Prevalence of Undiagnosed Hypothyroidism in Europe: A Systematic Review and Meta-Analysis. Eur Thyroid J 2019;8(3):130-143 «PMID: 31259155»PubMed
- Bothra N, Shah N, Goroshi M, ym. Hashimoto's thyroiditis: relative recurrence risk ratio and implications for screening of first-degree relatives. Clin Endocrinol (Oxf) 2017;87(2):201-206 «PMID: 28273382»PubMed
- Karlsson B, Gustafsson J, Hedov G, ym. Thyroid dysfunction in Down's syndrome: relation to age and thyroid autoimmunity. Arch Dis Child 1998;79(3):242-5 «PMID: 9875020»PubMed
- Gravholt CH, Andersen NH, Conway GS, ym. Clinical practice guidelines for the care of girls and women with Turner syndrome: proceedings from the 2016 Cincinnati International Turner Syndrome Meeting. Eur J Endocrinol 2017;177(3):G1-G70 «PMID: 28705803»PubMed
- Surks M. Iodine-induced thyroid dysfunction. UpToDate. https://www.uptodate.com/contents/iodine-induced-thyroid-dysfunction «https://www.uptodate.com/contents/iodine-induced-thyroid-dysfunction»11
- Ong KK, Kuh D, Pierce M, ym. Childhood weight gain and thyroid autoimmunity at age 60-64 years: the 1946 British birth cohort study. J Clin Endocrinol Metab 2013;98(4):1435-42 «PMID: 23436917»PubMed
- Gore AC, Chappell VA, Fenton SE, ym. EDC-2: The Endocrine Society's Second Scientific Statement on Endocrine-Disrupting Chemicals. Endocr Rev 2015;36(6):E1-E150 «PMID: 26544531»PubMed
- Szczuko M, Syrenicz A, Szymkowiak K, ym. Doubtful Justification of the Gluten-Free Diet in the Course of Hashimoto's Disease. Nutrients 2022;14(9): «PMID: 35565695»PubMed
- Rayman MP. Multiple nutritional factors and thyroid disease, with particular reference to autoimmune thyroid disease. Proc Nutr Soc 2019;78(1):34-44 «PMID: 30208979»PubMed
- Valsta L, Kaartinen N, Tapanainen H ym. (toim). Ravitsemus Suomessa - FinRavinto 2017 -tutkimus. THL Raportti 12/2018, https://urn.fi/URN:ISBN:978-952-343-238-3 «https://urn.fi/URN:ISBN:978-952-343-238-3»12
- Zimmermann MB, Boelaert K. Iodine deficiency and thyroid disorders. Lancet Diabetes Endocrinol 2015;3(4):286-95 «PMID: 25591468»PubMed
- Zimmermann MB. Methods to assess iron and iodine status. Br J Nutr 2008;99 Suppl 3():S2-9 «PMID: 18598585»PubMed
- Ma ZF, Venn BJ, Manning PJ, ym. Iodine Supplementation of Mildly Iodine-Deficient Adults Lowers Thyroglobulin: A Randomized Controlled Trial. J Clin Endocrinol Metab 2016;101(4):1737-44 «PMID: 26891118»PubMed
- Wu Q, Rayman MP, Lv H, ym. Low Population Selenium Status Is Associated With Increased Prevalence of Thyroid Disease. J Clin Endocrinol Metab 2015;100(11):4037-47 «PMID: 26305620»PubMed
- Carlé A, Pedersen IB, Knudsen N, ym. Hypothyroid symptoms and the likelihood of overt thyroid failure: a population-based case-control study. Eur J Endocrinol 2014;171(5):593-602 «PMID: 25305308»PubMed
- Ojala A, Strandberg T, Schalin-Jäntti C. Iäkkään poikkeava tyreotropiinipitoisuus. Duodecim 2019;135(23):2277-82 https://www.duodecimlehti.fi/duo15275 «https://www.duodecimlehti.fi/duo15275»13
- Biondi B, Cappola AR, Cooper DS. Subclinical Hypothyroidism: A Review. JAMA 2019;322(2):153-160 «PMID: 31287527»PubMed
- Canaris GJ, Manowitz NR, Mayor G, ym. The Colorado thyroid disease prevalence study. Arch Intern Med 2000;160(4):526-34 «PMID: 10695693»PubMed
- LeFevre ML, U.S. Preventive Services Task Force. Screening for thyroid dysfunction: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med 2015;162(9):641-50 «PMID: 25798805»PubMed
- Vanderpump MP, Ahlquist JA, Franklyn JA, ym. Consensus statement for good practice and audit measures in the management of hypothyroidism and hyperthyroidism. The Research Unit of the Royal College of Physicians of London, the Endocrinology and Diabetes Committee of the Royal College of Physicians of London, and the Society for Endocrinology. BMJ 1996;313(7056):539-44 «PMID: 8789985»PubMed
- Birtwhistle R, Morissette K, Dickinson JA, ym. Recommendation on screening adults for asymptomatic thyroid dysfunction in primary care. CMAJ 2019;191(46):E1274-E1280 «PMID: 31740537»PubMed
- Hegedüs L, Bianco AC, Jonklaas J, ym. Primary hypothyroidism and quality of life. Nat Rev Endocrinol 2022;18(4):230-242 «PMID: 35042968»PubMed
- Wilson SA, Stem LA, Bruehlman RD. Hypothyroidism: Diagnosis and Treatment. Am Fam Physician 2021;103(10):605-613 «PMID: 33983002»PubMed
- Garber JR, Cobin RH, Gharib H, ym. Clinical practice guidelines for hypothyroidism in adults: cosponsored by the American Association of Clinical Endocrinologists and the American Thyroid Association. Endocr Pract 2012;18(6):988-1028 «PMID: 23246686»PubMed
- NICE guideline [NG145]. Thyroid disease: assessment and management. Published: 20 November 2019, https://www.nice.org.uk/guidance/ng145 «https://www.nice.org.uk/guidance/ng145»14
- Viikari L, Jahnukainen J, Lähteenmäki P. Endokriiniset ja metaboliset ongelmat lapsuus- ja nuoruusiän syöpähoitojen jälkeen. Duodecim 2022;138(1):21-30
- Mäkimattila S, Harjutsalo V, Forsblom C, ym. Response to Comment on Mäkimattila et al. Every Fifth Individual With Type 1 Diabetes Suffers From an Additional Autoimmune Disease: A Finnish Nationwide Study. Diabetes Care 2020;43:1041-1047. Diabetes Care 2020;43(8):e106-e107 «PMID: 32669417»PubMed
- Taylor PN, Albrecht D, Scholz A, ym. Global epidemiology of hyperthyroidism and hypothyroidism. Nat Rev Endocrinol 2018;14(5):301-316 «PMID: 29569622»PubMed
- Demers LM, Spencer CA. Laboratory medicine practice guidelines: laboratory support for the diagnosis and monitoring of thyroid disease. Clin Endocrinol (Oxf) 2003;58(2):138-40 «PMID: 12580927»PubMed
- Russell W, Harrison RF, Smith N, ym. Free triiodothyronine has a distinct circadian rhythm that is delayed but parallels thyrotropin levels. J Clin Endocrinol Metab 2008;93(6):2300-6 «PMID: 18364382»PubMed
- Roelfsema F, Pereira AM, Veldhuis JD, ym. Thyrotropin secretion profiles are not different in men and women. J Clin Endocrinol Metab 2009;94(10):3964-7 «PMID: 19773394»PubMed
- Kuzmenko NV, Tsyrlin VA, Pliss MG, ym. Seasonal variations in levels of human thyroid-stimulating hormone and thyroid hormones: a meta-analysis. Chronobiol Int 2021;38(3):301-317 «PMID: 33535823»PubMed
- Wang D, Cheng X, Yu S, ym. Data mining: Seasonal and temperature fluctuations in thyroid-stimulating hormone. Clin Biochem 2018;60():59-63 «PMID: 30130522»PubMed
- Konno N, Morikawa K. Seasonal variation of serum thyrotropin concentration and thyrotropin response to thyrotropin-releasing hormone in patients with primary hypothyroidism on constant replacement dosage of thyroxine. J Clin Endocrinol Metab 1982;54(6):1118-24 «PMID: 6804476»PubMed
- Thienpont LM, Faix JD, Beastall G. Standardization of FT4 and harmonization of TSH measurements - a request for input from endocrinologists and other physicians. Endocr J 2015;62(10):855-6 «PMID: 26211473»PubMed
- Thienpont LM, Van Uytfanghe K, Beastall G, ym. Report of the IFCC Working Group for Standardization of Thyroid Function Tests; part 1: thyroid-stimulating hormone. Clin Chem 2010;56(6):902-11 «PMID: 20395624»PubMed
- Ain KB, Pucino F, Shiver TM, ym. Thyroid hormone levels affected by time of blood sampling in thyroxine-treated patients. Thyroid 1993;3(2):81-5 «PMID: 8369656»PubMed
- Dora JM, Biscolla RPM, Caldas G, ym. Choosing Wisely for Thyroid Conditions: Recommendations of the Thyroid Department of the Brazilian Society of Endocrinology and Metabolism. Arch Endocrinol Metab 2021;65(2):248-252 «PMID: 33587833»PubMed
- Halsall DJ, Oddy S. Clinical and laboratory aspects of 3,3',5'-triiodothyronine (reverse T3). Ann Clin Biochem 2021;58(1):29-37 «PMID: 33040575»PubMed
- Gomes-Lima C, Wartofsky L, Burman K. Can Reverse T3 Assay Be Employed to Guide T4 vs. T4/T3 Therapy in Hypothyroidism? Front Endocrinol (Lausanne) 2019;10():856 «PMID: 31920970»PubMed
- Vanderpump MP, Tunbridge WM, French JM, ym. The incidence of thyroid disorders in the community: a twenty-year follow-up of the Whickham Survey. Clin Endocrinol (Oxf) 1995;43(1):55-68 «PMID: 7641412»PubMed
- Khoodoruth MAS, Abdo AKA, Ouanes S. Quetiapine-Induced Thyroid Dysfunction: A Systematic Review. J Clin Pharmacol 2022;62(1):20-35 «PMID: 34467533»PubMed
- Vinayak Patki, Aniket Kumbhojkar, Praveen Khilnani. Sick Euthyroid Syndrome: A Myth or Reality. Journal of Pediatric Critical Care 2017. Vol 4 : 4. DOI-10.21304/2017.0403.00213
- DeGroo L. The Non-Thyroidal Illness Syndrome. [Updated 2015 Feb 1]. Teoksessa Feingold KR, Anawalt B, Blackman MR ym. toim. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK285570/ «https://www.ncbi.nlm.nih.gov/books/NBK285570/»15
- Gurnell M, Halsall DJ, Chatterjee VK. What should be done when thyroid function tests do not make sense? Clin Endocrinol (Oxf) 2011;74(6):673-8 «PMID: 21521292»PubMed
- Favresse J, Burlacu MC, Maiter D, ym. Interferences With Thyroid Function Immunoassays: Clinical Implications and Detection Algorithm. Endocr Rev 2018;39(5):830-850 «PMID: 29982406»PubMed
- Persani L. Clinical review: Central hypothyroidism: pathogenic, diagnostic, and therapeutic challenges. J Clin Endocrinol Metab 2012;97(9):3068-78 «PMID: 22851492»PubMed
- Somwaru LL, Rariy CM, Arnold AM, ym. The natural history of subclinical hypothyroidism in the elderly: the cardiovascular health study. J Clin Endocrinol Metab 2012;97(6):1962-9 «PMID: 22438233»PubMed
- Surks MI, Hollowell JG. Age-specific distribution of serum thyrotropin and antithyroid antibodies in the US population: implications for the prevalence of subclinical hypothyroidism. J Clin Endocrinol Metab 2007;92(12):4575-82 «PMID: 17911171»PubMed
- Bremner AP, Feddema P, Leedman PJ, ym. Age-related changes in thyroid function: a longitudinal study of a community-based cohort. J Clin Endocrinol Metab 2012;97(5):1554-62 «PMID: 22344200»PubMed
- Waring AC, Arnold AM, Newman AB, ym. Longitudinal changes in thyroid function in the oldest old and survival: the cardiovascular health study all-stars study. J Clin Endocrinol Metab 2012;97(11):3944-50 «PMID: 22879629»PubMed
- Meyerovitch J, Rotman-Pikielny P, Sherf M, ym. Serum thyrotropin measurements in the community: five-year follow-up in a large network of primary care physicians. Arch Intern Med 2007;167(14):1533-8 «PMID: 17646608»PubMed
- Biondi B, Cooper DS. The clinical significance of subclinical thyroid dysfunction. Endocr Rev 2008;29(1):76-131 «PMID: 17991805»PubMed
- Díez JJ, Iglesias P. Spontaneous subclinical hypothyroidism in patients older than 55 years: an analysis of natural course and risk factors for the development of overt thyroid failure. J Clin Endocrinol Metab 2004;89(10):4890-7 «PMID: 15472181»PubMed
- Klaver EI, van Loon HC, Stienstra R, ym. Thyroid hormone status and health-related quality of life in the LifeLines Cohort Study. Thyroid 2013;23(9):1066-73 «PMID: 23530992»PubMed
- Correia N, Mullally S, Cooke G, ym. Evidence for a specific defect in hippocampal memory in overt and subclinical hypothyroidism. J Clin Endocrinol Metab 2009;94(10):3789-97 «PMID: 19584178»PubMed
- Valdés S, Maldonado-Araque C, Lago-Sampedro A, ym. Reference values for TSH may be inadequate to define hypothyroidism in persons with morbid obesity: Di@bet.es study. Obesity (Silver Spring) 2017;25(4):788-793 «PMID: 28276648»PubMed
- Leng O, Razvi S. Hypothyroidism in the older population. Thyroid Res 2019;12():2 «PMID: 30774717»PubMed
- Treister-Goltzman Y, Yarza S, Peleg R. Lipid profile in mild subclinical hypothyroidism: systematic review and meta-analysis. Minerva Endocrinol (Torino) 2021;46(4):428-440 «PMID: 35078310»PubMed
- Biondi B, Palmieri EA, Lombardi G, ym. Effects of subclinical thyroid dysfunction on the heart. Ann Intern Med 2002;137(11):904-14 «PMID: 12458990»PubMed
- Pearce SH, Brabant G, Duntas LH, ym. 2013 ETA Guideline: Management of Subclinical Hypothyroidism. Eur Thyroid J 2013;2(4):215-28 «PMID: 24783053»PubMed
- Bekkering GE, Agoritsas T, Lytvyn L, ym. Thyroid hormones treatment for subclinical hypothyroidism: a clinical practice guideline. BMJ 2019;365():l2006 «PMID: 31088853»PubMed
- Stott DJ, Rodondi N, Kearney PM, ym. Thyroid Hormone Therapy for Older Adults with Subclinical Hypothyroidism. N Engl J Med 2017;376(26):2534-2544 «PMID: 28402245»PubMed
- Feller M, Snel M, Moutzouri E, ym. Association of Thyroid Hormone Therapy With Quality of Life and Thyroid-Related Symptoms in Patients With Subclinical Hypothyroidism: A Systematic Review and Meta-analysis. JAMA 2018;320(13):1349-1359 «PMID: 30285179»PubMed
- Waguespack SG. Thyroid Sequelae of Pediatric Cancer Therapy. Horm Res Paediatr 2019;91(2):104-117 «PMID: 30541010»PubMed
- Pasqualetti G, Pagano G, Rengo G, ym. Subclinical Hypothyroidism and Cognitive Impairment: Systematic Review and Meta-Analysis. J Clin Endocrinol Metab 2015;100(11):4240-8 «PMID: 26305618»PubMed
- Pollock MA, Sturrock A, Marshall K, ym. Thyroxine treatment in patients with symptoms of hypothyroidism but thyroid function tests within the reference range: randomised double blind placebo controlled crossover trial. BMJ 2001;323(7318):891-5 «PMID: 11668132»PubMed
- Jonklaas J, Bianco AC, Bauer AJ, ym. Guidelines for the treatment of hypothyroidism: prepared by the american thyroid association task force on thyroid hormone replacement. Thyroid 2014;24(12):1670-751 «PMID: 25266247»PubMed
- Kaptein EM, Beale E, Chan LS. Thyroid hormone therapy for obesity and nonthyroidal illnesses: a systematic review. J Clin Endocrinol Metab 2009;94(10):3663-75 «PMID: 19737920»PubMed
- Salmela P, Metso S, Moilanen L, ym. [Treatment of primary hypothyroidism in adult patients]. Duodecim 2016;132(1):33-42 «PMID: 27044179»PubMed
- Biondi B, Wartofsky L. Treatment with thyroid hormone. Endocr Rev 2014;35(3):433-512 «PMID: 24433025»PubMed
- Roos A, Linn-Rasker SP, van Domburg RT, ym. The starting dose of levothyroxine in primary hypothyroidism treatment: a prospective, randomized, double-blind trial. Arch Intern Med 2005;165(15):1714-20 «PMID: 16087818»PubMed
- Vasileiou M, Gilbert J, Fishburn S, ym. Thyroid disease assessment and management: summary of NICE guidance. BMJ 2020;368():m41 «PMID: 31996347»PubMed
- Bach-Huynh TG, Nayak B, Loh J, ym. Timing of levothyroxine administration affects serum thyrotropin concentration. J Clin Endocrinol Metab 2009;94(10):3905-12 «PMID: 19584184»PubMed
- Pang X, Pu T, Xu L, ym. Effect of l-thyroxine administration before breakfast vs at bedtime on hypothyroidism: A meta-analysis. Clin Endocrinol (Oxf) 2020;92(5):475-481 «PMID: 32022947»PubMed
- Ross DS. Treatment of primary hypothyroidism in adults. UpToDate. April 2023. https://www.uptodate.com/contents/treatment-of-primary-hypothyroidism-in-adults «https://www.uptodate.com/contents/treatment-of-primary-hypothyroidism-in-adults»16
- Wartofsky L, Dickey RA. The evidence for a narrower thyrotropin reference range is compelling. J Clin Endocrinol Metab 2005;90(9):5483-8 «PMID: 16148345»PubMed
- Walsh JP, Ward LC, Burke V, ym. Small changes in thyroxine dosage do not produce measurable changes in hypothyroid symptoms, well-being, or quality of life: results of a double-blind, randomized clinical trial. J Clin Endocrinol Metab 2006;91(7):2624-30 «PMID: 16670161»PubMed
- Surks MI, Goswami G, Daniels GH. The thyrotropin reference range should remain unchanged. J Clin Endocrinol Metab 2005;90(9):5489-96 «PMID: 16148346»PubMed
- Okosieme O, Gilbert J, Abraham P, ym. Management of primary hypothyroidism: statement by the British Thyroid Association Executive Committee. Clin Endocrinol (Oxf) 2016;84(6):799-808 «PMID: 26010808»PubMed
- Burgos N, Toloza FJK, Singh Ospina NM, ym. Clinical Outcomes After Discontinuation of Thyroid Hormone Replacement: A Systematic Review and Meta-Analysis. Thyroid 2021;31(5):740-751 «PMID: 33161885»PubMed
- Jonklaas J. Optimal Thyroid Hormone Replacement. Endocr Rev 2022;43(2):366-404 «PMID: 34543420»PubMed
- Briesacher BA, Andrade SE, Fouayzi H, ym. Comparison of drug adherence rates among patients with seven different medical conditions. Pharmacotherapy 2008;28(4):437-43 «PMID: 18363527»PubMed
- Briesacher BA, Andrade SE, Fouayzi H, ym. Medication adherence and use of generic drug therapies. Am J Manag Care 2009;15(7):450-6 «PMID: 19589012»PubMed
- Caron P, Declèves X. The Use of Levothyroxine Absorption Tests in Clinical Practice. J Clin Endocrinol Metab 2023;108(8):1875-1888 «PMID: 36916146»PubMed
- Walker JN, Shillo P, Ibbotson V, ym. A thyroxine absorption test followed by weekly thyroxine administration: a method to assess non-adherence to treatment. Eur J Endocrinol 2013;168(6):913-7 «PMID: 23554450»PubMed
- McMillan M, Rotenberg KS, Vora K, ym. Comorbidities, Concomitant Medications, and Diet as Factors Affecting Levothyroxine Therapy: Results of the CONTROL Surveillance Project. Drugs R D 2016;16(1):53-68 «PMID: 26689565»PubMed
- Thayakaran R, Adderley NJ, Sainsbury C, ym. Thyroid replacement therapy, thyroid stimulating hormone concentrations, and long term health outcomes in patients with hypothyroidism: longitudinal study. BMJ 2019;366():l4892 «PMID: 31481394»PubMed
- Lillevang-Johansen M, Abrahamsen B, Jørgensen HL, ym. Duration of over- and under-treatment of hypothyroidism is associated with increased cardiovascular risk. Eur J Endocrinol 2019;180(6):407-416 «PMID: 31035256»PubMed
- Perros P, Nirantharakumar K, Hegedüs L. Recent evidence sets therapeutic targets for levothyroxine-treated patients with primary hypothyroidism based on risk of death. Eur J Endocrinol 2021;184(2):C1-C3 «PMID: 33306038»PubMed
- Flynn RW, Bonellie SR, Jung RT, ym. Serum thyroid-stimulating hormone concentration and morbidity from cardiovascular disease and fractures in patients on long-term thyroxine therapy. J Clin Endocrinol Metab 2010;95(1):186-93 «PMID: 19906785»PubMed
- Flinterman LE, Kuiper JG, Korevaar JC, ym. Impact of a Forced Dose-Equivalent Levothyroxine Brand Switch on Plasma Thyrotropin: A Cohort Study. Thyroid 2020;30(6):821-828 «PMID: 32188356»PubMed
- Okosieme OE, Belludi G, Spittle K, ym. Adequacy of thyroid hormone replacement in a general population. QJM 2011;104(5):395-401 «PMID: 21109503»PubMed
- Rodondi N, den Elzen WP, Bauer DC, ym. Subclinical hypothyroidism and the risk of coronary heart disease and mortality. JAMA 2010;304(12):1365-74 «PMID: 20858880»PubMed
- Razvi S, Weaver JU, Butler TJ, ym. Levothyroxine treatment of subclinical hypothyroidism, fatal and nonfatal cardiovascular events, and mortality. Arch Intern Med 2012;172(10):811-7 «PMID: 22529180»PubMed
- Somwaru LL, Arnold AM, Joshi N, ym. High frequency of and factors associated with thyroid hormone over-replacement and under-replacement in men and women aged 65 and over. J Clin Endocrinol Metab 2009;94(4):1342-5 «PMID: 19126628»PubMed
- Olkkola K,Kiviluoma K, Saari T ym. (toim.). Anestesiologia, teho-, ensi- ja kivunhoito. 2021. 4., uudistettu painos. Kustannus Oy Duodecim
- Ross DS, Cooper DS, Mulder JE. Myxedema coma. UpToDate. UpToDate Inc. https://www.uptodate.com/contents/myxedema-coma (Accessed on Jan, 2023) «https://www.uptodate.com/contents/myxedema-coma»17
- Brent GA, Weetman AP. Hypothyroidism and Thyroiditis teoksessa Williams Textbook of Endocrinology (Toim. Melmed, Shlomo ym.) (14th Edition). Elsevier - OHCE, 2020.
- Raivio R. Väitöskirja. Hoidon jatkuvuus perusterveydenhuollossa. 2016. Tampere University Press https://urn.fi/URN:ISBN:978-952-03-0178-1 «https://urn.fi/URN:ISBN:978-952-03-0178-1»18
- Raivio R, Holmberg-Marttila D, Mattila KJ. Patients' assessments of the continuity of primary care in Finland: a 15-year follow-up questionnaire survey. Br J Gen Pract 2014;64(627):e657-63 «PMID: 25267052»PubMed
- Mitchell AL, Hegedüs L, Žarković M, ym. Patient satisfaction and quality of life in hypothyroidism: An online survey by the british thyroid foundation. Clin Endocrinol (Oxf) 2021;94(3):513-520 «PMID: 32978985»PubMed
- Peterson SJ, Cappola AR, Castro MR, ym. An Online Survey of Hypothyroid Patients Demonstrates Prominent Dissatisfaction. Thyroid 2018;28(6):707-721 «PMID: 29620972»PubMed
- Perros P, Hegedüs L, Nagy EV, ym. The Impact of Hypothyroidism on Satisfaction with Care and Treatment and Everyday Living: Results from E-Mode Patient Self-Assessment of Thyroid Therapy, a Cross-Sectional, International Online Patient Survey. Thyroid 2022;32(10):1158-1168 «PMID: 35959734»PubMed
- Perros P, Nagy EV, Papini E, ym. Hypothyroidism and Somatization: Results from E-Mode Patient Self-Assessment of Thyroid Therapy, a Cross-Sectional, International Online Patient Survey. Thyroid 2023;33(8):927-939 «PMID: 37134204»PubMed
- Panicker V, Evans J, Bjøro T, ym. A paradoxical difference in relationship between anxiety, depression and thyroid function in subjects on and not on T4: findings from the HUNT study. Clin Endocrinol (Oxf) 2009;71(4):574-80 «PMID: 19751298»PubMed
- Borson-Chazot F, Terra JL, Goichot B, ym. What Is the Quality of Life in Patients Treated with Levothyroxine for Hypothyroidism and How Are We Measuring It? A Critical, Narrative Review. J Clin Med 2021;10(7): «PMID: 33808358»PubMed
- Jørgensen P, Langhammer A, Krokstad S, ym. Diagnostic labelling influences self-rated health. A prospective cohort study: the HUNT Study, Norway. Fam Pract 2015;32(5):492-9 «PMID: 26240089»PubMed
- Sawicka-Gutaj N, Ruchala M, Feldt-Rasmussen U, ym. Patients with Benign Thyroid Diseases Experience an Impaired Sex Life. Thyroid 2018;28(10):1261-1269 «PMID: 30039748»PubMed
- Sairauspoissaolon tarpeen arviointi. Käypä hoito -suositus. Suomalaisen Lääkäriseuran Duodecimin Verkostovaliokunnan asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim, 2019 (viitattu 12.9.2023). Saatavilla internetissä: www.kaypahoito.fi «»8
- Wekking EM, Appelhof BC, Fliers E, ym. Cognitive functioning and well-being in euthyroid patients on thyroxine replacement therapy for primary hypothyroidism. Eur J Endocrinol 2005;153(6):747-53 «PMID: 16322379»PubMed
- Saravanan P, Chau WF, Roberts N, ym. Psychological well-being in patients on 'adequate' doses of l-thyroxine: results of a large, controlled community-based questionnaire study. Clin Endocrinol (Oxf) 2002;57(5):577-85 «PMID: 12390330»PubMed
- Saltevo J, Kautiainen H, Mäntyselkä P, ym. The Relationship between Thyroid Function and Depressive Symptoms-the FIN-D2D Population-Based Study. Clin Med Insights Endocrinol Diabetes 2015;8():29-33 «PMID: 25987853»PubMed
- Karmisholt J, Andersen S, Laurberg P. Weight loss after therapy of hypothyroidism is mainly caused by excretion of excess body water associated with myxoedema. J Clin Endocrinol Metab 2011;96(1):E99-103 «PMID: 20926526»PubMed
- Wiersinga WM, Duntas L, Fadeyev V, ym. 2012 ETA Guidelines: The Use of L-T4 + L-T3 in the Treatment of Hypothyroidism. Eur Thyroid J 2012;1(2):55-71 «PMID: 24782999»PubMed
- Kraut E, Farahani P. A Systematic Review of Clinical Practice Guidelines' Recommendations on Levothyroxine Therapy Alone versus Combination Therapy (LT4 plus LT3) for Hypothyroidism. Clin Invest Med 2015;38(6):E305-13 «PMID: 26654514»PubMed
- Lan H, Wen J, Mao Y, ym. Combined T4 + T3 therapy versus T4 monotherapy effect on psychological health in hypothyroidism: A systematic review and meta-analysis. Clin Endocrinol (Oxf) 2022;97(1):13-25 «PMID: 35445422»PubMed
- Leese GP, Soto-Pedre E, Donnelly LA. Liothyronine use in a 17 year observational population-based study - the tears study. Clin Endocrinol (Oxf) 2016;85(6):918-925 «PMID: 26940864»PubMed
- Tariq A, Wert Y, Cheriyath P, ym. Effects of Long-Term Combination LT4 and LT3 Therapy for Improving Hypothyroidism and Overall Quality of Life. South Med J 2018;111(6):363-369 «PMID: 29863229»PubMed
- DiStefano J 3rd, Jonklaas J. Predicting Optimal Combination LT4 + LT3 Therapy for Hypothyroidism Based on Residual Thyroid Function. Front Endocrinol (Lausanne) 2019;10():746 «PMID: 31803137»PubMed
- Jonklaas J, Bianco AC, Cappola AR, ym. Evidence-Based Use of Levothyroxine/Liothyronine Combinations in Treating Hypothyroidism: A Consensus Document. Thyroid 2021;31(2):156-182 «PMID: 33276704»PubMed
- Yi W, Kim BH, Kim M, ym. Heart Failure and Stroke Risks in Users of Liothyronine With or Without Levothyroxine Compared with Levothyroxine Alone: A Propensity Score-Matched Analysis. Thyroid 2022;32(7):764-771 «PMID: 35570696»PubMed
- Khan W, Van Der Gugten G, Holmes DT. Thyrotoxicosis due to 1000-fold error in compounded liothyronine: A case elucidated by mass spectrometry. Clin Mass Spectrom 2019;11():8-11 «PMID: 34841067»PubMed
- Van Tassell B, Wohlford GF 4th, Linderman JD, ym. Pharmacokinetics of L-Triiodothyronine in Patients Undergoing Thyroid Hormone Therapy Withdrawal. Thyroid 2019;29(10):1371-1379 «PMID: 31364488»PubMed
- Saberi M, Utiger RD. Serum thyroid hormone and thyrotropin concentrations during thyroxine and triiodothyronine therapy. J Clin Endocrinol Metab 1974;39(5):923-7 «PMID: 4422006»PubMed
- Nicoloff JT, Low JC, Dussault JH, ym. Simultaneous measurement of thyroxine and triiodothyronine peripheral turnover kinetics in man. J Clin Invest 1972;51(3):473-83 «PMID: 4110897»PubMed
- Celi FS, Zemskova M, Linderman JD, ym. Metabolic effects of liothyronine therapy in hypothyroidism: a randomized, double-blind, crossover trial of liothyronine versus levothyroxine. J Clin Endocrinol Metab 2011;96(11):3466-74 «PMID: 21865366»PubMed
- Terveydenhuoltolaki 30.12.2010/1326. §24. https://www.finlex.fi/fi/laki/ajantasa/2010/20101326 «https://www.finlex.fi/fi/laki/ajantasa/2010/20101326»19
- Laki potilaan asemasta ja oikeuksista 17.8.1992/785. 4a§. https://www.finlex.fi/fi/laki/ajantasa/1992/19920785 «https://www.finlex.fi/fi/laki/ajantasa/1992/19920785»20
- Alexander EK, Pearce EN, Brent GA, ym. 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. Thyroid 2017;27(3):315-389 «PMID: 28056690»PubMed
- Osinga JAJ, Derakhshan A, Feldt-Rasmussen U, ym. TSH and FT4 Reference Interval Recommendations and Prevalence of Gestational Thyroid Dysfunction: Quantification of Current Diagnostic Approaches. J Clin Endocrinol Metab 2024;109(3):868-878 «PMID: 37740543»PubMed
- De Groot L, Abalovich M, Alexander EK, ym. Management of thyroid dysfunction during pregnancy and postpartum: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2012;97(8):2543-65 «PMID: 22869843»PubMed
- Lee RH, Spencer CA, Mestman JH, ym. Free T4 immunoassays are flawed during pregnancy. Am J Obstet Gynecol 2009;200(3):260.e1-6 «PMID: 19114271»PubMed
- Aguree S, Gernand AD. Plasma volume expansion across healthy pregnancy: a systematic review and meta-analysis of longitudinal studies. BMC Pregnancy Childbirth 2019;19(1):508 «PMID: 31856759»PubMed
- Patel J, Landers K, Li H, ym. Thyroid hormones and fetal neurological development. J Endocrinol 2011;209(1):1-8 «PMID: 21212091»PubMed
- Filetti S, Durante C, Hartl D, ym. Thyroid cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Ann Oncol 2019;30(12):1856-1883 «PMID: 31549998»PubMed
- Suomen Kilpirauhassyöpäryhmä. Papillaarinen ja follikulaarinen kilpirauhasen syöpä. https://ammattilaiset.terveyskyla.fi/tietoa/papillaarinen-ja-follikulaarinen-kilpirauhasen-syöpä «https://ammattilaiset.terveyskyla.fi/tietoa/papillaarinen-ja-follikulaarinen-kilpirauhasen-syöpä»21
- Haugen BR, Alexander EK, Bible KC, ym. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid 2016;26(1):1-133 «PMID: 26462967»PubMed
- Welch JJG, Ames B, Cohen LE, ym. Management of childhood cancer survivors at risk for thyroid function abnormalities: A Delphi study. Pediatr Blood Cancer 2022;69(12):e29942 «PMID: 36069601»PubMed
- Danner E, Niuro L, Huopio H, ym. Incidence of primary congenital hypothyroidism over 24 years in Finland. Pediatr Res 2023;93(3):649-653 «PMID: 35661828»PubMed
- Wassner AJ. Congenital Hypothyroidism. Clin Perinatol 2018;45(1):1-18 «PMID: 29405999»PubMed
- Linko-Parvinen A, Kouki A, Uitto J. Synnynnäisen hypotyreoosin seulonta vastasyntyneiltä kuiva- ja napaverinäytteistä. Lääkäril 2018;73:512-7
- Rose SR, Wassner AJ, Wintergerst KA, ym. Congenital Hypothyroidism: Screening and Management. Pediatrics 2023;151(1): «PMID: 36827523»PubMed
- van Trotsenburg P, Stoupa A, Léger J, ym. Congenital Hypothyroidism: A 2020-2021 Consensus Guidelines Update-An ENDO-European Reference Network Initiative Endorsed by the European Society for Pediatric Endocrinology and the European Society for Endocrinology. Thyroid 2021;31(3):387-419 «PMID: 33272083»PubMed
- Niuro L, Danner E, Viikari L, ym. Treatment of Congenital Hypothyroidism: Impact of Secular Changes in Levothyroxine Initial Dose on Early Growth. Horm Res Paediatr 2023;96(4):376-384 «PMID: 36476603»PubMed
- Hunter I, Greene SA, MacDonald TM, ym. Prevalence and aetiology of hypothyroidism in the young. Arch Dis Child 2000;83(3):207-10 «PMID: 10952634»PubMed
- Crisafulli G, Gallizzi R, Aversa T, ym. Thyroid function test evolution in children with Hashimoto's thyroiditis is closely conditioned by the biochemical picture at diagnosis. Ital J Pediatr 2018;44(1):22 «PMID: 29415743»PubMed
- Saari A, Pokka J, Mäkitie O, ym. Early Detection of Abnormal Growth Associated with Juvenile Acquired Hypothyroidism. J Clin Endocrinol Metab 2021;106(2):e739-e748 «PMID: 33245341»PubMed
- Jonklaas J. Sex and age differences in levothyroxine dosage requirement. Endocr Pract 2010;16(1):71-9 «PMID: 19833578»PubMed
- Paone L, Fleisch AF, Feldman HA, ym. Liothyronine Improves Biochemical Control of Congenital Hypothyroidism in Patients with Central Resistance to Thyroid Hormone. J Pediatr 2016;175():167-172.e1 «PMID: 27178621»PubMed
- Torlontano M, Durante C, Torrente I, ym. Type 2 deiodinase polymorphism (threonine 92 alanine) predicts L-thyroxine dose to achieve target thyrotropin levels in thyroidectomized patients. J Clin Endocrinol Metab 2008;93(3):910-3 «PMID: 18073314»PubMed
- Ross DS. Central hypothyroidism. UpToDate. April 2022. https://www.uptodate.com/contents/central-hypothyroidism «https://www.uptodate.com/contents/central-hypothyroidism»22

