Multipel skleros (MS)
Hur kan man hänvisa till God medicinsk praxis-rekommendationen? «K1»1
Den här svenskspråkiga God medicinsk praxis-rekommendationen har översatts från den finska God medicinsk praxis-rekommendationen (Käypä hoito -suositus MS-tauti «MS-tauti»1). Om det finns skillnader i texterna gäller den uppdaterade finskspråkiga versionen.
Huvudsakligen finns evidenssammandragen och bakgrundsmaterialen samt internetlänkarna på finska.
Centrala rekommendationer
- Multipel skleros eller MS är en kronisk autoimmun sjukdom i centrala nervsystemet.
- Diagnosen MS ställs enligt McDonalds kriterier från år 2017, dvs. utgående från förekomsten av typiska neurologiska symtomperioder samt på fynd i magnetundersökning (MRT) och lumbalpunktion.
- Behandlingen inleds utan dröjsmål efter att diagnosen ställts om sjukdomsaktivitet konstateras.
- MS definieras som aktiv eller mycket aktiv på basen av kliniska försämringsskov och/eller T2- eller gadolinium (Gd)-förstärkta lesioner passande för MS i magnetundersökning.
- Läkemedelsvalet görs i samråd med patienten och vid valet bör även kostnaderna för patienten och samhället beaktas «hoi36070a.pdf»1, «The effectiveness and costs of disease-modifying therapies for relapsing-remitting multiple sclerosis»1.
- Betydelsen av tidig läkemedelsbehandling med hög effekt för prognosen ska beaktas vid valet av läkemedelsbehandling. Detta är särskilt viktigt vid mycket aktiv MS, men sannolikt även nyttigt vid aktiv skovvis förlöpande MS.
- Patienter med CIS (kliniskt isolerat syndrom) som på basis av likvor- eller MRT-fynd löper förhöjd risk att insjukna i MS följs upp med MRT med 3–12 månaders mellanrum för att säkerställa en tidig diagnos av MS.
- Sjukdomsaktiviteten följs upp regelbundet på basen av sjukdomsskov, det kliniska tillståndet (vanligtvis bedömt med EDSS-poäng) och MRT, och utifrån dessa fattas beslut om huruvida behandlingen behöver effektiveras eller ändras.
- Med inflammatorisk aktivitet avses skov och Gd-förstärkta eller nya och/eller utvidgade T2-lesioner som är synliga i MRT. Vid skovvis förlöpande MS utgör en långsamt framskridande symtombild inte en sådan inflammatorisk aktivitet som avses här.
- Reboundrisken i samband med avslutande av en medicinering ska beaktas vid byte av vissa läkemedel.
- Avslutande av läkemedelsbehandlingen rekommenderas om symtomen på MS framskrider stadigt och det inte längre finns någon inflammatorisk aktivitet, och vanligtvis senast när patienten är över 60 år.
- Till den medicinska rehabiliteringen hör adekvat information om sjukdomen, tillräcklig anpassningsträning i rätt tid, motionsrådgivning samt individuell och multiprofessionell rehabilitering enligt observerade behov.
- Risken för arbetsoförmåga bör identifieras i god tid och man bör utan dröjsmål skrida till åtgärder med hjälp av företagshälsovården och yrkesinriktade rehabiliteringsåtgärder. Bedömningen av arbetsförmågan görs av en företagsläkare som känner till arbetsförhållandena. En specialist i neurologi planerar den övriga behandlingen och bedömer sjukdomens inverkan på funktionsförmågan, vid behov med hjälp av en multiprofessionell arbetsgrupp.
Innehåll och målgrupper
- Rekommendationen fokuserar på diagnostik, behandling och rehabilitering av MS.
- Rekommendationen är avsedd för hälso- och sjukvårdspersonal, som arbetar med MS.
Definitioner
- MS: en disseminerad inflammatorisk sjukdom i centrala nervsystemet, vars symtom orsakas antingen av en direkt skada på nervvävnaden eller av att inflammatoriska transmittorer påverkar nervcellerna i infektionshärdar eller i deras omgivning «Ruutiainen J, Tienari P. MS-tauti ja muut demyelin...»1.
- CIS: kliniskt isolerat syndrom: tidsmässigt begränsad första symtomperiod som passar för MS, där de diagnostiska kriterierna för MS inte uppfylls.
- Symtomepisod/försämringsskov: en situation där ett nytt neurologiskt symtomkomplex orsakat av MS eller en plötslig tydlig försämring av gamla symtom varar i minst 24 timmar och högst fyra veckor. Symtomen kan härstamma från ett eller flera områden i centrala nervsystemet. Patienten kan återhämta sig helt eller endast delvis från symtomepisoden «Thompson AJ, Banwell BL, Barkhof F, ym. Diagnosis ...»2.
- RIS: radiologiskt isolerat syndrom (RIS; radiologically isolated syndrome). Förändringar som passar för MS, utan kliniska fynd på MS, konstateras av en slump i MRT.
- RRMS (relapsing remitting MS): skovvis förlöpande MS. I diagnosstadiet omfattar RRMS
85–90 % av alla MS-fall. Patienten har återkommande inflammatorisk aktivitet, som
uttrycker sig som
- försämringsskov som patienten antingen delvis eller helt har återhämtat sig från eller
- ett försämringsskov i samband med vilken man konstaterar typiska MRT-förändringar samt oligoklonalitet i likvor, varvid diagnosen bekräftas redan i samband med en symtomepisod, eller
- CIS, där man i uppföljningsskedet konstaterar nya inflammatoriska förändringar i MRT.
- PPMS (primary progressive MS): primärprogressiv MS: rörelse- och funktionsförmågan
försämras i jämn takt ända från sjukdomens början utan tydliga försämringsskov.
- PPMS drabbar 10–15 % av MS-patienterna.
- SPMS (secondary progressive MS): sekundärprogressiv MS. Hos vissa patienter blir en
skovvis förlöpande MS progressiv under årens lopp.
- Patientens rörelse- och funktionsförmåga försämras i jämn takt. Även försämringsskov kan ännu förekomma.
- Det är svårt att ange exakta diagnostiska kriterier för SPMS-sjukdomsformen.
- MS-registret https://www.neurorekisteri.fi/ bedömer övergången till SPMS-sjukdomsformen utifrån kliniska uppgifter (kriterier «Ziemssen T, Bhan V, Chataway J, ym. Secondary Prog...»3).
- EDSS (extended disability severity scale): mätare för uppföljning av MS-patientens funktionsförmåga (bild «Toimintakyvyn arviointiasteikko EDSS (Expanded Disability Status Scale)»1).

Toiminta- ja liikuntakykyä MS-taudissa voidaan arvioida kymmentasoisella EDSS-asteikolla. Taso 0 tarkoittaa oireetonta henkilöä, jolla on normaali toimintakyky, kun taas suurempi pistemäärä ilmaisee liikunta- tai muun toimintakyvyn heikkenemistä. Taso 10 merkitsee MS-taudista johtuvaa kuolemaa. Asteikon kehitti alun perin neurologi John Kurtzke vuonna 1983, minkä jälkeen se on ollut neurologien laajassa käytössä kliinisenä toimintakyvyn heikkenemisen seurannan työkaluna.
Muokattu lähteestä: Kurtzke JF. Rating neurologic impairment in multiple sclerosis: an expanded disability status scale (EDSS). Neurology 1983;33:1444-52 PMID: 6685237
© Suomalainen Lääkäriseura Duodecim
Symtom och fynd
- Den första symtomepisoden för skovvis förlöpande MS kommer vanligtvis från
- synnerven (ensidig synnervsinflammation, symtomen består av nedsatt synskärpa och rörelseömhet i ögat)
- storhjärnan (till exempel ensidig känselstörning eller ensidig extremitetssvaghet)
- ryggmärgen (känselstörning eller svaghet i en extremitet eller ett extremitetspar eller ena kroppshalvan, ofta med urinblåssymtom)
- hjärnstammen och lillhjärnan (dubbelseende, rörelserubbning i ögonen såsom internukleär oftalmoplegi, balanssvårigheter, ataxi) «Thompson AJ, Banwell BL, Barkhof F, ym. Diagnosis ...»2.
- Restsymtom efter ett försämringsskov kan bestå av
- muskelsvaghet i extremiteterna och spasticitet, som utvecklas senare
- känselbortfall som passar för att härstamma från centrala nervsystemet, avvikande känselupplevelser eller neuropatiska smärtor
- störningar i koordinationen av extremiteterna och ataxi som yttrar sig till exempel som gång- och balanssvårigheter
- störning i urinblåsans eller tarmens funktion
- avvikande utmattning och kognitiva svårigheter.
- Det vanligaste initiala symtomet på PPMS (hos 70–80 %) är en spastisk parapares, som i första hand yttrar sig som gång- och balanssvårigheter «Miller DH, Leary SM. Primary-progressive multiple ...»4.
- Inom primärvården bör man kunna misstänka en eventuell MS och identifiera sjukdomens symtom.
Diagnostik
- MS-diagnosen är en klinisk slutsats baserad på en helhet med typiska symtom och undersökningsfynd. Diagnosen förutsätter en klinisk och bilddiagnostisk bedömning samt i regel säkerställande av oligoklonalitet i likvor.
- MS konstateras i allmänhet hos personer i 20–40 års ålder.
- McDonalds kriterier från år 2017 fastställer tilläggskriterier som ska uppfyllas för att ställa en MS-diagnos «Thompson AJ, Banwell BL, Barkhof F, ym. Diagnosis ...»2. Andra diagnoser ska i regel vara mer osannolika för att en MS-diagnos ska kunna ställas.
- En diagnos av skovvis förlöpande MS förutsätter alltid minst en symtomepisod.
- Utöver den kliniska undersökningen är MRT av huvudet den centrala undersökningen vid diagnostiken av MS «Wattjes MP, Ciccarelli O, Reich DS, ym. 2021 MAGNI...»5.
- Med hjälp av MRT av huvudet och vid behov av ryggmärgen kan man konstatera den tidsmässiga och lokala dissemination av inflammatoriska härdförändringar i centrala nervsystemet som diagnosen förutsätter.
- Efter en CIS-diagnos kan följande undersökning göras individuellt enligt klinisk prövning inom 3–6 månader.
- Med tidsmässig dissemination avses två symtomepisoder vid olika tidpunkt eller (förstärkta och icke-förstärkta) förändringar av olika ålder i MRT. Oligoklonalitet i likvor ersätter vid behov den tidsmässiga disseminationen som saknas i MRT.
- Lokal dissemination innebär kliniska fynd eller symtomepisoder i minst två områden av det centrala nervsystemet eller att MRT-fyndet uppfyller kriterierna för lokal dissemination i minst två av fyra områden i centrala nervsystemet «McDonaldin diagnostiset kriteerit 2017: aaltomainen MS-tauti ja ensisijaisesti etenevä MS-tauti»2.
Typisk symtomepisod
- Diagnosen skovvis förlöpande MS förutsätter en symtomepisod «Thompson AJ, Banwell BL, Barkhof F, ym. Diagnosis ...»2.
- Symtomepisoden vid MS är typiskt neuroanatomiskt relaterad till det centrala nervsystemet och varar oavbrutet i minst ett dygn.
- De första symtomen kan härstamma från ett eller flera områden i det centrala nervsystemet (se Symtom och fynd «A1»2).
- Det vanligaste första symtomet på primärprogressiv MS (PPMS) (70–80 %) är en spastisk parapares som utvecklas långsamt (under veckor eller månader) och som i första hand yttrar sig som gång- och balanssvårigheter «Miller DH, Leary SM. Primary-progressive multiple ...»4, «Abdelhak A, Hottenrott T, Mayer C, ym. CSF profile...»6.
Typiska magnetundersökningsförändringar
- För diagnosen MS behövs en MRT-apparat med en fältstyrka på 1,5 T eller 3 T. En dylik är tillräcklig för diagnostiken och uppföljningen av MS.
- MRT-förändringar typiska för MS är ovala, periventrikulära (vinkelräta mot hjärnventriklarna), juxtakortikala (relaterade till hjärnbarken) härdar och härdar i bakre skallgropen «Rovira À, Wattjes MP, Tintoré M, ym. Evidence-base...»7, «Filippi M, Preziosa P, Arnold DL, ym. Present and ...»8.
- Olika magnetsekvenser ger olika slags information för diagnostiken:
- T2-förändringar med hög signal vars form, storlek och läge i centrala nervsystemet bedöms som en del av differentialdiagnostiken. I uppföljningsbilder vittnar nya T2-förändringar med hög signal om ny aktivitet.
- Uppföljningsförändringar av nya härdar i FLAIR (fluid attenuated inversion recovery)-sekvenser
- Kroniska MS-förändringar i T1-sekvenserna ("black holes") och tillsammans med kontrastmedel fynd på färsk inflammationsaktivitet.
- Patologin för de avvikande fynden kan inte bedömas exakt med hjälp av MRT.
- Härdförändringarna i MRT utvecklas från en aktiv Gd-förstärkt förändring till T2-härdar med hög signal inom 1–2 månader.
- CVS (central vein sign) i MRT är förknippad med utvecklingen av T2-förändringar vid MS, och en radiolog kan utnyttja detta fynd i den differentialdiagnostiska bedömningen av T2-förändringar [ «Sati P, Oh J, Constable RT, ym. The central vein s...»9, «Castellaro M, Tamanti A, Pisani AI, ym. The Use of...»10.
- Kortikala lesioner i hjärnbarken är lika signifikanta MRT-fynd som juxtakortikala lesioner, men visualiseringen av dessa med dagens MRT-metoder är otillförlitlig «Harrison DM, Oh J, Roy S, ym. Thalamic lesions in ...»11.
- MRT av huvudet hos en MS-patient omfattar en axial T1-, koronal T2-, FLAIR- och diffusionsbild. Andra MRT-tekniker (DWI, DIR, MTR, DTI, PWI) kan behövas för differentialdiagnostiken samt för en noggrannare bedömning av den inflammatoriska vävnadsskadan och lokaliseringen av atrofi.
- Hos MS-patienter kan hjärnatrofi förekomma redan i början av sjukdomen både centralt och i hjärnbarken, men detta är sällsynt «Wattjes MP, Ciccarelli O, Reich DS, ym. 2021 MAGNI...»5.
- Största delen (cirka 80 %) av MS-patienterna har redan i diagnosstadiet infektionshärdar med symtom också i ryggmärgen «Wattjes MP, Ciccarelli O, Reich DS, ym. 2021 MAGNI...»5, «Polman CH, Reingold SC, Banwell B, ym. Diagnostic ...»12.
- MRT bör göras före en steroidbehandling eller 2–3 månader därefter, när steroidbehandlingens inverkan på det bilddiagnostiska fyndet har upphört (steroidbehandlingen kan minska Gd-förstärkta förändringar) «Wattjes MP, Ciccarelli O, Reich DS, ym. 2021 MAGNI...»5.
Typiska likvorfynd
- Vid misstanke om MS ska åtminstone följande likvorundersökningar utföras: celler, protein, oligoklonala band och IgG-index samt nödvändiga differentialdiagnostiska undersökningar. Tecken på immunopatologi i centrala nervsystemet är en lindrigt ökad leukocytmängd, förhöjt IgG-index och förekomst av oligoklonala band (OCB) «Thompson AJ, Banwell BL, Barkhof F, ym. Diagnosis ...»2, «Boscá I, Magraner MJ, Coret F, ym. The risk of rel...»13.
- Den ökade immunologiska aktiviteten i ryggmärgsvätskan, dvs. syntesen av IgG som härstammar från centrala nervsystemet, konstateras hos cirka 95 % av dem som har säker MS, och flera oligoklonala band (≥ 2, ofta över 10) är ett typiskt fynd som stöder MS-diagnosen «Bernitsas E, Khan O, Razmjou S, ym. Cerebrospinal ...»14, «Cole SR, Beck RW, Moke PS, ym. The predictive valu...»15, «Imrell K, Landtblom AM, Hillert J, ym. Multiple sc...»16.
- IgG-indexet är förhöjt hos 70–80 % av personer med en kliniskt säkerställd MS «McLean BN, Luxton RW, Thompson EJ. A study of immu...»17, «Link H, Kostulas V. Utility of isoelectric focusin...»18, «Giles PD, Heath JP, Wroe SJ. Oligoclonal bands and...»19.
- Likvorfynden är likartade vid RRMS och PPMS. IgG-indexet är förhöjt hos 49–82 % och oligoklonala band hittas hos 89–91 % av PPMS-patienterna «Abdelhak A, Hottenrott T, Mayer C, ym. CSF profile...»6, «Sola P, Mandrioli J, Simone AM, ym. Primary progre...»20.
Diagnostiska kriterier
- MS-diagnosen ställs enligt McDonalds kriterier från år 2017 «Thompson AJ, Banwell BL, Barkhof F, ym. Diagnosis ...»2, «McDonaldin diagnostiset kriteerit 2017: aaltomainen MS-tauti ja ensisijaisesti etenevä MS-tauti»2.
Skovvis förlöpande MS
- Diagnosen skovvis förlöpande MS (RRMS, relapsing remitting MS) ställs redan efter en symtomepisod om oligoklonaliteten i likvor är positiv och en demyeliniseringslesion konstateras i MRT i minst två av följande fyra lokalisationer: 1) kortikal eller juxtakortikal, 2) periventrikulär, 3) infratentoriell och 4) spinal. 85–90 % av MS-patienterna har RRMS i skedet när diagnosen ställs «Lublin FD, Reingold SC, Cohen JA, ym. Defining the...»21.
Primärprogressiv MS
- Diagnosen primärprogressiv MS (PPMS, primary progressive MS) förutsätter att sjukdomen redan från början framskrider jämnt utan tydliga skov i minst ett år och orsakar nedsatt rörelse- och funktionsförmåga. Dessutom konstateras hos patienten minst två av följande tre kriterier: 1) minst en kortikal eller juxtakortikal, periventrikulär eller infratentoriell demyeliniseringslesion, 2) minst två demyeliniseringslesioner i ryggmärgen, 3) positiv oligoklonalitet i likvor.
- 10–15 % av MS-patienterna har PPMS i skedet när diagnosen ställs «Lublin FD, Reingold SC, Cohen JA, ym. Defining the...»21.
Differentialdiagnostik
- I kriterierna för MS poängteras noggrann differentialdiagnostik innan diagnosen ställs «Solomon AJ, Pettigrew R, Naismith RT, ym. Challeng...»22.
- Vid flera differentialdiagnostiska sjukdomar är oligoklonaliteten i likvor negativ.
- Atypiska symtom «Thompson AJ, Baranzini SE, Geurts J, ym. Multiple ...»23 eller MRT-fynd tyder på andra sjukdomar såsom
- ADEM (acute disseminated encephalomyelitis)
- neuromyelitis optica-spektrumstörning eller MOGAD (MOG antibody-associated disease) «Banwell B, Bennett JL, Marignier R, ym. Diagnosis ...»24
- neurosarkoidos
- vaskulit i centrala nervsystemet
- manifestationer av bindvävssjukdomar i centrala nervsystemet: SLE (systemisk lupus erythematosus), Sjögrens syndrom, antifosfolipidsyndrom
- genetiska sjukdomar i hjärnans små blodkärl
- Susacs syndrom
- Behçets syndrom
- CLIPPERS (chronic lymphocytic inflammation, pontine perivascular enhancement responsive to steroids)
- Fabrys sjukdom.
Demyelinisering som slumpmässigt fynd (radiologiskt isolerat syndrom, RIS)
- Med ett radiologiskt isolerat syndrom (radiologically isolated syndrome, RIS) avses ett slumpmässigt fynd i MRT, där man utan typiska MS-symtomepisoder eller kliniska fynd konstaterar typiska inflammationshärdförändringar som tyder på MS «Wattjes MP, Ciccarelli O, Reich DS, ym. 2021 MAGNI...»5.
- Hos cirka en tredjedel av dem som konstateras ha RIS utvecklas MS inom fem år «Thompson AJ, Banwell BL, Barkhof F, ym. Diagnosis ...»2, «Maunula A, Martola J, Atula S, ym. Incidental demy...»25, och risken är som störst hos personer under 35 år «Maunula A, Martola J, Atula S, ym. Incidental demy...»25.
- Läkemedelsbehandling rekommenderas inte för RIS-patienter. Noggrannhet krävs dock för att identifiera symtomepisoder och den primärprogressiva sjukdomsbilden, och om dessa väcker misstanke om MS rekommenderas lumbalpunktion.
Inledning och uppföljning av behandling vid skovvis förlöpande MS
Bedömning av sjukdomsaktiviteten
- I de europeiska behandlingsrekommendationerna finns skillnader i kriterierna för aktiv och mycket aktiv MS i diagnosstadiet och vid uppföljningen av behandlingen «Wiendl H, Gold R, Berger T, ym. Multiple Sclerosis...»26, «Medicinrådets behandlingsvejledning vedrørende læg...»27. Arbetsgruppen rekommenderar följande bedömningssätt.
I diagnosstadiet
- I diagnosstadiet klassificeras skovvis förlöpande MS som mycket aktiv om ett av följande
villkor uppfylls:
- minst två försämringsskov under det senaste året
- ett försämringsskov under det senaste året OCH bestående restsymtom
- ett försämringsskov under det senaste året OCH minst nio T2-förändringar OCH minst en T1 Gd+-förändring eller en ny T2-förändring.
Under uppföljningen av behandlingen
- Under läkemedelsbehandlingen av aktiv MS effektiveras behandlingen till den behandling
som gäller för en mycket aktiv skovvis förlöpande MS om medicineringens fulla effekt
har uppnåtts och ett av följande villkor uppfylls:
- minst ett försämringsskov under det senaste året
- minst två nya T2-förändringar under det senaste året
- en T1 Gd+-förändring under det senaste året.
- Man kan bedöma att läkemedelsbehandlingens fulla effekt har uppnåtts om doseringen har genomförts enligt anvisningarna och det har gått 6 månader sedan läkemedelsbehandlingen inleddes.
- MRT på utgångsnivå, dvs. baseline-MRT, görs 6 månader efter att läkemedlet påbörjats. I den kan man acceptera nya T2-lesioner, men inte T1 Gd+-förändringar.
- Försämringsskovens svårighetsgrad och symtom (sensoriska/motoriska) och nya lesioners storlek, läge (infratentoriella och spinala lesioner förutspår progressiv MS och eventuellt även högre återfallsfrekvens «Minneboo A, Barkhof F, Polman CH, ym. Infratentori...»28, «Tintore M, Rovira A, Arrambide G, ym. Brainstem le...»29, «Cordonnier C, de Seze J, Breteau G, ym. Prospectiv...»30) och behandlingens längd kan beaktas i beslutsfattandet.
- Remission bör eftersträvas under de första åren.
- MRT återspeglar sjukdomens inflammatoriska aktivitet och utnyttjas därför i uppföljningen av läkemedelsbehandlingen.
- I den kliniska uppföljningen ingår regelbunden bedömning av funktionsförmågan.
- EDSS (extended disability severity scale) är en mätare för bedömning av funktionsförmågan «Kurtzke JF. Rating neurologic impairment in multip...»31.
- Neuroregistrets MS-del används i uppföljningen av behandlingen «Laakso SM, Viitala M, Kuusisto H, ym. Multiple scl...»32.
- I registret antecknas försämringsskov, MRT samt årligen EDSS, som kan beräknas med hjälp av registrets automatiserade EDSS-räknare.
- Registrets självrapporteringsportal (MyMS) rekommenderas för att samla in information om patientupplevelsen och den av patienten rapporterade funktionsförmågan.
- Användningen av halten av neurofilament-L-kedjor (NfL) i blod vid uppföljningen av MS är ännu inte etablerad «Neurofilamentti MS-taudin seurannassa»3.
Faktorer som påverkar valet av läkemedelsbehandling
- Faktorer som bör beaktas vid valet av läkemedelsbehandling är förutom sjukdomens aktivitet (se ovan) bland annat patientens ålder, andra sjukdomar, önskemål om barn, eventuella förutsägbara biverkningar av läkemedlet och behovet av säkerhetsuppföljning i anslutning till medicineringen. Beslutet om valet av läkemedel fattas tillsammans med patienten «Kysely MS-tautia sairastavien ja heidän läheistensä näkemyksistä»4, «Jaettu päätöksenteko»5.
- När läkemedelsbehandlingen planeras ska man också kontrollera patientens vaccinationsstatus och planera nödvändiga tilläggsvaccinationer innan medicineringen inleds (se punkten Vaccinationer «A2»3).
- Enligt FPA:s ersättningskriterier ersätts kladribin och fingolimod endast vid mycket aktiv MS (www.fpa.fi «»2).
Betydelsen av att inleda läkemedelsbehandling med hög effekt
- I och med att utbudet av immunologiska läkemedel blivit mångsidigare har det ansamlats
forskningsevidens för att ett högeffektivt läkemedel som inletts i ett tidigt skede
kan skydda mot en senare försämring av funktionsförmågan bättre än en så kallad eskalerande
behandlingsstrategi «Korkeatehoisella lääkehoidolla aloittaminen aaltomaisessa MS-taudissa, kirjallisuuskatsaus»6.
- En eskalerande behandling inleds med medicinering med måttlig effekt och man övergår till läkemedel med hög effekt om sjukdomsaktivitet manifesteras i skov eller i form av nya MRT-förändringar.
- Ett läkemedel kan klassificeras som högeffektivt om det kan förväntas minska försämringsskov med minst 50 % och minska nya eller förstärkta förändringar i MRT med minst 70 % jämfört med placebo «Filippi M, Amato MP, Centonze D, ym. Early use of ...»33.
- CD20-monoklonala antikroppar (ofatumumab, okrelizumab och rituximab), natalizumab, alemtuzumab, kladribin och fingolimod har klassificerats som läkemedel med hög effekt.
- I studier där prognoseffekten av tidig läkemedelsbehandling med hög effekt har undersökts, har de högeffektiva läkemedlen huvudsakligen varit CD20-monoklonala antikroppar i infusionsform, natalizumab och alemtuzumab «Korkeatehoisella lääkehoidolla aloittaminen aaltomaisessa MS-taudissa, kirjallisuuskatsaus»6.
- Studier av högeffektiva läkemedels betydelse i diagnosstadiet är riktgivande men entydiga. Kontrollerade direkta jämförande studier mellan tidig högeffektiv medicinering och eskalerande behandling pågår fortfarande.
- I internationella specialistställningstaganden föreslås att tidig högeffektiv behandling rekommenderas särskilt för patienter under 40 år. För äldre patienter kan läkemedelsbehandling med måttlig effekt däremot lämpa sig bättre med beaktande av infektions- och andra risker «Filippi M, Amato MP, Centonze D, ym. Early use of ...»33, «Stankiewicz JM, Weiner HL. An argument for broad u...»34.
- Den största nyttan av immunologisk medicinering fås sannolikt inom två år från diagnosen «Scalfari A, Neuhaus A, Daumer M, ym. Onset of seco...»35, «Chalmer TA, Baggesen LM, Nørgaard M, ym. Early ver...»36, och nyttan är större hos personer under 41 år än hos äldre «Weideman AM, Tapia-Maltos MA, Johnson K, ym. Meta-...»37.
Immunologiska läkemedelsbehandlingar
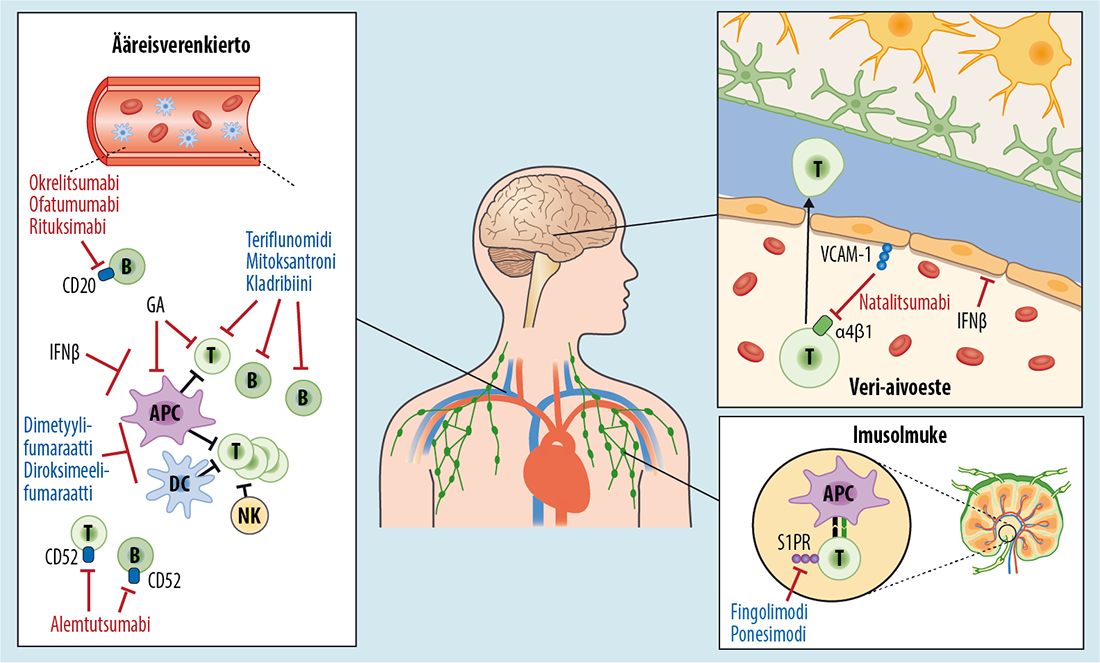
- Verkningsmekanismerna för de immunologiska läkemedelsbehandlingarna är förknippade med lymfocytfunktioner (bild «MS-taudin immunologisten lääkkeiden vaikutusmekanismit»2).
CD20-monoklonala antikroppar (ofatumumab, okrelizumab, rituximab)
Klinisk effekt
- Vid behandling av MS har effekten av CD20-monoklonala antikroppar som minskar mängden
B-celler konstaterats i flera studier «Hauser SL, Bar-Or A, Comi G, ym. Ocrelizumab versu...»38, «Hauser SL, Bar-Or A, Cohen JA, ym. Ofatumumab vers...»39, «Svenningsson A, Frisell T, Burman J, ym. Safety an...»40:
- Ofatumumab minskar antalet försämringsskov, nedsättningen av funktionsförmågan, antalet kontrastförstärkta MRT-förändringar samt utvecklingen av nya MRT-förändringar «Ofatumumab reduces annualized relapse rate, decreases 6-month confirmed disability worsening, the number of gadolinium-enhancing lesions and the annualized rate of new lesions on T2-weighted MRI.»A.
- Okrelizumab minskar antalet skov och bromsar upp försämringen av funktionsförmågan samt minskar den sjukdomsaktivitet som kan bedömas med magnetundersökning vid skovvis förlöpande MS «Okrelitsumabi vähentää pahenemisvaiheiden määrää ja hidastaa toimintakyvyn heikkenemistä sekä vähentää magneettikuvauksella (MK) arvioitavaa taudin aktiivisuutta aaltomaisessa MS-taudissa.»A.
- Rituximab verkar minska antalet skov och de aktiva förändringar som syns i MRT vid skovvis förlöpande MS «Rituksimabi ilmeisesti vähentää pahenemisvaiheiden ja magneettikuvauksessa näkyvien aktiivisten muutosten määrää aaltomaisessa MS-taudissa.»B.
- Okrelizumab och rituximab är preparat i infusionsform, ofatumumab doseras som subkutana injektioner.
- Okrelizumab doseras med ett halvt års mellanrum, rituximab med ett halvt års mellanrum under två år och därefter vanligtvis mer sällan «Starvaggi Cucuzza C, Longinetti E, Ruffin N, ym. S...»41 och ofatumumab en gång i månaden.
- Ofatumumab är en human, okrelizumab en humaniserad och rituximab en kimerisk antikropp.
- För ofatumumab beviljas specialersättning vid skovvis förlöpande MS (ersättningsrättighet 157).
- I Norden har man också använt rituximab, även om man här inte har ansökt om indikation för läkemedlet för behandling av MS.
Genomförande av behandlingen
- Innan behandlingen inleds ska patientens aktuella vaccinationsstatus kontrolleras (se avsnittet Vaccinationer «A2»3).
- Innan behandlingen inleds kontrolleras som säkerhetsprover hepatitvirusantikroppar, HIV-test, undersökningar som krävs för att utesluta tuberkulos enligt en individuell riskbedömning, halten av immunglobuliner i blodet, fullständig blodbild (minimivärdet för lymfocyter 0,8) och graviditetstest.
- Säkerhetsproven följs upp före administrering av preparat i infusionsform och tre månader efter administreringen; enligt produktresumén behöver behandlingen med ofatumumab inte följas upp med säkerhetsprov.
- Okrelizumab kan jämfört med placebo bromsa upp försämringen av rörelse- och funktionsförmågan
samt minska den sjukdomsaktivitet som bedöms med magnetundersökning (MRT) vid primärprogressiv
MS «Okrelitsumabi saattaa hidastaa liikunta- ja toimintakyvyn heikentymistä sekä vähentää magneettikuvauksella (MK) arvioitavaa taudin aktiivisuutta primaaristi etenevässä MS-taudissa lumeeseen verrattuna.»C.
- Vid primärprogressiv MS är det meningsfullt att följa upp upprätthållandet av funktionsförmågan utgående från en bedömning av en fysioterapeut.
- Om gångsträckan eller den övriga funktionsförmågan i vardagen försämras betydligt på grund av MS, avslutas medicineringen. För patienter över 50 år bör man noggrant beakta den individuell infektions- och cancerrisk som en immunsuppressiv medicinering ger upphov till. Risken för allvarlig infektion ökar särskilt hos rullstolspatienter (8,5-faldig risk «Vollmer BL, Wallach AI, Corboy JR, ym. Serious saf...»42).
- Beträffande påbörjandet av behandling, läkemedelsdosering, uppföljning av behandlingen och kontraindikationer, se produktresuméerna.
De viktigaste biverkningarna
- De viktigaste biverkningarna av CD20-monoklonala antikroppar är infektioner i de övre luftvägarna och infusions- eller injektionsreaktioner.
- På grund av risken för infusionsreaktion doseras antihistamin och paracetamol oralt samt metylprednisolon intravenöst en halv timme före en rituximab- eller okrelizumab-infusion.
Fumarat (dimetylfumarat och diroximelfumarat)
Klinisk effekt
- Dimetylfumarat har undersökts hos RRMS-patienter i tre randomiserade studier, vilkas längd har varierat från 6 månader till 2 år (n = 2 908) «Fox RJ, Miller DH, Phillips JT, ym. Placebo-contro...»43, «Kappos L, Gold R, Miller DH, ym. Efficacy and safe...»44, «Gold R, Kappos L, Arnold DL, ym. Placebo-controlle...»45.
- Dimetylfumarat minskar jämfört med placebo risken för skov hos patienter med skovvis förlöpande MS «Dimethyl fumarate reduces both the number of patients with a relapse and the annualised relapse rate over two years in comparison with placebo in relapsing remitting multiple sclerosis. The efficacy is sustained over 5 years regarding both low relapse rate and MRI activity.»A.
- En öppen uppföljningsstudie om långtidseffekten i en fem år lång randomiserad originalstudie (44 % av patienterna i den ursprungliga studien deltog ända till slut) gav vid handen att antalet försämringsskov forfarande var litet och att största delen av patienterna inte fick nya MRT-lesioner «Gold R, Arnold DL, Bar-Or A, ym. Long-term effects...»46.
- Diroximel- och dimetylfumarat omvandlas snabbt vid oral administration till monometylfumarat innan de kommer in i blodomloppet och deras nytto- och biverkningar efter absorptionen är sannolikt desamma (se produktresumén).
Genomförande av behandlingen
- Preparatet tas oralt 2 gånger dagligen.
- För påbörjande av behandling, läkemedelsdosering, uppföljning av behandlingen och kontraindikationer, se produktresumén.
De viktigaste biverkningarna
- Biverkningar av dimetylfumarat är rodnad och symtom från mag-tarmkanalen (diarré, illamående, buksmärta).
- Prevalensen för biverkningar i mag-tarmkanalen var i en studie 34,8 % i diroximelfumaratgruppen
och 49,0 % i dimetylfumaratgruppen «Naismith RT, Wundes A, Ziemssen T, ym. Diroximel F...»47.
- Diroximelfumarat verkar i början av läkemedelsbehandlingen orsaka färre biverkningar i mag-tarmkanalen än dimetylfumarat «Diroksimeelifumaraatti näyttää lääkehoidon alkuvaiheessa aiheuttavan vähemmän maha-suolikanavan haittavaikutuksia kuin dimetyylifumaraatti.»B.
- Patienter som får besvärliga biverkningar i mag-tarmkanalen kan ha nytta av att dimetylfumarat byts ut mot diroximelfumarat eller ett läkemedel med en annan verkningsmekanism.
- Behandlingen inleds alltid med dimetylfumarat, men om biverkningar i mag-tarmkanalen förekommer och de inte försvinner under uppföljningen byter man till diroximelfumarat.
- Båda preparaten är förknippade med en benägenhet för rodnad, som minskas med en ASA-dos på 100 mg före läkemedelsintaget.
- För att minimera biverkningarna kan användningen av inledningsdosen enligt övervägande förlängas från en vecka till 2–4 veckor.
- På grund av risken för lymfocytopeni följs lymfocythalten upp med 3 månaders intervall under hela behandlingen.
- Om patientens lymfocythalt kontinuerligt är under 0,5 x 109/l i över 6 månader, bör behandlingen avslutas på grund av risken för progressiv multifokal leukoencefalopati (PML).
- Om behandlingen avslutas på grund av lymfocytopeni, ska lymfocythalten följas upp tills den återgår till det normala.
Natalizumab
Klinisk effekt
- Effekten av natalizumab jämfört med placebo eller betainterferon vid behandling av RRMS har utretts i tre randomiserade studier, vilkas längd varierade från 6 månader till 2 år (n = 2 344).
- Natalizumab minskar antalet skov och magnetundersökningsförändringar (MRT) vid skovvis förlöpande MS «Natalitsumabi vähentää pahenemisvaiheiden ja magneettikuvausmuutosten (MK) määrää aaltomaisessa MS-taudissa.»A.
- Natalizumab minskar inte nedsättningen av funktionsförmågan vid sekundärprogressiv MS «Natalitsumabi ei vähennä toimintakyvyn heikentymistä toissijaisesti etenevässä MS-taudissa.»A
- Flera öppna långtidsuppföljningsstudier har publicerats och uppföljningstiden är som bäst över 10 år «Butzkueven H, Kappos L, Wiendl H, ym. Long-term sa...»48, «Bigaut K, Fabacher T, Kremer L, ym. Long-term effe...»49. Säkerhetsresultaten har motsvarat resultaten från registerundersökningar.
Genomförande av behandlingen
- Preparatet ges som intravenösa infusioner eller subkutant med 4–6 veckors intervall.
I undersökningar av doseringsform och förlängt dosintervall har behandlingen efter
en månatlig dos på 7–12 månader bytts ut mot annan doseringsform eller annat dosintervall.
- Doseringsformen (intravenös eller subkutan) påverkar uppenbarligen inte effekten och säkerheten av natalizumabbehandling i ett stadigt skede av sjukdomen när behandlingen har fortsatt i minst ett år «Annostelumuoto (suonensisäinen tai ihonalainen) ei ilmeisesti vaikuta natalitsumabihoidon tehoon ja turvallisuuteen sairauden tasaisessa vaiheessa, kun hoitoa on jatkettu vähintään vuoden ajan.»B.
- Doseringsintervallen på fyra eller sex veckor påverkar uppenbarligen inte effekten eller säkerheten av intravenös natalizumabbehandling i ett stadigt skede av sjukdomen när behandlingen har pågått i minst ett år «Neljän tai kuuden viikon annosteluväli ei ilmeisesti vaikuta suonensisäisen natalitsumabihoidon tehoon tai turvallisuuteen MS-taudin tasaisessa vaiheessa, kun hoito on ollut käytössä vähintään vuoden ajan.»B.
- För påbörjande av behandling, läkemedelsdosering, uppföljning av behandlingen och kontraindikationer, se produktresumén.
De viktigaste biverkningarna
- Avslutandet av natalizumab är förknippat med en betydande risk för rebound-sjukdomsaktivering «Prosperini L, Kinkel RP, Miravalle AA, ym. Post-na...»50, (se punkten Rebound vid avslutande av medicinering «A3»4), vilket är skäl att beakta när behandling övervägs.
- De viktigaste biverkningarna av natalizumab är
- PML
- Behandling med natalizumab är förknippad med en risk för PML. PML leder till döden inom ett år från diagnosen hos 38 % av patienterna «Joly M, Conte C, Cazanave C, ym. Progressive multi...»51.
- Förekomsten av JC-virus och ett stort JC-virusindex, tidigare immunsuppressiv medicinering och en lång behandlingstid ökar risken för PML «Ho PR, Koendgen H, Campbell N, ym. Risk of nataliz...»52. PML-risken minskas avsevärt genom att förlänga dosintervallet från fyra till sex veckor «Ryerson LZ, Foley J, Chang I, ym. Risk of natalizu...»53. För att bedöma PML-risken undersöks JC-virusantikroppar i blodet innan behandlingen inleds och hos antikroppsnegativa patienter med ett halvt års intervall under behandlingen «Plavina T, Subramanyam M, Bloomgren G, ym. Anti-JC...»54.
- Natalizumabbehandling för JC-virusantikroppspositiva patienter bör undvikas.
- Om patienten blir antikroppspositiv rekommenderas byte av läkemedel.
- På grund av risken för PML görs MRT av hjärnan under behandlingen enligt separat anvisning, även efter ett läkemedelsbyte (se bilddiagnostisk uppföljning av skovvis förlöpande MS «A4»5).
- PML kan aktiveras inom cirka 6 månader efter att natalizumab avslutats «Rigau V, Mania A, Béfort P, ym. Lethal multiple sc...»55, «Clerico M, Artusi CA, Liberto AD, ym. Natalizumab ...»56.
- infusionsreaktioner; oftast huvudvärk, utmattning, ledsmärtor och överkänslighetsreaktioner «Polman CH, O'Connor PW, Havrdova E, ym. A randomiz...»57
- uppkomst av bestående antikroppar (hos 3–6 %), vilket är förknippat med både allergiska reaktioner och försämrad vårdrespons «O'Connor P, Goodman A, Kappos L, ym. Long-term saf...»58, «Calabresi PA, Giovannoni G, Confavreux C, ym. The ...»59. Natalizumab-antikropparna bestäms 3, 6 och 12 månader efter att behandlingen inletts samt om patienten får försämringsskov. Om det uppstår bestående antikroppar (uppföljning om 6 veckor), avslutas behandlingen.
- infektioner, inklusive opportunistiska infektioner
- förhöjda leverenzymnivåer, hyperbilirubinemi och allvarliga leverskador har rapporterats efter att försäljningstillståndet för natalizumab beviljades. ALAT-uppföljning görs under det första behandlingsåret med 3 månaders intervall.
- PML
Kladribin
Klinisk effekt
- Effekten av kladribin har utretts i två randomiserade placebostudier på 96 veckor hos RRMS- och CIS-patienter (n = 1 942). Kladribin verkar minskar antalet skov, fördröjer sjukdomens framskridande enligt EDSS-poängsättningen och minskar antalet aktiva förändringar i magnetundersökning vid skovvis förlöpande MS «Kladribiini ilmeisesti vähentää pahenemisvaiheiden määrää, viivästyttää taudin etenemistä EDSS-pisteytyksellä arvioituna ja vähentää magneettikuvauksessa (MK) aktiivisten muutosten määrää aaltomaisessa MS-taudissa.»B.
- Effekten av kladribin ses efter 1 månads behandling, varvid antalet MS-förändringar i MRT minskar och efter 2 månader minskar också de T1 Gd-förstärkta lesionerna «de Stefano N, Barkhof F, Montalban X, ym. Early Re...»60.
- Tilläggsdosering av kladribinbehandling under åren 3 och 4 ger uppenbarligen ingen extra effekt för patienter med aktiv skovvis förlöpande MS, men verkar öka risken för herpesinfektioner «Kladribiinihoidon lisäannostelu vuosina 3 ja 4 ei ilmeisesti tuo lisätehoa aktiivista aaltomaista MS-tautia sairastavalle potilaalle, mutta ilmeisesti lisää herpesinfektioiden riskiä.»B.
- Det finns inga forskningsdata om en upprepad doseringscykel efter 4 år. Hos en patient som fått fullständigt terapisvar i fyra år kan man överväga att förnya kladribinbehandlingen om sjukdomsaktiviteten återkommer, men det finns inga forskningsdata om långtideffekterna av en förnyad behandling «Centonze D, Amato MP, Brescia Morra V, ym. Multipl...»61.
- Om man vid uppföljningen av behandlingen redan under den första vårdcykeln konstaterar en Gd-förstärkt lesion i utgångsnivån (baseline) 6 månader efter att behandlingen inletts, bör man överväga byte av läkemedel med beaktande av patientens kliniska helhetssituation.
Genomförande av behandlingen
- Preparatet tas oralt under två behandlingsperioder med ett års mellanrum. Mängden tabletter beräknas enligt patientens vikt. Behandlingsperioden omfattar medicinering enligt vikten i 4–5 dagar två gånger med en månads intervall.
- För påbörjande av behandling, läkemedelsdosering, uppföljning av behandlingen och kontraindikationer, se produktresumén.
- Doseringsperioden under det andra året kan flyttas framåt med 6 månader om det är medicinskt indicerat, till exempel för att normalisera antalet lymfocyter till minst nivån 0,8 x 109 celler/l innan behandlingen inleds det andra året.
De viktigaste biverkningarna
- De vanligaste biverkningarna av kladribin är lymfocytopeni (allvarlig lymfocytopeni 1%), herpes och bältros i munområdet «Kladribiini ilmeisesti vähentää pahenemisvaiheiden määrää, viivästyttää taudin etenemistä EDSS-pisteytyksellä arvioituna ja vähentää magneettikuvauksessa (MK) aktiivisten muutosten määrää aaltomaisessa MS-taudissa.»B, eksem, alopeci och infektioner (10 %), «Nabizadeh F, Mohamadi M, Rahmani S, ym. Safety and...»62, «Giovannoni G, Soelberg Sorensen P, Cook S, ym. Saf...»63, «Giovannoni G, Comi G, Cook S, ym. A placebo-contro...»64.
- Behandlingen kan vara förknippad med en risk för allvarlig leverskada och uppföljningen av leverfunktionen har preciserats efter att läkemedlet kom ut på marknaden «Rauma I, Viitala M, Kuusisto H, ym. Finnish multip...»65.
Injicerbara immunstimulanter (betainterferoner, glatirameracetat)
Klinisk effekt
- Betainterferon 1a har jämförts med placebo hos RRMS-patienter i två randomiserade 2-åriga studier (n = 861) och betainterferon 1b i en randomiserad 2-årig studie (n = 372).
- Betainterferon 1a minskar antalet skov och den sjukdomsaktivitet som bedöms med magnetundersökning vid skovvis förlöpande MS «Beetainterferoni 1a vähentää pahenemisvaiheiden määrää ja magneettikuvauksella (MK) arvioitavaa taudin aktiivisuutta aaltomaisessa MS-taudissa.»A.
- Betainterferon 1b verkar minska antalet skov jämfört med placebo vid skovvis förlöpande MS, men påverkar uppenbarligen inte funktionsförmågan vid 2 års uppföljning. Dessutom verkar interferon minska den sjukdomsaktivitet som bedöms med magnetundersökning vid 3 års uppföljning «Beetainterferoni 1b ilmeisesti vähentää pahenemisvaiheiden määrää lumeeseen verrattuna aaltomaisessa MS-taudissa, mutta sillä ei ilmeisesti ole vaikutusta toimintakykyyn 2 vuoden seurannassa. Lisäksi se ilmeisesti vähentää magneettikuvauksella arvioitavaa taudin aktiivisuutta 3 vuoden seurannassa.»B.
- Pegylerat interferon, peginterferon, har jämfört med placebo påvisats minska antalet skov samt antalet nya och utvidgade T2-lesioner i MRT under en uppföljning på 48 veckor «Calabresi PA, Kieseier BC, Arnold DL, ym. Pegylate...»66.
- Glatirameracetat har undersökts vid RRMS i en placebokontrollerad randomiserad 3-årig studie (n = 251). Glatirameracetat minskar antalet skov, förbättrar funktionsförmågan och minskar sannolikt antalet magnetundersökningsförändringar vid skovvis förlöpande MS «Glatirameeriasetaatti vähentää pahenemisvaiheiden määrää, parantaa toimintakykyä ja ilmeisesti vähentää magneettikuvausmuutosten (MK) lukumäärää aaltomaisessa MS-taudissa.»A.
Genomförande av behandlingen
- På marknaden finns både produkter som injiceras subkutant (varannan dag, 3 gånger i veckan eller varannan vecka) och preparat som injiceras intramuskulärt (en gång i veckan). I behandlingen bör man prioritera alternativ med subkutan administreringmed så stora intervall som möjligt «Coyle PK, Shang S, Xiao Z, ym. Matching-adjusted c...»67.
- För påbörjande av behandling, läkemedelsdosering, uppföljning av behandlingen och kontraindikationer, se produktresumén.
- Vid användning av betainterferoner bestäms MxA-responsen, dvs. MxA-proteinhalten (mätare för läkemedelsrespons), 12 och 24 månader efter att behandlingen inletts. Om responsen är obetydlig eller saknas helt kan ett nytt kontrolltest göras senast om 3 månader. Om man vid två tillfällen konstaterat att MxA-respons saknas, bör behandlingen avslutas. Den minskade responsen kan följas upp utan att behandlingen avslutas tills MxA-responsen antingen ökar till normal eller saknas helt, varvid behandlingen avslutas «Lublin FD, Reingold SC, Cohen JA, ym. Defining the...»21.
De viktigaste biverkningarna
- Förkylningsliknande symtom och lokala injektionsreaktioner i huden i början av behandlingen kan lindras med antiinflammatoriska smärtstillande läkemedel «Lublin FD, Reingold SC, Cohen JA, ym. Defining the...»21.
- Glatirameracetat kan orsaka injektionsreaktioner och lipoatrofi på injektionsstället
«Drago F, Brusati C, Mancardi G, ym. Localized lipo...»68.
- Hos ca 15 % förekommer åtminstone en gång genast efter injektionen rodnad i ansiktet och tryckkänsla över bröstkorgen, hjärtklappning och andnöd som varar i mindre än en minut till 30 minuter. Dessa symtom är ofarliga.
Teriflunomid
Klinisk effekt
- Effekten av teriflunomid vid RRMS har undersökts i sex randomiserade studier (n = 3 354), i vilka läkemedlet getts antingen ensamt jämfört med placebo «O'Connor P, Wolinsky JS, Confavreux C, ym. Randomi...»69, «Confavreux C, O'Connor P, Comi G, ym. Oral teriflu...»70, «Vermersch P, Czlonkowska A, Grimaldi LM, ym. Terif...»71 eller placebokontrollerat som tilläggsläkemedel tillsammans med betainterferon «Freedman MS, Wolinsky JS, Wamil B, ym. Teriflunomi...»72, «NCT01252355. Efficacy and Safety of Teriflunomide ...»73 eller glatirameracetat «Freedman MS, Wolinsky JS, Truffinet P, ym. A rando...»74. Studiernas längd har varierat från 24 veckor till 2 år.
- Teriflunomid verkar minska risken för skov under en uppföljningstid på 1–2 år vid skovvis förlöpande MS jämfört med placebo «Teriflunomide at a dose of 14 mg/day appears to decrease both the number of patients with at least one relapse and the relapse rate in multiple sclerosis over one or two years.»B.
- Teriflunomid har jämförts med ponesimod och ofatumumab. Med ponesimod och ofatumumab förekom färre skov och nya MK-lesioner «Kappos L, Fox RJ, Burcklen M, ym. Ponesimod Compar...»75, och ofatumumab minskade dessutom progressionen av sjukdomsbördan jämfört med teriflunomid «Hauser SL, Bar-Or A, Cohen JA, ym. Ofatumumab vers...»39.
- Sjukdomsförloppet mätt med EDSS-poäng bromsades upp under ett års uppföljning jämfört med placebo [R68]. Om andelen personer som avbröt studien beaktas, var skillnaden inte signifikant.
- Teriflunomid som tilläggsläkemedel tillsammans med antingen betainterferon eller glatirameracetat gav ingen betydande tilläggsnytta «Freedman MS, Wolinsky JS, Wamil B, ym. Teriflunomi...»72, «Freedman MS, Wolinsky JS, Truffinet P, ym. A rando...»74.
- Det finns långtidsevidens på säkerheten från en öppen RRMS-uppföljningsstudie, i vilken patienterna deltog i genomsnitt i 6,3 år (37 % avbröt sitt deltagande i studien) «Freedman MS, Wolinsky JS, Wamil B, ym. Teriflunomi...»72, «Freedman MS, Wolinsky JS, Truffinet P, ym. A rando...»74, «Miller AE, Olsson TP, Wolinsky JS, ym. Long-term s...»76. Inga nya biverkningar observerades och läkemedlet var säkert även vid långvarigt bruk.
Genomförande av behandlingen
- Preparatet tas oralt en gång per dag.
- För påbörjande av behandling, läkemedelsdosering, uppföljning av behandlingen och kontraindikationer, se produktresumén.
- Teriflunomid elimineras mycket långsamt ur kroppen: den genomsnittliga eliminationstiden är 8 månader, men kan vara upp till två år.
- Läkemedlet kan påskyndat elimineras ur kroppen med kolestyramin. Se produktresumén.
De viktigaste biverkningarna
- De viktigaste biverkningarna av teriflunomid är
- infektioner i övre luftvägarna och urinvägarna
- övergående håravfall eller -förtunning
- diarré
- förhöjt ALAT-värde
- lymfocytopeni och neutropeni.
Sfingosin-1-fosfatreceptorns (S1PR) antagonister (fingolimod, ponesimod, siponimod)
Klinisk effekt
- Effekten av fingolimod har undersökts i jämförelse med placebo och betainterferon hos RRMS-patienter i tre randomiserade kontrollerade studier, vilka varade från 6 månader till 2 år (n = 2 845).
- Fingolimod minskar skov och nya MRT-förändringar jämfört med placebo, men hindrar inte nedsättningen av funktionsförmågan, och nytta-risk-balansen är oklar jämfört med till exempel beta-interferon «Fingolimod compared with placebo is effective in reducing inflammatory disease activity, measured by relapses and MRI activity, but is not effective in preventing disability worsening. The evidence on the risk/benefit profile when compared with im.»A.
- Ponesimod minskar antalet skov och nya MRT-förändringar jämfört med teriflunomid samt minskar nya kontrastförstärkta MRT-förändringar jämfört med placebo «Ponesimod at the dose of 20 mg daily reduces annualized relapse rate and the number of combined unique active lesions when compared with teriflunomide. Ponesimod also reduces the number of new T1 Gd+ lesions when compared with placebo.»A.
- Siponimod kan minska funktionsnedsättningen och MRT-förändringarnas volym vid sekundärprogressiv MS «Siponimod may decrease the 3-month confirmed disease progression and the volume of T2 lesions in patients with secondary progressive multiple sclerosis.»C. Läkemedlet är inte tillgängligt i Finland.
- Fingolimod har indikation för mycket aktiv MS, ponesimod för skovvis förlöpande aktiv MS.
Genomförande av behandlingen
- Preparatet tas oralt en gång per dag.
- För påbörjande av behandling, läkemedelsdosering, uppföljning av behandlingen och kontraindikationer, se produktresuméerna.
- Konsultation med kardiolog begärs om patienten har hjärtrelaterade riskfaktorer (sjukt sinus-syndrom, AV-ledningsstörning eller symtomatisk bradykardi: pulsen < 55/min) eller medicineras med betablockerare eller verapamil.
- Ögonläkarkonsultation begärs, om patienten har diabetes eller har haft uveit.
- I samband med intaget av den första fingolimod-tabletten ska patienten övervakas på
en neurologisk poliklinik i 6 timmar. Under övervakningen kontrolleras puls och blodtryck. Vid
användning av ponesimod behövs inte denna uppföljning, om patienten inte har en känd
hjärtsjukdom (se produktresumén).
- EKG kontrolleras innan behandlingen inleds och på nytt efter 6 timmar.
- Om hjärtsymtom (bradykardi eller atrioventrikulära störningar) förekommer efter övervakningen, fortsätter övervakningen av patienten under sjukhusförhållanden över natten.
- Om det uppstår en paus på två veckor i medicineringen, ska den påbörjas på nytt under en 6 timmars poliklinisk övervakning.
- Om lymfocythalten är < 0,2 E9/l, hålls en veckas läkemedelspaus och en fullständig blodbild tas på nytt. Om värdet igen är normalt, fortsätter medicineringen inom 2 veckor utan ny inledande uppföljning.
- Ögonläkarkonsultation eller OCT görs cirka 4 månader efter att behandlingen inletts.
De viktigaste biverkningarna
- Inledning av fingolimodbehandling ska övervägas noggrant och användningen ska begränsas till specialsituationer med beaktande av risken för rebound i samband med avslutande av läkemedlet (se avsnittet Rebound vid avslutande av medicinering «A3»4). Det finns inte tillräckligt med data om reboundrisken efter ponesimodbehandling.
- De viktigaste biverkningarna av sfingosin-1-fosfatreceptorns antagonister är
- bradykardi i samband med den första doseringen av fingolimod
- förhöjda levervärden
- risk för makulasvullnad, som allmänt taget är liten (0,4 %), men förhöjd hos diabetiker och patienter med tidigare konstaterad uveit.
- Enligt FDA:s biverkningsregister rapporterades 87 PML-fall under åren 2015–2017 hos patienter som fått fingolimidbehandling och den justerade oddskvoten (OR) för PML bedömdes vara 4,98 (95 % konfidensintervall 3,64–6,81) «Cohen JA, Barkhof F, Comi G, ym. Oral fingolimod o...»77.
- Huden ska följas upp regelbundet under användningen av fingolimod på grund av risken för hudcancer.
Alemtuzumab
Klinisk effekt
- Effekten av alemtuzumab vid RRMS jämfört med betainterferon 1a har undersökts i tre randomiserade kontrollerade 2–3 års studier «CAMMS223 Trial Investigators, Coles AJ, Compston D...»78, «Cohen JA, Coles AJ, Arnold DL, ym. Alemtuzumab ver...»79, «Coles AJ, Twyman CL, Arnold DL, ym. Alemtuzumab fo...»80.
- Alemtuzumab kan minska risken för skov och nedsatt funktionsförmåga vid skovvis förlöpande MS jämfört med beta-interferon, men tillförlitlig evidens saknas «Alemtuzumab is better than interferon beta-1a for relapse-free survival, sustained disease progression-free survival and MRI lesions at 24 months in multiple sclerosis. However, adverse events are more common for alemtuzumab.»A.
Genomförande av behandlingen
- Den första behandlingsperioden ges under fem dagar i följd och den andra inom ett år under tre dagar i följd i form av intravenösa infusioner.
- För påbörjande av behandling, läkemedelsdosering, uppföljning av behandlingen och kontraindikationer, se produktresumén.
- Patienten bör innan behandlingen inleds informeras tydligt om behovet av regelbunden säkerhetsuppföljning under fem år, och patienten bör förbinda sig till den.
- Risken för allvarliga biverkningar i anslutning till behandlingen, såsom autoimmuna sjukdomar och inflammationer, ska diskuteras med patienten innan behandlingen inleds.
- Infektionsprofylax
- För att förebygga herpesinfektion används till exempel valaciklovir 500 mg 2 gånger om dagen i 4 veckor efter infusionerna.
- För att förebygga listerios bör man 2–3 veckor före infusionerna och 4 veckor efter dem undvika födoämnen som är förknippade med listeriarisk «Holmøy T, von der Lippe H, Leegaard TM. Listeria m...»81.
De viktigaste biverkningarna
- Europeiska läkemedelsmyndigheten (EMA) genomförde 2019 en säkerhetsbedömning av alemtuzumab, eftersom läkemedlet förknippats med bland annat skador i hjärt- och kärlsystemet samt immunsystemet, och även några dödsfall rapporterats i anslutning till behandling med alemtuzumab. Därför ska inledningen av alemtuzumabbehandling övervägas särskilt noggrant.
- Enligt bedömningen rekommenderas inte alemtuzumab till patienter som
- tidigare haft stroke
- har en blodtryckssjukdom i dålig terapeutisk balans
- har en koagulopati eller en medicinering som påverkar blodets koagulation
- har haft dissektion i en halsartär
- har kranskärlssjukdom eller har haft hjärtinfarkt
- samtidigt har andra autoimmuna sjukdomar.
- Infusionsreaktionerna som i studier påvisats hos cirka 90 % är huvudvärk, eksem, feber, illamående, urtikaria, klåda och sömnlöshet.
- De allvarligaste biverkningarna är anknutna till autoimmuna sjukdomar.
- Sjukdomar i sköldkörteln utvecklas hos cirka 40 % av de behandlade patienterna «Pariani N, Willis M, Muller I, ym. Alemtuzumab-Ind...»82. Hyper- eller hypotyreos kan utvecklas ännu fem år efter den sista infusionen. Hos ca 70 % av de patienter som drabbas utvecklas Basedows sjukdom.
- Immunologisk trombocytopeni observerades hos 0,8–2,8 % i tre olika studier «CAMMS223 Trial Investigators, Coles AJ, Compston D...»78, «Cohen JA, Coles AJ, Arnold DL, ym. Alemtuzumab ver...»79, «Coles AJ, Twyman CL, Arnold DL, ym. Alemtuzumab fo...»80.
- Hos fyra patienter har anti-GBM-sjukdom (Goodpastures syndrom) rapporterats.
- Allvarliga infektioner har rapporterats vara dubbelt vanligare än hos patienter behandlade med betainterferon «Cohen JA, Coles AJ, Arnold DL, ym. Alemtuzumab ver...»79, «Coles AJ, Twyman CL, Arnold DL, ym. Alemtuzumab fo...»80.
- Som biverkningar har akuta stenfria gallvägsinfektioner rapporterats «Croteau D, Flowers C, Kulick CG, ym. Acute acalcul...»83 och i Finland och England har även två fall av hemofagocyterande lymfohistiocytos rapporterats «Saarela M, Senthil K, Jones J, ym. Hemophagocytic ...»84.
Mitoxantron
Klinisk effekt
- Effekten av mitoxantron vid både RRMS- och SPMS-sjukdom har undersökts i tre randomiserade 2–3 års studier kontrollerade med placebo eller aktivt läkemedel (metylprednisolon) (n = 294) «Hartung HP, Gonsette R, König N, ym. Mitoxantrone ...»85, «Millefiorini E, Gasperini C, Pozzilli C, ym. Rando...»86, «van de Wyngaert FA, Beguin C, D'Hooghe MB, ym. A d...»87.
- Mitoxantron kan bromsa sjukdomens framskridande, minska antalet skov och minska antalet aktiva magnetundersökningsförändringar vid skovvis förlöpande och progressiv MS under 2 års uppföljning «Mitoksantroni saattaa hidastaa taudin etenemistä, vähentää pahenemisvaiheiden määrää ja vähentää aktiivisten magneettikuvausmuutosten määrää aaltomaisessa ja etenevässä MS-taudissa 2 vuoden seurannassa.»C.
- Indikationen för mitoxantron är behandling av mycket aktiv, skovvis förlöpande MS, när sjukdomen snabbt leder till funktionsnedsättning och det inte finns några andra behandlingsmetoder.
Genomförande av behandlingen
- Preparatet ges som intravenös infusion, till exempel med 3 månaders mellanrum 1–3 gånger med beaktande av läkemedelstoleransen. Den totala livslånga dosen är 120 mg.
- För påbörjande av behandling, läkemedelsdosering, uppföljning av behandlingen och kontraindikationer, se produktresumén.
- EKG och ultraljudsundersökning av hjärtat bör göras innan behandlingen inleds.
De viktigaste biverkningarna
- Mitoxantron kan vara hjärttoxiskt, och ökar även risken för akut leukemi.
- I den senaste översikten var risken för leukemi 0,7 % «Ellis R, Brown S, Boggild M. Therapy-related acute...»88.
Stamcellstransplantation
- Stamcellstransplantation har tills vidare inte genomförts i Finland vid MS. Enligt
arbetsgruppen kan den inflammatoriska sjukdomsaktiviteten oftast lugnas med de högeffektiva
MS-läkemeden som numera används, och stamcellstransplantation har en sekundär roll
i behandlingen av MS.
- I en observationsstudie undersöktes antalet skov hos patienter som fått en autolog stamcellstransplantation för mycket aktiv skovvis förlöpande MS (n = 167) och den bestående förändringen i EDSS-poängen jämfört med patienter som använde fingolimod (n = 2 558), natalizumab (n = 1 490) och okrelizumab (n = 700). Effekten av okrelizumab och stamcellstransplantation var densamma mätt med dessa ändvariabler, effekten av natalizumab var något sämre och effekten av fingolimod klart sämre «Kalincik T, Sharmin S, Roos I, ym. Comparative Eff...»89.
- Vid en stamcellstransplantation avlägsnas det immunologiska minnet med en cytostatikakombination och i en autolog stamcellstransplantation införs en början till nya immunceller i kroppen.
- En stamcellstransplantation kan minska antalet nya MRT-förändringar hos personer med skovvis förlöpande och sekundärprogressiv MS, men evidensen beträffande långvarig nytta och säkerhet är bristfällig «Stem cell transplantation seems to decrease the number of new lesions in MRI and the number of relapses for patients with relapsing-remitting or secondary progressive multiple sclerosis, but the evidence for long-term effect and safety is insufficient.»C.
- En mycket aggressiv fulminant demyelinisering, en okontrollerad sjukdom som börjar i tidig vuxen ålder, är en sällsynt uttrycksform av MS. Patienter med denna sjukdomsform kan ha nytta av en stamcellstransplantation, om de högeffektiva läkemedlen inte är verksamma «Sharrack B, Saccardi R, Alexander T, ym. Autologou...»90.
- Vid progressiv MS rekommenderas inte stamcellstransplantation «Sharrack B, Saccardi R, Alexander T, ym. Autologou...»90.
- I en observationsstudie minskade stamcellstransplantationen vid sekundärprogressiv MS den bestående funktionsnedsättningen vid 5 års uppföljning (HR 0,50; 95 % konfidensintervall = 0,31–0,81; p = 0,005), varför tillförlitliga forskningsdata från dubbelblinda studier behövs «Boffa G, Signori A, Massacesi L, ym. Hematopoietic...»91.
- Stamcellstransplantationer är förknippade med allvarliga biverkningar, framför allt
infektioner. I en svensk observationsstudie konstaterades neutropeni med feber hos
28 av 69 patienter (41 %) inom 100 dagar från ingreppet «Zhukovsky C, Sandgren S, Silfverberg T, ym. Autolo...»92 och incidensen för infektioner i en undersökning av 139 patienter var 108/1 000 personår
(95 % konfidensintervall 75–150) «Alping P, Burman J, Lycke J, ym. Safety of Alemtuz...»93. Vårdrelaterad dödlighet inom 100 dagar är 0,3 % och inom 5 år 4 % hos MS-patienter
under 60 år «Nabizadeh F, Pirahesh K, Rafiei N, ym. Autologous ...»94.
- Sena biverkningar kan också vara amenorré, sekundär autoimmunitet och ökad cancerrisk. Patienten ska ges omfattande mikrobprofylax och vaccinationer efter stamcellstransplantationen (se Vaccinationer «A2»3) «Sharrack B, Saccardi R, Alexander T, ym. Autologou...»90.
- Det finns ännu inte tillräckligt med information om långtidsbiverkningar (> 15 år).
- Uppföljningen efter stamcellstransplantationer bedöms individuellt.
Bilddiagnostisk uppföljning av skovvis förlöpande MS
- Magnetundersökningar behövs för uppföljning av sjukdomsaktiviteten efter MS-diagnosen, eftersom MRT påvisar sjukdomsaktiviteten med större känslighet och objektivitet än kliniska symtom «Wattjes MP, Ciccarelli O, Reich DS, ym. 2021 MAGNI...»5.
- Den årliga MRT-uppföljningen av läkemedelsbehandlingen koncentreras till sjukdomens immunologiskt mest aktiva tid, som i allmänhet är cirka 3–5 år från diagnosen «Wattjes MP, Ciccarelli O, Reich DS, ym. 2021 MAGNI...»5.
- Sex månader efter att läkemedelsbehandlingen inletts bör en MRT med kontrastmedel göras på utgångsnivå (baseline), eftersom läkemedlens effekt har uppnåtts fram till dess.
- Om baseline-MRT som tagits efter 6 månader har en kontrastförstärkt förändring, är läkemedelsbehandlingens effekt inte tillräcklig och läkemedlet bör bytas. Följande MRT-uppföljningar görs 6–12 månader efter att den nya läkemedelsbehandlingen har inletts och därefter med ett års mellanrum i 3–5 år «Wattjes MP, Ciccarelli O, Reich DS, ym. 2021 MAGNI...»5.
- Om man jämfört med föregående MRT upptäcker minst två nya förändringar med hög signal eller en kontrastförstärkt förändring, bör läkemedlet bytas.
- Under det första året görs MRT av huvudet med kontrastmedel, men därefter rekommenderas inte rutinmässig användning av kontrastmedel. Senare kan behovet bedömas individuellt speciellt på basen av skovförekomsten.
- Om det senare framkommer intensifierade förändringar i MRT-uppföljningen ska effektivering av MS-medicineringen övervägas även om identifierbara kliniska skov inte har observerats.
- Kontrastmedel ska inte användas rutinmässigt
- i uppföljningen av behandlingen efter 1 år
- mindre än 6 månader efter föregående Gd-undersökning
- någonsin för gravida
- för PML-screening.
- Rutinmässig MRT-uppföljning av ryggmärgen rekommenderas inte i uppföljningen av behandlingen.
- Europeiska läkemedelsmyndigheten (EMA) rekommenderar endast kelerande gadoliniumkontrastmedel i små doser «European Medicines Agency. Gadolinium-containing c...»95.
- I uppföljningsbilderna kan leptomeningeal kontrastmedelsförstärkning påträffas oftare vid SPMS än i andra MS-former, men detta fynd kan också vara en indikation för differentialdiagnostiska undersökningar «Filippi M, Preziosa P, Langdon D, ym. Identifying ...»96.
- Vid behandling med natalizumab hos JCV-positiva (JCV-index > 0,9) görs MRT med 3–4
månaders mellanrum.
- Det rekommenderas att MRT utförs ännu 9–12 månader efter avslutad natalizumabbehandling hos patienter med hög PML-risk (JCV-titerindex > 0,9, behandlingstiden ≥ 18 månader eller immunsuppressiva behandlingar i bakgrunden).
Specialsituationer inom läkemedelsbehandlingen
Läkemedelsbyte
- Om ett MS-läkemedel med måttlig effekt orsakar biverkningar eller förlorar sin effekt på grund av antikroppsbildning, rekommenderas byte till ett annat läkemedel med måttlig eller hög effekt för skovvis förlöpande MS.
- Om medicineringens fulla effekt har uppnåtts och det fortfarande förekommer klinisk sjukdomsaktivitet eller sjukdomsaktivitet i magnetundersökningen (se Bedömning av sjukdomsaktiviteten «A5»6), rekommenderas att läkemedlet byts ut mot ett MS-läkemedel med hög effekt (se Inledande och uppföljning av behandling av skovvis förlöpande MS «A6»7).
- Det finns ingen evidens om säkerhetsintervaller vid läkemedelsbyte, utan säkerhetsintervallen grundar sig på expertgruppers rekommendationer «Bigaut K, Cohen M, Durand-Dubief F, ym. How to swi...»97. Tabell «Säkerhetsintervaller mellan olika preparat före ny behandling....»1 innehåller arbetsgruppens rekommendation om säkerhetsintervaller.
- Vid läkemedelsbyten ska man beakta effektens varaktighet för det utbytta läkemedlet och eventuella farmakodynamiska interaktioner samt immunsystemsinteraktioner med det nya läkemedlet [R26].
- Byte från ett läkemedel med måttlig effekt till ett annat läkemedel med måttlig effekt eller hög effekt görs utan ett säkerhetsintervall.
- Okrelizumab, ofatumumab, rituximab och mitoxantron kan bytas ut mot ett läkemedel
med måttlig effekt efter ett uppehåll på 3 månader.
- Ofatumumab har en något kortare halveringstid än okrelizumab och rituximab, men dess effekt på CD20-cellerna varar cirka 24 veckor och arbetsgruppen rekommenderar att också det byts ut med ett säkerhetsintervall på 3 månader «Bigaut K, Cohen M, Durand-Dubief F, ym. How to swi...»97.
- Byte av fingolimod och natalizumab rekommenderas på grund av reboundrisken endast till ett annat läkemedel med hög effekt. Det rekommenderas dock inte att dessa preparat byts ut direkt mot kladribin (se Rebound vid avslutande av medicinering «A3»4).
- Om ett läkemedel med hög effekt byts ut mot ett annat läkemedel med hög effekt, rekommenderas
vid byte av fingolimod och natalizumab mot ett annat läkemedel ett säkerhetsintervall
på högst 1 månad (se punkt Rebound «A3»4), vid byte av okrelizumab ett säkerhetsintervall på 3 månader och vid byte av mitoxantron
ett säkerhetsintervall på 6 månader «Bigaut K, Cohen M, Durand-Dubief F, ym. How to swi...»97.
- Om möjligt bör lymfocythalten vara > 0,8 × 109/l innan ett nytt läkemedel inleds, men när det gäller läkemedel som orsakar risk för rebound kan man inte alltid vänta tills lymfocytopenin korrigerats till denna nivå.
| Läkemedel som byts ut | Byte till läkemedel med måttlig effekt | Byte till läkemedel med hög effekt |
|---|---|---|
| Om möjligt bör lymfocythalten vara > 0,8 × 109/l innan ett nytt läkemedel inleds. Beträffande natalizumab utesluts PML innan ett nytt läkemedel inleds (MRT av hjärnan och vid behov påvisande av JC-virusnukleinsyra i likvor). Efter byte av natalizumab utförs MRT av hjärnan med 3–6 månaders mellanrum under det första året om JCV-indexet ≥ 0,9 och behandlingen varat över 18 månader. |
||
| Betainterferoner | Inget uppehåll | Inget uppehåll |
| Dimetylfumarat eller diroximelfumarat | Inget uppehåll | Inget uppehåll |
| Glatirameracetat | Inget uppehåll | Inget uppehåll |
| Teriflunomid | Inget uppehåll (påskyndad eliminering) | Inget uppehåll (påskyndad eliminering) |
| Alemtuzumab | Enligt individuell prövning | Enligt individuell prövning |
| Fingolimod | Inget uppehåll | ≤ 1 mån. |
| Ponesimod | 1 vecka | 1 vecka |
| Kladribin | Enligt individuell prövning | Enligt individuell prövning |
| Mitoxantron | 3 mån. | 6 mån. |
| Natalizumab | Inget uppehåll | 1 mån. |
| Ofatumumab | 3 mån. | 3 mån. |
| Okrelizumab | 3 mån. | 3 mån. |
| Rituximab | 3 mån. | 3 mån. |
Rebound vid avslutande av medicinering (kraftigaste sjukdomsaktiviteten under livstiden)
- Med reboundfenomen avses en betydande ökning av sjukdomsaktiviteten efter avslutad behandling jämfört med nivån före medicineringen eller ett mycket svårt försämringsskov där EDSS-poängtalet ökar med minst 2 poäng och man ser minst 5 Gd-förstärkta förändringar i MRT av hjärnan.
- Reboundrisken finns endast hos de läkemedel som påverkar lymfocyternas förlopp från periferin till det centrala nervsystemet (natalizumab och fingolimod). Det är dock sannolikt att fenomenet är en så kallad klasseffekt och kan inträffa även efter avslutat ponesimod.
- Incidensen för rebound efter avslutat natalizumab är 10–30 % «Sorensen PS, Koch-Henriksen N, Petersen T, ym. Rec...»98, «Lo Re M, Capobianco M, Ragonese P, ym. Natalizumab...»99, «Mustonen T, Rauma I, Hartikainen P, ym. Corrigendu...»100, «Ladeira F, Braz L, Salgado P, ym. A multicenter, n...»101, «Fuentes-Rumí L, Hernández-Clares R, Carreón-Guarni...»102 och rebound framträder 8–24 veckor efter att läkemedlet avslutats «González-Suarez I, Rodríguez de Antonio L, Orviz A...»103, «Prosperini L, Kinkel RP, Miravalle AA, ym. Post-na...»50, «Hua LH, Harris H, Conway D, ym. Disease activity o...»104, «Roos I, Malpas C, Leray E, ym. Disease Reactivatio...»105.
- Incidensen av rebound efter avslutat fingolimod är 10–25 % «Hatcher SE, Waubant E, Nourbakhsh B, ym. Rebound S...»106, «Evangelopoulos ME, Miclea A, Schrewe L, ym. Freque...»107, «Frau J, Sormani MP, Signori A, ym. Clinical activi...»108, «Uygunoglu U, Tutuncu M, Altintas A, ym. Factors Pr...»109, «Fragoso YD, Adoni T, Gomes S, ym. Severe Exacerbat...»110 och rebound framträder 4–16 veckor efter avslutat läkemedel «Roos I, Malpas C, Leray E, ym. Disease Reactivatio...»105, «Hatcher SE, Waubant E, Nourbakhsh B, ym. Rebound S...»106, «Fragoso YD, Adoni T, Gomes S, ym. Severe Exacerbat...»110, «Roos I, Malpas C, Leray E, ym. Disease Reactivatio...»105.
- Efter avslutat fingolimod kan kvinnor som planerar en graviditet ha en särskild reboundrisk.
- 40 % av kvinnor hos vilka fingolimod avslutades på grund av graviditetsplaner fick rebound «Sepúlveda M, Montejo C, Llufriu S, ym. Rebound of ...»113och 22 % av kvinnor hos vilka fingolimod avslutades på grund av graviditetsplaner fick relaps under graviditeten och 44 % under barnsängstiden. Relaps under graviditeten korrelerar med relapsfrekvensen efter förlossningen «Bianco A, Lucchini M, Totaro R, ym. Disease Reacti...»114.
- Riskfaktorerna för rebound efter avslutat natalizumab är en stor relapsfrekvens innan natalizumab inleds «Lo Re M, Capobianco M, Ragonese P, ym. Natalizumab...»99, «Prosperini L, Kinkel RP, Miravalle AA, ym. Post-na...»50, «Roos I, Malpas C, Leray E, ym. Disease Reactivatio...»105, «Iaffaldano P, Lucisano G, Pozzilli C, ym. Fingolim...»115, «Auer M, Zinganell A, Hegen H, ym. Experiences in t...»116, ung ålder «Prosperini L, Kinkel RP, Miravalle AA, ym. Post-na...»50, långt läkemedelsuppehåll «Lo Re M, Capobianco M, Ragonese P, ym. Natalizumab...»99, «Mustonen T, Rauma I, Hartikainen P, ym. Corrigendu...»100, «Iaffaldano P, Lucisano G, Pozzilli C, ym. Fingolim...»115, «Kappos L, Radue EW, Comi G, ym. Switching from nat...»117, högt EDSS-poängantal vid inledningsfasen av natalizumab «Vidal-Jordana A, Tintoré M, Tur C, ym. Significant...»118 samt EDSS-progression under behandlingen «Vidal-Jordana A, Tintoré M, Tur C, ym. Significant...»118. Riskfaktorer är dessutom associerade sjukdomar «Iaffaldano P, Lucisano G, Pozzilli C, ym. Fingolim...»115, sjukdomsaktivitet under behandlingen «Sorensen PS, Koch-Henriksen N, Petersen T, ym. Rec...»98, «Iaffaldano P, Lucisano G, Pozzilli C, ym. Fingolim...»115, «Vidal-Jordana A, Tintoré M, Tur C, ym. Significant...»118, neutraliserande antikroppar «Sorensen PS, Koch-Henriksen N, Petersen T, ym. Rec...»98 och kortvarig behandlingstid «Lo Re M, Capobianco M, Ragonese P, ym. Natalizumab...»99, «Prosperini L, Kinkel RP, Miravalle AA, ym. Post-na...»50, varför natalizumab- och fingolimodbehandling alltså alltid bör planeras som långvarig.
- Riskfaktorerna för rebound efter avslutat fingolimod är en stor relapsfrekvens innan behandlingen inleds «Roos I, Malpas C, Leray E, ym. Disease Reactivatio...»105, «Hatcher SE, Waubant E, Nourbakhsh B, ym. Rebound S...»106, «Nygaard GO, Torgauten H, Skattebøl L, ym. Risk of ...»119, låg lymfocythalt i inledningsfasen «Sepúlveda M, Montejo C, Llufriu S, ym. Rebound of ...»113 eller avslutningsfasen , långt läkemedelsuppehåll «Goncuoglu C, Tuncer A, Bayraktar-Ekincioglu A, ym....»111, kvinnligt kön «Framke E, Pontieri L, Bramow S, ym. Rebound of cli...»112 samt ung ålder «Goncuoglu C, Tuncer A, Bayraktar-Ekincioglu A, ym....»111, «Framke E, Pontieri L, Bramow S, ym. Rebound of cli...»112, , «Nygaard GO, Torgauten H, Skattebøl L, ym. Risk of ...»119.
- Efter att e dessa läkemedel har avslutats ska läkemedelsuppehållet hållas så kort som möjligt, i praktiken högst en månad «Roos I, Malpas C, Leray E, ym. Disease Reactivatio...»105, «Leurs CE, van Kempen ZL, Dekker I, ym. Switching n...»120.
- Inledning av immunstimulanter förhindrar inte uppkomsten av rebound «Sellner J, Rommer PS. A review of the evidence for...»121.
- Dimetylfumarat kan vara tillräckligt för de patienter som hade få försämringsskov innan behandlingen inleddes, ingen sjukdomsaktivitet under behandlingen och inget annat läkemedelsalternativ finns att tillgå «Sellner J, Rommer PS. A review of the evidence for...»121, «Cohan SL, Moses H, Calkwood J, ym. Clinical outcom...»122.
- I regel ska man dock byta till ett snabbverkande läkemedel med hög effekt «Hersh CM, Harris H, Conway D, ym. Effect of switch...»123, med vilka man i detta sammanhang avser rituximab, okrelizumab «Lo Re M, Capobianco M, Ragonese P, ym. Natalizumab...»99, «Nygaard GO, Torgauten H, Skattebøl L, ym. Risk of ...»119, «Hersh CM, Harris H, Conway D, ym. Effect of switch...»123, «Alping P, Frisell T, Novakova L, ym. Rituximab ver...»124, «Langer-Gould AM. Pregnancy and Family Planning in ...»125 eller alemtuzumab «Federle L, Puthenparampil M, Stenta G, ym. Alemtuz...»126, «Huhn K, Bayas A, Doerck S, ym. Alemtuzumab as resc...»127, «Alcalá C, Gascón F, Pérez-Miralles F, ym. Treatmen...»128.
- Ofatumumab torde verka på samma sätt som andra CD20-monoklonala antikroppar, men det finns tills vidare inga forskningsdata om dess effekt vid förebyggande av rebound.
- Efter natalizumab kan även fingolimod övervägas «Iaffaldano P, Lucisano G, Pozzilli C, ym. Fingolim...»115, «Capobianco M, di Sapio A, Malentacchi M, ym. No im...»129, och på motsvarande sätt rekommenderas natalizumab efter fingolimod hos JCV-antikroppsnegativa «Zhu C, Zhou Z, Roos I, ym. Comparing switch to ocr...»130.
- Kladribin förhindrar inte rebound efter fingolimod lika effektivt som rituximab, okrelizumab eller natalizumab «Nygaard GO, Torgauten H, Skattebøl L, ym. Risk of ...»119, «Zhu C, Zhou Z, Roos I, ym. Comparing switch to ocr...»130.
- Kortison minskar inte risken för rebound efter natalizumab «Vidal-Jordana A, Tintoré M, Tur C, ym. Significant...»118, «Sellner J, Rommer PS. A review of the evidence for...»121, «Borriello G, Prosperini L, Marinelli F, ym. Observ...»131, «Magraner MJ, Coret F, Navarré A, ym. Pulsed steroi...»132 och det finns inga data om dess effekt vid förhindrande av rebound efter avslutat fingolimod «Berger B, Baumgartner A, Rauer S, ym. Severe disea...»133, «Sánchez P, Meca-Lallana V, Vivancos J. Tumefactive...»134.
Graviditet och amning
- MS inverkar inte negativt på graviditeten eller fosterutvecklingen.
- Graviditetsplaner ska diskuteras med patienten genast efter att diagnosen ställts och de ska i mån av möjlighet beaktas vid valet av behandling.
- Graviditetsplanerna får inte fördröja inledandet av behandlingar som påverkar sjukdomsförloppet.
- Preventivmedel är trygga för MS-patienter «Otero-Romero S, Carbonell-Mirabent P, Midaglia L, ...»135. Kombinerade preventivmedel är förknippade med en ökad trombosrisk särskilt om rörelseförmågan är nedsatt. Eventuella biverkningar av läkemedel (t.ex. GI-symtom och absorption) samt eventuella interaktioner med de läkemedel som patienten använder ska bedömas.
- Infertilitetsbehandlingar ökar inte risken för skov hos kvinnor med MS «Mainguy M, Tillaut H, Degremont A, ym. Assessing t...»136.
- Folsyratillskott (längre än 3 månader innan preventivmedlet avslutas) och tillräcklig D-vitaminsubstitution ingår i planeringen av en graviditet «Krysko KM, Dobson R, Alroughani R, ym. Family plan...»137.
- Vid behandling av MS under graviditeten måste man hitta den bästa balansen mellan mammans och fostrets eller den nyföddas hälsa.
- Andra och tredje trimestern har oftast en lugnande effekt på MS «Confavreux C, Hutchinson M, Hours MM, ym. Rate of ...»138. Risken för försämringsskov minskar betydligt fram till den sista trimestern, men ökar efter förlossningen. Risken för försämringsskov är störst under de tre första månaderna efter graviditeten.
- Amning har ingen betydande inverkan på MS-sjukdomens aktivitet «Portaccio E, Amato MP. Breastfeeding and post-part...»139.
- Under amningen är det tryggt att använda CD20-monoklonala antikroppar (amning tillåten 4 timmar efter infusionen), betainterferoner, glatirameracetat och natalizumab.
- Karenstiderna för immunmodulativ behandling av MS före graviditeten varierar (tabell
«Säkerhetsintervaller för olika preparat före planerad graviditet och användning av
preparaten under amning ....»2). Ett eventuellt reboundfenomen förknippade med vissa läkemedel ska beaktas i planeringen
av behandlingen (se punkten Rebound vid avslutande av medicinering «A3»4).
- Användningen av betainterferoner och glatirameracetat kan fortsätta under hela graviditeten.
- Man kan fortsätta med en natalizumabbehandling till den sista trimestern eller man kan överväga att byta till en annan läkemedelsbehandling med hög effekt (med beaktande av risken för rebound) före graviditetsförsök.
- Dimetylfumarat, diroximetylfumarat och ofatumumab kan fortsätta fram till ett positivt graviditetstest.
- Gällande teriflunomid rekommenderas påskyndad eliminering till exempel med kolestyramin innan preventivmedlet avslutas, och läkemedelshalten i blodet bör vara omätbar två gånger före graviditetsförsök.
- Karenstiderna för andra läkemedel är olika långa. Se produktresumén.
- Det är viktigt att förebygga reboundfenomen när man planerar en graviditet (se punkt
Rebound «A3»4) «Yeh WZ, Widyastuti PA, Van der Walt A, ym. Nataliz...»140, «Razaz N, Piehl F, Frisell T, ym. Disease activity ...»141, «Kümpfel T, Thiel S, Meinl I, ym. Anti-CD20 therapi...»142.
- Byte av natalizumab och fingolimod till en CD20-monoklonal antikropp före ett graviditetsförsök eller en förlängning av natalizumabbehandlingen under graviditeten minskar avsevärt risken för reboundrelaps. Om natalizumabbehandlingen fortsätter till den sista trimestern ska blodbilden hos den nyfödda kontrolleras och administreringen av levande försvagade vaccin skjutas upp «Krysko KM, Dobson R, Alroughani R, ym. Family plan...»137.
- Vid behandling av försämringsskov under graviditet används metylprednisolon (se Försämringsskov och dess behandling «A7»8). Plasmaferes kan övervägas om kortison inte ger respons. Immunglobulin används endast i särskilda situationer.
- Med växande användarerfarenhet ökar kunskapen om användningen av läkemedel under graviditet och amning. Databaserna för graviditet och amning i Terveysportti innehåller en omfattande sammanställning av hur tryggt det är att använda immunmodulerande och immunsuppressiva läkemedel under graviditet och amning. (Databaserna kräver användarbehörighet; Gravbase och Lactbase, «https://www.terveysportti.fi/apps/raim/»1).
- Magnetundersökning rekommenderas inte under graviditeten. Om magnetundersökning dock av medicinska skäl är nödvändig bör Gd-kontrastmedel inte användas «Ray JG, Vermeulen MJ, Bharatha A, ym. Association ...»143. Efter graviditeten kan man använda Gd-kontrastmedel vid bilddiagnostiska undersökningar och amningen kan fortsätta, även om kontrastmedlet i liten utsträckning utsöndras i modersmjölken «American College of Radiology. ACR Committee on Dr...»144.
| Aktiv läkemedelssubstans | Tid från sista dosen till att preventivmedel avslutas i samband med graviditetsönskan | Amning möjlig under användningen av läkemedlet |
|---|---|---|
| 1 > 5 halveringstid för elimineringen | ||
| Betainterferoner | Är inte kontraindicerade under graviditet | Ja |
| Dimetylfumarat eller diroximelfumarat | Avslutas när graviditetstestet är positivt | Nej |
| Glatirameracetat | Är inte kontraindicerad under graviditet | Ja |
| Teriflunomid | Efter påskyndad eliminering. 24 månader utan eliminering. | Nej |
| Alemtuzumab | 4 mån. | Nej (amning kan inledas 4 mån. efter infusionen) |
| Fingolimod1 | 2 mån. | Nej |
| Ponesimod1 | 1 vecka | Nej |
| Kladribin | 6 mån. | Nej (amning kan inledas 1 vecka efter den sista dosen) |
| Mitoxantron | 6 mån. | Nej |
| Natalizumab | Preparatet kan användas fram till graviditetsvecka 34 (förlängt dosintervall) och det kan inledas på nytt 1–2 veckor efter förlossningen. Återupptas så att uppehållet inte är mer än 8 veckor. | Ja |
| Ofatumumab | Avslutas när graviditetstestet är positivt | Ja |
| Okrelizumab | 3 mån. | Ja |
| Rituximab | 3 mån. | Ja |
Läkemedelsbehandling av primärprogressiv MS
- Okrelizumab är indicerat för behandling av progressiv MS. Man kan överväga att inleda
behandlingen i ett tidigt skede av sjukdomen om inflammatorisk aktivitet i MRT konstateras.
- Jämfört med placebo kan okrelizumab bromsa upp försämringen av rörelse- och funktionsförmågan och minska den sjukdomsaktivitet som bedöms med magnetundersökning (MRT) vid primärprogressiv MS «Okrelitsumabi saattaa hidastaa liikunta- ja toimintakyvyn heikentymistä sekä vähentää magneettikuvauksella (MK) arvioitavaa taudin aktiivisuutta primaaristi etenevässä MS-taudissa lumeeseen verrattuna.»C.
- Fingolimod fördröjer uppenbarligen inte sjukdomens framskridande vid primärprogressiv MS «Oral fingolimod, 0.5 mg daily for 36 months compared to placebo, appears not to slow disease progression in patients with primary progressive multiple sclerosis, when measured with the time to confirmed disability progression as a composite outcome or as an EDSS score change.»B.
- EDSS-värdet bör vara ≤ 6,5 i det skedet behandlingen inleds.
- Behandlingens effekt bör bedömas noggrant. Vid bedömning av effekten är en fysioterapeuts
bedömning av rörelseförmågan en gång per år till nytta. Behandlingen bör avslutas
om funktionsnedsättningen inte blir långsammare och senast när gångförmågan har gått
förlorad.
- MRT-uppföljning är i regel inte till någon nytta i denna patientgrupp.
Avslutande av immunologisk medicinering
Sekundärprogressiv MS
- Immunologisk läkemedelsbehandling kan användas om försämringsskov fortfarande förekommer i den sekundärprogressiva fasen.
- Läkemedelsbehandlingen ska avslutas senast om antalet EDSS-poäng är ≥ 7 som bestående restsymtom.
- Natalizumab minskar inte nedsättningen av funktionsförmågan vid sekundärprogressiv MS «Natalitsumabi ei vähennä toimintakyvyn heikentymistä toissijaisesti etenevässä MS-taudissa.»A.
- Om sjukdomen fortsätter att försämra rörelse- och funktionsförmågan under årens lopp utan akuta skov och det i MRT av huvudet inte syns några nya T2- eller Gd-förstärkta lesioner, rekommenderas att man överväger att avsluta medicineringen.
Beaktande av åldern vid skovvis förlöpande MS
- Försämringsskov är mycket sällsynta hos personer över 60 år «Tremlett H, Zhao Y, Joseph J, ym. Relapses in mult...»145, «Hua LH, Fan TH, Conway D, ym. Discontinuation of d...»146.
- Effekten av immunologisk läkemedelsbehandling försämras kraftigt med ökande ålder: i en metaanalys var ingen läkemedelsbehandling av MS effektiv hos personer över 53 år och högeffektiva läkemedel kunde bromsa nedsättningen av funktionsförmågan jämfört med mindre effektiva läkemedel endast hos personer under 40 år «Weideman AM, Tapia-Maltos MA, Johnson K, ym. Meta-...»37.
- I behandlingen bör man beakta infektionsrisken i samband med medicineringen och den
ökade åldersrelaterade cancerrisken «Atula S, Laakso S, Nevala R, Järvinen E. MS-taudin...»147, «Prosperini L, Haggiag S, Tortorella C, ym. Age-rel...»148.
- Risken för svårbehandlad infektion ökar till 8,5-faldig vid rituximabbehandling när antalet EDSS-poäng är minst 7 «Vollmer BL, Wallach AI, Corboy JR, ym. Serious saf...»42.
- En randomiserad, enkelblindad non-inferioritetsstudie (DISCOMS) har gjorts gällande avslutande av immunologisk läkemedelsbehandling hos personer över 55 år. Patienterna hade inga skov under de föregående 5 åren och inga nya MRT-förändringar under de föregående 3 åren. Som primär slutmätpunkt valdes en ny MRT-lesion eller ett nytt försämringsskov, som konstaterades i högre grad hos dem som avslutat medicineringen (12,2 % vs 4,7 % av patienterna; en uppföljningstid på 2 år). När man direkt granskade risken för försämringsskov skiljde sig gruppen som avslutat medicineringen inte märkbart från gruppen som fortsatte läkemedelsbehandlingen «Corboy JR, Fox RJ, Kister I, ym. Risk of new disea...»149.
- Vid stabil skovvis förlöpande MS bör man hos äldre patienter (över 55–60 år) överväga den individuellt lämpligaste tiden för att avsluta medicineringen «Vaughn CB, Jakimovski D, Kavak KS, ym. Epidemiolog...»150.
- Sjukdomens tidigare aktivitet ska beaktas vid bedömningen av situationen.
- MRT av huvudet kan i oklara situationer utföras som stöd för vårdbeslutet. Bilddiagnostik strax innan medicineringen avslutas (även för att bedöma den aktuella sjukdomsaktiviteten) och 6–12 månader efter en läkemedelsfri period kan underlätta att bedöma situationen: nya T2-lesioner stöder ett återupptagande av läkemedelsbehandlingen.
- En immunmodulerande behandling kan återupptas om det uppkommer nya försämringsskov efter att behandlingen avslutats.
Försämringsskov och dess behandling
- Ett försämringsskov av MS är ett nytt neurologiskt symtom på grund av en inflammatorisk reaktion i centrala nervsystemet eller en betydande försämring av ett gammalt symtom som börjar småningom under loppet av några dagar. Vanligtvis ökar symtomen under cirka två veckor, varefter de blir lindrigare och vanligtvis avklingar helt eller delvis inom en månad.
- Olika stressituationer i kroppen, såsom infektioner (tandinflammation, förkylning, magsjuka, urinvägsinfektion) och andra sjukdomar kan öka risken för försämringsskov «McDonald WI, Compston A, Edan G, ym. Recommended d...»151.
- Vanliga symtom vid försämringsskov är till exempel nedsatt syn och rörelseömhet i ena ögat, muskelsvaghet och känselstörningar i en eller flera extremiteter, dubbelseende, balanssvårigheter och klumpighet «Kuusisto H, Elovaara I MS-taudin pahenemisvaiheen ...»152.
- Enbart utmattning bör inte tolkas som ett försämringsskov.
- När kroppstemperaturen stiger till exempel vid feber, i sommarhetta eller i samband med bastubad blir nervernas ledningshastighet långsammare och de neurologiska symtomen kan öka. Det är fråga om ett fysiologiskt så kallat Uthoffs fenomen, som inte är ett försämringsskov «McDonald WI, Compston A, Edan G, ym. Recommended d...»151.
- Nedsatt funktionsförmåga som småningom ökar under månadernas lopp är inte heller ett försämringsskov till följd av inflammationsaktivitet, utan beror i första hand på degenerativa förändringar i centrala nervsystemet «Noseworthy JH, Lucchinetti C, Rodriguez M, ym. Mul...»153.
- Läkemedelsbehandling vid ett akut skov förkortar symtomens längd «Barnes MP, Bateman DE, Cleland PG, ym. Intravenous...»154, «Beck RW, Cleary PA, Anderson MM Jr, ym. A randomiz...»155. Behandling ska övervägas om patientens funktionsförmåga är betydligt nedsatt, till exempel om visus är under 0,5 eller om gångförmågan är väsentligt nedsatt.
- Den primära behandlingen är metylprednisolon i hög dos. Behandlingen genomförs genom att administrera 1 000 mg metylprednisolon i 3 (–5) dagar intravenöst eller oralt. Det har inte observerats några skillnader i behandlingens effekt eller säkerhet som skulle bero på administreringsvägen eller dosens storlek, förutsatt att dosen är minst 500 mg i 3 dagar eller högst 2 000 mg i 5 dagar «Kuusisto H, Elovaara I MS-taudin pahenemisvaiheen ...»152, «Oliveri RL, Valentino P, Russo C, ym. Randomized t...»156.
- Den första behandlingen (eller åtminstone den första natten) ska på grund av psykosrisken genomföras under övervakning på sjukhus.
- Akuta infektioner ska uteslutas innan behandlingen genomförs. En samtidig infektion i de nedre urinvägarna är i allmänhet inget hinder för behandling, men behandlingen ges med antibiotikaskydd.
- Plasmabyte kan övervägas i samband med skov med kraftiga symtom efter kortisonpulsbehandling, om kortisonpulsbehandlingen inte ger begynnande respons i symtombilden. Plasmabyte görs till exempel varannan dag och byte av sammanlagt 1–1,5 blodvolymer görs 5–7 gånger «Cortese I, Chaudhry V, So YT, ym. Evidence-based g...»157, «Frohman EM, Wingerchuk DM. Clinical practice. Tran...»158.
Symtomatisk behandling
- Residualsymtom orsakade av MS lindras på samma sätt som vid andra sjukdomar «MS-tautia sairastavan hoitoketju. Terveysportti -H...»159.
- Spasticitet: En optimal bedömning och behandling av spasticitet förutsätter multiprofessionalitet och både farmakologisk och läkemedelsfri behandling. Vid svår spasticitet kan intratekal baklofenbehandling vara till hjälp «Otero-Romero S, Sastre-Garriga J, Comi G, ym. Phar...»160, «Multiple sclerosis in adults: management. London: ...»161, «Smith KA, Piehl F, Olsson T, ym. Spasticity treatm...»162, «Filippini G, Minozzi S, Borrelli F, ym. Cannabis a...»163. Kannabinoid (Sativex) har försäljningstillstånd för behandling av spasticitet vid MS. Beslut om inledning av behandlingen fattas av en specialist.
- Depression: Depression hos personer med MS behandlas enligt samma principer som gäller för andra depressionspatienter (se God medicinsk praxis-rekommendationen Depression «Depressio»3, «Depressio. Käypä hoito -suositus. Suomalaisen Lääk...»164).
- Smärta: Före behandlingsbeslutet är det viktigt att utreda bakgrunden till smärtan: är det fråga om neuropatisk smärta eller smärta i stöd- och rörelseorganen? Vid MS bör neuropatisk smärta behandlas enligt sedvanliga rekommendationer. Smärta i rörelseorganen är ofta en följd av orörlighet, spasticitet eller felställningar, och då bör man koncentrera sig på att behandla dessa orsaker «Multiple sclerosis in adults: management. London: ...»161.
- Urineringsstörningar: MS är förknippad med problem med både lagringen och tömningen av urin, ofta bägge samtidigt. Orsaken till störningen bör utredas och behandlingen planeras enligt orsaken. Den mest optimala nyttan vid behandlingen uppnås multiprofessionellt genom att kombinera läkemedelsfria, farmakologiska och andra urologiska behandlingar «Vecchio M, Chiaramonte R, DI Benedetto P. Manageme...»165.
- Förstoppning: Sedvanlig behandling av kronisk förstoppning kan användas och ibland kan det behövas en kombination av flera läkemedel. Det lönar sig att undvika laktulos vid svår tarmmotilitetsstörning, eftersom laktulos vid fermentering kan orsaka gasbesvär och effekten kan försämras «Preziosi G, Gordon-Dixon A, Emmanuel A. Neurogenic...»166.
- Sömnstörningar: I första hand rekommenderas läkemedelsfria behandlingar eller läkemedelsbehandling enligt orsak (se God medicinsk praxis-rekommendationen Sömnlöshet «Unettomuus»4), «Unettomuus. Käypä hoito -suositus. Suomalaisen Lää...»167.
- Gångsvårigheter: Fampridin kan övervägas. Läkemedlet är inte ersättningsgillt och har ett högt pris. Gånghastigheten bör förbättras med minst 25 % efter 2 veckors användning av läkemedlet «Ghorbanpour S, Rahimibarghani S, Rohani S, ym. Fam...»168.
- Utmattning: All utmattning beror inte på MS-sjukdomen och det är bra att utesluta sömnapné, depression, trötthet orsakad av (antikolinerga) läkemedel eller till exempel tätt urineringsbehov nattetid bakom utmattning dagtid. Motion har påvisats ge respons vid behandling av utmattning hos MS-patienter «Liikunta ilmeisesti vähentää MS-tautiin liittyvää uupumusta.»B, «Pilates saattaa vähentää MS-tautia sairastavan kokemaa uupumusta ja parantaa fyysistä toimintakykyä ja elämänlaatua yhtä paljon kuin muut liikuntamuodot.»C. Jämfört med placebo minskar modafinil inte utmattning hos MS-patienter «Lumelääkkeeseen verrattuna modafiniili ei vähennä MS-tautia sairastavan potilaan uupumusta.»A och bör inte användas (se Avstå klokt-rekommendationen «Modafiniili MS-tautiin liittyvän uupumuksen hoidossa»7). Man kan göra ett försök med bupropion och venlafaxin, och även amantadin har använts för behandling av utmattning vid MS.
Vaccinationer
- Ett samband mellan vaccinationer och risken för MS eller försämringsskov vid MS har inte kunnat påvisas «Otero-Romero S, Lebrun-Frénay C, Reyes S, ym. ECTR...»169.
- Vaccinationsstatus för en person som insjuknat i MS bör kontrolleras och uppdateras så snart som möjligt efter att MS-diagnosen fastställts «Otero-Romero S, Lebrun-Frénay C, Reyes S, ym. ECTR...»169. Vaccinationsrekommendationerna har sammanställts i tabell «Vaccination av MS-patienter....»3.
- Alla MS-patienter rekommenderas vaccinationer enligt det nationella vaccinationsprogrammet.
- Om vaccinationer enligt vaccinationsprogrammet saknas, ska inaktiverade vaccin ges minst 2 veckor och levande försvagade vaccin (såsom MPR- och vattkoppsvaccin) 4–6 veckor innan läkemedelsbehandlingen inleds.
- Levande försvagade vaccin ska inte ges under läkemedelsbehandlingen av MS.
- Vaccin mot gula febern är ett levande försvagat vaccin. I en liten serie på 7 patienter var vaccinet förknippat med ett försämringsskov hos 5 patienter «Farez MF, Correale J. Yellow fever vaccination and...»170. Den ökade risken för försämringsskov kunde inte fastställas i ett senare registermaterial med 128 patienter, men risk-nytta-balansen för vaccinationen ska övervägas från fall till fall «Papeix C, Mazoyer J, Maillart E, ym. Multiple scle...»171.
- Antikroppar mot vattkoppsvirus (VZV) ska bestämmas innan behandling med alemtuzumab, fingolimod, kladribin, natalizumab, ofatumumab, okrelizumab, ponesimod eller rituximab inleds. Patienter med negativ eller svagt positiv antikroppsnivå och patienter som inte har tydliga bevis på tidigare exponering ska få immunisering med levande försvagat vattkoppsvaccin 4–6 veckor innan läkemedelsbehandlingen inleds «Reyes S, Ramsay M, Ladhani S, ym. Protecting peopl...»172.
- Pneumokockkonjugatvaccin rekommenderas för alla MS-patienter över 50 år som har över 6 EDSS-poäng, samt om högeffektiv läkemedelsbehandling av MS inleds. Rekombinant bältrosvaccination ska övervägas för personer över 50 år och före högeffektiva läkemedelsbehandlingar av MS. Hepatit B-vaccination rekommenderas om läkemedelsbehandling med hög effekt inleds och patienten hör till riskgrupperna för hepatit B och är HBsAg- och HBcAb-negativ «Otero-Romero S, Lebrun-Frénay C, Reyes S, ym. ECTR...»169, «Reyes S, Ramsay M, Ladhani S, ym. Protecting peopl...»172.
- Efter en kortisonpulsbehandling rekommenderas en väntetid på 3 månader före vaccination med levande försvagade virus (MPR, VZV) och 4 veckor före vaccination med inaktiverade vaccin «Ciotti JR, Valtcheva MV, Cross AH. Effects of MS d...»173.
- Läkemedel som påverkar sjukdomsförloppet vid MS begränsar inte användningen av inaktiverade
vaccin, men de kan försämra vaccinens effekt.
- Betainterferon och dimetylfumarat har minst inverkan på effekten av olika typer av vaccin. Natalizumab, glatirameracetat och teriflunomid försämrar influensavaccinets effekt i viss mån, men inte i betydande grad effekten av coronavaccin eller tetanusvaccin.
- Den mest försvagade responsen på olika vaccin har konstaterats hos patienter som behandlats med rituximab, okrelizumab och fingolimod. Ett förlängt infusionsintervall förbättrar vaccinsvaret hos patienter som använder rituximab «Asplund Högelin K, Ruffin N, Pin E, ym. B-cell rep...»174. Det finns ännu lite forskningsdata om de nyaste läkemedlen, såsom ofatumumab och ponesimod «Gold R, Fätkenheuer G, Hartung HP, ym. Vaccination...»175, «Faissner S, Heitmann N, Plaza-Sirvent C, ym. Immun...»176. Boostervaccin kan förbättra uppkomsten av antikroppar för både corona- och influensavaccin «Gold R, Fätkenheuer G, Hartung HP, ym. Vaccination...»175, «Sormani MP, Inglese M, Schiavetti I, ym. Effect of...»177, «Olberg HK, Eide GE, Cox RJ, ym. Antibody response ...»178.
- Det är att rekommendera att de vaccinationer som behövs efter behandling med kladribin och alemtuzumab planeras till en tidpunkt då lymfocythalterna har återställts så att normala vaccinationsresponser är möjliga.
- Patienter som genomgått en stamcellstransplantation förlorar tidigare vaccinresponser och behöver ett fullständigt ombyggt vaccinationsprogram «Gold R, Fätkenheuer G, Hartung HP, ym. Vaccination...»175.
- För att optimera vaccinsvaret rekommenderas vaccination några veckor före följande infusion av ett CD20-monoklonalt läkemedel i stället för vaccination strax efter infusionen. Det T-cellmedierade vaccinsvaret bevaras dock under dessa behandlingar och det är inte motiverat att fördröja behandlingen med flera månader.
| * alemtuzumab, fingolimod, kladribin, natalizumab, ofatumumab, okrelizumab, ponesimod
eller rituximab ** Effekten kan vara nedsatt särskilt hos patienter som behandlats med B-cellsläkemedel och sfingosinreceptorhämmare, vid behov antikroppsbestämning och/eller boosterdos av vaccinet. *** Pneumokockvaccin hör till det nationella vaccinationsprogrammet för patienter som får behandling med rituximab och okrelizumab |
|
| Rekommenderas innan läkemedelsbehandlingen inleds | |
|---|---|
| Vaccin enligt det nationella vaccinationsprogrammet för vuxna | Inaktiverade ≥ 2 veckor innan Levande försvagade ≥ 4–6 veckor innan |
| Vaccin mot vattkoppor (om VZV-antikroppar saknas) | ≥ 4–6 veckor innan behandlingen inleds med högeffektiva läkemedel* |
| Pneumokockkonjugatvaccin (20-valent)*** | Patienter över 50 år med EDSS-poäng över 6 samt patienter som börjar använda högeffektiva läkemedel |
| Bör övervägas innan läkemedelsbehandling inleds | |
| Rekombinant bältrosvaccin | Personer över 50 år, patienter som inleder högeffektiva läkemedelsbehandlingar |
| Hepatiitti B -rokote | Hepatit B-riskgrupper, personer som inleder högeffektiva läkemedelsbehandlingar |
| Rekommenderas under läkemedelsbehandling | |
| Vaccin mot difteri och stelkramp (dT) | Oberoende av läkemedelsbehandling** för personer som fått grundvaccinserien vid 45 och 65 års ålder och därefter med 10 års mellanrum |
| Influensavaccin årligen | Oberoende av läkemedelsbehandling** |
| Levande försvagade GES EJ | Oberoende av läkemedelsbehandling |
MS hos barn
- MS hos barn (pediatric onset MS) innebär att sjukdomen bryter ut före 18 års ålder.
- MS hos barn är sällsynt.
- I västvärlden får cirka 5 % av MS-patienterna diagnosen före 18 års ålder och incidensen i denna åldersgrupp är 0,2–2,85/100 000 «Alroughani R, Boyko A. Pediatric multiple sclerosi...»179, «Waldman A, Ness J, Pohl D, ym. Pediatric multiple ...»180.
- Endast 1 % av MS-patienterna får de första symtomen när de är under 10 år «Waldman A, Ness J, Pohl D, ym. Pediatric multiple ...»180.
- Diagnostiken och behandlingen av MS hos barn har koncentrerats till universitetssjukhusen.
- Det nationella MS-registret bör användas också för uppföljning av MS hos barn.
- McDonalds diagnostiska kriterier från år 2017 fungerar väl också för barn.
- I två olika material var den prognostiserade precisionen 71–87 %, specificiteten cirka 95 % och sensitiviteten 71–84 % «Hacohen Y, Brownlee W, Mankad K, ym. Improved perf...»181, «Fadda G, Brown RA, Longoni G, ym. MRI and laborato...»182.
- I differentialdiagnostiken är det viktigt att särskilt beakta MOG-antikroppspositiva demyeliniseringssjukdomar (MOGAD).
- MS-typen hos barn är skovvis förlöpande hos över 97 %.
- MS hos barn är inflammatoriskt aktivare än hos vuxna.
- I den första MRT-undersökningen kan man konstatera fler förändringar än hos vuxna patienter «Waubant E, Chabas D, Okuda DT, ym. Difference in d...»183, och skov förekommer 2–3 gånger oftare «Benson LA, Healy BC, Gorman MP, ym. Elevated relap...»184.
- I början av sjukdomen förekommer residualsymtom mer sällan än hos vuxna, vilket anses bero på hjärnans bättre förmåga att producera myelin och den ökade formbarheten hos hjärnan som ännu utvecklas «Chitnis T, Aaen G, Belman A, ym. Improved relapse ...»185.
- Hos personer som insjuknat i MS som barn kan den typiska förväntade hjärnvolymen eventuellt inte uppnås i vuxen ålder «Aubert-Broche B, Fonov V, Narayanan S, ym. Onset o...»186, och kognitiva svårigheter kan förekomma redan i början av sjukdomen «Amato MP, Goretti B, Ghezzi A, ym. Cognitive and p...»187.
- MS framskrider långsammare hos barn än hos vuxna, men eftersom sjukdomen börjar tidigare, uppnås en nedsatt funktionsförmåga på nivån EDSS 6,0 i genomsnitt 10 år tidigare än hos vuxna patienter (vid 45 års ålder vs 54 års ålder) «Ghezzi A, Pozzilli C, Liguori M, ym. Prospective s...»188, «Renoux C, Vukusic S, Mikaeloff Y, ym. Natural hist...»189, «Harding KE, Liang K, Cossburn MD, ym. Long-term ou...»190.
- Det är viktigt att inleda en tidig och tillräckligt effektiv läkemedelsbehandling
även i denna åldersgrupp «Sandesjö F, Wassmer E, Deiva K, ym. Current intern...»191.
- Tills vidare har bara en officiell rekommendation av en expertarbetsgrupp publicerats (2012), och i den rekommenderas att påbörja glatirameracetat eller betainterferon «Chitnis T, Tenembaum S, Banwell B, ym. Consensus s...»192.
- Största delen av erfarenheterna av läkemedelsbehandling av MS hos barn har fåtts från
öppna studier «Chitnis T, Tenembaum S, Banwell B, ym. Consensus s...»192.
- I en öppen andra fasens studie av dimetylfumarat (FOCUS, fortsatt uppföljning CONNECTED) konstaterades att läkemedlet är säkert även hos barn och unga (vikt över 30 kg) och att effekten motsvarar den effekt som konstaterats hos vuxna patienter «Alroughani R, Das R, Penner N, ym. Safety and Effi...»193, «Alroughani R, Huppke P, Mazurkiewicz-Beldzinska M,...»194.
- Även randomiserade placebokontrollerade läkemedelsstudier har gjorts:
- I PARADIGMS-studien som publicerades 2018 konstaterades att fingolimod minskar antalet årliga relapser med 82 % jämfört med betainterferon i denna åldersgrupp «Chitnis T, Arnold DL, Banwell B, ym. Trial of Fing...»195.
- I TERIKIDS-studien som publicerades 2021 minskade teriflunomid antalet årliga relapser med 34 % jämfört med placebo, men skillnaden var inte statistiskt signifikant «Chitnis T, Banwell B, Kappos L, ym. Safety and eff...»196.
- De europeiska läkemedelsmyndigheterna har godkänt betainterferon för användning från 2 års ålder och glatirameracetat från 12 års ålder samt fingolimod och teriflunomid från 10 års ålder.
- Man bör notera risken för rebound vid avslutande av fingolimod (se Rebound «A3»4). Fingolimod ska användas med stor eftertanke hos flickor som kan ha graviditetsplaner, eftersom läkemedlet då alltid måste avslutas.
- Senast i puberteten kan minderåriga till sitt immunförsvarssystem och sin vikt jämföras
med vuxna, varvid man i regel kan använda MS-läkemedel enligt samma principer som
hos vuxna. Vid medicinering av yngre barn ska individuell prövning användas, om officiellt
godkännande saknas.
- Det finns till exempel rikligt med observationsstudier gällande natalizumab och rituximab, där biverkningsprofilerna och effektiviten inte skiljt sig från dem man ser hos vuxna «Krysko KM, Graves J, Rensel M, ym. Use of newer di...»197, «Ghezzi A, Banwell B, Bar-Or A, ym. Rituximab in pa...»198, «Kornek B, Aboul-Enein F, Rostasy K, ym. Natalizuma...»199.
Yrkesinriktad och medicinsk rehabilitering för MS-patienter
- I Finland är 37 % av alla samhälleliga kostnader för MS relaterade till produktionsförluster orsakade av sjukpensioner «Ruutiainen J, Viita AM, Hahl J, ym. Burden of illn...»200.
- Av dem som fick en MS-diagnos i Sverige 2001–2012 gick 12 % i sjukpension inom ett år och 55 % inom elva år. Bland jämförelsebefolkningen i samma ålder och av samma kön var motsvarande siffror 7 % och 9 % «Landfeldt E, Castelo-Branco A, Svedbom A, ym. Sick...»201. I en finländsk studie fick personer som fått MS-diagnosen före 1995 invalidpension i genomsnitt 8,3 år efter diagnosen, medan personer som fått diagnosen efter 1995 fick invalidpension i genomsnitt efter 11,1 år «Heinonen T, Castrén E, Luukkaala T, ym. The retire...»202.
- MS-patienternas förmåga att klara sig i arbetslivet kan främjas genom rehabilitering, läkemedelsbehandling och arbetsarrangemang «Heinonen T, Castrén E, Luukkaala T, ym. The retire...»202, «Wickström A, Fagerström M, Wickström L, ym. The im...»203.
- Rehabilitering, vars mål är att förbättra arbets- och funktionsförmågan, är en del av helhetsbehandlingen av MS «Ruutiainen J, Wikström J, Sivenius J. Etenevät neu...»204, «Amatya B, Khan F, Galea M. Rehabilitation for peop...»205, «Abou L, Qin K, Alluri A, ym. The effectiveness of ...»206, «Binshalan T, Nair KPS, McNeill A. The Effectivenes...»207, «Centonze D, Leocani L, Feys P. Advances in physica...»208.
Yrkesinriktad rehabilitering
- Med yrkesinriktad rehabilitering avses de metoder med vilka rehabiliteringsklienten kan stödas i arbetet.
- Faktorer som indikerar att en MS-patient kan klara sig bra i arbetslivet är ett skovvis förlöpande sjukdomsförlopp, en hög utbildningsnivå och ett fysiskt lätt arbete «Messmer Uccelli M, Specchia C, Battaglia MA, ym. F...»209.
- I en finländsk studie identifierades högre ålder vid diagnostidpunkten och manligt kön som riskfaktorer för tidig pensionering. Dessutom var risken för tidig pensionering högre hos de patienter med skovvis förlöpande MS som aldrig använt läkemedel som modifierar sjukdomsförloppet «Heinonen T, Castrén E, Luukkaala T, ym. The retire...»202.
- I ett finländskt material observerades att personer med MS fortfarande sällan remitteras till neuropsykologisk eller yrkesinriktad rehabilitering «Castrén E, Heinonen T, Mäkinen K, ym. The rate of ...»210.
- Vid bedömning av arbetsförmågan hos MS-patienter som är i arbetslivet bör företagshälsovården och primärvården eller den specialiserade sjukvården samarbeta: den behandlande neurologen eller hälsocentralläkaren bedömer sjukdomens prognos och inverkan på arbetstagarens funktionsförmåga vid behov multiprofessionellt, och en företagsläkare som känner till arbetsförhållandena bedömer arbetstagarens återstående arbetsförmåga i förhållande till de krav patientens arbete ställer «Työterveyshuoltolaki 1383/2001, https://www.finlex...»211.
- Utlåtanden till myndigheterna om arbetsförmågan och den yrkesinriktade rehabiliteringen hos MS-patienter utfärdas från företagshälsovården när patienten har tillgång till sådan och i andra fall (bl.a. arbetslösa, studerande, föräldralediga samt privatföretagare) från primärvården eller den specialiserade sjukvården.
- Företagshälsovården ska kopplas till uppföljningen av hälsotillståndet hos en MS-patient så tidigt som möjligt.
- Anpassning av arbetet ska beaktas i god tid. Mycket enkla faktorer, såsom tillgänglighet, svala arbetsutrymmen och bra tillgång till toaletter samt möjlighet till distansarbete kan vara avgörande för att upprätthålla arbetsförmågan.
- Vid utredningen av rehabiliteringsbehoven är det skäl att agera snabbt och beakta olika möjligheter till yrkesinriktad rehabilitering för att upprätthålla arbetsförmågan. Särskilt när arbetsoförmågan blivit långvarig är det viktigt att bedöma arbetstagarens möjligheter att återgå till arbetet.
- Om patientens arbetsförmåga inte kan förbättras med hjälp av arbetsanpassning och rehabiliteringsåtgärder så att den motsvarar kraven för heltidsarbete, är förkortad arbetstid med hjälp av delinvalidpension eller handikappbidrag ofta den rätta lösningen.
Medicinsk rehabilitering
- Till den medicinska rehabiliteringen hör
- rehabiliteringsrådgivning och -handledning
- bedömning av funktions- och arbetsförmågan samt rehabiliteringsbehovet
- en rehabiliteringsundersökning för att utreda rehabiliteringsmöjligheterna
- terapier och andra nödvändiga åtgärder som syftar till att förbättra och upprätthålla funktionsförmågan
- hjälpmedelstjänster
- anpassningsträning
- rehabiliteringsperioder inom institutions- eller öppenvården.
- Ansvaret för att ordna medicinsk rehabilitering ligger hos välfärdsområdena «Terveydenhuoltolaki 30.12.2010/1326, https://www.f...»212, «Valtakunnaliset lääkinnällisen kuntoutuksen ohjaam...»213. Primärvården, den specialiserade sjukvården, den privata sektorn och tredje sektorn kan fungera som rehabiliteringsproducenter.
- Rehabiliteringsplanen utarbetas tillsammans med patienten och så långt möjligt i en multiprofessionell arbetsgrupp.
- FPA ordnar lagstadgad krävande medicinsk rehabilitering för MS-patienter under 65 år i de fall de allmänna kriterierna för att bevilja denna uppfylls, samt därtill rehabilitering enligt prövning «Laki Kansaneläkelaitoksen kuntoutusetuuksista ja k...»214.
- Till MS-patientens rehabiliteringskedja hör god tidig information om sjukdomen, tillräcklig anpassningsträning i rätt tid, motionsrådgivning samt individuell och multiprofessionell rehabilitering utgående från observerade behov. Rehabiliteringen kan genomföras som individuell eller grupprehabilitering enligt rehabiliteringsklientens individuella behov.
- Det är viktigt att komma överens om ett tydligt rehabiliteringsmål och att bedöma hur målet skall uppnås i samråd mellan den som ansvarar för rehabiliteringen och rehabiliteringsklienten.
- Rehabiliteringsplanen ska grunda sig på graden av nedsatt funktionsförmåga på grund av sjukdom samt på patientens rehabiliterbarhet. För rehabiliteringen ska uppställas mål som är betydelsefulla i vardagen och som uttrycker patientens eget engagemang. Resultaten av den medicinska rehabiliteringen ska utvärderas regelbundet. Medicinsk rehabilitering som visar sig vara ineffektiv bör avbrytas. Vid en långt framskriden sjukdom framhävs betydelsen av rehabiliterande vårdarbete.
- Motion verkar förbättra den motoriska funktionsförmågan hos personer med MS «Liikunta ilmeisesti parantaa MS-tautia sairastavan motorista toimintakykyä.»B och minskar utmattning i samband med MS «Liikunta ilmeisesti vähentää MS-tautiin liittyvää uupumusta.»B. Det finns sannolikt inga signifikanta skillnader mellan olika motionsformer. Pilates kan minska den utmattning som en person med MS upplever och förbättra den fysiska funktionsförmågan och livskvaliteten lika mycket som andra motionsformer «Pilates saattaa vähentää MS-tautia sairastavan kokemaa uupumusta ja parantaa fyysistä toimintakykyä ja elämänlaatua yhtä paljon kuin muut liikuntamuodot.»C.
- Robotassisterad gångträning ökar gångförmågan på kort sikt lika mycket som traditionell gångträning hos MS-patienter med klart nedsatt funktionsförmåga «Robottiavusteinen kävelyharjoittelu parantaa kävelykykyä lyhyellä aikavälillä yhtä paljon kuin perinteinen kävelyharjoittelu sellaisilla MS-tautia sairastavilla henkilöillä, joiden toimintakyky on selkeästi heikentynyt.»A.
- Individuell fysioterapi kan förbättra och upprätthålla MS-patientens funktionsförmåga, åtminstone om sjukdomen medför tydliga funktionella men «Sosiaali- ja terveysturvan tutkimuksia 161. Toim. ...»215.
- Träning av muskulaturen i bäckenbotten verkar minska urineringssymtom i anslutning till MS (såsom urininkontinens och symtom på överaktiv urinblåsa) samt de olägenheter de orsakar jämfört med om övningar inte görs «Lantionpohjan lihasharjoittelu ilmeisesti vähentää MS-tautiin liittyviä virtsaamisoireita, kuten virtsankarkailua ja yliaktiivisen virtsarakon oireita, sekä näiden haittaavuutta harjoittelemattomuuteen verrattuna.»B.
- Multiprofessionell institutionsrehabilitering kan förbättra den fysiska funktionsförmågan hos en MS-patient med nedsatt funktionsförmåga på kort sikt jämfört med att patienten inte deltar i någon som helst rehabilitering «Moniammatillinen laitoskuntoutus saattaa parantaa toimintakyvyltään heikentyneen MS-potilaan fyysistä toimintakykyä lyhyellä aikavälillä verrattuna siihen, ettei potilas osallistu mihinkään kuntoutukseen.»C.
- Distansrehabilitering som grundar sig på tekniska tillämpningar verkar förbättra den fysiska aktiviteten och den motoriska funktionsförmågan hos personer med MS «Teknologisiin sovelluksiin perustuva etäkuntoutus ilmeisesti parantaa MS-tautia sairastavien henkilöiden fyysistä aktiivisuutta ja motorista toimintakykyä.»B.
- Neuropsykologisk rehabilitering kan förbättra den kognitiva prestationen och minska de kognitiva symtomen vid MS «Neuropsykologinen kuntoutus saattaa kohentaa kognitiivista suoritusta ja vähentää kognitiivisia oireita MS-taudissa.»C. Rehabiliteringen kan åtminstone delvis genomföras på distans «Lampit A, Heine J, Finke C, ym. Computerized Cogni...»216.
- Ergoterapi kan förbättra funktionen i övre extremiteterna hos patienter med MS «Toimintaterapia saattaa parantaa yläraajan toimintaa potilailla, joilla on MS-tauti.»C.
- Det finns ingen evidens för andra terapiformers effekt i rehabiliteringen av personer med MS.
Egenvård vid MS
- Rökning är en riskfaktor för både insjuknande i MS och sjukdomens progression «Wu J, Olsson T, Hillert J, ym. Influence of oral t...»217. Även passiv rökning ökar risken för progression av MS «Wu J, Olsson T, Hillert J, ym. Influence of oral t...»217. Avvänjning från tobak är därför en central del av behandlingen av MS. Om patienten slutar röka minskar risken för att MS-sjukdomen framskrider och blir lika stor som hos de MS-patienter som aldrig rökt «Rodgers J, Friede T, Vonberg FW, ym. The impact of...»218. Rökningens negativa inverkan på MS beror inte på nikotin, varför en person med MS vid behov kan använda nikotinpreparat för avvänjning från tobak «Wu J, Olsson T, Hillert J, ym. Influence of oral t...»217, (se God medicinsk praxis-rekommendationen Tobaks- och nikotinberoende – profylax och behandling «Tobaks- och nikotinberoende – profylax och behandling»5), «Tupakka- ja nikotiiniriippuvuuden ehkäisy ja hoito...»219.
- D-vitaminbrist har identifierats som en riskfaktor för MS «Munger KL, Hongell K, Åivo J, ym. 25-Hydroxyvitami...»220. I observationsstudier har en liten D-vitaminhalt i serum haft samband med en ökad risk för skov «Ascherio A, Munger KL, White R, ym. Vitamin D as a...»221. D-vitamintillskott kan minska sjukdomsaktiviteten som konstateras med magnetundersökning vid skovvis förlöpande MS «D-vitamiinilisä saattaa vähentää aaltomaisen MS-taudin magneettikuvauksella todettavaa tautiaktiviteettia.»C.
- MS är förknippad med en förhöjd risk för osteoporos, och D-vitaminbrist är en riskfaktor för osteoporos «Åivo J, Kurki S, Sumelahti ML, ym. Risk of osteopo...»222. Det rekommenderas att D-vitaminhalten hos en person som insjuknat i MS bestäms och att D-vitaminbrist (kalcidiol D-25 under 50 nmol/l) behandlas «Boltjes R, Knippenberg S, Gerlach O, ym. Vitamin D...»223. Målsättningen för kalcidiolhalten för personer med osteoporos är 75–120 nmol/l (se God medicinsk praxis-rekommendationen Osteoporoosi «Osteoporoosi»6; Osteoporos «Osteoporos»7), «Osteoporoosi. Käypä hoito -suositus. Suomalaisen L...»224.
- Den rekommenderade dosen D-vitamin är 50 μg/dygn. Enligt en studie av finländska MS-patienter var dosen säker och ökade de flesta patienters kalcidiolhalt till den rekommenderade nivån «Soilu-Hänninen M, Åivo J, Lindström BM, ym. A rand...»225. Myndigheterna har fastställt gränsen för ett säkert intag till 100 μg/dygn «Paakkari I. D-vitamiini. www.terveyskirjasto.fi. L...»226.
- Regelbunden motion är hörnstenen i egenvården. På basis av forskningsevidens bör en MS-patient röra på sig åtminstone enligt de allmänna hälsorekommendationerna, dvs. tre gånger i veckan i minst 30 minuter. Det är inte känt att ens en stor mängd motion skulle försämra MS. Motion kan förbättra den fysiska funktionsförmågan hos personer med MS samt minska utmattning (se punkten Medicinsk rehabilitering «A8»9). Under motionen kan kroppstemperaturen stiga och hos en del patienter kan Uthoffs fenomen uppstå, där gamla neurologiska bristsymtom accentueras tillfälligt. Fenomenet är ofarligt och går tillbaka när kroppstemperaturen sjunker. Det finns sannolikt inga väsentliga skillnader mellan olika motionsformer (se punkten Medicinsk rehabilitering «A8»9). Det väsentliga är att hitta en motionsform som patienten tycker om.
- MS kan påverka munhälsan och munhälsan kan påverka MS. I en färsk översikt har MS-patienter konstaterats ha nedsatt munhygien och därmed ökad risk för hål i tänderna och gingivit. Obehandlade ökar dessa riskerna för att insjukna i en inflammation i munnens stödjevävnader, dvs. parodontit «Manchery N, Henry JD, Nangle MR. A systematic revi...»227. Infektioner i munnen kan öka risken för skov. Personer med MS ska dagligen mekaniskt rengöra tänderna och tandmellanrummen och se till att tandsten regelbundet avlägsnas.
- Det finns ingen specifik kostbehandling för MS och på basen av nuvarande forskningsevidens kan man inte direkt påverka sjukdomsförloppet med hjälp av kosten.
Ekonomisk information
- Se effekten av FPA:s specialersättningsgilla läkemedel för aktiv skovvis förlöpande MS jämfört med placebo och årspriset «hoi36070a.pdf»1, mer information «The effectiveness and costs of disease-modifying therapies for relapsing-remitting multiple sclerosis»1 och en video om hur man läser tabellen «Hoitovasteen kustannukset Käypä hoito -suosituksissa: näin luen taulukoita (video)»8.
- I regel är det skäl att använda det förmånligaste preparatet vid valet av läkemedel och det finns ingen anledning att göra en anteckning om bytesförbud i recept.
Arbetsgrupp tillsatt av Finska Läkarföreningen Duodecim och Neurologiska föreningen i Finland
För mer information om arbetsgruppsmedlemmar samt anmälan om intressekonflikter, se «MS-tauti»1 (på finska)
Översättare: Lingsoft Language Services Oy
Granskning av översättningen: Peter Nyberg
Litteratur
Multipel skleros (MS). God medicinsk praxis-rekommendation. Arbetsgrupp tillsatt av Finska Läkarföreningen Duodecim och Neurologiska föreningen i Finland. Helsingfors: Finska Läkarföreningen Duodecim, 2024 (hänvisning dd.mm.åååå). Tillgänglig på internet: www.kaypahoito.fi
Närmare anvisningar: «https://www.kaypahoito.fi/sv/god-medicinsk-praxis/nyttjanderattigheter/citering»2
Ansvarsbegränsning
God medicinsk praxis- och Avstå klokt-rekommendationerna är sammandrag gjorda av experter gällande diagnostik och behandling av bestämda sjukdomar. Rekommendationerna fungerar som stöd när läkare eller andra yrkesutbildade personer inom hälso- och sjukvården ska fatta behandlingsbeslut. De ersätter inte läkarens eller annan hälsovårdspersonals egen bedömning av vilken diagnostik, behandling och rehabilitering som är bäst för den enskilda patienten då behandlingsbeslut fattas.
Litteratur
- Ruutiainen J, Tienari P. MS-tauti ja muut demyelinaatiosairaudet. Kirjassa: Neurologia, toimittaneet Soinila S, Kaste M, Somer H. Duodecim 2006;379-94
- Thompson AJ, Banwell BL, Barkhof F, ym. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol 2018;17(2):162-173 «PMID: 29275977»PubMed
- Ziemssen T, Bhan V, Chataway J, ym. Secondary Progressive Multiple Sclerosis: A Review of Clinical Characteristics, Definition, Prognostic Tools, and Disease-Modifying Therapies. Neurol Neuroimmunol Neuroinflamm 2023;10(1): «PMID: 36414428»PubMed
- Miller DH, Leary SM. Primary-progressive multiple sclerosis. Lancet Neurol 2007;6(10):903-12 «PMID: 17884680»PubMed
- Wattjes MP, Ciccarelli O, Reich DS, ym. 2021 MAGNIMS-CMSC-NAIMS consensus recommendations on the use of MRI in patients with multiple sclerosis. Lancet Neurol 2021;20(8):653-670 «PMID: 34139157»PubMed
- Abdelhak A, Hottenrott T, Mayer C, ym. CSF profile in primary progressive multiple sclerosis: Re-exploring the basics. PLoS One 2017;12(8):e0182647 «PMID: 28797088»PubMed
- Rovira À, Wattjes MP, Tintoré M, ym. Evidence-based guidelines: MAGNIMS consensus guidelines on the use of MRI in multiple sclerosis-clinical implementation in the diagnostic process. Nat Rev Neurol 2015;11(8):471-82 «PMID: 26149978»PubMed
- Filippi M, Preziosa P, Arnold DL, ym. Present and future of the diagnostic work-up of multiple sclerosis: the imaging perspective. J Neurol 2023;270(3):1286-1299 «PMID: 36427168»PubMed
- Sati P, Oh J, Constable RT, ym. The central vein sign and its clinical evaluation for the diagnosis of multiple sclerosis: a consensus statement from the North American Imaging in Multiple Sclerosis Cooperative. Nat Rev Neurol 2016;12(12):714-722 «PMID: 27834394»PubMed
- Castellaro M, Tamanti A, Pisani AI, ym. The Use of the Central Vein Sign in the Diagnosis of Multiple Sclerosis: A Systematic Review and Meta-analysis. Diagnostics (Basel) 2020;10(12): «PMID: 33260401»PubMed
- Harrison DM, Oh J, Roy S, ym. Thalamic lesions in multiple sclerosis by 7T MRI: Clinical implications and relationship to cortical pathology. Mult Scler 2015;21(9):1139-50 «PMID: 25583851»PubMed
- Polman CH, Reingold SC, Banwell B, ym. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. Ann Neurol 2011;69(2):292-302 «PMID: 21387374»PubMed
- Boscá I, Magraner MJ, Coret F, ym. The risk of relapse after a clinically isolated syndrome is related to the pattern of oligoclonal bands. J Neuroimmunol 2010;226(1-2):143-6 «PMID: 20538349»PubMed
- Bernitsas E, Khan O, Razmjou S, ym. Cerebrospinal fluid humoral immunity in the differential diagnosis of multiple sclerosis. PLoS One 2017;12(7):e0181431 «PMID: 28727770»PubMed
- Cole SR, Beck RW, Moke PS, ym. The predictive value of CSF oligoclonal banding for MS 5 years after optic neuritis. Optic Neuritis Study Group. Neurology 1998;51(3):885-7 «PMID: 9748050»PubMed
- Imrell K, Landtblom AM, Hillert J, ym. Multiple sclerosis with and without CSF bands: clinically indistinguishable but immunogenetically distinct. Neurology 2006;67(6):1062-4 «PMID: 17000979»PubMed
- McLean BN, Luxton RW, Thompson EJ. A study of immunoglobulin G in the cerebrospinal fluid of 1007 patients with suspected neurological disease using isoelectric focusing and the Log IgG-Index. A comparison and diagnostic applications. Brain 1990;113 ( Pt 5)():1269-89 «PMID: 2245296»PubMed
- Link H, Kostulas V. Utility of isoelectric focusing of cerebrospinal fluid and serum on agarose evaluated for neurological patients. Clin Chem 1983;29(5):810-5 «PMID: 6839458»PubMed
- Giles PD, Heath JP, Wroe SJ. Oligoclonal bands and the IgG index in multiple sclerosis: uses and limitations. Ann Clin Biochem 1989;26 ( Pt 4)():1317-23 «PMID: 2764482»PubMed
- Sola P, Mandrioli J, Simone AM, ym. Primary progressive versus relapsing-onset multiple sclerosis: presence and prognostic value of cerebrospinal fluid oligoclonal IgM. Mult Scler 2011;17(3):303-11 «PMID: 21078694»PubMed
- Lublin FD, Reingold SC, Cohen JA, ym. Defining the clinical course of multiple sclerosis: the 2013 revisions. Neurology 2014;83(3):278-86 «PMID: 24871874»PubMed
- Solomon AJ, Pettigrew R, Naismith RT, ym. Challenges in multiple sclerosis diagnosis: Misunderstanding and misapplication of the McDonald criteria. Mult Scler 2021;27(2):250-258 «PMID: 32162581»PubMed
- Thompson AJ, Baranzini SE, Geurts J, ym. Multiple sclerosis. Lancet 2018;391(10130):1622-1636 «PMID: 29576504»PubMed
- Banwell B, Bennett JL, Marignier R, ym. Diagnosis of myelin oligodendrocyte glycoprotein antibody-associated disease: International MOGAD Panel proposed criteria. Lancet Neurol 2023;22(3):268-282 «PMID: 36706773»PubMed
- Maunula A, Martola J, Atula S, ym. Incidental demyelination in magnetic resonance imaging and 10-year risk of multiple sclerosis: A data lake cohort study. Eur J Neurol 2023;30(8):2376-2384 «PMID: 37158298»PubMed
- Wiendl H, Gold R, Berger T, ym. Multiple Sclerosis Therapy Consensus Group (MSTCG): position statement on disease-modifying therapies for multiple sclerosis (white paper). Ther Adv Neurol Disord 2021;14():17562864211039648 «PMID: 34422112»PubMed
- Medicinrådets behandlingsvejledning vedrørende lægemidler til attakvis multipel sklerose. Medicinrådet. 2022. PDF-dokumentti. viitattu 9.12.2022. https://medicinraadet.dk/media/ezamqbey/medicinr%C3%A5dets-behandlingsvejledning-vedr%C3%B8rende-l%C3%A6gemidler-til-attakvis-multipel-sklerose-version-2-0-adlegacy.pdf «https://medicinraadet.dk/media/ezamqbey/medicinr%C3%A5dets-behandlingsvejledning-vedr%C3%B8rende-l%C3%A6gemidler-til-attakvis-multipel-sklerose-version-2-0-adlegacy.pdf»3
- Minneboo A, Barkhof F, Polman CH, ym. Infratentorial lesions predict long-term disability in patients with initial findings suggestive of multiple sclerosis. Arch Neurol 2004;61(2):217-21 «PMID: 14967769»PubMed
- Tintore M, Rovira A, Arrambide G, ym. Brainstem lesions in clinically isolated syndromes. Neurology 2010;75(21):1933-8 «PMID: 21098409»PubMed
- Cordonnier C, de Seze J, Breteau G, ym. Prospective study of patients presenting with acute partial transverse myelopathy. J Neurol 2003;250(12):1447-52 «PMID: 14673577»PubMed
- Kurtzke JF. Rating neurologic impairment in multiple sclerosis: an expanded disability status scale (EDSS). Neurology 1983;33(11):1444-52 «PMID: 6685237»PubMed
- Laakso SM, Viitala M, Kuusisto H, ym. Multiple sclerosis in Finland 2018-Data from the national register. Acta Neurol Scand 2019;140(5):303-311 «PMID: 31271648»PubMed
- Filippi M, Amato MP, Centonze D, ym. Early use of high-efficacy disease‑modifying therapies makes the difference in people with multiple sclerosis: an expert opinion. J Neurol 2022;269(10):5382-5394 «PMID: 35608658»PubMed
- Stankiewicz JM, Weiner HL. An argument for broad use of high efficacy treatments in early multiple sclerosis. Neurol Neuroimmunol Neuroinflamm 2020;7(1): «PMID: 31757815»PubMed
- Scalfari A, Neuhaus A, Daumer M, ym. Onset of secondary progressive phase and long-term evolution of multiple sclerosis. J Neurol Neurosurg Psychiatry 2014;85(1):67-75 «PMID: 23486991»PubMed
- Chalmer TA, Baggesen LM, Nørgaard M, ym. Early versus later treatment start in multiple sclerosis: a register-based cohort study. Eur J Neurol 2018;25(10):1262-e110 «PMID: 29847005»PubMed
- Weideman AM, Tapia-Maltos MA, Johnson K, ym. Meta-analysis of the Age-Dependent Efficacy of Multiple Sclerosis Treatments. Front Neurol 2017;8():577 «PMID: 29176956»PubMed
- Hauser SL, Bar-Or A, Comi G, ym. Ocrelizumab versus Interferon Beta-1a in Relapsing Multiple Sclerosis. N Engl J Med 2017;376(3):221-234 «PMID: 28002679»PubMed
- Hauser SL, Bar-Or A, Cohen JA, ym. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med 2020;383(6):546-557 «PMID: 32757523»PubMed
- Svenningsson A, Frisell T, Burman J, ym. Safety and efficacy of rituximab versus dimethyl fumarate in patients with relapsing-remitting multiple sclerosis or clinically isolated syndrome in Sweden: a rater-blinded, phase 3, randomised controlled trial. Lancet Neurol 2022;21(8):693-703 «PMID: 35841908»PubMed
- Starvaggi Cucuzza C, Longinetti E, Ruffin N, ym. Sustained Low Relapse Rate With Highly Variable B-Cell Repopulation Dynamics With Extended Rituximab Dosing Intervals in Multiple Sclerosis. Neurol Neuroimmunol Neuroinflamm 2023;10(1): «PMID: 36411076»PubMed
- Vollmer BL, Wallach AI, Corboy JR, ym. Serious safety events in rituximab-treated multiple sclerosis and related disorders. Ann Clin Transl Neurol 2020;7(9):1477-1487 «PMID: 32767531»PubMed
- Fox RJ, Miller DH, Phillips JT, ym. Placebo-controlled phase 3 study of oral BG-12 or glatiramer in multiple sclerosis. N Engl J Med 2012;367(12):1087-97 «PMID: 22992072»PubMed
- Kappos L, Gold R, Miller DH, ym. Efficacy and safety of oral fumarate in patients with relapsing-remitting multiple sclerosis: a multicentre, randomised, double-blind, placebo-controlled phase IIb study. Lancet 2008;372(9648):1463-72 «PMID: 18970976»PubMed
- Gold R, Kappos L, Arnold DL, ym. Placebo-controlled phase 3 study of oral BG-12 for relapsing multiple sclerosis. N Engl J Med 2012;367(12):1098-107 «PMID: 22992073»PubMed
- Gold R, Arnold DL, Bar-Or A, ym. Long-term effects of delayed-release dimethyl fumarate in multiple sclerosis: Interim analysis of ENDORSE, a randomized extension study. Mult Scler 2017;23(2):253-265 «PMID: 27207449»PubMed
- Naismith RT, Wundes A, Ziemssen T, ym. Diroximel Fumarate Demonstrates an Improved Gastrointestinal Tolerability Profile Compared with Dimethyl Fumarate in Patients with Relapsing-Remitting Multiple Sclerosis: Results from the Randomized, Double-Blind, Phase III EVOLVE-MS-2 Study. CNS Drugs 2020;34(2):185-196 «PMID: 31953790»PubMed
- Butzkueven H, Kappos L, Wiendl H, ym. Long-term safety and effectiveness of natalizumab treatment in clinical practice: 10 years of real-world data from the Tysabri Observational Program (TOP). J Neurol Neurosurg Psychiatry 2020;91(6):660-668 «PMID: 32234967»PubMed
- Bigaut K, Fabacher T, Kremer L, ym. Long-term effect of natalizumab in patients with RRMS: TYSTEN cohort. Mult Scler 2021;27(5):729-741 «PMID: 32643521»PubMed
- Prosperini L, Kinkel RP, Miravalle AA, ym. Post-natalizumab disease reactivation in multiple sclerosis: systematic review and meta-analysis. Ther Adv Neurol Disord 2019;12():1756286419837809 «PMID: 30956686»PubMed
- Joly M, Conte C, Cazanave C, ym. Progressive multifocal leukoencephalopathy: epidemiology and spectrum of predisposing conditions. Brain 2023;146(1):349-358 «PMID: 35779271»PubMed
- Ho PR, Koendgen H, Campbell N, ym. Risk of natalizumab-associated progressive multifocal leukoencephalopathy in patients with multiple sclerosis: a retrospective analysis of data from four clinical studies. Lancet Neurol 2017;16(11):925-933 «PMID: 28969984»PubMed
- Ryerson LZ, Foley J, Chang I, ym. Risk of natalizumab-associated PML in patients with MS is reduced with extended interval dosing. Neurology 2019;93(15):e1452-e1462 «PMID: 31515290»PubMed
- Plavina T, Subramanyam M, Bloomgren G, ym. Anti-JC virus antibody levels in serum or plasma further define risk of natalizumab-associated progressive multifocal leukoencephalopathy. Ann Neurol 2014;76(6):802-12 «PMID: 25273271»PubMed
- Rigau V, Mania A, Béfort P, ym. Lethal multiple sclerosis relapse after natalizumab withdrawal. Neurology 2012;79(22):2214-6 «PMID: 23100404»PubMed
- Clerico M, Artusi CA, Liberto AD, ym. Natalizumab in Multiple Sclerosis: Long-Term Management. Int J Mol Sci 2017;18(5): «PMID: 28468254»PubMed
- Polman CH, O'Connor PW, Havrdova E, ym. A randomized, placebo-controlled trial of natalizumab for relapsing multiple sclerosis. N Engl J Med 2006;354(9):899-910 «PMID: 16510744»PubMed
- O'Connor P, Goodman A, Kappos L, ym. Long-term safety and effectiveness of natalizumab redosing and treatment in the STRATA MS Study. Neurology 2014;83(1):78-86 «PMID: 24898925»PubMed
- Calabresi PA, Giovannoni G, Confavreux C, ym. The incidence and significance of anti-natalizumab antibodies: results from AFFIRM and SENTINEL. Neurology 2007;69(14):1391-403 «PMID: 17761550»PubMed
- de Stefano N, Barkhof F, Montalban X, ym. Early Reduction of MRI Activity During 6 Months of Treatment With Cladribine Tablets for Highly Active Relapsing Multiple Sclerosis: MAGNIFY-MS. Neurol Neuroimmunol Neuroinflamm 2022;9(4): «PMID: 35701185»PubMed
- Centonze D, Amato MP, Brescia Morra V, ym. Multiple sclerosis patients treated with cladribine tablets: expert opinion on practical management after year 4. Ther Adv Neurol Disord 2023;16():17562864231183221 «PMID: 37434878»PubMed
- Nabizadeh F, Mohamadi M, Rahmani S, ym. Safety and efficacy of cladribine in multiple sclerosis: a systematic review and meta-analysis. Neurol Sci 2023;44(9):3045-3057 «PMID: 37062787»PubMed
- Giovannoni G, Soelberg Sorensen P, Cook S, ym. Safety and efficacy of cladribine tablets in patients with relapsing-remitting multiple sclerosis: Results from the randomized extension trial of the CLARITY study. Mult Scler 2018;24(12):1594-1604 «PMID: 28870107»PubMed
- Giovannoni G, Comi G, Cook S, ym. A placebo-controlled trial of oral cladribine for relapsing multiple sclerosis. N Engl J Med 2010;362(5):416-26 «PMID: 20089960»PubMed
- Rauma I, Viitala M, Kuusisto H, ym. Finnish multiple sclerosis patients treated with cladribine tablets: a nationwide registry study. Mult Scler Relat Disord 2022;61():103755 «PMID: 35483129»PubMed
- Calabresi PA, Kieseier BC, Arnold DL, ym. Pegylated interferon β-1a for relapsing-remitting multiple sclerosis (ADVANCE): a randomised, phase 3, double-blind study. Lancet Neurol 2014;13(7):657-65 «PMID: 24794721»PubMed
- Coyle PK, Shang S, Xiao Z, ym. Matching-adjusted comparisons demonstrate better clinical outcomes with SC peginterferon beta-1a every two weeks than with SC interferon beta-1a three times per week. Mult Scler Relat Disord 2018;22():134-138 «PMID: 29679749»PubMed
- Drago F, Brusati C, Mancardi G, ym. Localized lipoatrophy after glatiramer acetate injection in patients with remitting-relapsing multiple sclerosis. Arch Dermatol 1999;135(10):1277-8 «PMID: 10522686»PubMed
- O'Connor P, Wolinsky JS, Confavreux C, ym. Randomized trial of oral teriflunomide for relapsing multiple sclerosis. N Engl J Med 2011;365(14):1293-303 «PMID: 21991951»PubMed
- Confavreux C, O'Connor P, Comi G, ym. Oral teriflunomide for patients with relapsing multiple sclerosis (TOWER): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Neurol 2014;13(3):247-56 «PMID: 24461574»PubMed
- Vermersch P, Czlonkowska A, Grimaldi LM, ym. Teriflunomide versus subcutaneous interferon beta-1a in patients with relapsing multiple sclerosis: a randomised, controlled phase 3 trial. Mult Scler 2014;20(6):705-16 «PMID: 24126064»PubMed
- Freedman MS, Wolinsky JS, Wamil B, ym. Teriflunomide added to interferon-β in relapsing multiple sclerosis: a randomized phase II trial. Neurology 2012;78(23):1877-85 «PMID: 22622860»PubMed
- NCT01252355. Efficacy and Safety of Teriflunomide in Patients with Relapsing Multiple Sclerosis and Treated with Interferon-beta (TERACLES). www.clinicaltrials.gov/ct2/show/results/NCT01252355 (assessed 12 January 2016) «http://www.clinicaltrials.gov/ct2/show/results/NCT01252355»4
- Freedman MS, Wolinsky JS, Truffinet P, ym. A randomized trial of teriflunomide added to glatiramer acetate in relapsing multiple sclerosis. Mult Scler J Exp Transl Clin 2015;1():2055217315618687 «PMID: 28607708»PubMed
- Kappos L, Fox RJ, Burcklen M, ym. Ponesimod Compared With Teriflunomide in Patients With Relapsing Multiple Sclerosis in the Active-Comparator Phase 3 OPTIMUM Study: A Randomized Clinical Trial. JAMA Neurol 2021;78(5):558-567 «PMID: 33779698»PubMed
- Miller AE, Olsson TP, Wolinsky JS, ym. Long-term safety and efficacy of teriflunomide in patients with relapsing multiple sclerosis: Results from the TOWER extension study. Mult Scler Relat Disord 2020;46():102438 «PMID: 32911306»PubMed
- Cohen JA, Barkhof F, Comi G, ym. Oral fingolimod or intramuscular interferon for relapsing multiple sclerosis. N Engl J Med 2010;362(5):402-15 «PMID: 20089954»PubMed
- CAMMS223 Trial Investigators, Coles AJ, Compston DA, ym. Alemtuzumab vs. interferon beta-1a in early multiple sclerosis. N Engl J Med 2008;359(17):1786-801 «PMID: 18946064»PubMed
- Cohen JA, Coles AJ, Arnold DL, ym. Alemtuzumab versus interferon beta 1a as first-line treatment for patients with relapsing-remitting multiple sclerosis: a randomised controlled phase 3 trial. Lancet 2012;380(9856):1819-28 «PMID: 23122652»PubMed
- Coles AJ, Twyman CL, Arnold DL, ym. Alemtuzumab for patients with relapsing multiple sclerosis after disease-modifying therapy: a randomised controlled phase 3 trial. Lancet 2012;380(9856):1829-39 «PMID: 23122650»PubMed
- Holmøy T, von der Lippe H, Leegaard TM. Listeria monocytogenes infection associated with alemtuzumab - - a case for better preventive strategies. BMC Neurol 2017;17(1):65 «PMID: 28376817»PubMed
- Pariani N, Willis M, Muller I, ym. Alemtuzumab-Induced Thyroid Dysfunction Exhibits Distinctive Clinical and Immunological Features. J Clin Endocrinol Metab 2018;103(8):3010-3018 «PMID: 29878256»PubMed
- Croteau D, Flowers C, Kulick CG, ym. Acute acalculous cholecystitis: A new safety risk for patients with MS treated with alemtuzumab. Neurology 2018;90(18):e1548-e1552 «PMID: 29602912»PubMed
- Saarela M, Senthil K, Jones J, ym. Hemophagocytic lymphohistiocytosis in 2 patients with multiple sclerosis treated with alemtuzumab. Neurology 2018;90(18):849-851 «PMID: 29602914»PubMed
- Hartung HP, Gonsette R, König N, ym. Mitoxantrone in progressive multiple sclerosis: a placebo-controlled, double-blind, randomised, multicentre trial. Lancet 2002;360(9350):2018-25 «PMID: 12504397»PubMed
- Millefiorini E, Gasperini C, Pozzilli C, ym. Randomized placebo-controlled trial of mitoxantrone in relapsing-remitting multiple sclerosis: 24-month clinical and MRI outcome. J Neurol 1997;244(3):153-9 «PMID: 9050955»PubMed
- van de Wyngaert FA, Beguin C, D'Hooghe MB, ym. A double-blind clinical trial of mitoxantrone versus methylprednisolone in relapsing, secondary progressive multiple sclerosis. Acta Neurol Belg 2001;101(4):210-6 «PMID: 11851027»PubMed
- Ellis R, Brown S, Boggild M. Therapy-related acute leukaemia with mitoxantrone: four years on, what is the risk and can it be limited? Mult Scler 2015;21(5):642-5 «PMID: 25013152»PubMed
- Kalincik T, Sharmin S, Roos I, ym. Comparative Effectiveness of Autologous Hematopoietic Stem Cell Transplant vs Fingolimod, Natalizumab, and Ocrelizumab in Highly Active Relapsing-Remitting Multiple Sclerosis. JAMA Neurol 2023;80(7):702-713 «PMID: 37437240»PubMed
- Sharrack B, Saccardi R, Alexander T, ym. Autologous haematopoietic stem cell transplantation and other cellular therapy in multiple sclerosis and immune-mediated neurological diseases: updated guidelines and recommendations from the EBMT Autoimmune Diseases Working Party (ADWP) and the Joint Accreditation Committee of EBMT and ISCT (JACIE). Bone Marrow Transplant 2020;55(2):283-306 «PMID: 31558790»PubMed
- Boffa G, Signori A, Massacesi L, ym. Hematopoietic Stem Cell Transplantation in People With Active Secondary Progressive Multiple Sclerosis. Neurology 2023;100(11):e1109-e1122 «PMID: 36543569»PubMed
- Zhukovsky C, Sandgren S, Silfverberg T, ym. Autologous haematopoietic stem cell transplantation compared with alemtuzumab for relapsing-remitting multiple sclerosis: an observational study. J Neurol Neurosurg Psychiatry 2021;92(2):189-194 «PMID: 33106366»PubMed
- Alping P, Burman J, Lycke J, ym. Safety of Alemtuzumab and Autologous Hematopoietic Stem Cell Transplantation Compared to Noninduction Therapies for Multiple Sclerosis. Neurology 2021;96(11):e1574-e1584 «PMID: 33514645»PubMed
- Nabizadeh F, Pirahesh K, Rafiei N, ym. Autologous Hematopoietic Stem-Cell Transplantation in Multiple Sclerosis: A Systematic Review and Meta-Analysis. Neurol Ther 2022;11(4):1553-1569 «PMID: 35902484»PubMed
- European Medicines Agency. Gadolinium-containing contrast agents. https://www.ema.europa.eu/en/medicines/human/referrals/ gadolinium-containing-contrast-agents (accessed June 19, 2019; Magnims 2021) «https://www.ema.europa.eu/en/medicines/human/referrals/ gadolinium-containing-contrast-agents»5
- Filippi M, Preziosa P, Langdon D, ym. Identifying Progression in Multiple Sclerosis: New Perspectives. Ann Neurol 2020;88(3):438-452 «PMID: 32506714»PubMed
- Bigaut K, Cohen M, Durand-Dubief F, ym. How to switch disease-modifying treatments in multiple sclerosis: Guidelines from the French Multiple Sclerosis Society (SFSEP). Mult Scler Relat Disord 2021;53():103076 «PMID: 34161898»PubMed
- Sorensen PS, Koch-Henriksen N, Petersen T, ym. Recurrence or rebound of clinical relapses after discontinuation of natalizumab therapy in highly active MS patients. J Neurol 2014;261(6):1170-7 «PMID: 24728334»PubMed
- Lo Re M, Capobianco M, Ragonese P, ym. Natalizumab Discontinuation and Treatment Strategies in Patients with Multiple Sclerosis (MS): A Retrospective Study from Two Italian MS Centers. Neurol Ther 2015;4(2):147-57 «PMID: 26647006»PubMed
- Mustonen T, Rauma I, Hartikainen P, ym. Corrigendum to "Risk factors for reactivation of clinical disease activity in multiple sclerosis after natalizumab cessation" [Multiple Sclerosis and Related Disorders 38 (2020) 101498]. Mult Scler Relat Disord 2020;41():102107 «PMID: 32571611»PubMed
- Ladeira F, Braz L, Salgado P, ym. A multicenter, non-interventional study to evaluate the disease activity in Multiple Sclerosis after withdrawal of Natalizumab in Portugal. Clin Neurol Neurosurg 2019;184():105390 «PMID: 31306895»PubMed
- Fuentes-Rumí L, Hernández-Clares R, Carreón-Guarnizo E, ym. Prevention of rebound effect after natalizumab withdrawal in multiple sclerosis. Study of two high-dose methylprednisolone schedules. Mult Scler Relat Disord 2020;44():102311 «PMID: 32593958»PubMed
- González-Suarez I, Rodríguez de Antonio L, Orviz A, ym. Catastrophic outcome of patients with a rebound after Natalizumab treatment discontinuation. Brain Behav 2017;7(4):e00671 «PMID: 28413713»PubMed
- Hua LH, Harris H, Conway D, ym. Disease activity outcomes with different washout periods after switching from natalizumab to an alternative disease-modifying therapy. J Neurol 2020;267(8):2214-2220 «PMID: 32270292»PubMed
- Roos I, Malpas C, Leray E, ym. Disease Reactivation After Cessation of Disease-Modifying Therapy in Patients With Relapsing-Remitting Multiple Sclerosis. Neurology 2022;99(17):e1926-e1944 «PMID: 35977837»PubMed
- Hatcher SE, Waubant E, Nourbakhsh B, ym. Rebound Syndrome in Patients With Multiple Sclerosis After Cessation of Fingolimod Treatment. JAMA Neurol 2016;73(7):790-4 «PMID: 27135594»PubMed
- Evangelopoulos ME, Miclea A, Schrewe L, ym. Frequency and clinical characteristics of Multiple Sclerosis rebounds after withdrawal of Fingolimod. CNS Neurosci Ther 2018;24(10):984-986 «PMID: 29898493»PubMed
- Frau J, Sormani MP, Signori A, ym. Clinical activity after fingolimod cessation: disease reactivation or rebound? Eur J Neurol 2018;25(10):1270-1275 «PMID: 29851435»PubMed
- Uygunoglu U, Tutuncu M, Altintas A, ym. Factors Predictive of Severe Multiple Sclerosis Disease Reactivation After Fingolimod Cessation. Neurologist 2018;23(1):12-16 «PMID: 29266038»PubMed
- Fragoso YD, Adoni T, Gomes S, ym. Severe Exacerbation of Multiple Sclerosis Following Withdrawal of Fingolimod. Clin Drug Investig 2019;39(9):909-913 «PMID: 31152369»PubMed
- Goncuoglu C, Tuncer A, Bayraktar-Ekincioglu A, ym. Factors associated with fingolimod rebound: A single center real-life experience. Mult Scler Relat Disord 2021;56():103278 «PMID: 34655957»PubMed
- Framke E, Pontieri L, Bramow S, ym. Rebound of clinical disease activity after fingolimod discontinuation? A nationwide cohort study of patients in Denmark. J Neurol Neurosurg Psychiatry 2022;(): «PMID: 36171103»PubMed
- Sepúlveda M, Montejo C, Llufriu S, ym. Rebound of multiple sclerosis activity after fingolimod withdrawal due to planning pregnancy: Analysis of predisposing factors. Mult Scler Relat Disord 2020;38():101483 «PMID: 31734621»PubMed
- Bianco A, Lucchini M, Totaro R, ym. Disease Reactivation after Fingolimod Discontinuation in Pregnant Multiple Sclerosis Patients. Neurotherapeutics 2021;18(4):2598-2607 «PMID: 34494237»PubMed
- Iaffaldano P, Lucisano G, Pozzilli C, ym. Fingolimod versus interferon beta/glatiramer acetate after natalizumab suspension in multiple sclerosis. Brain 2015;138(Pt 11):3275-86 «PMID: 26362907»PubMed
- Auer M, Zinganell A, Hegen H, ym. Experiences in treatment of multiple sclerosis with natalizumab from a real-life cohort over 15 years. Sci Rep 2021;11(1):23317 «PMID: 34857795»PubMed
- Kappos L, Radue EW, Comi G, ym. Switching from natalizumab to fingolimod: A randomized, placebo-controlled study in RRMS. Neurology 2015;85(1):29-39 «PMID: 26024899»PubMed
- Vidal-Jordana A, Tintoré M, Tur C, ym. Significant clinical worsening after natalizumab withdrawal: Predictive factors. Mult Scler 2015;21(6):780-5 «PMID: 25392320»PubMed
- Nygaard GO, Torgauten H, Skattebøl L, ym. Risk of fingolimod rebound after switching to cladribine or rituximab in multiple sclerosis. Mult Scler Relat Disord 2022;62():103812 «PMID: 35462167»PubMed
- Leurs CE, van Kempen ZL, Dekker I, ym. Switching natalizumab to fingolimod within 6 weeks reduces recurrence of disease activity in MS patients. Mult Scler 2018;24(11):1453-1460 «PMID: 28823223»PubMed
- Sellner J, Rommer PS. A review of the evidence for a natalizumab exit strategy for patients with multiple sclerosis. Autoimmun Rev 2019;18(3):255-261 «PMID: 30639651»PubMed
- Cohan SL, Moses H, Calkwood J, ym. Clinical outcomes in patients with relapsing-remitting multiple sclerosis who switch from natalizumab to delayed-release dimethyl fumarate: A multicenter retrospective observational study (STRATEGY). Mult Scler Relat Disord 2018;22():27-34 «PMID: 29524759»PubMed
- Hersh CM, Harris H, Conway D, ym. Effect of switching from natalizumab to moderate- vs high-efficacy DMT in clinical practice. Neurol Clin Pract 2020;10(6):e53-e65 «PMID: 33510948»PubMed
- Alping P, Frisell T, Novakova L, ym. Rituximab versus fingolimod after natalizumab in multiple sclerosis patients. Ann Neurol 2016;79(6):950-8 «PMID: 27038238»PubMed
- Langer-Gould AM. Pregnancy and Family Planning in Multiple Sclerosis. Continuum (Minneap Minn) 2019;25(3):773-792 «PMID: 31162316»PubMed
- Federle L, Puthenparampil M, Stenta G, ym. Alemtuzumab as rescue therapy in case of multiple sclerosis rebound following Natalizumab break: Clinical case and literature review. Mult Scler Relat Disord 2019;30():262-264 «PMID: 30851640»PubMed
- Huhn K, Bayas A, Doerck S, ym. Alemtuzumab as rescue therapy in a cohort of 50 relapsing-remitting MS patients with breakthrough disease on fingolimod: a multi-center observational study. J Neurol 2018;265(7):1521-1527 «PMID: 29696498»PubMed
- Alcalá C, Gascón F, Pérez-Miralles F, ym. Treatment with alemtuzumab or rituximab after fingolimod withdrawal in relapsing-remitting multiple sclerosis is effective and safe. J Neurol 2019;266(3):726-734 «PMID: 30661133»PubMed
- Capobianco M, di Sapio A, Malentacchi M, ym. No impact of current therapeutic strategies on disease reactivation after natalizumab discontinuation: a comparative analysis of different approaches during the first year of natalizumab discontinuation. Eur J Neurol 2015;22(3):585-7 «PMID: 24995482»PubMed
- Zhu C, Zhou Z, Roos I, ym. Comparing switch to ocrelizumab, cladribine or natalizumab after fingolimod treatment cessation in multiple sclerosis. J Neurol Neurosurg Psychiatry 2022;93(12):1330-1337 «PMID: 36261289»PubMed
- Borriello G, Prosperini L, Marinelli F, ym. Observations during an elective interruption of natalizumab treatment: a post-marketing study. Mult Scler 2011;17(3):372-5 «PMID: 21148264»PubMed
- Magraner MJ, Coret F, Navarré A, ym. Pulsed steroids followed by glatiramer acetate to prevent inflammatory activity after cessation of natalizumab therapy: a prospective, 6-month observational study. J Neurol 2011;258(10):1805-11 «PMID: 21625938»PubMed
- Berger B, Baumgartner A, Rauer S, ym. Severe disease reactivation in four patients with relapsing-remitting multiple sclerosis after fingolimod cessation. J Neuroimmunol 2015;282():118-22 «PMID: 25903738»PubMed
- Sánchez P, Meca-Lallana V, Vivancos J. Tumefactive multiple sclerosis lesions associated with fingolimod treatment: Report of 5 cases. Mult Scler Relat Disord 2018;25():95-98 «PMID: 30056362»PubMed
- Otero-Romero S, Carbonell-Mirabent P, Midaglia L, ym. Oral contraceptives do not modify the risk of a second attack and disability accrual in a prospective cohort of women with a clinically isolated syndrome and early multiple sclerosis. Mult Scler 2022;28(6):950-957 «PMID: 34841948»PubMed
- Mainguy M, Tillaut H, Degremont A, ym. Assessing the Risk of Relapse Requiring Corticosteroids After In Vitro Fertilization in Women With Multiple Sclerosis. Neurology 2022;99(17):e1916-e1925 «PMID: 35953288»PubMed
- Krysko KM, Dobson R, Alroughani R, ym. Family planning considerations in people with multiple sclerosis. Lancet Neurol 2023;22(4):350-366 «PMID: 36931808»PubMed
- Confavreux C, Hutchinson M, Hours MM, ym. Rate of pregnancy-related relapse in multiple sclerosis. Pregnancy in Multiple Sclerosis Group. N Engl J Med 1998;339(5):285-91 «PMID: 9682040»PubMed
- Portaccio E, Amato MP. Breastfeeding and post-partum relapses in multiple sclerosis patients. Mult Scler 2019;25(9):1211-1216 «PMID: 30793658»PubMed
- Yeh WZ, Widyastuti PA, Van der Walt A, ym. Natalizumab, Fingolimod and Dimethyl Fumarate Use and Pregnancy-Related Relapse and Disability in Women With Multiple Sclerosis. Neurology 2021;96(24):e2989-e3002 «PMID: 33879599»PubMed
- Razaz N, Piehl F, Frisell T, ym. Disease activity in pregnancy and postpartum in women with MS who suspended rituximab and natalizumab. Neurol Neuroimmunol Neuroinflamm 2020;7(6): «PMID: 33087582»PubMed
- Kümpfel T, Thiel S, Meinl I, ym. Anti-CD20 therapies and pregnancy in neuroimmunologic disorders: A cohort study from Germany. Neurol Neuroimmunol Neuroinflamm 2021;8(1): «PMID: 33334856»PubMed
- Ray JG, Vermeulen MJ, Bharatha A, ym. Association Between MRI Exposure During Pregnancy and Fetal and Childhood Outcomes. JAMA 2016;316(9):952-61 «PMID: 27599330»PubMed
- American College of Radiology. ACR Committee on Drugs and Contrast Media: ACR manual on contrast media. April, 2022. https://www.acr.org/-/media/ACR/files/clinical-resources/contrast_ media.pdf (accessed Aug 26, 2022). «https://www.acr.org/-/media/ACR/files/clinical-resources/contrast_ media.pdf»6
- Tremlett H, Zhao Y, Joseph J, ym. Relapses in multiple sclerosis are age- and time-dependent. J Neurol Neurosurg Psychiatry 2008;79(12):1368-74 «PMID: 18535026»PubMed
- Hua LH, Fan TH, Conway D, ym. Discontinuation of disease-modifying therapy in patients with multiple sclerosis over age 60. Mult Scler 2019;25(5):699-708 «PMID: 29557704»PubMed
- Atula S, Laakso S, Nevala R, Järvinen E. MS-taudin ja sen lääkehoitojen vaikutus syöpäriskiin. Duodecim 2022;138:1595-1602
- Prosperini L, Haggiag S, Tortorella C, ym. Age-related adverse events of disease-modifying treatments for multiple sclerosis: A meta-regression. Mult Scler 2021;27(9):1391-1402 «PMID: 33104449»PubMed
- Corboy JR, Fox RJ, Kister I, ym. Risk of new disease activity in patients with multiple sclerosis who continue or discontinue disease-modifying therapies (DISCOMS): a multicentre, randomised, single-blind, phase 4, non-inferiority trial. Lancet Neurol 2023;22(7):568-577 «PMID: 37353277»PubMed
- Vaughn CB, Jakimovski D, Kavak KS, ym. Epidemiology and treatment of multiple sclerosis in elderly populations. Nat Rev Neurol 2019;15(6):329-342 «PMID: 31000816»PubMed
- McDonald WI, Compston A, Edan G, ym. Recommended diagnostic criteria for multiple sclerosis: guidelines from the International Panel on the diagnosis of multiple sclerosis. Ann Neurol 2001;50(1):121-7 «PMID: 11456302»PubMed
- Kuusisto H, Elovaara I MS-taudin pahenemisvaiheen hoito. Suomen Lääkäril 2003;5849-59:5043-5046
- Noseworthy JH, Lucchinetti C, Rodriguez M, ym. Multiple sclerosis. N Engl J Med 2000;343(13):938-52 «PMID: 11006371»PubMed
- Barnes MP, Bateman DE, Cleland PG, ym. Intravenous methylprednisolone for multiple sclerosis in relapse. J Neurol Neurosurg Psychiatry 1985;48(2):157-9 «PMID: 2984332»PubMed
- Beck RW, Cleary PA, Anderson MM Jr, ym. A randomized, controlled trial of corticosteroids in the treatment of acute optic neuritis. The Optic Neuritis Study Group. N Engl J Med 1992;326(9):581-8 «PMID: 1734247»PubMed
- Oliveri RL, Valentino P, Russo C, ym. Randomized trial comparing two different high doses of methylprednisolone in MS: a clinical and MRI study. Neurology 1998;50(6):1833-6 «PMID: 9633736»PubMed
- Cortese I, Chaudhry V, So YT, ym. Evidence-based guideline update: Plasmapheresis in neurologic disorders: report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Neurology 2011;76(3):294-300 «PMID: 21242498»PubMed
- Frohman EM, Wingerchuk DM. Clinical practice. Transverse myelitis. N Engl J Med 2010;363(6):564-72 «PMID: 20818891»PubMed
- MS-tautia sairastavan hoitoketju. Terveysportti -Hoitoketjut, Varsinais-Suomen sairaanhoitopiiri hoitoketjut. 25.8.2021, https://www.terveysportti.fi/apps/dtk/ltk/article/shp01352/search/shp01352 «https://www.terveysportti.fi/apps/dtk/ltk/article/shp01352/search/shp01352»7
- Otero-Romero S, Sastre-Garriga J, Comi G, ym. Pharmacological management of spasticity in multiple sclerosis: Systematic review and consensus paper. Mult Scler 2016;22(11):1386-1396 «PMID: 27207462»PubMed
- Multiple sclerosis in adults: management. London: National Institute for Health and Care Excellence (NICE); 2022 Jun 22. «PMID: 36279391»PubMed
- Smith KA, Piehl F, Olsson T, ym. Spasticity treatment patterns among people with multiple sclerosis: a Swedish cohort study. J Neurol Neurosurg Psychiatry 2023;94(5):337-348 «PMID: 36539267»PubMed
- Filippini G, Minozzi S, Borrelli F, ym. Cannabis and cannabinoids for symptomatic treatment for people with multiple sclerosis. Cochrane Database Syst Rev 2022;5(5):CD013444 «PMID: 35510826»PubMed
- Depressio. Käypä hoito -suositus. Suomalaisen Lääkäriseuran Duodecimin ja Suomen Psykiatriyhdistys ry:n asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim, 2023 (viitattu 16.8.2023). Saatavilla internetissä: www.kaypahoito.fi
- Vecchio M, Chiaramonte R, DI Benedetto P. Management of bladder dysfunction in multiple sclerosis: a systematic review and meta-analysis of studies regarding bladder rehabilitation. Eur J Phys Rehabil Med 2022;58(3):387-396 «PMID: 35102733»PubMed
- Preziosi G, Gordon-Dixon A, Emmanuel A. Neurogenic bowel dysfunction in patients with multiple sclerosis: prevalence, impact, and management strategies. Degener Neurol Neuromuscul Dis 2018;8():79-90 «PMID: 30584387»PubMed
- Unettomuus. Käypä hoito -suositus. Suomalaisen Lääkäriseuran Duodecimin ja Suomen Unitutkimusseura ry:n asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim, 2023 (viitattu 16.8.2023). Saatavilla internetissä: www.kaypahoito.fi
- Ghorbanpour S, Rahimibarghani S, Rohani S, ym. Fampridine for gait imbalance in patients with multiple sclerosis (MS): a systematic review and meta-analysis. Neurol Sci 2023;44(9):3059-3069 «PMID: 37055710»PubMed
- Otero-Romero S, Lebrun-Frénay C, Reyes S, ym. ECTRIMS/EAN consensus on vaccination in people with multiple sclerosis: Improving immunization strategies in the era of highly active immunotherapeutic drugs. Mult Scler 2023;29(8):904-925 «PMID: 37293841»PubMed
- Farez MF, Correale J. Yellow fever vaccination and increased relapse rate in travelers with multiple sclerosis. Arch Neurol 2011;68(10):1267-71 «PMID: 21670384»PubMed
- Papeix C, Mazoyer J, Maillart E, ym. Multiple sclerosis: Is there a risk of worsening after yellow fever vaccination? Mult Scler 2021;27(14):2280-2283 «PMID: 33870792»PubMed
- Reyes S, Ramsay M, Ladhani S, ym. Protecting people with multiple sclerosis with vaccination. Pract Neurol 2020;20:435-45
- Ciotti JR, Valtcheva MV, Cross AH. Effects of MS disease-modifying therapies on responses to vaccinations: A review. Mult Scler Relat Disord 2020;45():102439 «PMID: 32769063»PubMed
- Asplund Högelin K, Ruffin N, Pin E, ym. B-cell repopulation dynamics and drug pharmacokinetics impact SARS-CoV-2 vaccine efficacy in anti-CD20-treated multiple sclerosis patients. Eur J Neurol 2022;29(11):3317-3328 «PMID: 35808856»PubMed
- Gold R, Fätkenheuer G, Hartung HP, ym. Vaccination in multiple sclerosis patients treated with highly effective disease-modifying drugs: an overview with consideration of cladribine tablets. Ther Adv Neurol Disord 2021;14():17562864211019598 «PMID: 34671422»PubMed
- Faissner S, Heitmann N, Plaza-Sirvent C, ym. Immune response in ofatumumab treated multiple sclerosis patients after SARS-CoV-2 vaccination. Front Immunol 2022;13():980526 «PMID: 36119053»PubMed
- Sormani MP, Inglese M, Schiavetti I, ym. Effect of SARS-CoV-2 mRNA vaccination in MS patients treated with disease modifying therapies. EBioMedicine 2021;72():103581 «PMID: 34563483»PubMed
- Olberg HK, Eide GE, Cox RJ, ym. Antibody response to seasonal influenza vaccination in patients with multiple sclerosis receiving immunomodulatory therapy. Eur J Neurol 2018;25(3):527-534 «PMID: 29205701»PubMed
- Alroughani R, Boyko A. Pediatric multiple sclerosis: a review. BMC Neurol 2018;18(1):27 «PMID: 29523094»PubMed
- Waldman A, Ness J, Pohl D, ym. Pediatric multiple sclerosis: Clinical features and outcome. Neurology 2016;87(9 Suppl 2):S74-81 «PMID: 27572865»PubMed
- Hacohen Y, Brownlee W, Mankad K, ym. Improved performance of the 2017 McDonald criteria for diagnosis of multiple sclerosis in children in a real-life cohort. Mult Scler 2020;26(11):1372-1380 «PMID: 31317829»PubMed
- Fadda G, Brown RA, Longoni G, ym. MRI and laboratory features and the performance of international criteria in the diagnosis of multiple sclerosis in children and adolescents: a prospective cohort study. Lancet Child Adolesc Health 2018;2(3):191-204 «PMID: 30169254»PubMed
- Waubant E, Chabas D, Okuda DT, ym. Difference in disease burden and activity in pediatric patients on brain magnetic resonance imaging at time of multiple sclerosis onset vs adults. Arch Neurol 2009;66(8):967-71 «PMID: 19667217»PubMed
- Benson LA, Healy BC, Gorman MP, ym. Elevated relapse rates in pediatric compared to adult MS persist for at least 6 years. Mult Scler Relat Disord 2014;3(2):186-93 «PMID: 25878006»PubMed
- Chitnis T, Aaen G, Belman A, ym. Improved relapse recovery in paediatric compared to adult multiple sclerosis. Brain 2020;143(9):2733-2741 «PMID: 32810215»PubMed
- Aubert-Broche B, Fonov V, Narayanan S, ym. Onset of multiple sclerosis before adulthood leads to failure of age-expected brain growth. Neurology 2014;83(23):2140-6 «PMID: 25378667»PubMed
- Amato MP, Goretti B, Ghezzi A, ym. Cognitive and psychosocial features of childhood and juvenile MS. Neurology 2008;70(20):1891-7 «PMID: 18474844»PubMed
- Ghezzi A, Pozzilli C, Liguori M, ym. Prospective study of multiple sclerosis with early onset. Mult Scler 2002;8(2):115-8 «PMID: 11990867»PubMed
- Renoux C, Vukusic S, Mikaeloff Y, ym. Natural history of multiple sclerosis with childhood onset. N Engl J Med 2007;356(25):2603-13 «PMID: 17582070»PubMed
- Harding KE, Liang K, Cossburn MD, ym. Long-term outcome of paediatric-onset multiple sclerosis: a population-based study. J Neurol Neurosurg Psychiatry 2013;84(2):141-7 «PMID: 23154123»PubMed
- Sandesjö F, Wassmer E, Deiva K, ym. Current international trends in the treatment of multiple sclerosis in children-Impact of the COVID-19 pandemic. Mult Scler Relat Disord 2021;56():103277 «PMID: 34624643»PubMed
- Chitnis T, Tenembaum S, Banwell B, ym. Consensus statement: evaluation of new and existing therapeutics for pediatric multiple sclerosis. Mult Scler 2012;18(1):116-27 «PMID: 22146610»PubMed
- Alroughani R, Das R, Penner N, ym. Safety and Efficacy of Delayed-Release Dimethyl Fumarate in Pediatric Patients With Relapsing Multiple Sclerosis (FOCUS). Pediatr Neurol 2018;83():19-24 «PMID: 29681490»PubMed
- Alroughani R, Huppke P, Mazurkiewicz-Beldzinska M, ym. Delayed-Release Dimethyl Fumarate Safety and Efficacy in Pediatric Patients With Relapsing-Remitting Multiple Sclerosis. Front Neurol 2020;11():606418 «PMID: 33473248»PubMed
- Chitnis T, Arnold DL, Banwell B, ym. Trial of Fingolimod versus Interferon Beta-1a in Pediatric Multiple Sclerosis. N Engl J Med 2018;379(11):1017-1027 «PMID: 30207920»PubMed
- Chitnis T, Banwell B, Kappos L, ym. Safety and efficacy of teriflunomide in paediatric multiple sclerosis (TERIKIDS): a multicentre, double-blind, phase 3, randomised, placebo-controlled trial. Lancet Neurol 2021;20(12):1001-1011 «PMID: 34800398»PubMed
- Krysko KM, Graves J, Rensel M, ym. Use of newer disease-modifying therapies in pediatric multiple sclerosis in the US. Neurology 2018;91(19):e1778-e1787 «PMID: 30333163»PubMed
- Ghezzi A, Banwell B, Bar-Or A, ym. Rituximab in patients with pediatric multiple sclerosis and other demyelinating disorders of the CNS: Practical considerations. Mult Scler 2021;27(12):1814-1822 «PMID: 32552353»PubMed
- Kornek B, Aboul-Enein F, Rostasy K, ym. Natalizumab therapy for highly active pediatric multiple sclerosis. JAMA Neurol 2013;70(4):469-75 «PMID: 23420110»PubMed
- Ruutiainen J, Viita AM, Hahl J, ym. Burden of illness in multiple sclerosis (DEFENSE) study: the costs and quality-of-life of Finnish patients with multiple sclerosis. J Med Econ 2016;19(1):21-33 «PMID: 26360615»PubMed
- Landfeldt E, Castelo-Branco A, Svedbom A, ym. Sick leave and disability pension before and after diagnosis of multiple sclerosis. Mult Scler 2016;22(14):1859-1866 «PMID: 27650517»PubMed
- Heinonen T, Castrén E, Luukkaala T, ym. The retirement rate due to multiple sclerosis has decreased since 1995- A retrospective study in a Finnish central hospital. Mult Scler Relat Disord 2020;45():102360 «PMID: 32688302»PubMed
- Wickström A, Fagerström M, Wickström L, ym. The impact of adjusted work conditions and disease-modifying drugs on work ability in multiple sclerosis. Mult Scler 2017;23(8):1137-1147 «PMID: 27758955»PubMed
- Ruutiainen J, Wikström J, Sivenius J. Etenevät neurologiset sairaudet. Kirjassa: Kuntoutus (Rissanen P, Kallanranta T, Suikkanen A) 2.p. Kustannus Oy Duodecim; Jyväskylä 2008;235-50
- Amatya B, Khan F, Galea M. Rehabilitation for people with multiple sclerosis: an overview of Cochrane Reviews. Cochrane Database Syst Rev 2019;1(1):CD012732 «PMID: 30637728»PubMed
- Abou L, Qin K, Alluri A, ym. The effectiveness of physical therapy interventions in reducing falls among people with multiple sclerosis: A systematic review and meta-analysis. J Bodyw Mov Ther 2022;29():74-85 «PMID: 35248292»PubMed
- Binshalan T, Nair KPS, McNeill A. The Effectiveness of Physiotherapy Interventions for Mobility in Severe Multiple Sclerosis: A Systematic Review and Meta-Analysis. Mult Scler Int 2022;2022():2357785 «PMID: 35860179»PubMed
- Centonze D, Leocani L, Feys P. Advances in physical rehabilitation of multiple sclerosis. Curr Opin Neurol 2020;33(3):255-261 «PMID: 32304436»PubMed
- Messmer Uccelli M, Specchia C, Battaglia MA, ym. Factors that influence the employment status of people with multiple sclerosis: a multi-national study. J Neurol 2009;256(12):1989-96 «PMID: 19582536»PubMed
- Castrén E, Heinonen T, Mäkinen K, ym. The rate of neuropsychological assessments in multiple sclerosis has increased-A retrospective study in a Finnish Central Hospital. Acta Neurol Scand 2020;141(2):156-161 «PMID: 31585023»PubMed
- Työterveyshuoltolaki 1383/2001, https://www.finlex.fi/fi/laki/ajantasa/2001/20011383 «https://www.finlex.fi/fi/laki/ajantasa/2001/20011383»8
- Terveydenhuoltolaki 30.12.2010/1326, https://www.finlex.fi/fi/laki/ajantasa/2010/20101326 «https://www.finlex.fi/fi/laki/ajantasa/2010/20101326»9
- Valtakunnaliset lääkinnällisen kuntoutuksen ohjaamisen perusteet 2022. Opas terveyden- ja sosiaalihuollon ammattilaisille ja kuntoutuksen parissa työskenteleville. Sosiaali ja terveysministeriön julkaisuja 2022:17 http://urn.fi/URN:ISBN:978-952-00-5423-6 «http://urn.fi/URN:ISBN:978-952-00-5423-6»10
- Laki Kansaneläkelaitoksen kuntoutusetuuksista ja kuntoutusrahaetuuksista. 15.7.2005/566. https://www.finlex.fi/fi/laki/ajantasa/2005/20050566 «https://www.finlex.fi/fi/laki/ajantasa/2005/20050566»11
- Sosiaali- ja terveysturvan tutkimuksia 161. Toim. Sjögren T, Rintala A, Paltamaa J, Korpi H. Fysioterapian vaikuttavuus ja merkityksellisyys aivoverenkiertohäiriötä ja multippeliskleroosia sairastaville kuntoutujille: Järjestelmälliset kirjallisuuskatsaukset kävelyn ja tasapainon meta-analyyseista ja fysioterapian koetun merkityksellisyyden metasynteeseistä. Kela 2022, http://hdl.handle.net/10138/350735 «http://hdl.handle.net/10138/350735»12
- Lampit A, Heine J, Finke C, ym. Computerized Cognitive Training in Multiple Sclerosis: A Systematic Review and Meta-analysis. Neurorehabil Neural Repair 2019;33(9):695-706 «PMID: 31328637»PubMed
- Wu J, Olsson T, Hillert J, ym. Influence of oral tobacco versus smoking on multiple sclerosis disease activity and progression. J Neurol Neurosurg Psychiatry 2023;94(8):589-596 «PMID: 37001984»PubMed
- Rodgers J, Friede T, Vonberg FW, ym. The impact of smoking cessation on multiple sclerosis disease progression. Brain 2022;145(4):1368-1378 «PMID: 34623418»PubMed
- Tupakka- ja nikotiiniriippuvuuden ehkäisy ja hoito. Käypä hoito -suositus. Käypä hoito -suositus. Suomalaisen Lääkäriseuran Duodecimin ja Suomen Yleislääketieteen yhdistyksen asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim, 2018 (viitattu 4.5.2023). Saatavilla internetissä: www.kaypahoito.fi
- Munger KL, Hongell K, Åivo J, ym. 25-Hydroxyvitamin D deficiency and risk of MS among women in the Finnish Maternity Cohort. Neurology 2017;89(15):1578-1583 «PMID: 28904091»PubMed
- Ascherio A, Munger KL, White R, ym. Vitamin D as an early predictor of multiple sclerosis activity and progression. JAMA Neurol 2014;71(3):306-14 «PMID: 24445558»PubMed
- Åivo J, Kurki S, Sumelahti ML, ym. Risk of osteoporotic fractures in multiple sclerosis patients in southwest Finland. Acta Neurol Scand 2017;135(5):516-521 «PMID: 27334254»PubMed
- Boltjes R, Knippenberg S, Gerlach O, ym. Vitamin D supplementation in multiple sclerosis: an expert opinion based on the review of current evidence. Expert Rev Neurother 2021;21(6):715-725 «PMID: 34058936»PubMed
- Osteoporoosi. Käypä hoito -suositus. Suomalaisen Lääkäriseuran Duodecimin, Suomen Endokrinologiyhdistyksen, Suomen Gynekologiyhdistyksen ja Suomen Geriatrit ry:n asettama työryhmä. Helsinki: Suomalainen Lääkäriseura Duodecim, 2020 (viitattu 1.5.2023). Saatavilla internetissä: www.kaypahoito.fi
- Soilu-Hänninen M, Åivo J, Lindström BM, ym. A randomised placebo-controlled trial with vitamin D3 as an add on treatment to interferon b-1b in patients with multiple sclerosis. J Neurol Neurosurg Psychiatry 2012;83:565-71
- Paakkari I. D-vitamiini. www.terveyskirjasto.fi. Lääkärikirja Duodecim. Kustannus Oy Duodecim 21.3.2022
- Manchery N, Henry JD, Nangle MR. A systematic review of oral health in people with multiple sclerosis. Community Dent Oral Epidemiol 2020;48(2):89-100 «PMID: 31815299»PubMed